血清INTS6P1作为肝细胞癌疾病筛查新型标志物的可行性研究
2016-11-11石文波彭晓朋冉瑞智张芳幸茂辉
石文波 彭晓朋 冉瑞智 张芳 幸茂辉
血清INTS6P1作为肝细胞癌疾病筛查新型标志物的可行性研究
石文波彭晓朋冉瑞智张芳幸茂辉
目的探讨血清中整合因子复合体亚基6假基因1(INTS6P1)作为肝细胞癌患者疾病筛查新型标志物的可行性。方法采用Northern杂交方法检测33例肝细胞癌患者肿瘤组织及临近肺肿瘤组织中INTS6P1的表达情况,通过细胞试验检测INTS6P1在细胞培养上清和胞内表达情况,最后检测INTS6P1在100例患者体内的表达情况。结果与临床非肿瘤组织相比,33例肝细胞癌患者肿瘤组织中的INTS6P1表达量显著降低(P=0.0066)。血清检测结果表明,肝细胞癌患者血清中INTS6P1表达水平显著低于非肝细胞癌患者(P<0.01)。此外,曲线下面积-ROC曲线分析表明,血清-AFP含量低于20 ng/ml时INTS6P1可以作为肝细胞癌患者疾病筛查的诊断标志物(P<0.05)。结论血清INTS6P1可以作为肝细胞癌疾病筛查新型标志物,将该标志物纳入检测能提高肝细胞癌临床诊断的准确率。
假基因;整合因子复合体亚基6假基因1;肝细胞癌;血清标志物
肝细胞癌(HCC)是全球第5大常见癌症,其特点为高迁移率和高复发率,且患者往往预后不良[1,2]。肝切除术是该疾病临床首选治疗方法[3]。由于HCC患者的早期诊断和筛查缺乏,患者往往错失最佳的手术治疗时机,导致临床疗效不甚理想[4]。国内慢性肝炎和HBV感染引起的肝硬化是引发HCC的主要原因。有报道表明,慢性HBV感染引发的HCC占总数的10%~25%[5-7]。由HBV感染导致的HCC患者能够通过早期诊断进而改善临床治疗效果。血清标志物检测(AFP,AFP-L3,AFU和GPC3)和影像学检查(超声,CT和MRI)常用于HCC高危人群的疾病检查[8,9]。血清AFP含量是目前HCC患者疾病诊断的最常用标志物,其缺点在于灵敏性(36%~64%)和特异性(79%~91%)均较低[10]。AFP在非HCC患者体内也会出现升高,例如慢性肝炎、肝硬化、妊娠12周孕妇和生殖系统肿瘤等[11]。由于经济实惠、操作简单,影像学检查是HCC患者疾病早期诊断的理想选择,然而,上述方法对病灶直径小于3 cm的肿瘤检出能力有限[12]。CT和MRI的检测灵敏性和特异性较高,且目前是HCC患者临床检查的常规方法[13]。但是该方法的缺点在于价格较为昂贵,并不能成为所有患者临床筛查和治疗的常规手段。上述因素的综合作用导致HCC的临床早期筛查结果不理想。需要寻找一种HCC特异性和准确性均较高的生物标志物以改善当前早期HCC检测所遇瓶颈。本研究探讨血清中INTS6P1作为肝细胞癌患者疾病筛查新型标志物的可行性。
1 材料与方法
1.1临床组织与血液样品本研究的临床样品均采集自湖北省恩施土家族苗族自治州中心医院和中国人民解放军第302医院2013至2015年治疗的肝细胞癌患者。该研究获得医院伦理委员会审批,且患者均知情。肝细胞癌组织样品和相应的临床肺肿瘤组织采集自芯片检测lncRNA 阳性的肝细胞患者。血液样品100例,HCC患者50例,慢性HBV感染患者20例,健康人群30例。血清样品采集时间为HCC患者手术治疗前7 d。新鲜组织样品在术后30 min内-80℃冷冻,直至本研究检测。所有患者为新发HCC,且未接受任何干预治疗。患者的确诊和肿瘤分期均由病理学专家完成。
1.2细胞系HCC细胞系(Hep3B,HepG2,Huh7,MHCC97L和MHCC97H)及正常人肝脏细胞系HL-7702均购自美国菌种保藏中心,培养方法为含10% FBS(Gibco,Invitrogen,USA)、100 U/ml青霉素和DMEM培养基(Gibco,Invitrogen,USA),5% CO2,37℃培养。
1.3样品处理及血清总RNA提取采用EDTA血液采集管采集患者全血,4℃,1 200 g离心15 min,去除细胞。收集上清于微量离心管内,4℃,12 000 g离心15 min,完全去除细胞碎片。血清置于-80℃保持备用。采用LS TRIzol(Invitrogen,USA)试剂盒根据说明书提取血清RNA,HCC样品的细胞系总RNA采用TRIzol试剂(Invitrogen,USA)提取。
1.4Northern blot采用TRIzol试剂提取HCC细胞系(Hep3B,HepG2,Hun7,MHCC97L和MHCC97H)和正常人源肝细胞HL-7702,向凝胶中加入20 μg RNA样品。Northern blot检测时,lncRNA(INTS6P1)探针序列为5’-ATATGAATTCGAGGAGACAGGTATATGCT-3’,甘油醛-3-磷酸脱氢酶(GAPDH,内参)探针序列为5’-CTGATGCCCCCATGTTCGT CATGGGTGTGA-3’。
1.5HCC组织和血液样本INTS6P1含量qRT-PCR检测采用Prime Script反转录试剂盒(Takara,大连)对每个样品的RNA进行逆转录合成cDNA。定量PCR总体积15 μl,包括3 μl cDNA模板,以GAPDH为内参。采用Light Cycler 480 SYBR Green I Master(罗氏)试剂进行定量扩增。采用罗氏公司的LC480型定量PCR仪进行扩增。通过2-ΔΔct计算INTS6P1的相对表达水平。
1.6统计学分析应用SPSS 14.0统计软件,组织、细胞和血清间的lncRNA表达水平采用双尾t检验、Wilcoxon分析和Kruskal-Wallis检验,P<0.05为差异有统计学意义。通过ROC曲线制图检测肿瘤患者血液样品与健康血液样品间INTS6P1表达水平的差异。
2 结果
2.1HCC组织与临近非肿瘤组织lncRNAs芯片检测结果为验证lncRNAs在HCC组织中表达失调,本研究采用芯片方法检测HCC肿瘤组织和临床非肿瘤组织中lncRNAs表达情况。临床非肿瘤组织INTS6P1水平为(2.65±1.32),HCC患者肿瘤中INTS6P1表达水平为(1.68±1.05),差异有统计学意义(P=0.015)。
2.2INTS6P1在HCC组织及正常肝脏组织中表达情况为进一步验证芯片检测结果,本研究采用定量PCR方法检测33例HCC患者肿瘤组织和33例正常肝脏组织样品中INTS6P1表达情况,与正常组比较,HCC组织中INTS6P1表达下调比例为78.8%(26/33)。33对样本检测结果表明,INTS6P1表达差异有统计学意义(P=0.0066)。见图1。

图1 33对肿瘤-正常肝细胞INTS6P1定量检测结果
2.3HCC细胞及HL-7702细胞培养基中INTS6P1表达检测为检测INTS6P1的来源,本研究检测了lncRNA-INTS6P1是否存在于细胞培养上清中。我们选择6株肝细胞系,包括正常肝细胞(HL-7702)和5株人HCC细胞系(HepG2,Hep3B,Huh7,MHCC97L和MHCC97H)。收集细胞传代后第1、2、3天的细胞培养上清。取上清的总RNA。收集上清后,采用qRT-PCR和northern blot检测6株细胞中INTS6P1表达情况。均检测到INTS6P1表达,且其表达量随时间延长而增加。正常肝脏细胞中INTS6P1表达情况与HCC细胞系不同。见图2~5。
2.4肝切除术前后患者血清中INTS6P1表达情况比较为进一步探究导致HCC患者INTS6P1表达下降的原因,采集8例肝脏切除术治疗的HCC患者术前和术后1个月血液。患者术后血液中INTS6P1表达量显著高于术前(P=0.022)。患者接受肝脏切除术治疗后血清中仍能检测到AFP。患者术后AFP与术前相比显著下降(P=0.0078)。见图6、7。
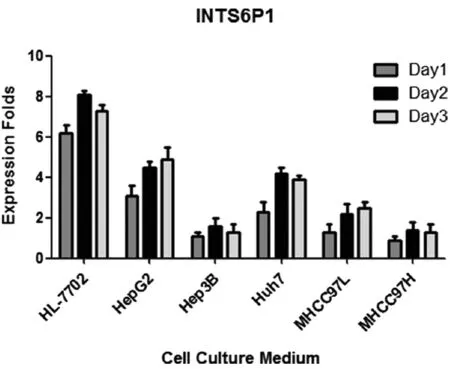
图2 细胞培养上清中LncRNA-INTS6P1表达情况

图3 northern blot方法检测不同细胞系中INTS6P1表达情况

图4 northern blot灰度扫描和量化结果

图5 qRT-PCR方法检测不同肝细胞系中INTS6P1表达情况
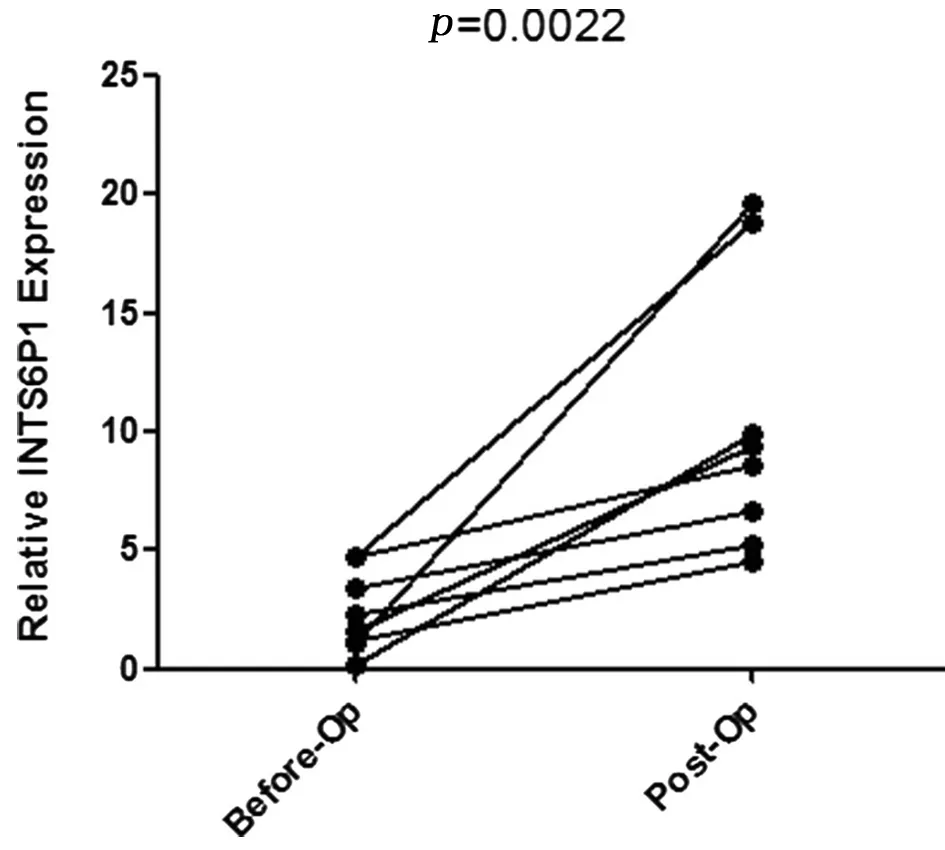
图6肝脏切除术治疗前后患者血浆中INTS6P1表达量比较(Wilcoxon检验)
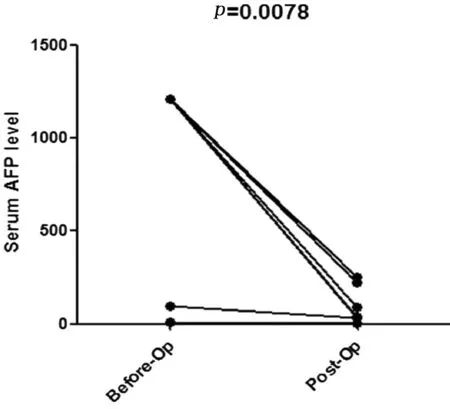
图7肝脏切除术治疗前后患者血浆中AFP表达量比较(Wilcoxon检验)
2.5血清INTS6P1表达作为疾病筛查研究为验证采用外周血中INTS6P1检测作为HCC患者疾病筛查的新型标志物的可行性。我们采用qRT-PCR方法检测50例HBsAg阳性HCC患者的血清样品,20例HBV感染患者血清样品和30例健康人群血清样品(AFP<10 ng/ml,HBsAg阴性)。HCC患者的临床病理学特征。与健康人群(P=0.04)和非HCC患者(P=0.03)相比,HCC患者的INTS6P1表达显著下降。此外,也比较了INTS6P1在慢性HBV感染和健康人群中的表达情况,前者显著低于后者(P=0.0458)。见表1,图8。
2.6血清AFP和INTS6P1的诊断价值为检测INTS6P1对疾病诊断的价值,本研究采用AUC-ROC分析血清AFP和血清INTS6P1。二者的诊断价值。结果表明,在血清AFP含量低于20 ng/ml时,INTS6P1(AUC-ROC,0.867,P<0.05)的临床诊断价值高于AFP(AUC-ROC,0.855,P<0.05)。见表2,图9。
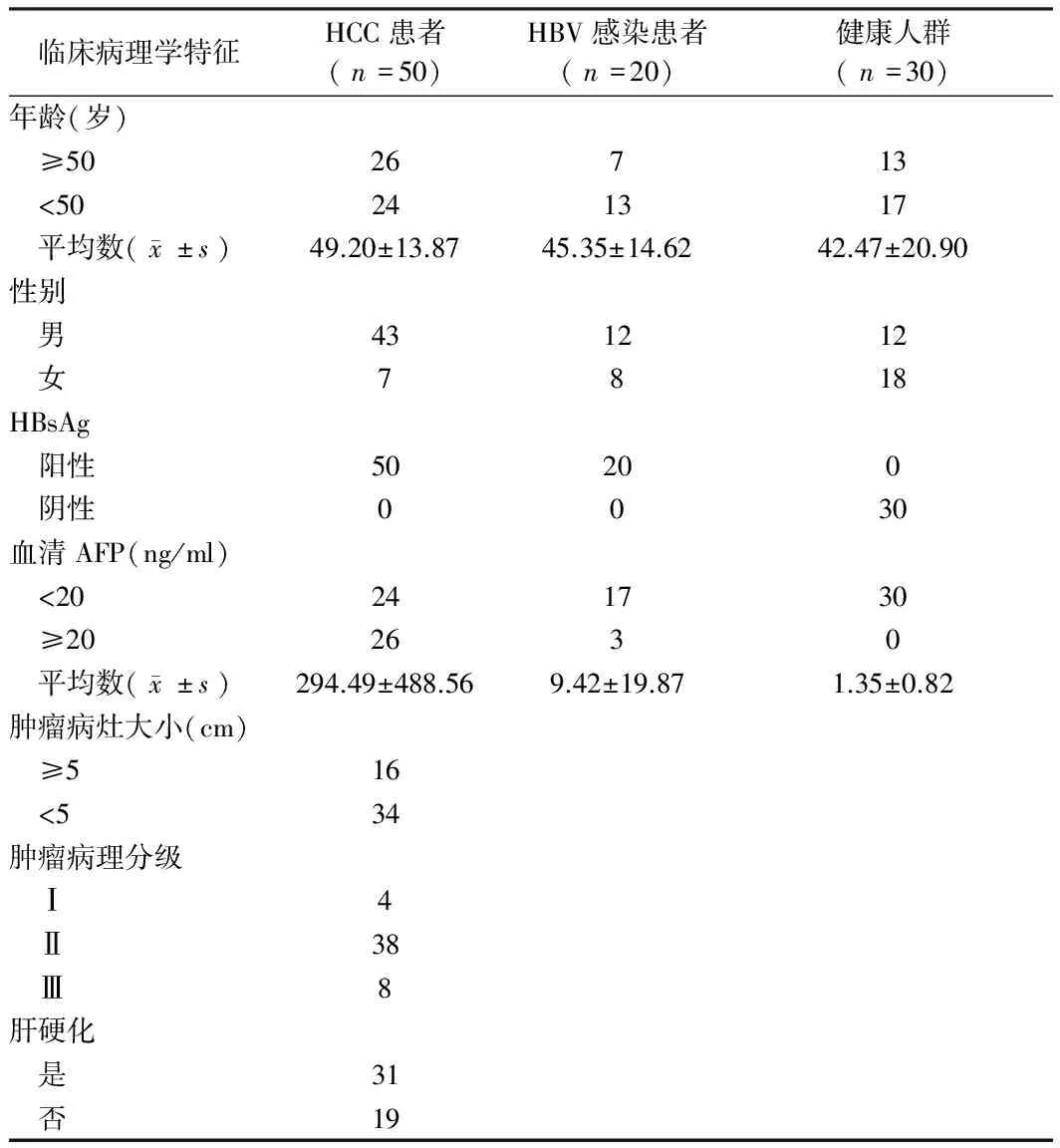
表1 HCC患者的临床病理学特征 例

图8 3组INTS6P1表达情况比较
3 讨论
近年来,高度稳定的游离DNA(cfCNA),包括RNA和DNA,均在人类的血液、血清和尿液中检测到。研究表明,cfCNA与多种疾病相关,特别是肿瘤性疾病[14]。随着基因测序和表观遗传学的不断发展,已经衍生出关于研究非编码RNAs(ncRNAs)的学科。长非编码RNAs(lncRNAs)已经被广泛发现和报道,其长度一般在200~10 000 nt[15],参与多种肿瘤细胞生物学功能的调节途径[16]。假基因是IncRNAs的一种。其结构与亲本蛋白编码基因相似。HULC,是首个在HCC中发现的lncRNA,在Hep3B细胞中通过调节CREB转录因子,导致HULC表达显著上调[17,18],在HCC组织中HULC的表达水平与HBx阳性密切相关。此外,越来越多的报道表明,HCC组织中lncRNAs表达失调[19,20],这一现象与肿瘤转移、筛查、诊断或肿瘤的预后密切相关[21]。有研究表明,整合因子复合体亚基6假基因1(INTS6P1)是一种HCC肿瘤抑制基因,其通过竞争性内源RNA(ceRNA)上调相应的肿瘤抑制同源基因INTS6,进而抑制HCC生长[22]。因此,INTS6P1具有作为HCC患者临床疾病诊断标志物的潜力。
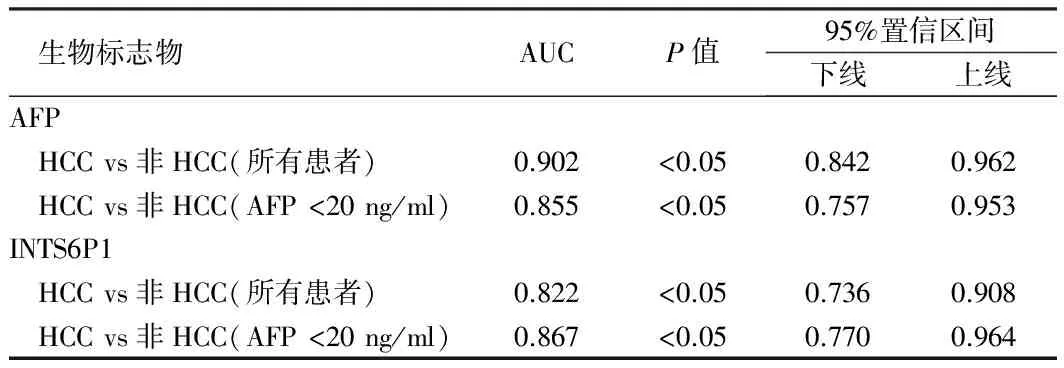
表2 血清AFP和INTS6P1诊断价值
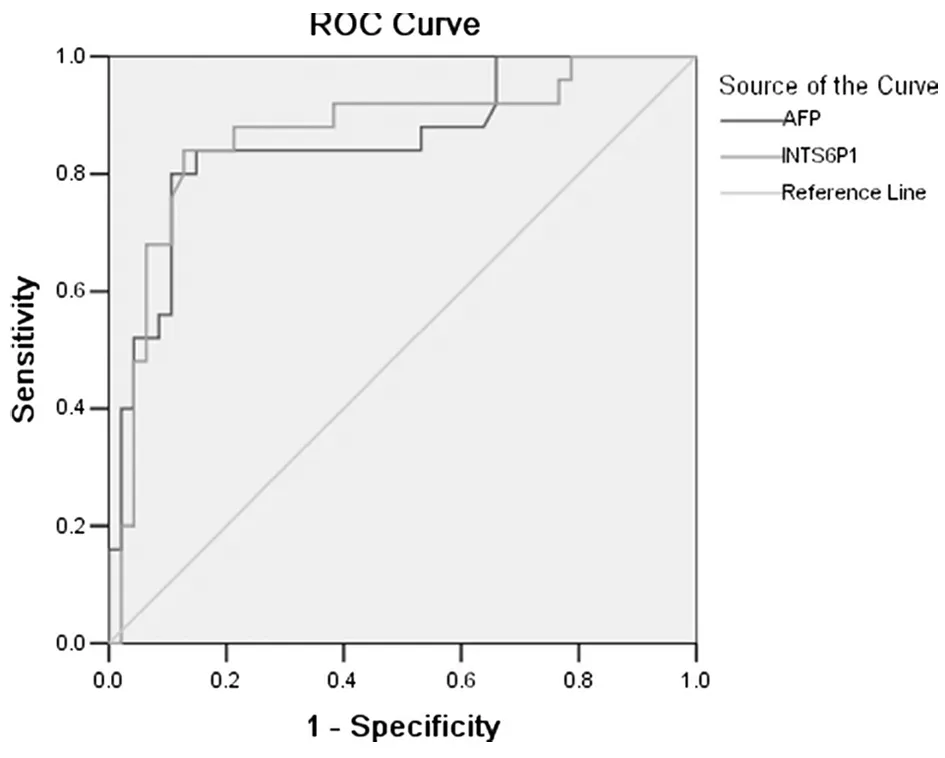
图9血清AFP含量低于20 ng/ml时AFP和INTS6P1用于疾病诊断比较
cfCNA是肿瘤诊断和筛查的潜在生物标志物。尽管报道表明许多与mRNA和microRNA类似的cfCNA是许多肿瘤检测的标志物[14,23],关于假基因的报道很少。Peng等[22]研究表明,INTS6P1能抑制HCC细胞生长和迁移,并能促进其凋亡。其机制是INTS6P1 竞争性结合HCC癌基因miR-17-5p转录后调节INTS6表达。本研究进一步探讨INTS6P1在HCC患者临床中的应用。
芯片检测结果表明,我们在HCC组织中检测到大量的假基因INTS6P1。本研究进一步比较HCC与正常肝脏组织中INTS6P1 表达水平,表明HCC中表达显著下调78.8%。细胞和血清检测结果表明,INTS6P1在患者的组织和血清中均有表达。与非HCC患者相比,HCC患者血清中INTS6P1表达水平显著下降,表明INTS6P1在正常人体内表达水平更高更稳定。
部分研究表明,肿瘤细胞能分泌miniRNA到细胞外,并进入循环系统[24]。HCC细胞实验表明,与正常肝脏细胞相比,不仅胞内INTS6P1表达下调,细胞培养上清中的INTS6P1表达也相应下降。此外,HCC患者肝脏切除术治疗前后的血清INTS6P1表达情况检测结果表明,术后INTS6P1表达量较术前有显著升高。综合组织和细胞培养试验结果,我们认为肿瘤细胞能抑制INTS6P1表达。表明与正常肝脏细胞相比HCC细胞分泌INTS6P1 假基因到细胞外显著降低。鉴于HCC患者与非HCC患者血清中INTS6P1表达量的不同,可以采用INTS6P1作为该疾病诊断的标志物。
lncRNA 的表达水平与肿瘤的发生发展密切相关[25]。检测血清中lncRNA表达水平作为疾病诊断手段,其结果准确、可靠。本研究中报道了假基因INTS6P1,证实其在HCC中表达被抑制,其通过竞争性内源RNA(ceRNA)上调相应的肿瘤抑制同源基因INTS6,进而抑制HCC生长。AUC-ROC 分析结果表明,在血清AFP含量低于20 ng/ml时,INTS6P1(AUC-ROC,0.867,P<0.05)的临床诊断价值高于AFP(AUC-ROC,0.855,P<0.05)。临床上HCC患者联合采用AFP和INTS6P1进行检测能提高诊断的灵敏性,从而能显著改善HCC患者筛查的结果。本研究还发现慢性HBV感染患者的INTS6P1表达量高于HCC患者,同时又低于正常人群。根据这个结果,我们认为可以通过INTS6P1表达检测进行HBV感染患者转为HCC的早期筛查。可以通过该标志物的检测为HBV患者疾病的治疗方案的制定提供重要依据。
目前,尚没有一种生物标志物能替代AFP作为HCC的临床诊断。然而由于AFP检测存在高灵敏性和低特异性的问题,开发一种辅助检测方法十分必要。本研究结果表明,血清INTS6P1假基因可以作为HCC患者早期筛查的新型非侵袭性生物标志物。
1EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma.J Hepatol,2012,56:908-943.
2Chen WQ,Zheng RS,Zhang SW.Liver cancer incidence and mortality in China,2009.Chin J Cancer,2013,32:162-169.
3Ercolani G,Grazi GL,Ravaioli M,et al.Liver resection for hepatocellular carcinoma on cirrhosis:univariate and multivariate analysis of risk factors for intrahepatic recurrence.Ann Surg,2003,237:536-543.
4Schwartz M,Roayaie S,Konstadoulakis M.Strategies for the management of hepatocellular carcinoma.Nat Clin Pract Oncol,2007,4:424-432.
5Turati F,Edefonti V,Talamini R,et al.Family history of liver cancer and hepatocellular carcinoma.Hepatology,2012,55:1416-1425.
6El-Aneed A,Banoub J.Proteomics in the diagnosis of hepatocellular carcinoma:focus on high risk hepatitis B and C patients.Anticancer Res,2006,26:3293-3300.
7Williams R.Global challenges in liver disease.Hepatology,2006,44:521-526.
8Marrero JA,Su GL,Wei W,et al.Des-gamma carboxyprothrombin can differentiate hepatocellular carcinoma from nonmalignant chronic liver disease in american patients.Hepatology,2003,37:1114-1121.
9Lok AS,Seeff LB,Morgan TR,et al.Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease.Gastroenterology,2009,136:138-148.
10Zhou L,Liu J,Luo F.Serum tumor markers for detection of hepatocellular carcinoma.World J Gastroenterol,2006,12:1175-1181.
11Di Bisceglie AM,Hoofnagle JH.Elevations in serum alphafetoprotein levels in patients with chronic hepatitis B.Cancer,1989,64:2117-2120.
12Sheu JC,Sung JL,Chen DS,et al.Early detection of hepatocellular carcinoma by real-time ultrasonography.A prospective study.Cancer,1985,56:660-666.
13Song ZZ.Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma.Hepatology,2008,47:2145-2156.
14Schwarzenbach H,Hoon DS,Pantel K.Cell-free nucleic acids as biomarkers in cancer patients.Nat Rev Cancer,2011,11:426-437.
15Wang KC,Yang YW,Liu B,et al.A long noncoding RNA maintains active chromatin to coordinate homeotic gene expression.Nature,2011,472:120-124.
16Mercer TR,Dinger ME,Mattick JS.Long non-coding RNAs: insights into functions.Nat Rev Genet,2009,10:155-159.
17Ma L,Bajic VB,Zhang Z.On the classification of long non-coding RNAs. RNA Biol,2013,10:276-280.
18Wang J,Liu X,Wu H,et al.CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer.Nucleic Acids Res,2010,38:5366-5383.
19Tian Y,Yang W,Song J,et al.Hepatitis B virus x protein induced aberrant epigenetic modifications contributing to human hepatocellular carcinoma pathogenesis.Mol Cell Biol,2013,33: 2810-2816.
20Wapinski O,Chang HY.Long noncoding RNAs and human disease.Trends Cell Biol,2011,21:354-361.
21He Y,Meng XM,Huang C,et al.Long noncoding RNAs: novel insights into hepatocelluar carcinoma.Cancer Lett,2014,344:20-27.
22Peng H,Ishida M,Li L,et al.Pseudogene INTS6P1 regulates its cognate gene INTS6 through competitive binding of miR- 17-5p in hepatocellular carcinoma.Oncotarget,2015,6:5666-5677.
23Liu R,Chen X,Du Y,et al.SerummicroRNA expression profile as a biomarker in the diagnosis and prognosis of pancreatic cancer.Clin Chem,2012,58:610-618.
24Ren S,Wang F,Shen J,et al.Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1 derived miniRNA as a novel plasma-based biomarker for diagnosing prostate cancer.Eur J Cancer,2013,49:2949-2959.
25Huarte M,Rinn JL.Large non-coding RNAs: missing links in cancer.Hum Mol Genet,2010,19:R152-R161.
The feasibility study on serum INTS6P1 as an novel marker for screening hepatocellular carcinoma
SHIWenbo*,PENGXiaopeng,RANRuizhi*,etal.
*DepartmentofOncology,EnshiCentralHospital,EnshiTujianationalityandMiaonationalityAutonomousPrefecture,Hubei,Enshi445000,China
ObjectiveTo investigate the feasibility of pseudogene integrator complex subunit 6 pseudogene 1 (INTS6P1) in serum as an novel marker to screen hepatocellular carcinoma (HCC). MethodsThe expression levels of INTS6P1 were detected by Northern hybridization method in 33 cases of hepatocellular carcinoma tissues and adjacent normal liver tissues.Moreover the expressions of INTS6P1 in supernatant of cell culture were measured by means of cell culture in vitro, besides, the expression levels of INTS6P1 were detected in 100 patients with HCC in vivo.ResultsAs compared with those in adjacent normal liver tissues,the expression levels of INTS6P1 in 33 cases of hepatocellular carcinoma tissues were significantly decreased (P<0.01). The expression levels of INTS6P1 in serum of patients with HCC were significantly lower than those of patients with non-HCC (P<0.01). In addition, the AUC-ROC curve analysis showed that when the serum levels of AFP were lower than 20ng/ml, INTS6P1 could be regarded as a diagnostic marker for screening hepatocellular carcinoma (P<0.05).ConclusionThe serum INTS6P1 can be regarded as an novel marker for screening hepatocellular carcinoma,moreover,the detection of serum INTS6P1 can increase the accuracy of clinical diagnosis of HCC.
pseudogene;INTS6P1;hepatocellular carcinoma;serum markers
10.3969/j.issn.1002-7386.2016.21.002
445000湖北省恩施土家族苗族自治州中心医院肿瘤Ⅱ科(石文波、冉瑞智、张芳、幸茂辉);中国人民解放军第302医院肝癌病区组肿瘤科(彭晓朋)
R 735.7
A
1002-7386(2016)21-3209-05
2016-04-05)
