五味子乙素降低苯并芘对HTR-8/SVneo细胞毒性作用的体外研究
2016-11-11董渠龙侯海燕陈俊高秀霞陈亚琼
董渠龙,侯海燕,陈俊,高秀霞,陈亚琼
·论著·
五味子乙素降低苯并芘对HTR-8/SVneo细胞毒性作用的体外研究
董渠龙#,侯海燕#,陈俊,高秀霞,陈亚琼
目的:探索苯并芘[Benzo(a)pyrene,BaP]是否对人早孕胎盘绒毛膜外滋养层细胞HTR-8/SVneo具有毒性作用以及五味子乙素(Schisandrin B,Sch B)是否可以降低BaP的毒性作用。方法:以HTR-8/SVneo细胞为载体,构建BaP对HTR-8/SVneo细胞的染毒模型和Sch B对HTR-8/SVneo细胞的保护模型,利用MTS细胞增殖实验检测不同浓度的BaP单独给药和Sch B联合BaP给药对HTR-8/SVneo细胞增殖的影响。结果:0.01,0.1μmol/L浓度的BaP并不抑制HTR-8/SVneo细胞的增殖(P>0.05),而1,10,100μmol/L浓度的BaP对HTR-8/SVneo细胞的增殖有抑制作用(P<0.05)且随着其作用时间(6,12,24,36和48 h)的延长而增大,但作用24 h后其抑制作用趋于平衡,通过绘制HTR-8/ SVneo细胞的生长曲线发现,20μmol/L的BaP对HTR-8/SVneo细胞作用24 h后的抑制作用最佳,其抑制率达到24.95%;0.01,0.1,1μmol/L浓度的Sch B并未抑制HTR-8/SVneo细胞的增殖(P>0.05),高于10μmol/L的Sch B抑制HTR-8/SVneo细胞的增殖(P<0.05)。0.25,0.5,1,2μmol/L的Sch B可以降低BaP的毒性作用且对HTR-8/SVneo细胞没有毒性作用,且其保护作用随着浓度增加而增大(P<0.05),其中2μmol/L的Sch B对HTR-8/SVneo细胞的保护作用最强,保护率达到17.84%。结论:BaP对HTR-8/SVneo细胞具有毒性作用,而一定浓度范围内的Sch B可以有效地降低BaP的这种毒性作用。
苯并芘;五味子素;五味子乙素;滋养层;滋养层细胞;比色法
苯并芘[Benzo(a)pyrene,BaP]是多环芳烃类化合物(polycyclic aromatic hydrocarbons,PAHs)的一种,其广泛存在于空气、水源和食物中[1-2]。BaP因具有强烈的致畸、致癌性被学术界公认为环境毒物[3]。随着研究的深入,近年的一些研究表明BaP还具有生殖毒性[4]。文献报道,BaP不仅可以诱导小鼠卵细胞及卵丘细胞出现明显的DNA损伤,从而降低小鼠的生殖能力[5],还可以严重影响移植前小鼠胚胎的发育、干扰胚胎DNA的稳定性以及诱导细胞凋亡[6]。研究证实,BaP可以在小鼠滋养细胞的体外培养中抑制其增殖[7],从而影响胎盘发育和胎儿生长。滋养细胞是妊娠中极为重要的一种细胞,其在胚胎植入、胎盘发育及母胎血液的交换中发挥重要作用,直接影响胚胎及胎儿的正常发育。BaP对人类滋养细胞是否具有毒性作用尚无报道,但上述研究提示BaP很可能对人滋养细胞有损伤作用,从而对人类产生生殖毒性,这也许是BaP可以引起胎盘功能不良、流产、胚胎停育、早产等不良妊娠结局的机制之一[8-10]。验证BaP是否对人类滋养细胞具有毒性作用对于阐明BaP的生殖毒性具有重要意义,因此本研究以人类滋养细胞HTR-8/SVneo细胞为模型,进行体外试验研究,探讨BaP对滋养细胞是否有损伤作用。
传统中药五子衍宗丸可以促进人类生育力,五味子乙素(Schisandrin B,Sch B)是其君药五味子的主要成分。研究表明,Sch B可以通过激活超氧化物歧化酶、谷胱甘肽等重要的抗氧化酶来抵抗机体的氧化应激并抑制细胞的凋亡[11]。同时,多项研究表明Sch B还可以激活Nrf2-ARE信号通路[12-14],而该通路的激活以及随后的血红素加氧酶、醌氧化还原酶表达可以降低BaP对角质细胞诱导的损伤[15]。
本试验旨在探讨BaP对HTR-8/SVneo细胞是否有直接的损伤作用,同时也探讨Sch B是否可以降低BaP引起的细胞损伤,这对于阐明BaP的生殖毒性和Sch B是否具有预防及治疗BaP引起的生殖毒性具有重要意义。
1 材料与方法
1.1 研究材料HTR-8/SVneo细胞株由加拿大Graham CH教授惠赠并经过相关认证,BaP(美国Sigma公司),Sch B(中国药品生物制品检定所),RPMI1640培养基(美国GIBCO公司),胎牛血清(美国GIBCO公司),胰蛋白酶(北京索莱宝生物科技公司),二甲基亚砜(DMSO,美国Sigma公司),MTS细胞增殖检测试剂盒(Promega北京生物技术有限公司),HERAcell细胞培养箱(美国Thermo公司),IX71倒置显微镜(日本OLYMPUS公司),SW-CJ-1F无菌超净工作台(苏州安泰空气技术公司),移液器(德国Eppendorf公司),imark酶标仪(美国Bio-Rad公司)。
1.2 细胞培养HTR-8/SVneo细胞接种于规格为10 cm细胞培养皿中,给予RPMI1640完全培养基7mL后置于37℃、含5%CO2的细胞培养箱中常规培养。根据细胞生长情况适时进行换液、传代、冻存及MTS细胞增殖实验。
1.3 MTS细胞增殖实验
1.3.1 MTS细胞增殖实验检测BaP对HTR-8/SVneo细胞增殖的抑制效应收集消化的细胞制成单细胞悬浮溶液,将细胞接种于96孔板中(每孔接种8 000个细胞),培养24 h后分组将RPMI1640完全培养基更替为0.01~1 000μmol/L的BaP溶液进行加药处理,同时以0.1%DMSO溶液作为对照组,每组5个孔。继续培养一段时间后(分批次培养6,12,24,36,48 h),加入20μLMTS溶剂+100μLRPMI1640完全培养基混合溶液于37℃下作用2 h,利用酶标仪在492 nm波长处测出每孔的OD值。
1.3.2 MTS细胞增殖实验检测Sch B对HTR-8/SVneo细胞的增殖效应实验方法如上述,不同之处在于加药组为0.01~1 000μmol/L的Sch B溶液。
1.3.3 MTS细胞增殖实验检测Sch B联合BaP给药对HTR-8/SVneo细胞的增殖效应实验方法如上述,不同之处在于加药组为Sch B联合BaP溶液。
1.4 结果计算根据各组所测OD值计算BaP对HTR-8/ SVneo细胞的损伤率和Sch B的保护率。计算公式如下:
保护率(%)=(实验组平均OD值-对照组平均OD值)/对照组平均OD值×100%
1.5 统计学方法采用SPSS 13.0统计软件包进行统计学分析。实验中各数据均为计量资料,以均数±标准差(±s)表示。经检验,各组数据均满足正态性和方差齐性的特点,故采用单因素方差分析(One-Way ANOVA)进行统计分析,组间差别采用LSD法进行检验。P<0.05为差异具有统计学意义。采用Graphpad软件对所得数据进行制图。
2 结果
2.1 BaP抑制HTR-8/SVneo细胞的增殖探索0.01~1 000μmol/L范围内不同浓度的BaP作用HTR-8/SVneo细胞24 h后的细胞增殖情况如图1所示,其中0.01、0.1μmol/L浓度的BaP对HTR-8/ SVneo细胞的增殖没有影响(P>0.05),1,10,100,1 000μmol/L浓度的BaP均抑制HTR-8/SVneo细胞的增殖,其细胞增殖率分别是对照组的92.06%、84.71%、93.75%、93.86%,差异有统计学意义(P<0.05)。由此可知,1,10,100μmol/L浓度的BaP对HTR-8/SVneo增殖的抑制作用最明显,故接下来在此范围内探索BaP的最佳染毒浓度。
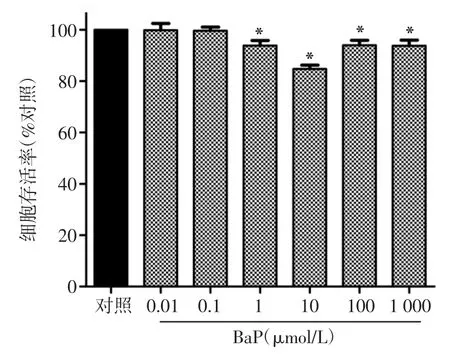
图1 各浓度BaP对HTR-8/SVneo细胞增殖的影响
2.2 不同浓度BaP在不同的作用时间对HTR-8/ SVneo细胞的影响确定BaP抑制HTR-8/SVneo细胞增殖的最佳浓度在1~100μmol/L范围内后,对该范围内的各BaP浓度分别作用HTR-8/SVneo细胞6,12,24,36和48 h后进行MTS细胞增殖实验,绘成细胞生长曲线,见图2(见封三)。从图中可以看出,BaP浓度为1,2.5,5,10,20μmol/L时,其对HTR-8/ SVneo细胞增殖的抑制作用随着浓度的增加而增加,BaP浓度为20,40,100μmol/L时则相反,其中,20μmol/L BaP对HTR-8/SVneo细胞增殖的抑制作用最强,其作用HTR-8/SVneo细胞24 h时抑制率达到24.95%。另外,各浓度BaP对HTR-8/SVneo细胞增殖的抑制作用随着作用时间的延长而增强,但是作用24 h后抑制强度减弱,趋于平衡。
2.3 Sch B对HTR-8/SVneo细胞增殖的影响探索0.01~1 000μmol/L范围内不同浓度的Sch B作用HTR-8/SVneo细胞24 h后的细胞增殖情况,见图3。0.01,0.1,1μmol/L浓度的Sch B并未抑制HTR-8/ SVneo细胞的增殖(P>0.05),其中1μmol/L浓度的Sch B对HTR-8/SVneo细胞有轻微的促增殖作用,但差异无统计学意义(P>0.05);10,100,1 000μmol/L浓度的Sch B则均抑制HTR-8/SVneo细胞的增殖,其细胞增殖率分别是对照组的95.71%、90.02%、81.75%,差异有统计学意义(P<0.05)。
从图3中不难发现,0.1、1、10μmol/L浓度范围内的Sch B中存在着具有潜在的保护作用,故研究0.1~10μmol/L浓度范围的Sch B作用HTR-8/SVneo细胞24 h后的细胞增殖情况,结果如图4所示:0.1 μmol/L浓度的Sch B对HTR-8/SVneo细胞的增殖没有影响(P>0.05);0.25,0.5,1,2,5μmol/L浓度的Sch B对HTR-8/SVneo细胞有轻微的促增殖作用,且在0.25~2μmol/L浓度范围内其促增殖作用随着剂量增加而轻微增加,但差异无统计学意义(P>0.05);10μmol/L浓度的Sch B则抑制了HTR-8/ SVneo细胞的增殖,差异有统计学意义(P<0.05)。
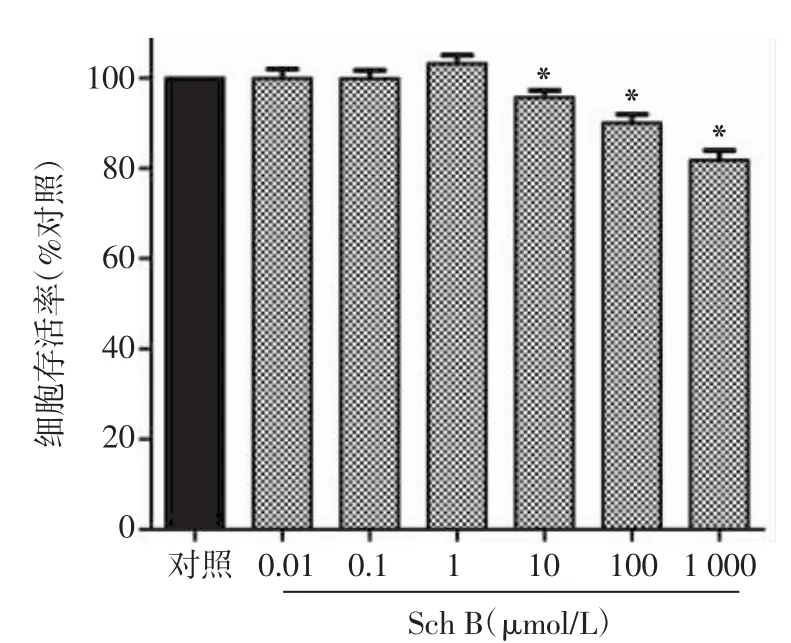
图3 各浓度Sch B对HTR-8/SVneo细胞增殖的影响

图4 确定最佳浓度后的各浓度Sch B对HTR-8/SVneo细胞增殖的影响
2.4 Sch B降低了BaP对HTR-8/SVneo细胞的毒性作用各浓度的Sch B和20μmol/LBaP联合给药作用HTR-8/SVneo细胞24 h后,与正常对照组相比,各组的细胞增殖则受到了不同程度的抑制,但是与BaP单独给药组相比,浓度为0.25,0.5,1,2,5 μmol/L的Sch B联合BaP给药组则促进了HTR-8/ SVneo细胞的增殖,即降低了BaP的毒性作用,且在此浓度范围内其抑制BaP毒性作用随着剂量增加而增加,差异有统计学意义(P<0.05)。10μmol/L的Sch B联合BaP给药组则增强了BaP对HTR-8/ SVneo细胞增殖的抑制作用(P<0.05),见图5。进一步分析各浓度Sch B对抗BaP从而保护HTR-8/ SVneo细胞的效率可以发现,与单独BaP给药组相比,0.1,0.25,0.5,1,2,5μmol/L的Sch B联合BaP给药组的细胞保护率分别为0.94%、2.60%、7.81%、12.05%、17.84%、2.63%;10μmol/L的Sch B联合BaP给药组则进一步抑制了细胞的增殖,其细胞增殖率为BaP单独给药组的96.43%。
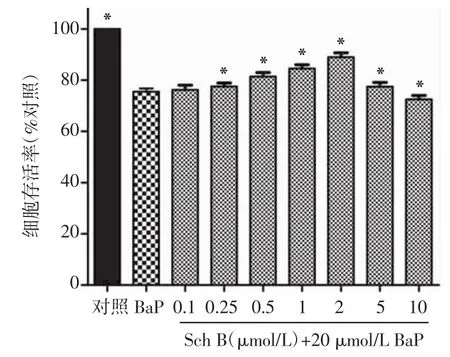
图5 各浓度Sch B联合BaP给药对HTR-8/SVneo细胞增殖的影响
3 讨论
滋养细胞是妊娠中极为重要的一种细胞,其直接参与胚胎植入、胎盘形成及母血交换等过程,其功能异常往往引起流产、胚胎停育、早产等不良妊娠结局。研究证实,BaP可以抑制小鼠滋养细胞的增殖,从而影响小鼠的胎盘发育及胎儿生长[7]。Pratt等[16]的研究发现吸烟女性的绒毛膜细胞滋养层细胞及合体滋养层细胞的二羟环氧BaP(BPDE)-DNA加合物的含量明显高于不吸烟者,而Lee等[17]研究表明BPDEDNA加合物可以产生生物毒性,这提示BaP很可能能够对人滋养细胞造成损害,从而对人类产生生殖毒性。本研究利用MTS细胞增殖实验检测BaP对HTR-8/SVneo细胞增殖的影响,结果发现0.01,0.1 μmol/L的BaP对HTR-8/SVneo细胞增殖不产生抑制作用,但是1,10,100,1 000μmol/L浓度的BaP均不同程度地抑制了HTR-8/SVneo细胞的增殖,且毒性作用在1~100μmol/L浓度范围内最强。为了更加明确BaP的毒性作用,我们将BaP浓度细分为1,2.5,5,10,20,40,100μmol/L共7个浓度梯度,并分批次地作用于HTR-8/SVneo细胞6,12,24,36,48 h,以观察HTR-8/SVneo细胞在不同浓度梯度的BaP不同作用时间下的细胞增殖情况。结果发现,1~100 μmol/L浓度范围内的BaP在各个时间点对HTR-8/ SVneo细胞均有抑制作用,其抑制作用在1,2.5,5,10,20μmol/L浓度范围内随着BaP浓度的增加而增加,在20,40,100μmol/L浓度范围内则相反,且各浓度的BaP对HTR-8/SVneo细胞的毒性都是随着作用时间的延长而增大,但是作用24 h毒性最明显,之后趋于“饱和”状态。因此,本研究明确了BaP对HTR-8/SVneo细胞的毒性作用,我们的前期研究发现孕早期胚胎停育的母亲外周血中BPDE-DNA含量较高[18],这一作用的明确也许可以解释BaP为什么可以引起胎盘功能不良、流产、胚胎停育、早产等不良妊娠结局[8-10,19]。需要注意的是,BaP对HTR-8/ SVneo细胞的毒性作用并不是随着BaP的浓度增加而一味地增加,而是在20μmol/L这个浓度处达到了最大,这可能与本研究中发现过高浓度的BaP易形成结晶,从而降低了BaP的毒性有关。该浓度对细胞的损伤程度与章艳燕等[20]的研究相吻合,且该研究也以20μmol/L的BaP作为染毒剂量,这加强了本实验的可靠性。
本研究又进一步探索了Sch B是否具有对抗BaP毒性从而保护HTR-8/SVneo细胞的作用,首先利用MTS细胞增殖实验验证Sch B本身对HTR-8/ SVneo细胞是否具有毒性作用。研究结果提示,0.01~1μmol/L浓度的Sch B并未抑制HTR-8/SVneo细胞的增殖,0.25,0.5,1,2,5μmol/L浓度的Sch B对HTR-8/SVneo细胞还有轻微的促增殖作用,且在0.25,0.5,1,2μmol/L浓度范围内其促增殖作用随着剂量增加而轻微增加,但是10,100,1 000μmol/L浓度的Sch B则抑制HTR-8/SVneo细胞增殖,即产生了细胞毒性,这说明适量浓度范围内的Sch B(≤5 μmol/L)不会对HTR-8/SVneo细胞产生毒性作用。之后将0.1~10μmol/L浓度Sch B与20μmol/LBaP共同培养24 h,之所以选择20μmol/LBaP浓度并作用24 h是因为前述实验证实该浓度及该作用时间具有最佳的毒性效率,适合探索Sch B的保护作用。结果发现,浓度为0.25,0.5,1,2,5μmol/L的Sch B联合BaP给药组则促进了HTR-8/SVneo细胞的增殖,即降低了BaP的毒性作用,且在此浓度范围内其抑制BaP毒性作用随着剂量增加而增加,但10μmol/L的Sch B联合BaP给药组则增强了BaP的毒性作用,这可能与10μmol/L的Sch B本身就具有细胞毒性有关,当然这种猜测还有待于进一步证实。进一步的分析发现,0.1,0.25,0.5,1,2,5μmol/L的Sch B对HTR-8/SVneo细胞的保护率分别为0.94%、2.60%、7.81%、12.05%、17.84%和2.63%,保护效果明确有效。
至于Sch B如何对抗BaP从而保护HTR-8/ SVneo细胞,本实验尚未明确。但是,从以前的研究中可以推测,这可能与Sch B减轻BaP对HTR-8/ SVneo细胞的氧化损伤、DNA损伤有关[21-23],具体机制还有待于进一步实验研究证实。
综上,本研究证实了BaP对HTR-8/SVneo细胞的毒性作用,也证实了一定浓度范围内的Sch B可以降低BaP的毒性作用,这对于阐明BaP的生殖毒性具有重要作用,同时也为预防或者逆转这一毒性开辟了一条新的道路。希望未来有更深入的机制研究可以阐明BaP的毒性机制和Sch B的保护机制,也相信在不久的将来可以开发出相关药物保护和促进人类生殖健康,为改善不良妊娠结局作出相应贡献。
[1]Nebert DW,Shi Z,Gálvez-Peralta M,et al.Oral benzo[a]pyrene: understanding pharmacokinetics,detoxication,and consequences--Cyp1 knockout mouse lines as a paradigm[J].Mol Pharmacol,2013,84(3):304-313.
[2]Ma Y,Harrad S.Spatiotemporal analysis and human exposure assessmenton polycyclic aromatic hydrocarbons in indoor air,settled house dust,and diet:A review[J].Environ Int,2015,84:7-16.
[3]Kasala ER,Bodduluru LN,Barua CC,et al.Benzo(a)pyrene induced lung cancer:Role of dietary phytochemicals in chemoprevention[J]. PharmacolRep,2015,67(5):996-1009.
[4]Deng X,Pan L,Miao J,et al.Digital gene expression analysis of reproductive toxicity of benzo[a]pyrene in male scallop chlamys farreri[J].Ecotoxicol Environ Saf,2014,110:190-196.
[5]Einaudi L,Courbiere B,Tassistro V,etal.In vivo exposure to benzo(a)pyrene induces significant DNA damage in mouse oocytes and cumulus cells[J].Hum Reprod,2014,29(3):548-554.
[6]Zhan S,Zhang X,Cao S,et al.Benzo(a)pyrene disrupts mouse preimplantation embryo development[J].Fertil Steril,2015,103(3):815-825.
[7]Xie Y,Abdallah ME,Awonuga AO,et al.Benzo(a)pyrene causes PRKAA1/2-dependent ID2 loss in trophoblast stem cells[J].Mol Reprod Dev,2010,77(6):533-539.
[8]Al-Saleh I,Alsabbahen A,Shinwari N,et al.Polycyclic aromatic hydrocarbons(PAHs)as determinants of various anthropometric measures of birth outcome[J].Sci Total Environ,2013,444:565-578.
[9]Wu J,Hou H,Ritz B,et al.Exposure to polycyclic aromatic hydrocarbons and missed abortion in early pregnancy in a Chinese population[J].SciTotalEnviron,2010,408(11):2312-2318.
[10]Duarte-Salles T,Mendez MA,Morales E,et al.Dietary benzo(a)pyrene and fetal growth:effectmodification by vitamin C intake and glutathione S-transferase P1 polymorphism[J].Environ Int,2012,45:1-8.
[11]Deng Y,Xu Z,Xu B,etal.Antioxidativeeffectsofschidandrin B and green tea polyphenols against mercuric chloride-induced hepatotoxicity in rats[J].JEnviron Pathol Toxicol Oncol,2014,33(4):349-361.
[12]Leong PK,Ko KM.Schisandrin B induces an Nrf2-mediated thioredoxin expression and suppresses the activation of inflammasome in vitro and in vivo[J].Biofactors,2015,41(5):314-323.
[13]Ba Q,Cui C,Wen L,et al.Schisandrin B shows neuroprotective effect in 6-OHDA-induced Parkinson′s disease via inhibiting the negative modulation of miR-34a on Nrf2 pathway[J].Biomed Pharmacother,2015,75:165-172.
[14]He JL,Zhou ZW,Yin JJ,et al.Schisandra chinensis regulates drug metabolizing enzymes and drug transporters via activation of Nrf2-mediated signaling pathway[J].Drug DesDevel Ther,2014,9:127-146.
[15]Wu Z,UchiH,Morino-Koga S,etal.Z-Ligustilide inhibitsbenzo(a)pyrene-induced CYP1A1 upregulation in cultured human keratinocytes via ROS-dependent Nrf2 activation[J].Exp Dermatol,2014,23(4):260-265.
[16]PrattMM,King LC,Adams LD,etal.Assessmentofmultiple typesof DNA damage in human placentas from smoking and nonsmoking women in the Czech Republic[J].Environ Mol Mutagen,2011,52(1):58-68.
[17]Lee HW,Wang HT,Weng MW,et al.Cigarette side-stream smoke lung and bladder carcinogenesis:inducingmutagenic acrolein-DNA adducts,inhibiting DNA repair and enhancing anchorageindependent-growth cell transformation[J].Oncotarget,2015,6(32):33226-33236.
[18]侯海燕,杨振华,朱淑平,等.母亲外周血BaP-DNA加合物与孕早期胚胎停育的关系[J].生殖医学杂志,2009,18(2):81-85.
[19]Perera F,PhillipsDH,Wang Y,etal.Prenatalexposure to polycyclic aromatic hydrocarbons/aromatics,BDNF and child development[J]. Environ Res,2015,142:602-608.
[20]章艳燕,侯海燕,陈晓,等.OGG1基因在五味子乙素预防苯并芘所致HTR8-Svneo细胞DNA氧化损伤中的作用[J].国际妇产科学杂志,2015,42(3):315-318.
[21]连立芬,陈亚琼,侯海燕.苯并芘的生殖毒性机制研究进展[J].国际生殖健康/计划生育杂志,2013,32(6):450-453.
[22]吴念,陈亚琼,陈晓,等.五味子乙素对BaP致HTR8-Svneo细胞损伤的保护作用及机制[J].国际妇产科学杂志,2016,43(1):45-48.
[23]章艳燕,侯海燕,陈晓,等.五味子乙素对苯并芘致HTR8-Svneo细胞氧化损伤的保护作用[J].国际妇产科学杂志,2015,34(3):181-183.
[本文编辑王昕]
Schisandrin B Attenuating Benzo(a)pyrene-induced HTR-8/SVneo Cells Damage In Vitro
DONG Qu-long,HOU Hai-
yan,CHEN Jun,GAOXiu-xia,CHEN Ya-qiong.DepartmentofObstetricsand Gynecology,Affiliated HospitalofMedicalCollege of Chinese People′sArmed Police Forces,Tianjin 300162,China(DONGQu-long,HOUHai-yan,CHEN Jun,GAOXiu-xia,CHEN Ya-qiong);Chinese Academy ofMedicalSciences&Peking Union MedicalCollege,Beijing 100730,China(HOUHai-yan)
CHENYa-qiong,E-mail:chenyq82@hotmail.com
Objective:To investigatewhether administering ofbenzo(a)pyrene(BaP)and schisandrin B(Sch B)to human trophoblast HTR-8/SVneo cells has cytotoxicity and cytoprotection,respectively.Methods:By HTR-8/SVneo cells culture in vitro,MTS cell proliferation assay was performed to detect the effectof different concentration of BaP-alone,Sch B-alone and Sch B combiningwith BaP treatmenton cell proliferation.Results:0.01 and 0.1μmol/LBaP did not inhibitHTR-8/SVneo cell proliferation(P>0.05),but1,10 and 100μmol/LBaPall inhibited HTR-8/SVneo cellproliferation(P<0.05).The inhibition rate were presented to be escalated accompanied by escalating BaP time exposure(6,12,24,36 and 48 h),and 24 h BaP
Benzo(a)pyrene;Schizandrin;Schizandrin B;Trophoblast;Trophoblastcell;Colorimetry(JInt Obstet Gynecol,2016,43:585-589,封三)
国家自然科学基金(81273977)
300162天津,中国人民武装警察部队后勤学院附属医院妇产科(董渠龙,侯海燕,陈俊,高秀霞,陈亚琼);中国医学科学院北京协和医学院(侯海燕)
陈亚琼,E-mail:chenyq82@hotmail.com
2016-02-26)
#共同第一作者exposure were presented to be a saturation,especially for 20μmol/L BaP with 24 h exposure which presented a suitable inhibition rate(24.95%).Besides,0.01,0.1 and 1μmol/LSch B did not inhibitHTR-8/SVneo cell proliferation(P>0.05),but the levelof SchB higher than 10μmol/L inhibited HTR-8/SVneo cellproliferation(P<0.05).0.25,0.5,1 and 2μmol/LSch B all attenuated the cytotoxicity induced by BaP in HTR-8/SVneo cellswith a dose-effect relationship,especially for 2μmol/L Sch Bwhich presented a highestprotection rate(17.84%).Conclusions:BaP can directly induce cytotoxicity in HTR-8/SVneo cells,while certain Sch B can attenuate the cytotoxicity.
