Raf-1对人血管内皮细胞增殖及细胞周期的影响
2016-11-10第四军医大学唐都医院肿瘤科西安710038
第四军医大学唐都医院肿瘤科(西安710038)
尤向辉 兰 飞 宋 扬 贺 新 苏海川▲
▲通讯作者
Raf-1对人血管内皮细胞增殖及细胞周期的影响
第四军医大学唐都医院肿瘤科(西安710038)
尤向辉 兰 飞 宋 扬 贺 新 苏海川▲
目的:探讨Raf-1蛋白激酶在血管内皮细胞生长增殖中的作用。方法:分别应用Raf-1蛋白激酶的真核表达载体pCDNA3-raf-1及干涉核苷酸片段Raf-1-siRNA转染人脐静脉内皮细胞(HUVECs),进而应用MTT法绘制HUVECs生长曲线,应用流式细胞仪分析细胞周期。结果:HUVECs转染真核表达载体后,细胞内Raf-1明显增高,与对照组比较,细胞增殖速度明显加快;而转染Raf-1-siRNA后,HUVECs细胞中Raf-1表达水平降低,与对照组比较,细胞增殖速度明显减慢,阻滞于G1期。结论:Raf-1蛋白激酶在血管内皮细胞生长增殖中发挥重要作用。
肿瘤新生血管的生成在肿瘤发生、发展中扮演着重要角色,其一方面为肿瘤生长提供必要的营养,另一方面与肿瘤的侵袭及转移密切相关[1]。因此以新生血管为靶向的肿瘤生物治疗近年来得到了快速发展[2]。丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号转导通路参与了多种恶性肿瘤的发生、发展,其中Raf-1蛋白作为该通路中的一个分子发挥着重要作用[3]。研究显示,在多种恶性肿瘤中,Raf-1表达明显上调,并与患者的预后密切相关[4]。因此针对Raf-1的抗肿瘤靶向药物研究一直是肿瘤生物治疗的热点之一[5]。但当前研究主要集中于通过抑制肿瘤细胞RAF-MEK-ERK信号转导通路,达到靶向治疗肿瘤的目的,而关于Raf-1与肿瘤血管形成、增殖之间的关系还不十分明确。在本研究中,我们通过探讨血管内皮细胞Raf-1对人血管内皮细胞增殖、细胞周期的影响,为Raf-1在肿瘤血管形成、增殖中作用研究打下基础。
材料与方法
1 实验材料 Raf-1真核表达载体pCDNA3-raf-1由本室保存;针对Raf-1的siRNA核苷酸片段Raf-1-siRNA:5’-CCU CAC GCC UUC ACC UUU Adtdt及不相关对照均由上海吉玛公司合成;人脐静脉内皮细胞(HUVECs)取自新鲜脐带,原代培养。抗兔抗人Raf-1抗体、兔抗人phosph-c-Raf(ser388)抗体均购自Cell signaling公司;流式细胞仪(FACSCalibur)购自BD公司;脂质体LipofectamineTM2000购自Invitrogen公司。
2 细胞转染及鉴定 依据脂质体转染试剂盒说明书,分别将真核表达载体pCDNA3-raf-1及小分子干扰RNA(Raf-1-siRNA)转染HUVECs,同时设置空载体(pCDNA3)及空白对照;48 h后,收集HUVECs细胞并进行细胞裂解,Western Blot检测HUVECs细胞中Raf-1及磷酸化Raf-1蛋白表达水平,一抗分别为兔抗人Raf-1抗体、兔抗人phosph-c-Raf(ser388)抗体,二抗为辣根过氧化物酶标记的羊抗兔IgG,同时设置β-Actin对照。
3 MTT检测细胞增殖 调整细胞浓度,以5×105/孔接种于96孔板,培养24 h后,连续7 d进行MTT检测并绘制生长曲线,简述步骤如下:每天测定8孔,每孔中加入20 μl四甲基偶氮唑盐(MTT)液(5 mg/ml),继续培养4 h;吸弃上清,每孔加入150 μl二甲基亚砜(DMSO),充分震荡后,490 nm波长测定吸光值,计算吸光度平均值,以时间为横坐标,吸光度为纵坐标,绘制细胞生长曲线。
4 细胞周期检测 胰酶消化细胞后,应用预冷PBS洗涤2次,加入预冷70%乙醇溶液重悬细胞,于4 ℃过夜,应用预冷PBS洗涤2次后,加入含有50 μg/ml溴化乙锭(PI)、0.2% Triton X-100及100 μg/ml RNase A的PBS 500 μl 4 ℃避光孵育30 min,流式细胞分析仪进行细胞周期检测。
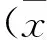
结 果
1 HUVECs细胞Raf-1蛋白水平测定 见图1。HUVECs分别转染pCDNA3-raf-1、Raf-1-siRNA后,Western-blot检测结果显示:转染真核表达载体pCDNA3-raf-1的HUVECs细胞中Raf-1蛋白水平及磷酸化水平较空载体对照组(pCDNA3)、脂质体对照组(lipofectin control)均明显增高(P<0.05);而HUVECs在转染干涉小分子RNA(Raf-1-siRNA)后,Raf-1蛋白水平及磷酸化水平均明显降低(P<0.05)。

图1 Western-blot检测蛋白水平
2 细胞增殖曲线 见图2。应用MTT法分析HUVECs细胞转染pCDNA3-raf-1、Raf-1-siRNA后,细胞生长增殖情况并绘制曲线。转染真核表达载体pCDNA3-raf-1后,HUVECs细胞生长增殖速度与对照组相比较明显增加(P<0.05);而转染干涉RNA小分子Raf-1-siRNA后,细胞增殖速度降低(P<0.05)。
3 细胞周期变化 见附表。应用流式细胞技术分析细胞周期分布情况:HUVECs细胞转染真核表达载体pCDNA3-raf-1后,S期细胞比例与空载体对照组相比较明显增加;相反,转染干涉RNA小分子Raf-1-siRNA后,G1期的HUVECs细胞比例明显增加(P<0.05)。
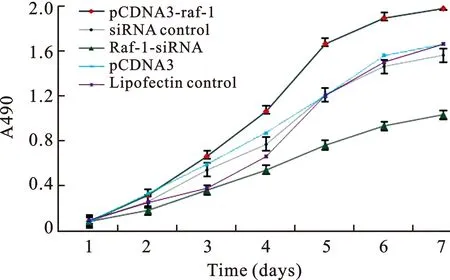
图2 HUVECs细胞增殖曲线
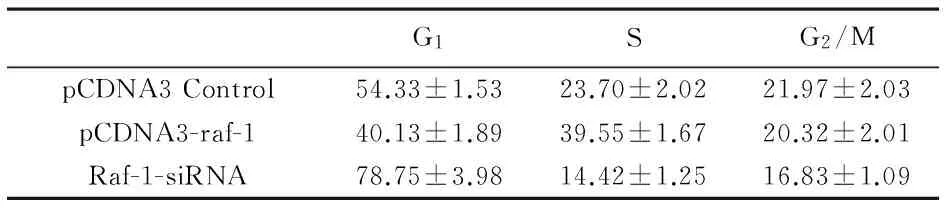
附表 流式细胞技术分析HUVECs细胞周期
讨 论
恶性肿瘤的有效治疗仍旧是人类面临的巨大挑战之一,传统的化疗具有治疗效果差、副作用大、特异性低等缺点。肿瘤微血管的生成在恶性肿瘤发生、发展及转移中扮演着重要角色,因此针对肿瘤血管的生物治疗研究越来越受到人们重视[6]。肿瘤微血管的生成是由多种因素、多种步骤参与的过程,多种细胞如肿瘤细胞、成纤维细胞、内皮细胞均参与了肿瘤微血管的生成。我们在本实验应用HUVECs细胞作为研究对象,HUVECs细胞在体外培养后,可以建立体外人造血管模型,形成网状结构,为以后抗肿瘤血管药物筛选、血管形成机制研究奠定基础[7]。
肿瘤血管生成受到肿瘤微环境中多种信号分子和通路的影响。目前已经有多种靶向肿瘤血管生成的药物进入临床,这些治疗靶标包括:抗血管生成因子、血管内皮生长因子(VEGF)、表皮生长因子受体(EGFR)等[8]。Ras/Raf-1/ERK信号转导通路在调控细胞增殖、分化、凋亡中发挥重要作用,与肿瘤的发生、发展密切相关[9]。在本实验中,为了验证Raf-1在血管内皮细胞增殖中的作用,我们构建了Raf-1真核表达载体并转染HUVECs细胞,结果显示,随着细胞内Raf-1表达增加,其磷酸化水平也明显增加,细胞增殖速度加快;同时,我们设计了针对Raf-1的干涉小RNA,转染HUVECs细胞后,细胞总Raf-1及磷酸化Raf-1水平均明显降低,细胞增殖速度也明显减慢。这些结果进一步明确了Raf-1在血管内皮增殖中具有重要作用,和其在肿瘤细胞中的作用相似,可以促进细胞增殖,为以后肿瘤治疗中以Raf-1为靶点的研究提供了新的实验基础。因此,抗Raf-1靶向药物一方面可通过抑制(降低)肿瘤细胞内Raf-1表达抑制肿瘤细胞生长,另一方面,也可抑制(降低)肿瘤血管内皮细胞内Raf-1表达,抑制肿瘤血管的生成,进而抑制肿瘤的增殖、侵润、转移等。
综上所述,本研究通过研究Raf-1对HUVECs细胞周期及增殖速度的影响,初步证实了其在新生血管内皮细胞中的作用,为进一步研究Raf-1在血管生成、肿瘤微循环中发挥的作用研究奠定了基础,也为肿瘤治疗靶点Raf-1在抗肿瘤血管治疗中的应用提供了新的实验依据。
[1] 张天一, 刘 丹, 李航宇, 等. Endoglin与肿瘤血管生成、浸润及转移之问的关系[J].现代肿瘤医学, 2014, 22(9):2225-2228.
[2] 杨丽桦,何融泉,张昌文,等.表皮生长因子受体靶向治疗鼻咽癌的研究进展[J].广东医学,2015,36(18):2929-2931.
[3] Zhang K, Chen H, Zhang B,etal. Overexpression of Raf-1 and ERK1/2 in sacral chordoma and association with tumor recurrence[J]. Int J Clin Exp Pathol,2015,8(1):608-614.
[4] Chen L, Shi Y, Jiang CY,etal. Expression and prognostic role of pan-Ras, Raf-1, pMEK1 and pERK1/2 in patients with hepatocellular carcinoma[J]. Eur J Surg Oncol,2011, 37(6):513-520.
[5] 祝 宇,华涛涛,赵砚瑾,等.新型酰基脲类Raf激酶抑制剂的合成及其抗肿瘤活性[J].化学合成,2015,23(9): 844-848.
[6] Li X, Wu M, Pan L,etal. Tumor vascular-targeted co-delivery of anti-angiogenesis and for synergetic therapy of tumor[J]. Int J Nanomedicine,2015,11: 93-105.
[7] 肖 辉,阚 轩,金德均,等.内皮抑素对人脐静脉内皮细胞(HUVEC)及体外微血管模型的作用及其可能的机制[J].现代生物医学进展,2006, 6(7):24-26.
[8] 张百红,岳红云.肿瘤新治疗靶标的研究进展[J].现代肿瘤医学, 2015, 23(7): 1012-1016.
[9] Jokinen E, Koivunen JP. MEK and PI3K inhibition in solid tumors: rationale and evidence to date[J]. Ther Adv Med Oncol, 2015, 7(3):170-180.
(收稿:2016-01-27)
The function of raf-1 in proliferation,cell cycle of human vascular endothelial cells
Department of Oncology,Tangdu Hospital of FMMU(Xi’an 710038)
You Xianghui Lan Fei Song Yang et al
Objective: To investigate the function of Raf-1 in cell proliferation and cell cycles in vascular endothelial cells. Methods: The Human Umbilical Vein Endothelial Cells(HUVECs) were transfected with the eukaryotic expression vector pCDNA3-raf-1 or Small interference RNA Raf-1-siRNA.Then, the cells growth curves were draw according of MTT, and cell cycles were detected by FACs. Results: After the HUVECs were transfected with the eukaryotic expression vector pCDNA3-raf-1,the proliferation of HUVECs increased significantly than the control. Vice versa, after the HUVECs were transfected with Raf-1-siRNA, the Raf-1 expression decreased, and the amplification of HUVECs was slower down than the control, the cell cycles were arrested at G1phase. Conclusion: The raf-1 plays an important role in the growth of vascular endothelial cells.
Mitogen-activated protein kinase kinases Human umbilical vein endothelial cells Neoplasm metastasis @Vascular endothelial cells
丝裂原活化蛋白激酶磷酸酶 人脐静脉内皮细胞 肿瘤转移 @肿瘤血管生成
R73-37
A
10.3969/j.issn.1000-7377.2016.10.004
