肥胖2型糖尿病患者腹腔内脂肪面积与胰岛素抵抗的相关性
2016-11-10林毅辉雷闽湘蒋建家黄文森
林毅辉,雷闽湘, 蒋建家, 黄文森
(1中南大学湘雅医院内分泌科,长沙 410000; 2福建医科大学附属泉州第一医院内分泌科; *通讯作者,E-mail:LMX618@medmail.com.cn)
肥胖2型糖尿病患者腹腔内脂肪面积与胰岛素抵抗的相关性
林毅辉1,2,雷闽湘1*, 蒋建家2, 黄文森2
(1中南大学湘雅医院内分泌科,长沙410000;2福建医科大学附属泉州第一医院内分泌科;*通讯作者,E-mail:LMX618@medmail.com.cn)
目的观察肥胖2型糖尿病患者腹腔内脂肪面积与胰岛素抵抗的相关性。方法170例新诊断的肥胖2型糖尿病患者采用螺旋CT于空腹状态下行腹部扫描,扫描相当于腰椎4-5水平,选定脂肪组织CT值范围为(-250)-(-50)Hu,测定该横断面腹腔内上述CT值范围的像素面积和为腹腔内脂肪面积(VA),按腹腔内脂肪面积分为皮下脂肪型肥胖组(DM1:腹腔内脂肪面积<100 cm2,n=68,男性/女性=29/39),内脏脂肪型肥胖组(DM2:腹腔内脂肪面积≥100 cm2,n=102,男性/女性=41/61),收集患者体重、身高、腰围、血压、血脂、糖化血红蛋白、空腹血糖、空腹胰岛素、腹腔内脂肪面积、皮下脂肪面积等指标,计算稳态模型评估胰岛素抵抗指数、体重指数,比较两组间差异,并将腔内脂肪面积与HOMA-IR进行双变量分析及偏相关分析。结果DM2组的体质量指数、腰围、收缩压、舒张压、糖化血红蛋白、稳态模型评估的胰岛素抵抗指数、总胆固醇、低密度脂蛋白胆固醇均高于DM1组,差异有统计学意义(P<0.05),双变量及偏相关分析显示腹腔内脂肪面积与HOMA-IR显著相关,且呈正相关(P<0.05),而与皮下脂肪面积无关。结论肥胖2型糖尿病胰岛素抵抗与腹腔内脂肪面积呈正相关,而与皮下脂肪面积无显著相关性。
腹腔内脂肪面积;肥胖;2型糖尿病;胰岛素抵抗
在2007-2008年全国调查的数据中,按WHO诊断标准,超重人群占25.1%,肥胖人群占5%.肥胖,特别是腹型肥胖,与增加的胰岛素抵抗有关,并且也是2型糖尿病发生和进展的一个重要危险因素[1]。中国2型糖尿病防治指南(2013版)中提出以腰围(男性≥90 cm,女性≥85 cm)取代体质量指数(BMI)作为代谢综合征中肥胖的诊断标准[2],这一改变强调了腹型肥胖与胰岛素抵抗的相关性,但是单纯以腰围来诊断腹型肥胖最大的问题是无法区分腰围的增加到底是内脏脂肪还是皮下脂肪的堆积,而目前研究已证实内脏脂肪、皮下脂肪两者在成脂能力、分泌功能、受体分布和细胞内酶的活性等方面有显著差异[3]。内脏脂肪堆积以腹腔内脂肪面积(visceral fat area ,VA)表示,国内外对其相关研究数据较少。本研究旨在探讨肥胖2型糖尿病患者腹腔内脂肪面积(VA)与胰岛素抵抗的相关性。
1 资料与方法
1.1研究对象
选择2014-01~2015-08在福建医科大学附属泉州第一医院内分泌科新诊断的肥胖2型糖尿病患者共170例,其中男性90例,女性80例。入选标准:①符合1999年WHO糖尿病诊断标准及2型糖尿病分型标准;②体质量指数BMI≥25 kg/m2。排除标准:①1型糖尿病、妊娠期糖尿病及特殊类型糖尿病;②2型糖尿病合并糖尿病急性并发症、感染、应激等情况;③妊娠、哺乳期或长期服用避孕药妇女;④其他原因引起的肥胖(如多囊卵巢综合征、皮质醇增多症等);⑤肝肾功能不全(谷丙转氨酶>40 U/L,肌酐>130 μmol/L)。将入选患者按VA<100 cm2,VA≥100 cm2[4]分为皮下脂肪型肥胖组(DM1组,n=68,男性29例,女性39例)和内脏脂肪型肥胖组(DM2组,n=102,男性41例,女性61例)。研究方案遵循赫尔辛基宣言和药物临床试验质量管理规范(GCP),试验开始前征得受试者同意并签署知情同意书。
1.2方法
1.2.1体格检查以标准方法由内分泌科专业医师专人测量身高(H)、体重(W)、腰围(WC)、血压(常规袖套式血压计测量),体重指数(BMI)的计算为体重(kg)/身高2(m2)。
1.2.2腹部脂肪含量和分布采用螺旋CT于空腹状态下行腹部扫描,患者仰卧并于扫描过程中屏气,扫描相当于腰椎4-5水平。选定脂肪组织CT值范围为(-250)-(-50)Hu,测定腹部横断面内在上述CT值范围的像素面积和为腹部总脂肪面积,测定该横断面腹腔内上述CT值范围的像素面积和为腹腔内脂肪面积(VA),腹部皮下脂肪面积(SA)等于腹部总脂肪面积减去腹腔内脂肪面积(VA)。
1.2.3生化指标测定所有患者于入院第2天空腹取静脉血,使用日立7070全自动生化分析仪检测甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),使用日本TOSOH公司的HLC-723G7全自动糖化血红蛋白分析仪检测糖化血红蛋白(HbA1c)。葡萄糖氧化酶法测定空腹血糖(FPG),免疫化学发光法测定空腹胰岛素(FINS),稳态模型评估的胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5。
1.3统计学处理
2 结果
2.1DM1组与DM2组的临床资料比较
两组间年龄、性别差异无统计学意义(P>0.05)。DM2组的BMI、WC、SBP、DBP、HbA1c、HOMA-IR、TC、LDL-C均高于DM1组,差异有统计学意义(P<0.05,见表1)。
2.2相关分析
HOMA-IR分别与BMI、腰围、SBP、DBP、HbA1c、VA、SA、TC、LDL-C进行双变量分析,HOMA-IR与BMI(r=0.175)、腰围(r=0.299)、HbA1c(r=0.202)、LDL-C(r=0.213)、VA(r=0.463)正相关(P<0.05),而与SBP、DBP、SA、TC无显著相关性(P>0.05)。进一步行偏相关分析显示,校正BMI、HbA1c、腰围、LDL-C后,HOMA-IR水平仍与VA呈正相关(r=0.411,P<0.05)。
表1DM1组与DM2组的临床资料比较
Table 1Comparison of clinical parameters between DM1 group and DM2 group cases(%)
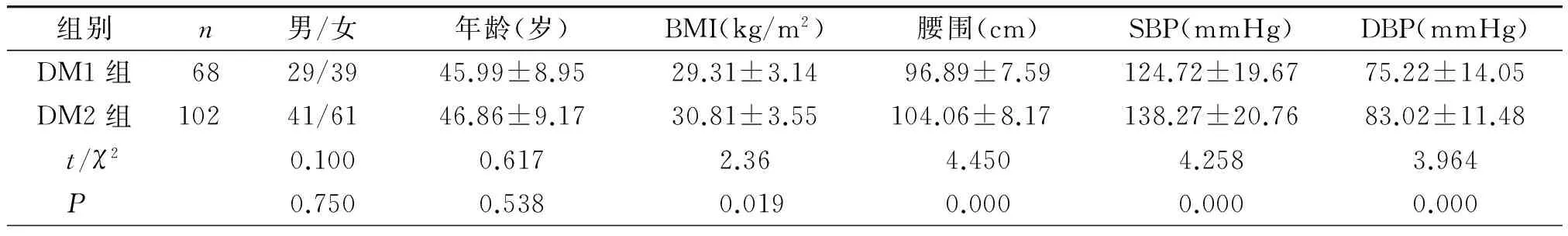
组别n男/女年龄(岁)BMI(kg/m2)腰围(cm)SBP(mmHg)DBP(mmHg)DM1组6829/3945.99±8.9529.31±3.1496.89±7.59124.72±19.6775.22±14.05DM2组10241/6146.86±9.1730.81±3.55104.06±8.17138.27±20.7683.02±11.48 t/χ20.1000.6172.364.4504.2583.964 P0.7500.5380.0190.0000.0000.000
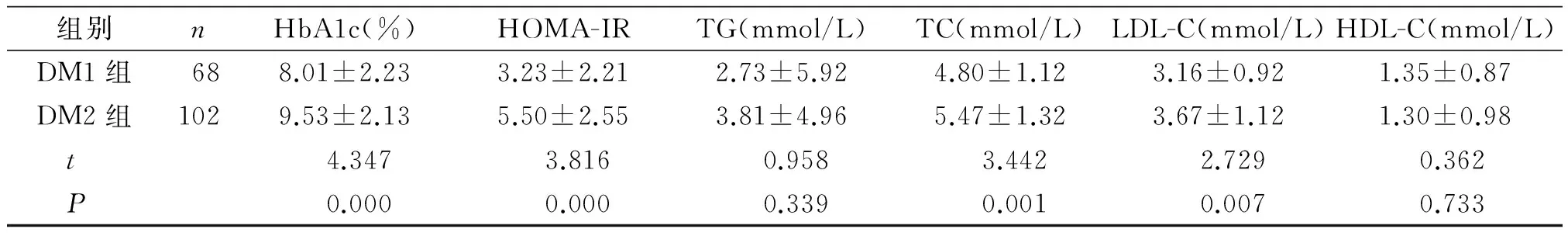
组别nHbA1c(%)HOMA-IRTG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)DM1组688.01±2.233.23±2.212.73±5.924.80±1.123.16±0.921.35±0.87DM2组1029.53±2.135.50±2.553.81±4.965.47±1.323.67±1.121.30±0.98 t4.3473.8160.9583.4422.7290.362 P0.0000.0000.3390.0010.0070.733
3 讨论
肥胖是2型糖尿病的最主要危险因素,BMI与2型糖尿病有明确的正相关性[5]。肥胖与2型糖尿病的危险性不仅表现为脂肪总数的增加,更与体内脂肪的分布相关,腹部脂肪堆积引起的内脏脂肪型肥胖导致胰岛素抵抗增加,是2型糖尿病发生发展的一个重要因素。内脏脂肪型肥胖的评估方法包括腰围、腰臀比、腹部矢状径、超声、CT、MRI等,而CT是确立内脏脂肪型肥胖诊断的金标准,可较好地区分内脏脂肪和皮下脂肪,本研究采用螺旋CT测量腹腔内脂肪面积(VA)和腹部皮下脂肪面积(SA),并以CT检查确定的VA≥100 cm2作为判断内脏脂肪型肥胖的诊断标准。目前临床上常用腰围作为内脏型肥胖的诊断标准,但腰围作为判断标准有一定的局限性。Schneider等[6]学者研究显示,身高对腰围评价内脏脂肪型肥胖的效果存在一定影响,特别是当身高差别较大时,其评价效能有可能降低。而国内学者研究显示[7],在腰围相似人群中,VA≥100 cm2人群胰岛素抵抗显著高于VA<100 cm2人群。本研究显示HOMA-IR与BMI(r=0.175)、腰围(r=0.299)、VA(r=0.463)均呈正相关(P<0.05),进一步行偏相关分析显示,校正BMI、HbA1c、腰围、LDL-C后,VA仍与HOMA-IR水平呈正相关(r=0.411,P<0.05),提示VA为肥胖2型糖尿病患者胰岛素抵抗的独立危险因素。
Sandeep等[8]研究显示内脏脂肪更易导致胰岛素抵抗,Sironi等[9]进行的一项涉及113名受试者的研究显示内脏脂肪含量与冠心病风险正相关,而与胰岛素敏感性负相关。腹部皮下脂肪与胰岛素抵抗的相关性则争议较大。Fain等[10]研究显示腹部皮下脂肪与内脏脂肪均与胰岛素抵抗相关,但内脏脂肪与HOMA-IR关系更为密切,Kim等[11]研究则认为腹部皮下脂肪面积和胰岛素抵抗呈反比。本研究结果显示:HOMA-IR与VA密切相关,且呈正相关(r=0.463,P<0.05),与SA无明显相关性(P>0.05)。内脏脂肪堆积引起胰岛素抵抗的机制目前考虑主要有以下几个方面:①脂肪组织不仅是储能器官,而且是一个功能活跃的内分泌器官,可以分泌多种细胞因子,如瘦素、IL-6、TNF-α、抵抗素、单核细胞趋化蛋白-1(MCP-l)、脂联素等,这些因子与2型糖尿病的发生发展密切相关。内脏型肥胖人群内脏脂肪细胞增大会导致其分泌过多的瘦素、IL-6、TNF-α、抵抗素、单核细胞趋化蛋白-1(MCP-l),脂联素的分泌量却是减少的,这些细胞因子分泌水平,尤其是脂联素水平的变化会使肥胖和2型糖尿病人群发生胰岛素抵抗的风险增加[12]。周逸丹等[13]的研究亦证实,脂联素的浓度与人体胰岛素抵抗呈负相关。相对于内脏脂肪,皮下脂肪可以分泌更多的脂联素,这可能是腹腔内脂肪面积和皮下脂肪面积与胰岛素抵抗相关性差异的重要原因。②内脏脂肪组织分泌大量的游离脂肪酸(FFA)损害胰岛β细胞功能。内脏脂肪具有较多转运脂肪酸的通道,使得它的代谢活性高于皮下脂肪,因此可以释放更多游离脂肪酸。王冰等[14]进行的动物实验显示,高游离脂肪酸可引起大鼠β细胞自身胰岛素抵抗。人体的相关研究亦显示:当胰岛细胞暴露于游离脂肪酸,在短期内胰岛素分泌增加[15],但长期会损害β细胞的敏感性和分泌功能[16]。过多的游离脂肪酸从腹内脂肪组织外溢,流向非脂肪细胞,如胰岛细胞、肝细胞、骨骼肌细胞、心肌细胞、内皮细胞等,并在该处发生脂质的异位沉积,导致或加重相关靶器官的胰岛素抵抗[17]。
腹腔内脂肪面积不仅与胰岛素抵抗密切相关,而且可以预测冠状动脉硬化的风险。Sironi等[9]的研究证实,内脏脂肪含量和以Framingham分数衡量的冠心病风险正相关。与BMI相比,腹腔内脂肪面积可更显著预测冠状动脉疾病风险,腹腔内脂肪面积与冠状动脉疾病危险因素协同能更好地预测冠脉非钙化型斑块的进展。
综上所述,在肥胖2型糖尿病患者中,脂肪分布主要是腹腔内脂肪面积,而非肥胖本身,引起或加重胰岛素抵抗,推动了2型糖尿病的进程,同时腹腔内脂肪面积还可以评估2型糖尿病主要慢性并发症冠心病的风险。因此,在肥胖2型糖尿病患者中,腹腔内脂肪面积可作为胰岛素抵抗和冠心病风险的评估监测项目。
[1]邹大进.利拉鲁肽:控制体重和减少内脏脂肪有助于2型糖尿病综合管理[J].中华内分泌代谢杂志,2013,29(7):增录7b1-7b4.
[2]中华医学会糖尿病学分会.2013版2型中国糖尿病防治指南[J]. 中华内分泌代谢杂志,2014,30(10):893-942.
[3]蒋建家,曾又晓,林振忠,等.肥胖者内脏脂肪蓄积与脂代谢的关系[J].心血管康复医学杂志,2012,21(5):489-491.
[4]Examination Committee of Criteria for Obesity Disease in Japan,Japan Society for the study of Obesity.New criteria for obesity disease in Japan[J].Circ J,2002,66(11):987-992.
[5]GraciaArnaiz M.Obesity as disease and as social problem[J].Gac Med Mex,2010,146(6):389-396.
[6]Schneider HJ,Klotche J,Silber S,etal.Measuring abdominal obesity:effects of height on distribution of cardiometabolic risk factors risk using waist circumference and waist-to-height ratio[J].Diabetes Care,201l,34(1):e7.
[7]何洪波,赵志刚,蒲云飞,等.腹型肥胖的类型与代谢综合征发生的风险[J] .中华医学杂志,2008,88(18):1251-1254.
[8]Sandeep S,Gokulakrishnan K,Velmumgan K,etal.Visceral & subcutaneous abdominal fat in relation to insulin resistance & metabolic syndrome in nondiabetic south Indians[J]. Indian J Med Res,20lO,13l:629-635.
[9]Sironi AM,Petz R,De-Marchi D,etal.Impact of increased visceral and cardiac fat on cardiometabolic risk and disease[J].Diabet Med,2012,29(5):622-627.
[10]Fain JN,Buehrer B,Bahouth SW,etal.Comparison of messenger RNA distribution for 60 proteins in fat cells vs.the nonfat cells of human omental adipose tissue[J].Metabolism,2008,57(7):1005-1015.
[11]Kim S,Cho B,Lee H,etal.Distribution of abdominal visceral and subcutaneous adipose tissue and metabolic syndrome in a Korean population[J].Diabetes Care,2011,34(2):504-506.
[12]Guilherme A,Virbasius JV,Puri V,etal.Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes[J].Nat Rev Mol cell Biol,2008,9(5):367-377.
[13]周逸丹,吴佳丽,李利,等.不同糖代谢水平血清脂联素与胰岛素抵抗及血管舒张功能相关性研究[J].中国急诊医学杂志,2011,20(5):519-523.
[14]王冰,李宏亮,杨文英,等.高游离脂肪酸致大鼠β细胞自身胰岛素抵抗的机制[J].中国医师杂志,2013,15(5):604-608.
[15]Wen H,Gris D,Lei Y,etal.Fatty acid-induced NLRP3-ASC inflammasome activation interferes with insulin signaling[J].Nat Immunol,2011,12(5):408-415.
[16]Cascio G,Schiera G,DiLiegro I.Dietary fatty acids in metabolic syndrome,diabetes and cardiovascular diseases[J].Curt Diabetes Rev,2012,8(1):2-17.
[17]陈燕铭,王曼曼,王自明,等.2型糖尿病合并脂肪性肝病患者炎性因子和脂联素的变化及意义[J].中国综合临床,2012,28(1):1-5.
Correlation between visceral fat area with insulin resistance in obese patients with type 2 diabetes mellitus
LIN Yihui1,2,LEI Minxiang1*,JIANG Jianjia2,HUANG Wensen2
(1DepartmentofEndocrinology,XiangyaHospitalCentralSouthUniversity,Changsha410000,China;2DepartmentofEndocrinology,QuanzhouFirstHospitalAffiliatedtoFujianMedicalUniversity;*Correspondingauthor,E-mail:LMX618@medmail.com.cn)
ObjectiveTo explore the association of visceral fat area with insulin resistance in obese type 2 diabetic patients.MethodsThe abdominals of 170 newly diagnosed obese type 2 diabetic patients under fasting state were scanned by spiral CT at lumbar 4-5 level and in the range of fat area(-250)-(-50)Hu. The patients were divided into subcutaneous lard type obesity group (DM1: visceral fat area<100 cm2,n=68, the ratio of male to female of 29∶39) and visceral obesity group (DM2:visceral fat area≥100 cm2,n=68, the ratio of male to female of 41∶61) according to visceral fat area. The weight, height, waist circumference, blood pressure, blood lipids, glycosylated hemoglobin, fasting glucose, fasting insulin, abdominal fat area,subcutaneous fat area(SA) were collected. The homeostasis model assessment insulin resistance index and body mass index were calculated and compared between two groups, and double variables analysis and partial correlation were applied to analyze the visceral fat area and HOMA-IR.ResultsThe body mass index, waist circumference, systolic pressure, diastolic pressure, glycosylated hemoglobin, homeostasis model assessment insulin resistance index, cholesterol, low density lipoprotein in DM2 group were significantly higher than in DM1 group. Double variables analysis and the partial correlation showed that visceral fat area was positively correlated with HOMA-IR(P<0.05),but not with SA.ConclusionInsulin resistance in obese type 2 diabetes mellitus patients is positively correlated with visceral fat area but not with the subcutaneous fat area.
abdominal fat area;obesity;type 2 diabetes mellitus;insulin resistance
林毅辉,男,1975-01生,本科,副主任医师,E-mail:1157840276@qq.com
2016-06-28
R587.1
A
1007-6611(2016)10-0922-04DOI:10.13753/j.issn.1007-6611.2016.10.010
