丘脑背内侧核损毁对大鼠内侧前额叶皮层神经元电活动的影响
2016-11-10范玲玲孙保玉胡志红任爱红胡咏梅闫君宝
范玲玲, 孙保玉, 邓 博, 胡志红, 任爱红, 胡咏梅, 闫君宝
(1河南科技大学医学院生理学系,洛阳 471023; 2洛阳市妇女儿童医疗保健中心急诊科; *通讯作者,E-mail:emmafll@163.com)
丘脑背内侧核损毁对大鼠内侧前额叶皮层神经元电活动的影响
范玲玲1*, 孙保玉2, 邓博1, 胡志红1, 任爱红1, 胡咏梅1, 闫君宝1
(1河南科技大学医学院生理学系,洛阳471023;2洛阳市妇女儿童医疗保健中心急诊科;*通讯作者,E-mail:emmafll@163.com)
目的探讨丘脑背内侧核(MD)损毁对大鼠内侧前额叶皮层(mPFC)中神经元电活动的影响。方法实验大鼠随机分成正常组(n=15)和MD损毁组(n=15),MD损毁后2周,采用在体细胞外生物电记录的方法,观察mPFC中锥体神经元以及中间神经元的放电频率、变异系数以及放电形式的变化。结果与正常组大鼠相比,损毁MD后,大鼠mPFC中锥体神经元的放电频率较正常组显著增加,且差异具有统计学意义(P<0.001),放电形式更趋于爆发式活动;而mPFC中间神经元的放电频率在MD损毁后明显降低,与正常组相比差异有统计学意义(P<0.05),且放电形式趋向于不规则。结论MD损毁对大鼠mPFC锥体及中间神经元的电活动均有显著影响,表明MD对mPFC的功能活动可能起到重要的调节作用。
内侧前额叶皮层;丘脑背内侧核;电生理学;大鼠
内侧前额叶皮层(medial prefrontal cortex, mPFC)调控许多脑的高级功能,是治疗精神疾病的脑内药物靶点[1]。mPFC内的神经元以谷氨酸为神经递质的兴奋性锥体神经元为主,另有小部分γ-氨基丁酸(γ-aminobutyric acid, GABA)能抑制性中间神经元。mPFC在认知过程及情绪调控中都发挥重要作用,其功能异常与情感和智能障碍有关[2]。丘脑背内侧核(mediodorsal thalamic nucleus, MD)与mPFC间存在着大量的往返纤维投射。MD在情感、认知、学习和记忆等方面具有重要作用。临床证据显示,由肿瘤、意外伤害和退行性疾病引起的MD损伤可导致健忘症和痴呆。研究证据表明MD的形态、代谢改变和抑郁症状有直接关系[3]。MD是处理进出mPFC不同区域神经信息的核心结构[4],提示MD参与了mPFC的一些重要的生理功能。因此,本研究拟通过观察MD毁损后大鼠mPFC锥体和中间神经元电活动的变化,探讨MD对mPFC神经功能的影响。
1 材料与方法
1.1实验动物和试剂
清洁级封闭群雄性SD大鼠,体重270-350 g,全部购自西安交通大学实验动物中心,在标准环境下饲养,室温(21±2)℃,24 h昼夜循环光照,自由摄食、饮水。30只大鼠随机分成正常组(n=15)和MD损毁组(n=15)。所有实验均遵循实验动物管理和使用的相关规定。鹅膏蕈氨酸(ibotenic acid,IBO)购自于美国Sigma公司(St. Louis,MO,美国)。IBO溶于PBS。SN-2N动物脑立体定位仪(日本Narishige公司),CED1401 Spike2生物电信号采集与分析系统(英国Cambridge Electronic Design公司),G63Q4-A型打标仪(西安勤业仪表厂),CM-1900-1恒冷冰冻切片机(德国Leica公司)。
1.2IBO损毁MD
腹腔注射4%水合氯醛(400 mg/kg)麻醉大鼠,将大鼠头部固定于立体定位仪上,根据Paxinos-Watson大鼠脑定位图谱确定MD三维坐标位置:前囟后2.8 mm,旁开0.5-0.6 mm,颅骨下5.3 mm。微型电钻打开颅骨,剥离硬脑膜。利用尖端与玻璃微电极密闭相连的1 μl Hamilton微量注射器,按确定的坐标缓慢进针,将总量为0.3 μl的IBO溶液(10 μg/μl)注射到MD内,给药速度0.1 μl/min,注射完毕微注射器留置5 min,缓慢退出以防止药物逆流;彻底止血后缝合皮肤。
1.3在体电生理记录
mPFC神经元电生理记录在MD毁损后第2周进行,方法同前期实验[5]。简而言之,大鼠腹腔注射4%水合氯醛麻醉(400 mg/kg),行气管及颈外静脉插管术后,头部用立体定位仪固定。实验中随时静脉注射补充麻醉药(80 mg/kg),全程进行心电监控。采用玻璃微电极细胞外记录法记录mPFC(前囟前2.7-3.4 mm,旁开0.5-1.0 mm,颅骨下1.5-4.0 mm)神经元的电活动。细胞放电经微电极放大器显示于记忆示波器,并储存在装有Spike 2分析软件的计算机内,可随时进行离线分析。基础自发放电频率能稳定维持2 min的神经元放电被纳入下一步实验。同时计算平均放电间隔(interspike interval,ISI)的变异系数。判定放电形式和计算所有指标要求必须至少连续记录500个以上连续的动作电位。
1.4组织学染色判定记录位点及MD损毁情况
在电生理学记录完毕后,通过玻璃微电极电泳滂胺天蓝标记最后一个记录位点(-20 μA,15 min)。大鼠在过量麻醉下,灌注固定,取脑,行连续冠状冰冻切片,Nissl染色确定电生理记录点位置以及MD损毁情况。
1.5统计学分析
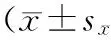
2 结果
在本实验中,所有电生理学记录位点均通过玻璃微电极电泳滂胺天蓝标记后,经组织学染色证实位于mPFC内(见图1A)。图1B显示的是mPFC中锥体神经元和中间神经元的自发电活动和动作电位波形。
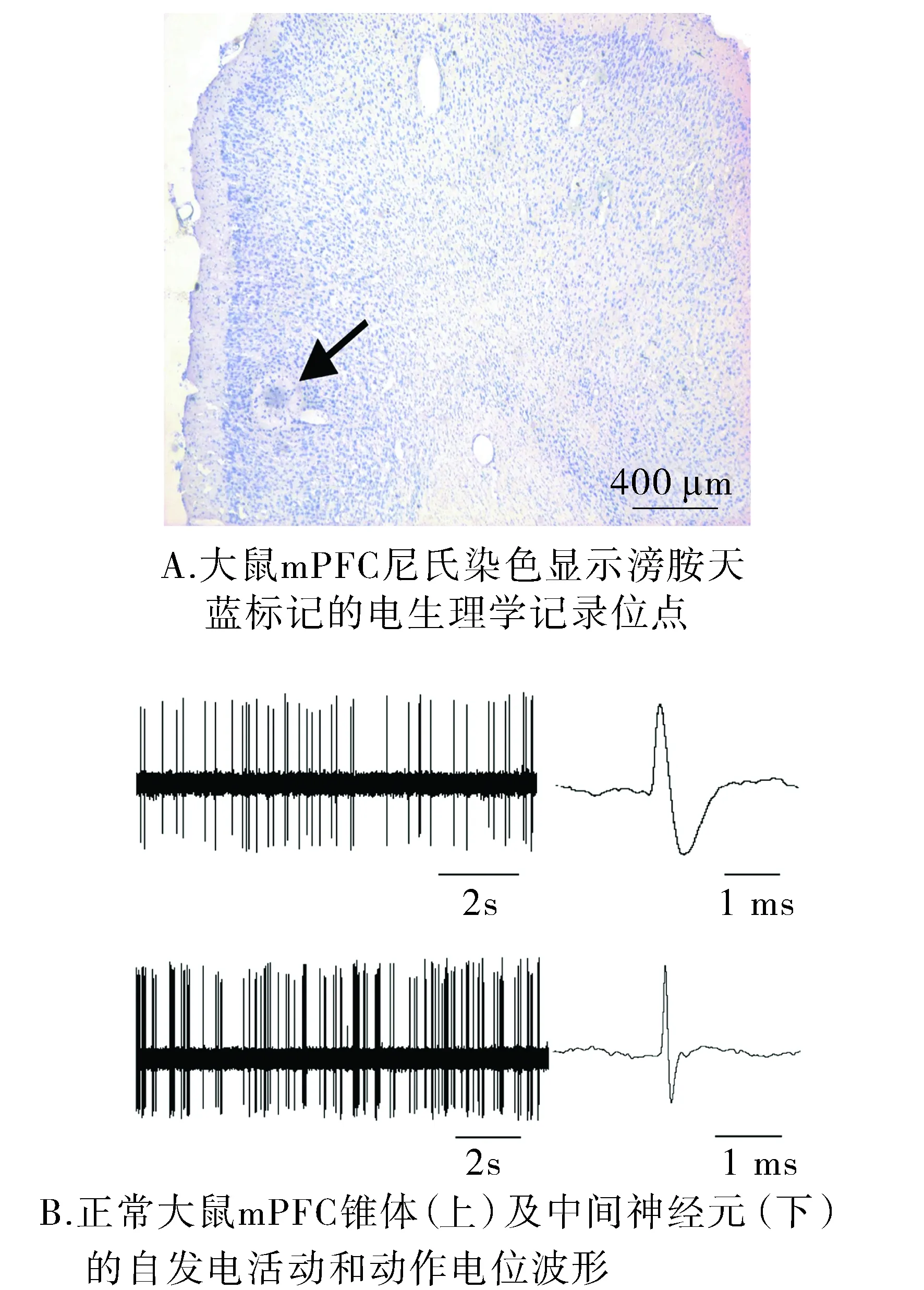
图1 大鼠mPFC中的记录位点以及mPFC锥体及中间神经元的放电特征Figure 1 The localization of the neurons recorded in mPFC of rat and spontaneos firing activity of mPFC pyramidal neurons and interneurons
2.1MD损毁效果
MD损毁的大鼠在电生理记录完毕后进行切片,尼氏染色,观察MD损毁的效果。在IBO注射2周后,与未损毁侧对比,损毁侧MD内的神经元发生固缩(见图2)。虚线表示MD核团的的范围。凡损伤位置有偏差,累及到MD周围如丘脑中央内侧核、丘脑室旁核和内侧缰核等核团的,其电生理记录结果予以剔除。

MHb:内侧缰核图2 尼氏染色显示MD的损毁效果Figure 2 Cresyl violet staining of the lesion of the MD
2.2大鼠mPFC中锥体和中间神经元的自发电活动
正常组大鼠锥体神经元的平均放电频率为(1.26±0.12)Hz,大多数神经元(75%)呈现不规则放电,只有25%的神经元为爆发式放电(见图3),平均ISI的变异系数为1.2±0.07(见表1);中间神经元的平均放电频率为(9.35±1.16)Hz,49%的神经元为爆发式放电,51%的神经元是不规则放电(见图3),平均ISI的变异系数为1.49±0.07(见表1)。
IBO损毁MD 后,大鼠mPFC锥体神经元平均放电频率为(2.36±0.27)Hz,显著高于正常组(P<0.001,见表1);其爆发式放电神经元的比例较正常组大鼠显著增高(64%),不规则放电神经元的比例显著降低(36%)(见图3);平均ISI的变异系数显著增加到1.74±0.11(见表1)。MD损毁后,mPFC中间神经元的平均放电频率为(6.55±0.68)Hz,显著低于正常组(P=0.036);放电形式更趋于不规则,爆发式放电占39%,不规则放电占61%(见图3);平均ISI的变异系数为2.02±0.08,与正常组相比显著升高(见表1)。
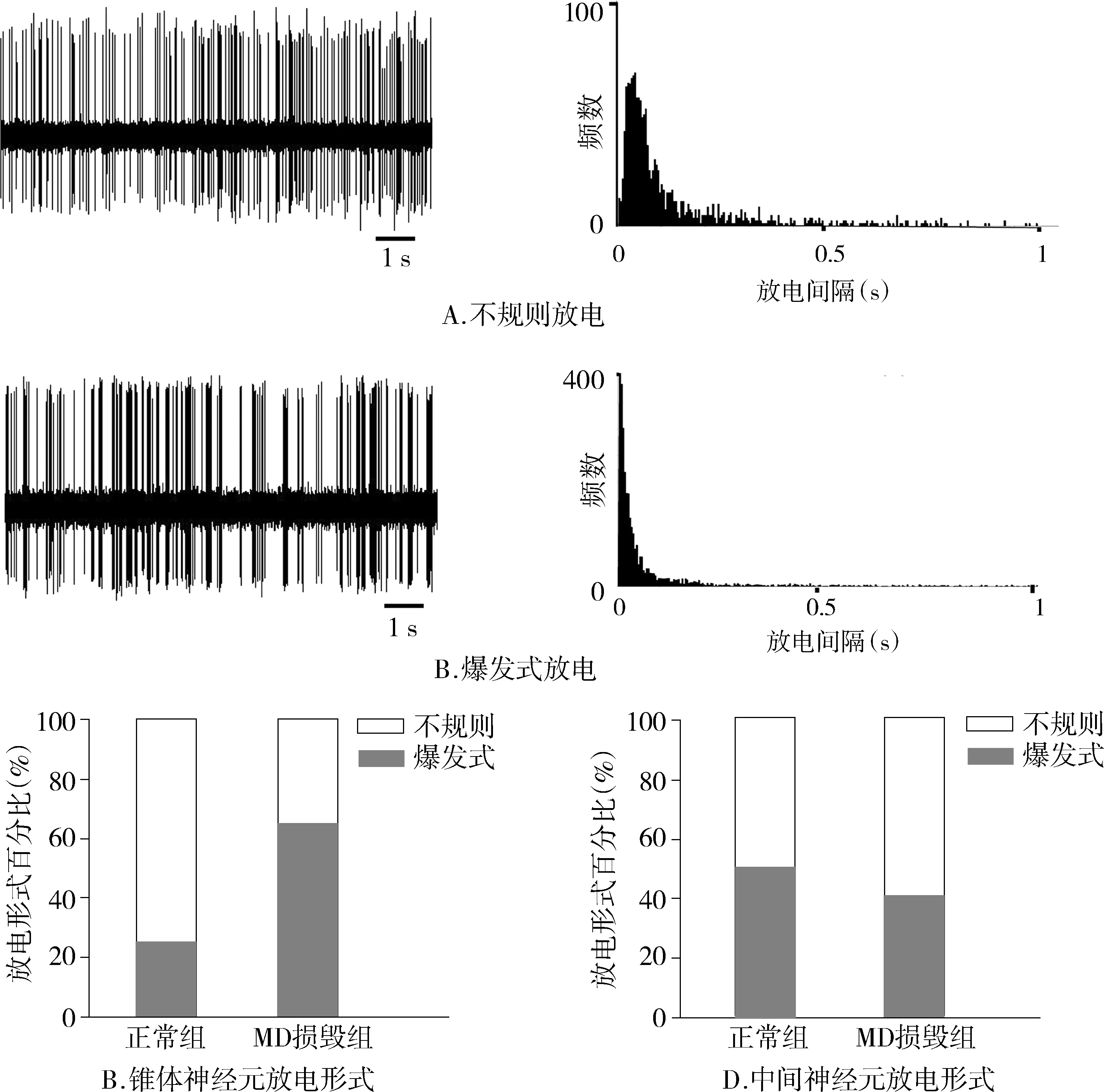
图3 mPFC锥体和中间神经元的放电形式及两组间放电形式的比较Figure 3 The pattern of neuronal firing and the distribution of firing patterns of mPFC pyramidal neurons and interneurons in two groups
表1两组大鼠mPFC锥体和中间神经元放电频率和ISI的变异系数比较
Table 1Comparison of the firing rate and interspike interval coefficient of variation of pyramidal cells and interneurons in mPFC

组别锥体神经元中间神经元n放电频率(Hz)变异系数n放电频率(Hz)变异系数正常组 591.26±0.121.20±0.07399.35±1.161.49±0.07MD损毁组562.36±0.271.74±0.11446.55±0.682.02±0.08t/U3.7778642.132340P<0.001 <0.0010.036 <0.001
3 讨论
mPFC的神经元组成主要包括谷氨酸能投射神经元(锥体神经元)和GABA能中间神经元,其中锥体神经元是皮层主要的兴奋性神经元,其数量远比中间神经元多,大概占mPFC神经元总数的70%-80%。中间神经元与锥体神经元形成大量突触,通过局部回路抑制性调控锥体神经元的活动,从而抑制或调节皮层的神经活动。鉴定mPFC锥体或中间神经元的电生理学标准是:锥体神经元细胞外放电呈宽波宽,一般大于1 ms,放电形式表现为不规则放电基础上伴发有爆发式活动;中间神经元放电波宽较窄,一般小于0.85 ms。实验中所有记录到的mPFC锥体和中间神经元的电生理学特征均与文献报道的电生理学特性相一致[6,7]。
IBO是一种兴奋性神经毒素,可以和突触后膜上的N-甲基-D-天冬氨酸受体结合,引起Ca2+内流,使胞内Ca2+浓度持续升高,继而引起一系列毒性反应,使神经元逐步变性坏死。IBO可以选择性破坏注射区域的神经元胞体和树突。本实验中所有MD损毁大鼠在电生理记录完毕后均要进行尼氏染色,结果显示MD内神经元在IBO注射后均被损毁,很少累及邻近结构。因此,MD损毁大大减少了这一神经结构向mPFC的信息传入。
本实验结果显示,与正常组大鼠相比,损毁MD大鼠mPFC中锥体神经元的放电频率显著增加,放电形式更趋于爆发式活动;而中间神经元的放电频率明显降低,且放电形式趋向于不规则。这些结果说明MD对mPFC神经元的电活动起到重要的调控作用。
MD无论在结构还是功能上都与PFC密切相关,二者之间存在大量的交互纤维联系。神经解剖学研究表明MD和PFC之间的交互投射是兴奋性谷氨酸能纤维。电刺激MD能引起PFC,尤其是ACC区神经元的兴奋性反应。Kuroda等[8]的研究显示MD发出的纤维主要和PFC中的锥体神经元形成突触联系。近年来,他们也发现PFC的GABA能中间神经元,主要是PV阳性中间神经元同样接受MD的纤维传入[8]。也就是说,MD既可以通过和PFC锥体神经元直接形成突触联系,来影响锥体神经元的活动,也可以通过PFC中间神经元,主要是PV阳性中间神经元,经过皮层局部环路间接影响锥体神经元的活性。有文献报道海人藻酸损毁MD 15 d后,电刺激MD引起PFC神经元兴奋的数量减少到18%[9]。由此可以推测,在本实验中,将IBO注入MD后,MD内神经元近乎完全变性,使MD投射到PFC的兴奋性传入减少,从而导致中间神经元的放电频率降低,同时也减弱了通过局部环路对锥体神经元的抑制性调控。所以,锥体神经元的电活动较正常组大鼠反而有所增强。
在啮齿类动物,MD与PFC和边缘皮层存在着大量的交互纤维联系,参与学习和记忆相关过程[10]。1895年,Monakow就提出MD在认知和情感调控中发挥关键作用,此后Baumer又提出MD是与精神分裂症病理关系密切的脑区。随后的一个多世纪,MD对PFC生理功能的调节作用遂成为研究热点。MD受损可使震颤、焦虑、紧张、攻击或妄想症状减少;也可能出现一时性健忘,并随时间推移而发展成慌乱[11]。MD的功能缺陷与mPFC受损(切除)相似,可缓解精神分裂症症状以及严重的焦虑状态[12]。目前,通过MD损毁术治疗精神分裂症已被广泛应用,其理论基础就是Hassler等[13]提出的MD损毁术相当于在丘脑水平上的前额叶切除术。因而,深入探讨MD和PFC在神经精神性疾病中的作用具有重要意义。
[1]Morici JF,Bekinschtein P,Weisstaub NV.Medial prefrontal cortex role in recognition memory in rodents[J].Behav Brain Res,2015,292:241-251.
[2]Ridderinkhof KR,Ullsperger M,Crone EA,etal.The role of the medial frontal cortex in cognitive control[J].Science,2004,306(5695):443-447.
[3]Li W,Liu J,Skidmore F,etal.White matter microstructure changes in the thalamus in Parkinson disease with depression:A diffusion tensor MR imaging study[J].Am J Neuroradiol,2010,31(10):1861-1866.
[4]Cross L,Brown MW,Aggleton JP,etal.The medial dorsal thalamic nucleus and the medial prefrontal cortex of the rat function together to support associative recognition and recency but not item recognition[J].Learn Mem,2012,20(1):41-50.
[5]范玲玲,王红伟,胡志红,等.5-羟色胺-7受体激动剂对大鼠内侧前额叶皮层锥体神经元电活动的影响[J].南京医科大学学报,2013,33(7):953-958.
[6]Gui ZH,Zhang QJ,Liu J,etal.Unilateral lesion of the nigrostriatal pathway decreases the response of fast-spiking interneurons in the medial prefrontal cortex to 5-HT1Areceptor agonist and expression of the receptor in parvalbumin-positive neurons in the rat[J].Neurochem Int,2011,59:618-627.
[7]Wang Y,Liu J,Gui ZH,etal.α2-Adrenoceptor regulates the spontaneous and the GABA/glutamate modulated firing activity of the rat medial prefrontal cortex pyramidal neurons[J].Neuroscience,2011,182:193-202.
[8]Kuroda M,Yokofujita J,Oda S,etal.Synaptic relationships between axon terminals from the mediodorsal thalamic nucleus and gamma-aminobutyric acidergic cortical cells in the prelimbic cortex of the rat[J].J Comp Neurol,2004,477(2):220-234.
[9]Ferron A,Thierry AM,Le Douarin C,etal.Inhibitory influence of the mesocortical dopaminergic system on spontaneous activity or excitatory response induced from the thalamic mediodorsal nucleus in the rat medial prefrontal cortex[J].Brain Res,1984,302(2):257-265.
[10]Watanabe Y,Funahashi S.Thalamic mediodorsal nucleus and working memory[J].Neurosci Biobehav Rev,2012,36(1):134-142.
[11]Mitchell AS,Chakraborty S.What does the mediodorsal thalamus do?[J].Front Syst Neurosci,2013,7:37.
[12]Marmolejo N,Paez J,Levitt JB,etal.Early postnatal lesion of the medial dorsal nucleus leads to loss of dendrites and spines in adult prefrontal cortex[J].Dev Neurosci,2013,34(6):463-476.
[13]Hassler R,Haug P,Nitsch C,etal.Effect of motor and premotor cortex ablation on concentrations of amino acids,monoamines,and acetylcholine and on the ultrastructure in rat striatum.A confirmation of glutamate as the specific cortico-striatal transmitter[J].J Neurochem,1982,38(4):1087-1098.
Effects of mediodorsal thalamic nucleus lesions on neuronal activity in medial prefrontal cortex of rats
FAN Lingling1*, SUN Baoyu2, DENG Bo1, HU Zhihong1, REN Aihong1, HU Yongmei1, YAN Junbao1
(1DepartmentofPhysiology,MedicalCollege,HenanUniversityofScienceandTechnology,Luoyang471023,China;2EmergencyDepartment,WomenandChildrenHealthCareCenterofLuoyang;*Correspondingauthor,E-mail:emmafll@163.com)
ObjectiveTo investigate the activity of medial prefrontal cortex(mPFC) pyramidal neurons and interneurons in normal and mediodorsal thalamic nucleus(MD)-damaged rats.MethodsThe experiments were performed in normal rats(n=15) and rats with MD lesions(n=15), The change of the spontaneous firing of neurons in mPFC was observed after unilateral lesions of the MD by extracellular recordinginvivo.ResultsCompared with normal rats,the firing rate of mPFC pyramidal neurons was significantly increased in rats with MD lesion(P<0.001), and the firing pattern changed towards a more burst-firing. Compared with normal rats, the firing rate of interneurons was markedly decreased in rats with MD lesion(P<0.05), and the firing pattern tended to irregular-firing activities.ConclusionThese results suggest that neuronal activity of the mPFC is modulated by the MD, which may be very important for the regulation of mPFC function.
medial prefrontal cortex;mediodorsal thalamic nucleus;electrophysiology;rats
河南省教育厅科学技术研究重点资助项目(14B180007);洛阳市科技发展计划资助项目(1401087A-5)
范玲玲,女,1970-08生,博士,副教授,E-mail:emmafll@163.com
2016-08-08
R338.2
A
1007-6611(2016)10-0879-05DOI:10.13753/j.issn.1007-6611.2016.10.001
