耐冬山茶抗寒基因CjCor1的全长克隆与表达分析
2016-11-10孙迎坤王奎玲刘庆华高捍东
杨 凯 孙迎坤 王奎玲 刘庆华 高捍东
(1.南京林业大学,南京 210037; 2.青岛农业大学,青岛 266109)
耐冬山茶抗寒基因CjCor1的全长克隆与表达分析
杨 凯1,2孙迎坤2王奎玲2刘庆华2高捍东1*
(1.南京林业大学,南京 210037;2.青岛农业大学,青岛 266109)
COR基因是植物冷驯化过程中重要的功能基因。为研究Cor基因在耐冬山茶(Camelliajaponica)抗寒方面的功能,采取同源克隆的方法,从自然低温条件下的耐冬山茶叶片中分离到了617 bp的耐冬山茶同源COR基因全长序列,命名为CjCor1。该序列全长完整,含有600 bp的开放阅读框。氨基酸序列分析显示,CjCor1基因编码的199个氨基酸蛋白质,含有冷驯化蛋白家族WCOR413 Superfamily特有的保守域结构,在同属物种中的保守性极高。荧光定量PCR结果表明,在低温(0℃以下时)条件下,相比南方山茶原种和常见栽培品种,CjCor1基因在耐冬山茶中具有较高表达量,且在耐寒性高的品种中的表达量也较高。
耐冬山茶;CjCor1基因;序列分析;基因表达
抗寒育种是目前世界所关注的研究热点。针对当前我国北方地区园林植物资源相对短缺以及大部分南方引进品种不能够在北方地区正常越冬等状况,寻求耐寒性高的园林植物种(品种)显得尤为重要。山茶(Camelliajaponica)为全世界人皆喜爱的木本常绿观花植物,也是中国传统十大名花之一,植株秀美,花期可自10月至翌年6月,其观赏性极佳[1]。作为山茶分布最北界的原种——青岛市市花耐冬山茶(C.japonica(Nai Dong)),较之分布于四川、浙江等地的其他山茶原种更具有强的耐寒性,可耐-17℃低温[2]。
对于植物抗寒基因研究主要包括植物冷诱导基因、相关酶基因(脯氨酸基因、脂肪酸去饱和酶基因、超氧化物歧化酶基因等)和植物抗冻蛋白(AFP)等方面。冷驯化是是在低温条件下植物内在分子机制调控所表现出来的生理生化过程,其过程涉及很多基因。COR基因是其中重要的功能基因,其原理是低温条件可诱导植物COR基因表达,生成COR蛋白,从而提高植物的抗寒能力[3]。目前已从拟南芥(Arabidopsisthaliana)、大麦(Hordeumvulgare)、番茄(Cyphomandrabetacea)中等分离多个植物冷诱导基因,如COR78、blt4、CBF4等[4~5]。Weiser和Guy等认为冷驯化能诱导和增加某些基因的表达发生改变。这些冷诱导基因表达的产物为调控蛋白或功能蛋白,其中后者与植物抗寒性的提高直接相关。冷驯化可以诱导多种COR蛋白基因表达,如拟南芥中产生的COR6.6、COR15a、COR47等。进一步研究发现,拟南芥在干旱或低温逆境中及ABA处理时能诱导COR15a蛋白基因表达产生可与叶绿体结合的多肽COR15am,其在转基因拟南芥中过量表达后可提高叶绿体、原生质体的耐寒冷性,并增强原生质膜稳定性,减轻寒冻损害。
抗寒基因是一种诱发基因,在低温、短日照等特定条件下,能够产生抗寒促进因子(如内源脱落酸ABA),与钙信号系统一起执行抗寒信号的传导,并启动相应抗寒基因的表达[6]。目前已发现的100多种由ABA诱导的基因可分为两类:依赖ABA的传导,如逆境诱导基因RD28和RD29;与ABA共同作用控制基因的表达,如拟南芥Cor6.6、PHH28等[7]。
鉴于此,本研究从耐冬山茶中分离了COR基因,对其蛋白质功能和生物学特性进行了分析,并在此基础上进行荧光定量实验,旨在探讨该基因对提高植物耐寒性的原理,并为后期的耐冬山茶抗寒机理的研究奠定基础。
1 材料与方法
1.1 材料和试剂
实验采用的植物材料为耐冬山茶,俗称耐冬,以及山茶原种(南方)、品种‘宽彩带’(C.japonica‘Kuancaidai’)和‘金盘荔枝’(C.japonica‘Jinpan Lizhi’)。其中,耐冬叶片采自山东省青岛市世纪公园露天栽培植株,‘宽彩带’叶片采自青岛农业大学胶州科技示范园塑料大棚内,山茶原种(南方)叶片采自浙江象山野外,‘金盘荔枝’叶片采自中国林科院亚林所。采集时间为2015年12月~2016年1月气温低于0℃时的清晨或傍晚,样品为植株上半部分嫩叶,采后迅速除主脉、剪碎,用锡箔纸包裹放入液氮中速冻暂存,带回实验室存放于-70℃冰箱。
植物总RNA提取试剂盒RN38-EASYspin Plus购自北京艾德莱生物科技有限公司,RNAase固相清除剂购自北京天恩泽基因公司,T4DNA连接酶购自宝生物工程大连有限公司,pGEM®-T easy vector试剂盒购自Promega公司。SMART RACE cDNA扩增试剂盒购自美国Clontech公司,高保真酶Prime STAR HS DNA Polymerase、常用限制性内切酶、大肠杆菌E.coliDH5α、荧光定量反转录试剂盒和染料法SYBR® Premix Ex TaqTM Ⅱ试剂盒皆购自宝生物工程大连有限公司,cDNA第一链合成试剂购自Fermentas公司。凝胶回收、质粒提取试剂和荧光定量所用耗材等皆来源于美国Axygen公司。PCR引物由上海生工合成,测序交由华大基因公司完成。
1.2 实验方法
1.2.1 耐冬CjCor1基因扩增引物设计
根据GenBank网站提供的山茶较近缘物种Cor同源基因的完整mRNA和CDS序列信息,通过比对软件分析出此类基因的保守区域,用Premier 5.0软件设计正向(P-1)和反向(P-2)引物片段并进行确认;然后在耐冬中进行PCR扩增获取保守区;根据测序所得目的序列设计3′和5′RACE扩增特异的引物GSP1和GSP2;然后根据扩增得到的保守区序列、3′和5′RACE的cDNA序列进行电子全长拼接,并根据拼接序列设计全长扩增引物P-3和P-4(表1)。
1.2.2 耐冬CjCor1基因全长扩增
样品耐冬山茶等的总RNA提取依据植物RN38-EASYspin Plus试剂盒进行操作,耐冬提取的RNA再反转录为cDNA。采用同源克隆方法,用上表中引物P-1、P-2对耐冬cDNA进行扩增,扩增条件为:95℃,5 min;95℃,30 s,54℃,30 s,72℃,50 s,32 cycles;72℃,7 min[8]。对目的条带凝胶进行回收,然后连接到T Easy载体,转化E.coliDH5α,蓝白斑筛选后,对阳性单克隆测序,得到该基因的保守区片段。然后,采用GSP1、GSP2引物分别进行cDNA末端扩增,得到相应的3′和5′序列。对于全长电子拼接序列利用P-3、P-4引物,在耐冬叶片中扩增全长序列,扩增产物进行测序并在GenBank网站中Blast,进行近缘植物的分析比对。
表1耐冬山茶CjCor1基因克隆和表达分析引物
Table1PrimersforcloningandexpressionofCjCor1geneinC.japonica

引物名称Primers引物序列(5′—3′)PrimerssequenceP⁃1CCAACATTCTCACAACGCTTTP⁃2TATGCAGACAGAGTTGGAAAGGCGSP1TGCTTTGCCATCGCGTGTTACTTGCGSP2TCGTATCAGCAATCAACCCGGGAGCP⁃3GAACAGTTATTTGGCTATGAAGGCP⁃4ACTATAGCAAGTCGTCAAACAGAGC18S⁃1GACTCAACACGGGGAAACTTACC18S⁃2CAGACAAATCGCTCCACCAACQP⁃1GGAAGACCAACATTCTCACAACGCTQP⁃2GCGACCACAACAAGAAGAATCAATG
1.2.3耐冬CjCor1基因编码蛋白质生物信息学比对分析
登录NCBI网站(http://www.ncbi.nlm.nih.gov),进行CjCor1基因编码蛋白的同源序列比对分析,采用ORF Finder分析该基因cDNA序列的开放阅读框ORF(Open reading frame)。利用DNAMAN软件进行氨基酸序列比对、系统发育等分析。
1.2.4CjCor1基因在山茶原种和品种叶片中的相对荧光定量表达
分别提取耐冬、山茶原种(南方)和‘宽彩带’、‘金盘荔枝’叶片总RNA,合成cDNA第一链。以山茶18S rRNA(GenBank网站登录号:U42815.1)为内参,进行实时荧光定量扩增。定量反应在PCR仪(StepOnePlus)上进行,所用试剂为SYBR® Premix Ex TaqTM Ⅱ,反应程序为94℃,30 s;94℃,5 s;60℃,31 s,设置40个循环。每个试验和样品各重复3次,采用2-ΔΔCT法进行数据分析。
2 结果与分析
2.1 耐冬CjCor1基因全长cDNA
运用CjCor1基因保守区的引物P-1和P-2,以耐冬山茶总RNA反转录后的cDNA为模板扩增,测序后获得357 bp的目的片段(图1中片段1)。对片段所编码的蛋白进行NCBI比对,发现其与茶树(C.sinensis)冷驯化蛋白WCOR413-like同源性高达97%以上。由特异引物GSP1、GSP2进一步进行RACE扩增扩增后,获得耐冬CjCor1基因的3′和5′末端序列(图1中片断2和片断3),结合已经得到的同源片断,获得780 bp的基因序列全长,命名为CjCor1。将此序列在ORF finder中分析开放阅读框信息,得到该基因的保守区序列,最终扩增后得到617 bp的目的基因序列(图1中片断4),测序结果与CjCor1基因电子拼接结果一致。
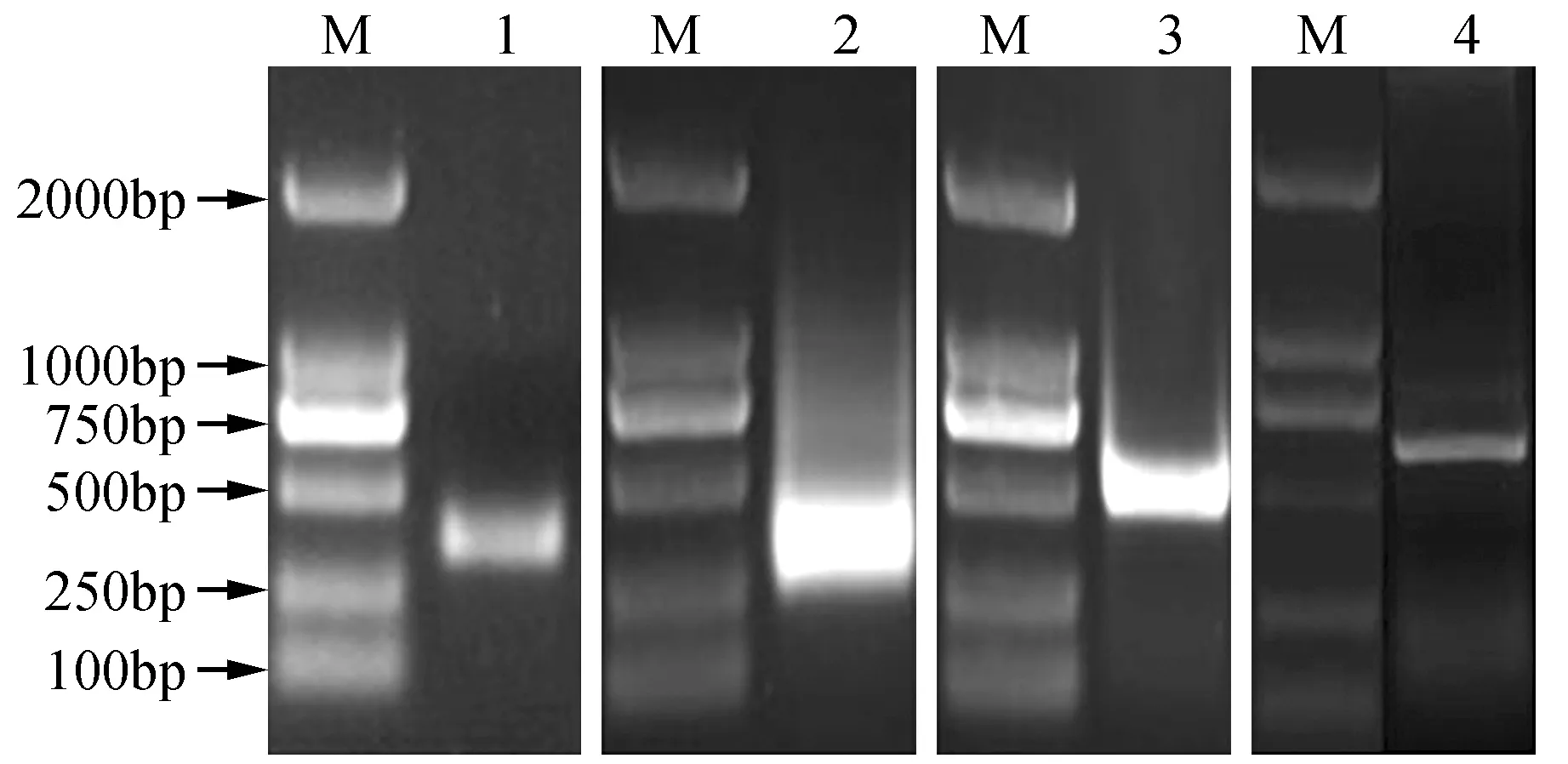
图1 耐冬CjCor1基因PCR扩增 M.分子量标准AL2000;1.CjCor1基因保守区片段;2. 3′RCAE扩增片段;3. 5′RACE扩增片段;4.CjCor1基因全长Fig.1 PCR amplification of CjCor1 in C.japonica M. Marker AL2000; 1.CjCor1 fragment; 2. 3′RCAE fragment; 3. 5′RACE fragment; 4. Full length of CjCor1
2.2 耐冬CjCor1基因cDNA核苷酸序列分析
在耐冬山茶中获得的CjCor1基因780 bp的电子拼接全长序列中(图2),包含典型的Poly(A)结构;利用ORF Finder软件对序列分析,该序列包含600 bp的开放阅读框。由全长引物对扩得的617 bp的基因全长序列,ORF长度为600 bp,5′UTR长16 bp,3′UTR长1 bp,终止密码子为TAG。由此证明本研究所克隆到的CjCor1基因开放阅读框独立、完整,基因序列合理。同时,在线比对分析结果显示,该基因与茶树全基因同源性高达97%。
2.3耐冬CjCor1基因编码蛋白序列多重比对与同源性分析
对耐冬山茶CjCor1基因编码的氨基酸序列进行BLAST,结果发现其保守域中的13~187个氨基酸与基因库中已有的冷驯化蛋白家族(WCOR413 Superfamily,登录号pfam05562)相吻合(图3),表明该序列的此部分保守域序列在许多物种[如日本柳杉(Cryptomeriajaponica)、海岛棉(Gossypiumbarbadense)、柽柳(Tamarixandrossowii)、拟南芥(Arabidopsisthaliana)、小立碗藓(Physcomitrellapatens)等]中都是稳定的。对序列相似度高于65%的12个物种的氨基酸序列进行比对,发现CjCor1基因编码的蛋白缺少其他物种起始的8~9个氨基酸序列,这是耐冬山茶物种特异性原因所致还是存在其他原因有待进一步研究;第21~30个氨基酸序列是山茶属区别与其他物种的特异性序列,其他序列物种间差别不太明显,尤其是中后部序列,相似度极高;尤其在WCOR413保守域结构中同源性更高,其高度同源位点如图4三角处标记所示多达74个氨基酸序列。这表明,山茶属的COR蛋白与其它物种区别较明显,耐冬山茶又与同属物种蛋白存在特异性差异,如图4星号所标记,与茶树在WCOR413保守域结构中存在10个特异性氨基酸序列。因此,分析耐冬山茶CjCor1基因对于植物的耐寒性研究具有特定的意义。
同时,在所登录的物种中,通过对包括耐冬山茶在内的13个Cor同源性较高的植物进行反复比对,建立了耐冬山茶耐冬CjCor1系统进化树。进化树包括2个大分支,其中,耐冬山茶与同属的茶树(Camelliasinensis)同属一个大分支,其余11个树种归属另一个大分支(图5)。此结果进一步表明,Cor序列在同属物种中的进化是高度保守的。
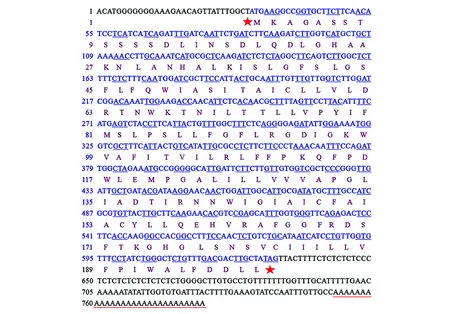
图2 CjCor1基因全长序列分析 第31~33个碱基为起始密码子,第628~630个碱基为终止密码子,最后2行红线以上碱基显示Poly(A)结构Fig.2 Nucleotide sequence analysis in CjCor1 gene Number 31-33 nucleotides is initiation codon; 628-630 ones is termination codon; Poly(A) form are up red lines of last two lines

图3 耐冬山茶CjCor1基因编码的蛋白保守域Fig.3 Conserved domain of CjCor1 gene encoded protein in C.japonica

图4 耐冬山茶Cor与其它物种氨基酸序列比对Fig.4 Amino acid sequence alignment of Cor protein in C.japonica with other species

图5 耐冬山茶CjCor1系统进化树分析Fig.5 Phylogenetic tree analysis of CjCor1 in C.japonica
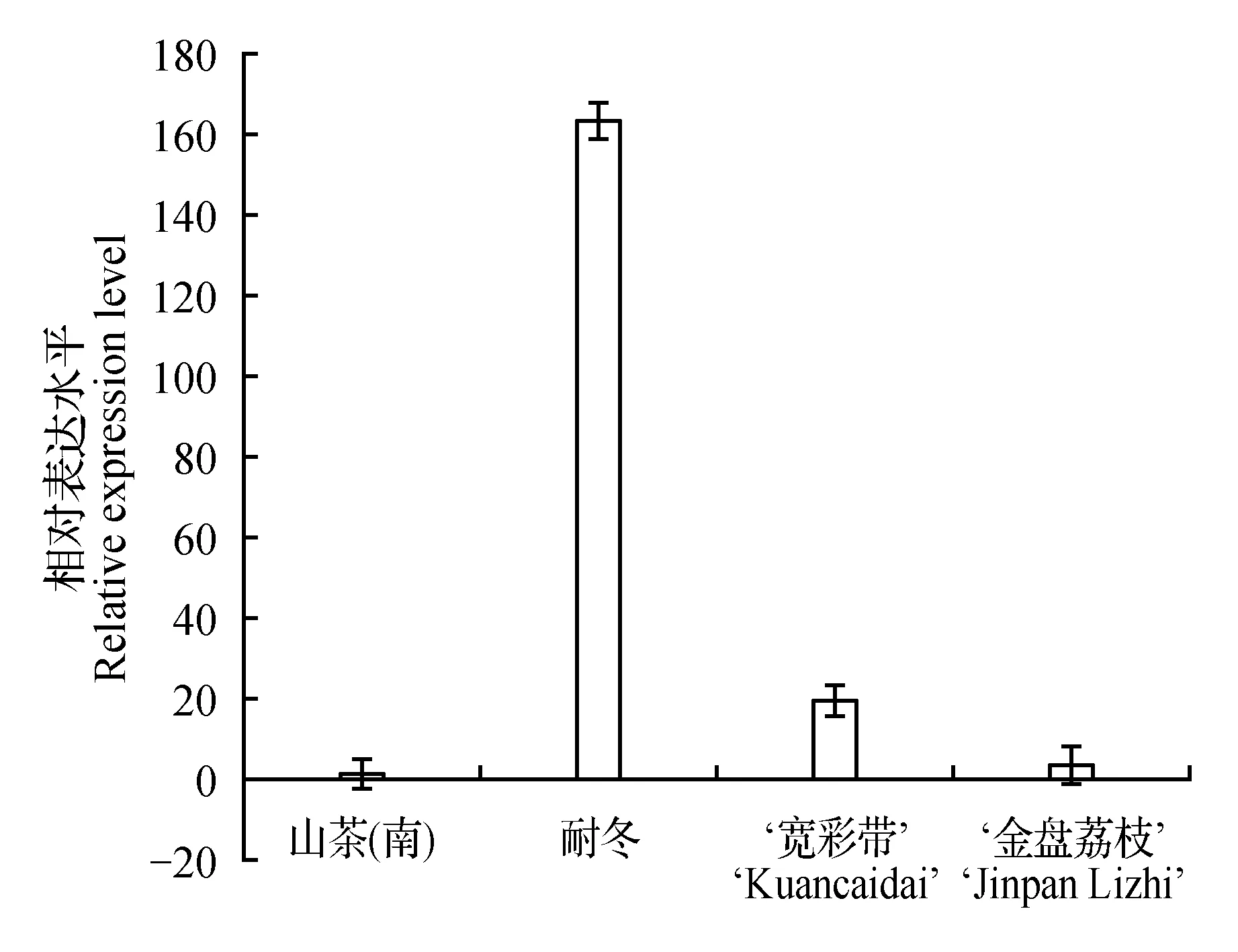
图6 CjCor1基因在山茶原种和品种中的相对表达量Fig.6 Relative expression level of CjCor1 gene in C.japonica and its varieties
2.4耐冬CjCor1基因在山茶原种及品种中的表达分析
荧光定量PCR所使用仪器为StepOnePlus,对耐冬山茶CjCor1基因在山茶原种(南方)、耐冬山茶以及南方栽培品种‘宽彩带’、‘金盘荔枝’中的表达情况进行测定,实验结果如图6所示。在低温(0℃以下时)条件下,相比南方山茶原种和常见栽培品种,CjCor1基因在耐冬中具有较高表达量;同时,此基因在‘宽彩带’、‘金盘荔枝’中的相对表达量也明显高于原种。这个结果也与所试材料的实际抗寒能力一致[9]。这初步表明,CjCor1基因的表达能力与植物的抗寒性成正比关系。
3 讨论
本研究采用同源片断克隆的方法,从耐冬山茶叶片中分离到了耐冬山茶Cor基因全长,命名为CjCor1基因。该基因全长617 bp,序列中开放阅读框为600 bp,编码199个氨基酸的蛋白质,全长序列完整。CjCor1基因编码的蛋白质含有冷驯化蛋白家族特有的WCOR413保守域结构,在同属物种中的保守性极高。
荧光定量PCR法对CjCor1基因在山茶原种(南方)、耐冬山茶以及南方栽培品种‘宽彩带’、‘金盘荔枝’中的表达情况分析结果表明,CjCor1基因在耐冬中较南方品种具有较高表达量。
Cor基因为冷驯化表达基因,目前多从经济植物中获得[10]。从目前研究报道可总结出其在低温处理条件下即可表达,且其相对表达量随着低温处理时间的延长而成倍增加[11~12]。葡萄Vvcor27基因在4℃条件下,处理24和48 h的表达量分别为早期处理0~8 h的50和100倍,这表明该基因的表达很可能受到其他胁迫基因的诱导调控[13~14]。此外,葡萄Vvcor27基因和拟南芥Atcor27基因启动子区的差别可能是2个基因相应冷胁迫表达模式不同的原因[10],在后续的研究中有必要对CjCor1基因的启动子区域进行研究,进一步明晰该基因的抗寒性能。
本实验中通过荧光定量分析,CjCor1基因的表达能力与植物的抗寒性成正比关系,这与同属物种茶树CsCOR1基因在茶树叶片中过表达后植株抗寒能力明显增强的结果是相符的[15],在其他物种中也有过类似结果的研究[13,16]。在对拟南芥等物种的研究中发现,Cor基因的表达与植物的抗寒性有关[17];耐冬叶片经历了从深秋到寒冬的低温驯化过程,由此推测CjCor1基因的表达可能也与耐冬的抗冻性有关。冻害发生时,细胞膜首先会受到损伤,由此推断CjCor1基因可能对于稳定膜脂双分子层结构具有一定作用,我们正在开展后续的实验进行验证。
本研究所分离到的CjCor1基因编码的蛋白质含有冷驯化蛋白家族特有的WCOR413保守域结构,从属于Cor413基因家族。通过对GenBank中所登录的Cor413基因家族表达的组织特异性进行研究,Breton等[18]发现多数Cor413基因在植物的营养器官(根、叶)中有表达,也有部分植物中Cor413基因在其生殖器官有表达(水稻花序、小麦花穗、西红柿花芽等),秦华等[19]还发现Cpcor413pm1基因在蜡梅(Chimonanthuspraecox)花发育的不同时期都有不同程度的表达,且随着花发育进程的发展表达量成升高趋势。因此,在下一步的研究工作中,可进一步研究耐冬山茶Cor基因在耐冬芽、花发育不同阶段等的表达情况,为全面挖掘该基因的耐寒功能提供参考;同时通过转基因和生理指标的测定,深入分析耐冬山茶CjCor1基因的上下游调控脉络,剖析耐冬山茶的抗寒机理,可为提高北方植物的抗寒育种提供科学基础。
1.张乐初,游慕贤,陈德松.中国茶花文化[M].上海:上海文化出版社,2003:85-122.
Zhang L C,You M X,Chen D S.Chinese camellia culture[M].Shanghai:Shanghai Culture Publishing House,2003:85-122.
2.王奎玲.耐冬山茶种质资源研究[D].北京:北京林业大学,2006.
Wang K L.Studies on the germplasm resources of Naidong Shancha(CamelliaJaponicaL.)[D].Beijing:Beijing Forestry University,2006.
3.黄永会,朱莉莎,王玉臣,等.结球白菜COR基因克隆及序列分析[J].贵州农业科学,2014,42(11):10-13.
Huang Y H,Zhu L S,Wang Y C,et al.Gene clone and sequence analysis ofBrassicacampestrisssp.Pekinensis[J].Guizhou Agricultural Sciences,2014,42(11):10-13.
4.Huang B,Jin L G,Liu H Y.Molecular cloning and functional characterization of aDREB1/CBF-like gene(GhDREB1L) from cotton[J].Science in China Series C:Life Sciences,2007,50(1):7-14.
5.贺泂杰.高寒冰缘植物高山离子芥CbCBF4基因功能的研究[D].兰州:兰州大学,2012.
He J J.The functional research onCbCBF4[D].Lanzhou:Lanzhou University,2012.
6.洪剑明,邱泽生.植物抗性生理(一)[J].生物学通报,1997(5):13-15.
Hong J M,Qiu Z S.Plant resistant physiology(No.1)[J].Bulletin of Biology,1997(5):13-15.
7.王国莉,郭振飞.植物耐冷性分子机理的研究进展[J].植物学通报,2003,20(6):671-679.
Wang G L,Guo Z F.The progress of researches on molecular mechanism of chilling tolerance in plants[J].Chinese Bulletin of Botany,2003,20(6):671-679.
8.孙迎坤,李纪元,殷恒福,等.重瓣山茶花‘金盘荔枝’C功能基因CjAGL6的全长克隆与表达分析[J].植物研究,2013,33(3):330-338.
Sun Y K,Li J Y,Yin H F,et al.Cloning and expression analysis of C functionCjAGL6 gene cDNA fromCamelliajaponica‘Jinpan Lizhi’[J].Bulletin of Botanical Research,2013,33(3):330-338.
9.王仁卿,张淑萍,石竹,等.青岛耐冬山茶的多样性特征及其保护[J].山东林业科技,1998,(3):1-4.
Wang R Q,Zhang S P,Shi Z,et al.Diversity characteristics and protection of Naidong Shancha in Qingdao[J].Journal of Shandong forestry science and technology,1998(3):1-4.
10.Mikkelsen M D,Thomashow M F.A role for circadian evening elements in cold-regulated gene expression inArabidopsis[J].The Plant Journal,2009,60(2):328-339.
11.Kilian J,Whitehead D,Horak J,et al.The AtGenExpress global stress expression data set:protocols,evaluation and model data analysis of UV-B light,drought and cold stress responses[J].The Plant Journal,2007,50(2):347-363.
12.Xu W R,Li R M,Zhang N B,et al.Transcriptome profiling ofVitisamurensis,an extremely cold-tolerant Chinese wildVitisspecies,reveals candidate genes and events that potentially connected to cold stress[J].Plant Molecular Biology,2014,86(4-5):527-541.
13.范高韬,孙小明,任小蝶,等.葡萄COR27基因的克隆与抗寒功能研究[J].植物科学学报,2015,33(3):346-354.
Fan G T,Sun X M,Ren X D,et al.Cloning and functional analysis ofCOR27 gene fromVitisvinifera[J].Plant Science Journal,2015,33(3):346-354.
14.谢素霞,张媛,郭凯琳,等.一个新的茶树黄酮醇合酶基因的克隆和表达分析[J].植物生理学通讯,2009,45(11):1093-1097.
Xie S X,Zhang Y,Guo K L,et al.Cloning and expression analysis of a flavonol synthase gene fromCamelliasinensis[J].Plant Physiology Communications,2009,45(11):1093-1097.
15.Li X W,Feng Z G,Yang H M,et al.A novel cold-regulated gene fromCamelliasinensis,CsCOR1,enhances salt- and dehydration-tolerance in tobacco[J].Biochemical and Biophysical Research Communications,2010,394(2):354-359.
16.Chen L,Zhong H,Ren F,et al.A novel cold-regulated gene,COR25,ofBrassicanapusis involved in plant response and tolerance to cold stress[J].Plant Cell Reports,2011,30(4):463-471.
17.Seki M,Narusaka M,Abe H,et al.Monitoring the expression pattern of 1300Arabidopsisgenes under drought and cold stresses by using a full-length cDNA microarray[J].The Plant Cell,2001,13(1):61-72.
18.Breton G,Danyluk J,Charton J B F,et al.Expression profiling and bioinformatic analyses of a novel stress-regulated multispanning transmembrane protein family from cereals andArabidopsis[J].Plant Physiology,2003,132(1):64-74.
19.秦华,眭顺照,李名扬,等.蜡梅(Chimonanthuspraecox(L.)Link)COR413蛋白基因(Cpcor413pm1)的分子特性与表达分析[J].中国生物化学与分子生物学报,2006,22(7):547-552.
Qin H,Sui S Z,Li M Y,et al.Molecular characterization and expression analysis of a novelCOR413 gene from Wintersweet (Chimonanthuspraecox(L.) Link)[J].Chinese Journal of Biochemistry and Molecular Biology,2006,22(7):547-552.
Colleges and universities science & technology plan in Shandong province(No.J13LE16);National Science & Technology Pillar Program during the Twelfth Five-year Plan Period(No.2012BAD01B0703)
introduction:YANG Kai(1975—),male,ectorate,doctor in school,mainly engaged in the study of forest tree seedlings and ornamental plant breeding.
date:2016-05-16
CloningandExpressionAnalysisofCjCor1GenecDNAfromCamelliajaponica(NaiDong)
YANG Kai1,2SUN Ying-Kun2WANG Kui-Ling2LIU Qing-Hua2GAO Han-Dong1*
(1.Nanjing Forestry University,Nanjing 210037;2.Qingdao Agricultural University,Qingdao 266109)
CORgenes play important roles in plant cold acclimation process. In order to study theCorgene function ofCamelliajaponicato severe cold, adopting homologous cloning method, a 617 bp full-length cDNA sequence was cloned from leaves ofC.japonica(Nai Dong) under the natural low temperature condition, namedCjCor1. The total length sequence is complete, and contains an opening reading frame of 600 bp. Amino acids sequence alignment shows thatCjCor1 gene encodes a protein of 199 amino acids, containing specific conservative domain structure of WCOR413 in cold acclimatization protein superfamily, and highly conservative property in species belonged to same genus. By real-time PCR analysis, comparing with southernCamelliaspecies and common varieties,CjCor1 genes had higher expression inC.japonica(Nai Dong) under the condition of low temperature(below 0℃), and also had higher expression in higher cold resistance varieties.
Camelliajaponica(Nai Dong);CjCor1 gene;sequence analysis;gene expression
山东省高等学校科技计划项目(J13LE16);“十二五”农村领域国家科技计划课题(2012BAD01B0703)
杨凯(1975—),男,讲师,博士研究生,主要从事林木种苗和观赏植物育种研究。
* 通信作者:E-mail:gaohd@njfu.edu.cn
2016-05-16
* Corresponding author:E-mail:gaohd@njfu.edu.cn
S685.14
A
10.7525/j.issn.1673-5102.2016.05.017
