过量表达菊花DmDREBa基因提高转化烟草耐低温能力
2016-11-10杨艳芳刘黎卿陈发棣喻德跃
杨艳芳 武 剑 朱 凯 刘黎卿 陈发棣 喻德跃*
(1.中国林业科学研究院林业研究所,林木遗传育种国家重点实验室,国家林业局林木培育重点实验室,北京 100091; 2.南京农业大学大豆研究所,国家大豆改良中心,作物遗传与种质创新国家重点实验室,南京 210095; 3.南京农业大学园艺学院观赏园艺系,南京 210095; 4.福建省植物生理生化重点公共实验室,福建省亚热带植物研究所,厦门 361009)
过量表达菊花DmDREBa基因提高转化烟草耐低温能力
杨艳芳1武 剑2朱 凯2刘黎卿4陈发棣3喻德跃2*
(1.中国林业科学研究院林业研究所,林木遗传育种国家重点实验室,国家林业局林木培育重点实验室,北京 100091;2.南京农业大学大豆研究所,国家大豆改良中心,作物遗传与种质创新国家重点实验室,南京 210095;3.南京农业大学园艺学院观赏园艺系,南京 210095;4.福建省植物生理生化重点公共实验室,福建省亚热带植物研究所,厦门 361009)
各种环境因素,如干旱、高盐、激素和低/高温等非生物胁迫对植物的生长发育造成很大影响。DREB转录因子在植物抵抗非生物胁迫中起到关键作用。本研究通过根癌农杆菌介导的叶盘转化法将菊花DmDREBa基因导入烟草中并进行了耐低温能力分析。研究利用PCR的方法鉴定出了43株转基因阳性植株。随机选取其中9株转基因植株,有7株在RNA转录水平能够表达。Southern杂交检测表明,DmDREBa基因以1~3个拷贝形式随机插入到烟草基因组中。胁迫处理结果表明,DmDREBa基因明显增强了转基因烟草抵抗低温能力。通过叶片上下表皮气孔密度检测,发现转基因烟草的蒸腾失水量远远低于对照野生型。进一步对低温胁迫下转基因烟草的丙二醛含量进行测定分析,发现转基因烟草丙二醛含量比野生型烟草低22.29%。综上结果表明,DmDREBa基因能够提高转基因烟草对低温的耐受能力,为菊花DREB转录因子的深入研究提供理论依据,并为进一步解析菊花DREB基因功能奠定基础。
菊花;DREB;农杆菌转化;转基因烟草;耐逆性
干旱、高盐和低温等非生物胁迫严重影响植物的生长和发育,很多耐逆基因在这些非生物胁迫条件下被诱导表达[1~2]。目前,研究表明DREB转录因子能与DRE/CRT顺式作用元件特异性结合,启动调控大量下游的、在启动子区域含有靶元件的逆境相关基因。因此,DREB蛋白在调控非生物胁迫相关基因的表达和提高植株对非生物胁迫抗性方面有很重要的作用[3~5]。
DREB转录因子含有一个典型的高度保守的约60个氨基酸组成的AP2/ERF结构域,是一个多基因家族转录因子,研究者已从多种植物中分离克隆DREB基因,并对其功能进行了研究。Liu等[3]从拟南芥中克隆了两类共5个与DRE元件特异结合的DREB转录因子,它们所编码的基因分别命名为DREB1A(CBF3)、DREB1B(CBF1)、DREB1C(CBF2)和DREB2A、DREB2B,其中DREB1A、DREB1B和DREB1C受低温诱导,DREB2A、DREB2B受干旱和高盐诱导。随后,Sakuma等[6]用PCR方法从拟南芥基因组中扩增出3个与DREB1同源的DREB1D-DREB1F以及6个与DREB2同源的DREB2C~DREB2H,DREB1D基因受高盐诱导,DREB2E只在根中受ABA轻微诱导。Haake等[7]也研究报道了CBFs家族的第4个成员CBF4(DREB1D)。CBF4基因受ABA和干旱诱导,但不受低温诱导。Knight等[8]发现CBF1-4基因的表达都受到ABA的诱导,表明DREB1/CBF介导的低温信号途径和ABA途径也不是完全独立的,它们之间是有一定联系和相互作用的。Novillo等[9]报道拟南芥中DREB1C/CBF2是DREB1A和DREB1B基因表达的负调控子。Guo等[10]报道DREB1s基因受其自身转录产物和其诱导的下游基因产物的反馈调节。此外,也有研究表明DREB2A参与植物热激胁迫[11~12]。研究发现拟南芥中的DREB2A中存在负调控结构域,将此负调控结构域去掉之后,DREB2A表现为组成性激活形式(DREB2A CA)。在拟南芥中过表达DREB2ACA基因不仅能够增强干旱和高盐胁迫基因的表达,还上调了热激反应相关的AtHsfA3和3个HSPs基因的表达[12]。此外,研究者还发现DNA POLYMERASE II SUBUNIT B3-1(DPB3-1)与DREB2A相互作用,过表达DPB3-1能够增强DREB2A在热胁下的转录活性[13]。同时,研究表明,过量表达DREB基因能够诱导下游多个耐逆基因的表达,如RD29A/B等,最终提高了植物耐低温、干旱和高盐等胁迫的能力[3,14~17]。
自Stockinger最早从拟南芥中分离到CBF1(DREB1B)基因以来[18],目前,已经在多种植物中均克隆了DREB转录因子的基因,例如,油菜(Brassicanapus)、番茄(Solanumlycopersicum)、大麦(Hordeumvulgare)、玉米(Zeamays)、水稻(Oryzasativa)和小麦(Triticumturgidumssp.durum)等[14,19~23],涵盖了单子叶植物和双子叶植物,充分证实DREB转录因子在植物中广泛存在。菊花(Dendranthema×morifolium)为菊科(Compositae)菊属(Dendranthema)宿根草本花卉,具有良好的耐寒性和耐旱性。本研究组的前期工作中已从菊花克隆到三个DREB同源基因,并初步确定DmDREBa和DmDREBb与低温胁迫的耐受性相关[24],而DvDREB2A与低温、干旱、高盐以及高温等胁迫相关[25]。为了进一步研究菊花中DREB基因的耐逆功能,本研究通过根癌农杆菌介导法将DmDREBa基因转入烟草,分析了转基因植株在气孔密度以及低温胁迫下丙二醛(malondialdehyde,MDA)含量的变化,为利用DmDREBa基因改良植物耐逆性提供理论基础。
1 材料与方法
1.1 植物材料
实验材料为烟草品种‘三生烟’(Nicotianatabacum‘Xantbine’),以培养45 d的烟草的幼嫩叶片作为转化的外植体。
1.2 宿主菌与质粒载体
本研究所用大肠杆菌(Escherichiacoli)DH5α和根癌农杆菌(Agrobacteriumtumefaciens)EHA105均由国家大豆改良中心保存,克隆载体pGEM-T购自Promega公司,植物双元表达载体pBI121-GFP,为国家大豆改良中心保存。
1.3 表达载体的构建
根据研究组前期获得的DmDREBa基因(GenBank登录号:EF490996)序列设计引物,上下游引物中加入XbaⅠ-BamHⅠ酶切位点,以已插入DmDREBa基因的T载体质粒为模板进行PCR扩增,将PCR产物连接到克隆载体pGEM-T中。将含有目的基因完整ORF的重组载体pGEM-T和真核表达载体pBI121-GFP分别用BamHⅠ和XbaⅠ进行双酶切,将酶切后回收的DmDREBa基因片段与酶切的pBI121-GFP得到的大片段连接、转化大肠杆菌DH5α,经过蓝白斑筛选、PCR以及酶切鉴定重组质粒,最后对重组质粒35S:DmDREBa进行测序,确保序列正确。
1.4 烟草转化及再生
利用液氮速冻法将植物表达载体35S:DmDREBa导入根癌农杆菌菌株EHA105中。以培养45 d的烟草自上至下第4、5片叶作为转化受体,采用叶盘法[26]转化烟草并再生获得转基因烟草。
1.5T0代转基因阳性植株的鉴定
以CTAB法提取移栽至营养钵中抗卡那霉素转基因烟草的基因组DNA作为模板,利用DmDREBa全长序列为模板设计特异性引物DREBa-F:5′-ATCAATTATTCAAAGCTCAA-3′和DREBa-R:5′-GAGTAAAGTGATCTTTGGAA-3′,进行PCR扩增鉴定。反应总体积为20 μL:10×Taq缓冲液2 μL,10 mmol·L-1dNTP 0.4 μL,上下游引物0.4 μL(10 μmol·μL-1),模板1 μL(约50 ng),5 U·μL-1Taq酶0.2 μL,最后用灭菌超纯水补足。反应条件:95℃预变性5 min,95℃ 30 s,58℃ 40 s,72℃ 40 s,30个循环,72℃ 8 min终止反应。野生型烟草和灭菌超纯水作为阴性对照。
对于PCR鉴定的阳性的转基因植株,我们随机挑取了9株,用Trizol(天根,北京)提取总RNA,经过DNaseI处理后,进行反转录,合成cDNA第一链。以cDNA第一链为模板,相同的PCR引物和程序,进行转基因植株转录水平的鉴定。
1.6T0代转基因烟草的Southern杂交分析
选取研究确定的阳性转基因烟草植株15株,其中包括1.5中鉴定的9株,其他6株为随机选取。利用CTAB法提取基因组DNA,选用目的基因序列中不含酶切位点的BamHⅠ内切酶进行酶切,50 μL体系:DNA 30 μL(约10 μg),ddH2O 11 μL,Buffer 5 μL,BamHⅠ酶5 μL(40 U),37℃保温16~18 h,65℃ 10 min终止酶切反应。酶切的DNA加入loading buffer混匀后上样到0.8%的TBE琼脂糖胶,低电压电泳(1 V·cm-1,12 h)。电泳结束后,转移至尼龙膜上(Roche)。依照DIG High Prime DNA Labeling and Detection starter KitⅡ(Roche)说明书进行洗膜、检测。
1.7 蒸腾失水速率实验
分别取PCR鉴定的转DmDREBa基因阳性T0代和野生型烟草各三株自上至下的第三片叶,称取重量,并用描叶法[27]计算叶面积。将叶子放在滤纸上自然失水,间隔0.5 h称重,持续7 h后每隔1 h称重至失水12 h,最后在失水24 h时候再称重一次。统计数据,最后计算单位叶面积的失水量。
1.8 叶片上下表皮的气孔密度检测
用镊子小心剥取阳性转基因植株T0代和野生型烟草自上之下第三、四片叶片上下表皮,在OLYMPUS光电显微镜40×镜下观察叶片上下表皮气孔状况并照相,用SAS9.0软件进行统计分析,检验转基因烟草与野生型气孔密度间的差异显著性。
1.9T1代转基因烟草的分离比分析
将T0代PCR鉴定的3个阳性转基因株系和野生型烟草的种子播种到含有150 μmol·L-1Kan的1/2MS培养基上,16/8 h光照培养箱25℃培养。萌发出苗后,卡方测验计算分离比例。
1.10T1代转基因烟草MDA含量测定
取转DmDREBa基因烟草T1代株系L-35和L-39,取自上至下第三、四片叶进行。4℃低温处理,在第0、2和4 d分别取样,重复3次。选择同时期正常生长的大小相近野生型烟草作为对照。参照《植物生理生化实验原理和技术》[28]方法进行MDA含量测定。数据分析利用SAS软件(ver.9.0,SAS Institute,Inc)进行统计,采用Duncan(P<0.05)多重比较法对实验数据进行分析。
2 结果与分析
2.1 植物表达载体构建
将DmDREBa基因加上BamHⅠ和XbaⅠ酶切位点并克隆到载体pGEM-T中。利用BamHⅠ和XbaⅠ内切酶酶切重组质粒pDmDREBa和核表达载体,回收DmDREBa基因片段和pBI121-GFP酶切的大片段(约14 kB),用T4DNA连接酶连接两个片段,并转化、提取重组质粒DNA,PCR、酶切重组质粒,可得到目的基因大小片段,表明DmDREBa基因片段确实插入到植物表达载体pBI121-GFP中,重组载体命名为35S:DmDREBa。
2.2 转基因烟草阳性检测2.2.1 PCR及转录水平检测
利用DmDREBa基因设计特异性引物,对87株转DmDREBa基因的烟草植株进行PCR检测。结果有43株转基因植株扩增出目的条带(图1),阳性率为49.43%。

图1 35S:DmDREBa转基因植株的PCR鉴定(部分结果)Fig.1 The PCR identification of 35S:DmDREBa transgenic plants(parts)
为了判断DmDREBa基因是否能够在转基因阳性植株中进行转录,我们从检测出的阳性植株中选取了9株,以相同的DmDREBa的引物和PCR程序,进行转基因植株转录水平的鉴定。结果发现,9株中有7株扩增出目的条带,表明DmDREBa能够在转录水平表达(图2)。
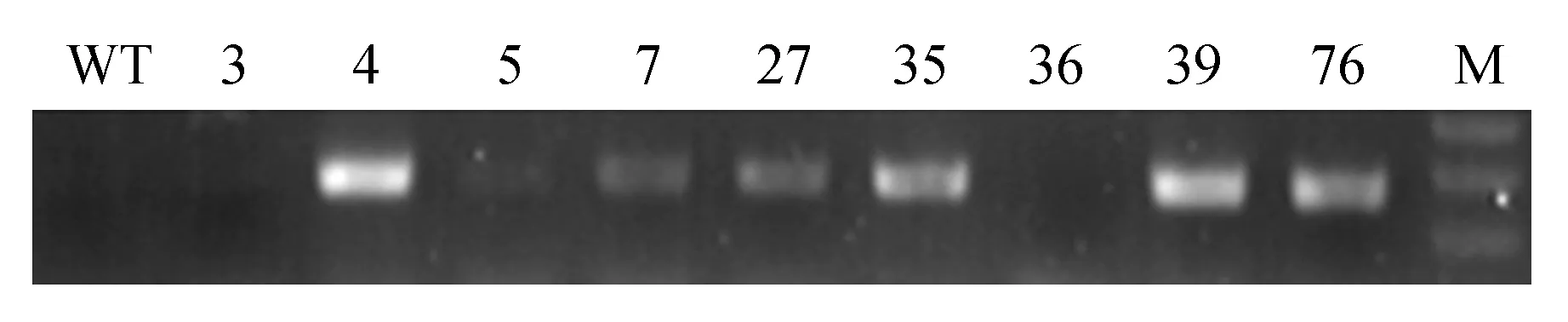
图2 35S:DmDREBa转基因植株的RT-PCR鉴定Fig.2 The RT-PCR identification of 35S:DmDREBa transgenic plants
2.3 转基因烟草Southern blot分析
提取T0代转基因烟草以及野生型烟草的基因组DNA,以地高辛标记的DmDREBa基因全长作为探针,对已经鉴定的PCR阳性植株进行Southern杂交分析。以野生型烟草和携带DmDREBa基因的重组质粒分别作为阴性对照和阳性对照。结果如图3所示,DmDREBa基因已经整合到烟草的基因组中,并且可以看出,检测植株中DmDREBa基因以1~3个拷贝形式随机插入到烟草基因组中。
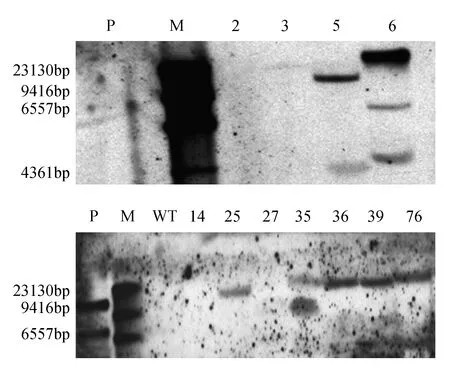
图3 转DmDREBa基因烟草植株的Southern blot鉴定 P. PBI121-GFP质粒;WT.野生型烟草Fig.3 Southern blot analysis of the T0 DmDREBa transgenic plants P. PBI121-GFP plasmid;WT.Wild type tobacco plants
2.4 转DmDREBa基因烟草叶片蒸腾失水分析
为更好的了解转DmDREBa基因植株的抗非生物胁迫的生理特性,我们对转DmDREBa基因T0烟草阳性植株和野生型烟草进行了叶片蒸腾失水速率的比较。结果显示转基因烟草单位时间内每平方厘米面积上比野生型烟草叶片失水量要小(图4),说明由于DmDREBa基因的导入,烟草叶片的保水能力有所增加。

图4 转DmDREBa基因烟草叶片的蒸腾失水分析Fig.4 Analysis of water-holding capacity of DmDREBa transgenic plants leaves
2.5 叶片上下表皮的气孔密度检测
通过气孔密度和大小的观察,发现转基因烟草叶片上下表皮气孔器和气孔开张的长宽度与野生型烟草叶片并无大的差异(图5),表明转基因烟草在气孔器的开张上并未有太大变化。在气孔的数目上,野生型烟草和转基因烟草的下表皮气孔数都多于上表皮,野生型烟草的上下表皮气孔数均多于转基因植株(表1)。经t值测验,转基因烟草和野生型烟草的上、下表皮气孔数的差异均达到显著水平(图6)。

图5 转DmDREBa基因烟草和WT烟草叶片表皮气孔观察 1~2.WT ;3~4.DmDREBa的转基因烟草Fig.5 Observation of stomas in leave epidermis of DmDREBa transgenic plants and wild type tobacco 1-2.WT; 3~4.DmDREBa transgenic plants
Table1ThestomatalnumberinleaveepidermisofDmDREBatransgenicplantsandwildtypetobacco
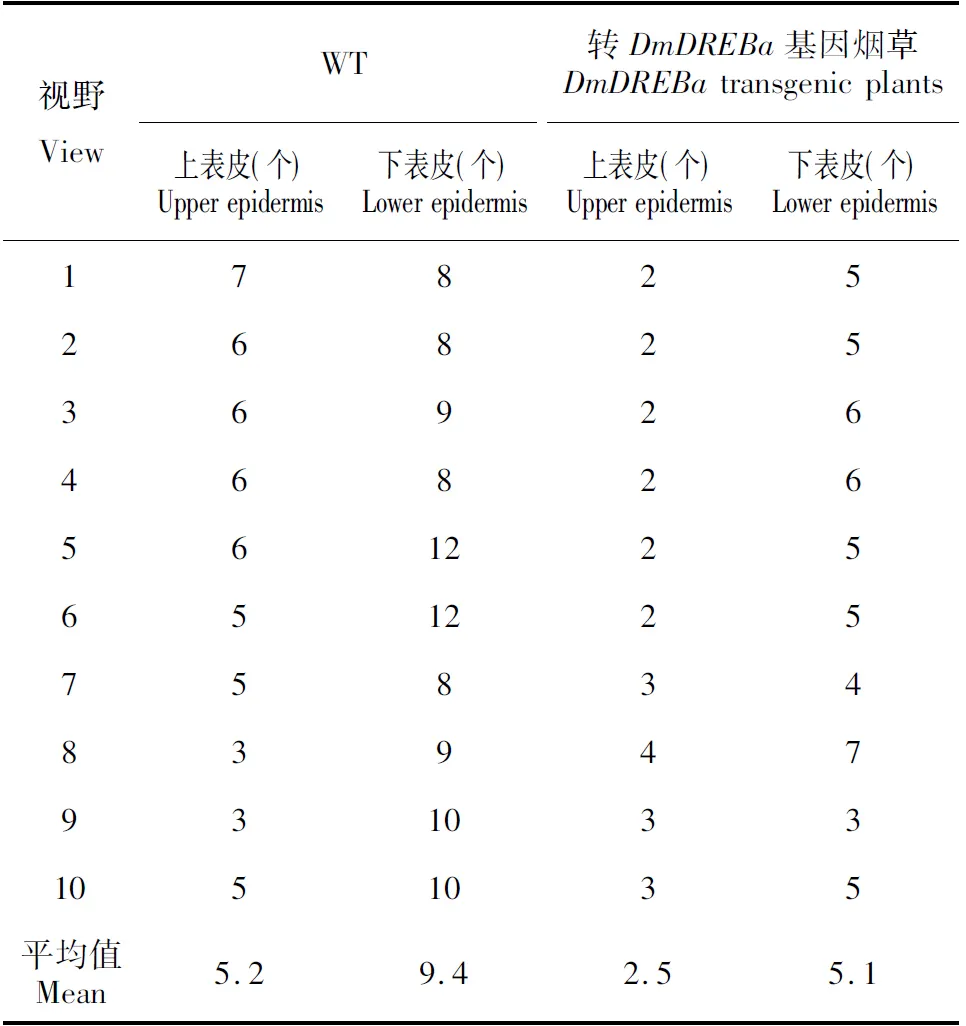
视野ViewWT转DmDREBa基因烟草DmDREBatransgenicplants上表皮(个)Upperepidermis下表皮(个)Lowerepidermis上表皮(个)Upperepidermis下表皮(个)Lowerepidermis1782526825369264682656122565122575834839479310331051035平均值Mean5.29.42.55.1
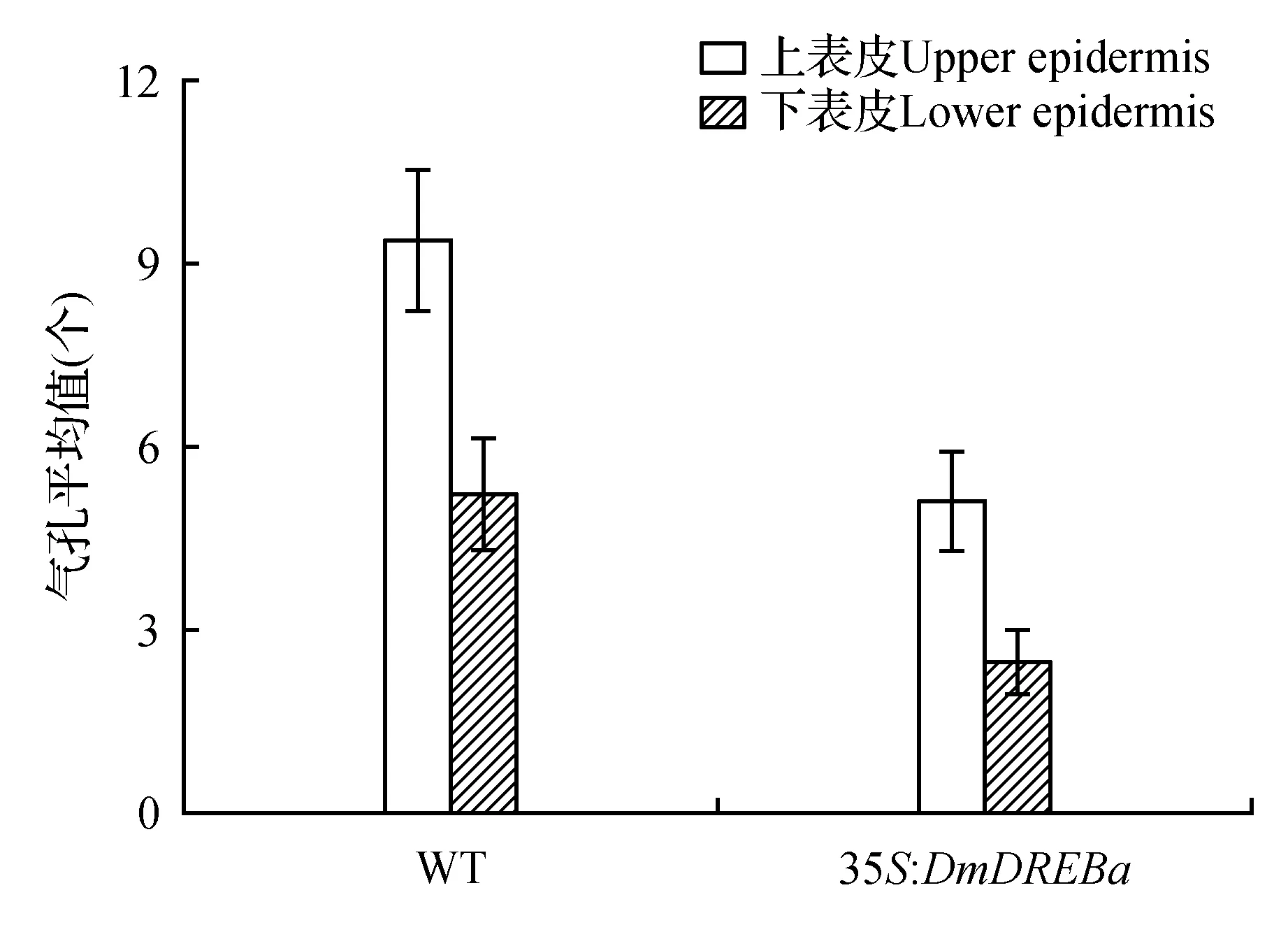
图6 转DmDREBa基因烟草与野生型烟草气孔个数比较Fig.6 The comparison of the stomatal number between DmDREBa transgenic plants and wild type tobacco
2.6T1代转基因烟草的分离比分析
选取了3个T1代株系,将种子播种在含有Kan的1/2MS培养基上。种子萌发两周后,统计其分离比率。卡方测验表明3个转基因株系的幼苗抗/感卡那霉素比例均不显著,表明3个株系均按照3∶1分离。表明这三个转株系内目的基因都是以单拷贝形式插入,与我们前面的所述的Southern杂交结果相一致。
表2转DmDREBa基因烟草T1代分离比较
Table2ThecomparisonamongtheT1linesofDmDREBatransgenictobaccoplants
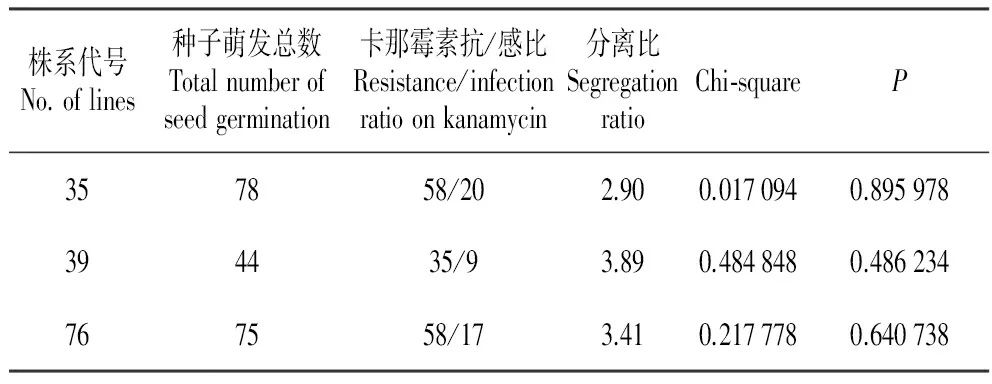
株系代号No.oflines种子萌发总数Totalnumberofseedgermination卡那霉素抗/感比Resistance/infectionratioonkanamycin分离比SegregationratioChi⁃squareP357858/202.900.0170940.895978394435/93.890.4848480.486234767558/173.410.2177780.640738
2.7低温胁迫对转DmDREBa基因T1代烟草叶片的MDA含量的影响
当植物受到低温胁迫时,植物体生物膜的脂类会发生相变,过氧化物增多,脂质过氧化物的形成使膜受体、膜蛋白酶和离子通道的脂质微环境改变,从而改变它们功能,由于脂质过氧化反应的增强,细胞膜内多价不饱和脂肪酸减少,生物膜不饱和脂肪酸/蛋白质比例失常,膜的液态性、流动性改变,通透性增强。含双键脂肪酸过氧化可生成丙二醛(MDA),它的产生与脂质过氧化相平行,因而测定丙二醛含量可代表脂质过氧化物的浓度。为了进一步了解DmDREBa基因的功能,我们对低温胁迫下T1代转基因烟草的丙二醛含量进行了分析。结果如图7所示,野生型烟草和转基因植株(35S:DmDREBa-35和35S:DmDREBa-39)在低温胁迫0 d时,转基因植株MDA含量低于WT,处理2 d后,两者MDA含量都稍有增加,转基因植株比WT略低但差异不明显,然而处理4 d后,转基因植株和WT植株MDA含量都明显增加,并且转基因烟草MDA含量显著低于WT烟草,代号35和代号39的转基因烟草植株之间差异并不明显。由此可以说明,由于DmDREBa基因的导入,提高了烟草的耐低温能力。
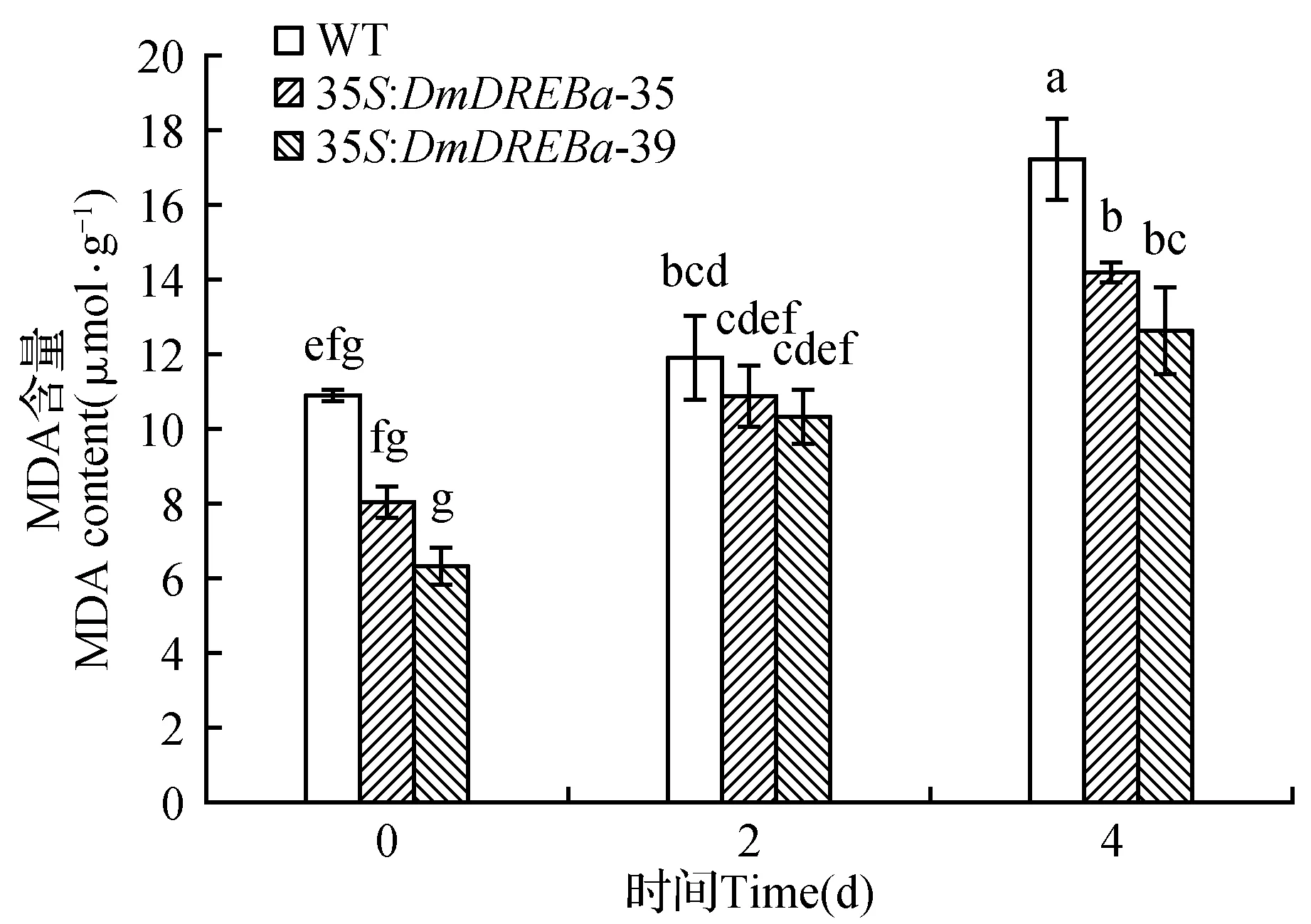
图7 低温胁迫下转DmDREBa基因烟草丙二醛(MDA)含量分析Fig.7 Analysis of MDA in wild type and 35S:DmDREBa transgenic tobacco plants under 4℃ condition
3 讨论
DREB转录因子能通过特异结合DRE/CRT顺式作用元件,激活一系列耐逆相关基因的表达,因此,向植物中导入DREB基因,理论上可以提高植株对低温、高盐和干旱等非生物胁迫的耐逆性[3~4,29]。目前,除拟南芥外,在烟草(Nicotianatabacum)[30]、甘蔗(Saccharumspp.hybrid)[5]、大豆(Glycinemax)[31]、马铃薯(Solanumtuberosum)[32]以及百脉根(Lotuscorniculatus)[33]等多种植物中过表达DREB基因,大大提升了相应转化植物的非生物胁迫耐受能力。在本研究中,在烟草中过表达菊花DmDREBa基因,同样提升了转基因烟草对低温的抗性,这些研究都表明DREB基因确实在植物抵抗低温、高盐和干旱等胁迫中起到了非常重要的作用,在植物抗逆育种方面具有巨大的应用前景。
气孔是植物叶片与外界进行气体交换的唯一可调节通道,与植物的光合作用、蒸腾作用等生理生态功能密切相关。刘卫群等[34]将油菜(Brassicanapus)来源的BnDREB1-5基因转入烟草,发现转基因烟草叶片单位时间内每平方厘米的失水量是野生型烟草叶片的62%,并发现转基因烟草叶片上表皮气孔比野生型大,但气孔开度小于野生型;野生型烟草叶片上的气孔密度为转基因烟草的1.5倍左右。本研究中对T0代转35S:DmDREBa基因烟草和野生型烟草叶片的失水速率进行了研究,发现转基因烟草叶片的保水能力大于野生型(图4)。然而对转35S:DmDREBa基因烟草和野生型烟草叶片气孔大小和开张度进行观察,发现两者并无太大差异;转基因烟草叶片上、下表皮气孔密度显著小于对照野生型烟草(表1)。这与刘卫群等人研究结果较为一致。由此,可以推断转基因烟草气孔密度的减少,导致转基因植株的蒸腾作用下降,是增强转基因烟草的保水能力的原因之一。此外还有其他原因,例如,马刘峰[35]将棉花中的GhCBF3(DREB1A)基因转化拟南芥,发现GhCBF3能够通过调控转基因拟南芥中与响应ABA信号的ABRE(ABA responsive element)顺式作用元件相结合的AREB1/ABF2(ABA-responsive element binding protein;ABF)和AREB2/ABF4转录因子编码基因的表达,通过转基因拟南芥叶片气孔对ABA的敏感性从而加速气孔关闭,进而提高了转基因植株的抗旱能力。
植物在遭受不良环境胁迫时,在细胞内会形成多种氧化活性物质,并在这些氧化活性物质作用下膜脂发生过氧化。丙二醛(MDA)含量是植物细胞膜脂过氧化程度的体现,丙二醛含量高,表明植物细胞膜脂过氧化程度高,细胞膜受到的伤害严重[36]。目前已经有众多研究报道DREB基因能够降低转基因植株中MDA含量[37~39],例如,过表达DREB1A基因的马铃薯中MDA含量在干旱胁迫前后显著低于对照植株[37],过表达拟南芥来源的CBF1/DREB1B基因的烟草中,与对照相比同样发现MDA含量较低[39]。本研究对低温胁迫下T1代转基因烟草的丙二醛含量进行测定分析,发现转基因烟草MDA含量比野生型烟草低22.29%,研究结果与前人研究结果一致。由此可见由于DmDREBa基因的导入,提高了转基因烟草的耐低温能力。鉴于DREB转录因子在植物生长发育中起到多步调控作用,本研究初步揭示DREB转录因子在菊花抵抗逆境胁迫过程中起到重要调控作用,并有利于今后利用基因工程手段获得高抗性的菊花品种奠定分子基础。
很多研究报道认为,DREB转录因子家族能够调控多个与植物干旱、高盐和低温耐性相关的功能基因的表达,组成型过量表达CBF基因还能引起拟南芥和其它植物中脯氨酸生物合成关键酶Δ-1-吡咯琳-5-羧酸合成酶(Δ-1-pyrroline-5-carboxylate synthetase,P5CS)基因的转录物水平的提高以及脯氨酸的积累[30,32,40]。而将拟南芥来源的AtDREB1A基因转入地被菊(Dendranthemagrandiflorum)‘Fall Color’,也提高了转基因菊花植株的脯氨酸含量和SOD活性[41]。因此,在提高植物对非生物胁迫抗性的分子育种中,与导入或改良个别功能基因来提高某种抗性的传统方法相比,改良或增强一个关键的转录因子,通过它促进多个功能基因发挥作用,获得综合改良结果,也许是改良植物抗性的更为有效的方法和途径。
1.Thomashow M F.Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J].Annual Reviews of Plant Physiology and Plant Molecular Biology,1999,50(1):571-599.
2.Shinozaki K,Yamaguchi-shinozaki K,Seki M.Regulatory network of gene expression in the drought and cold stress responses[J].Current Opinion in Plant Biology,2003,6(5):410-417.
3.Liu Q,Kasuga M,Sakuma Y,et al.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression,respectively,inArabidopsis[J].The Plant Cell,1998,10(8):1391-1406.
4.Janiak A,Kwasniewski M,Szarejko I.Gene expression regulation in roots under drought[J].Journal of Experimental Botany,2016,67(4):1003-1014.
5.Augustine S M,Ashwin N J,Syamaladevi D P,et al.Overexpression ofEaDREB2 and pyramiding of EaDREB2 with the pea DNA helicase gene(PDH45) enhance drought and salinity tolerance in sugarcane(Saccharumspp.hybrid)[J].Plant Cell Reports,2015,34(2):247-263.
6.Sakuma Y,Liu Q,Dubouzet J G,et al.DNA-Binding specificity of the ERF/AP2 domain ofArabidopsisDREBs,transcription factors involved in dehydration- and cold-inducible gene expression[J].Biochemical and Biophysical Research Communications,2002,290(3):998-1009.
7.Haake V,Cook D,Riechmann J L,et al.Transcription factor CBF4 is a regulator of drought adaptation inArabidopsis[J].Plant Physiology,2002,130(2):639-648.
8.Knight H,Zarka D G,Okamoto H,et al.Abscisic acid inducesCBFgene transcription and subsequent induction of cold-regulated genes via the CRT promoter element[J].Plant Physiology,2004,135(3):1710-1717.
9.Novillo F,Alonso J M,Ecker J R,et al.CBF2/DREB1C is a negative regulator ofCBF1/DREB1BandCBF3/DREB1Aexpression and plays a central role in stress tolerance inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(11):3985-3990.
10.Guo Y,Xiong L,Ishitani M,et al.AnArabidopsismutation in translation elongation factor 2 causes superinduction of CBF/DREB1 transcription factor genes but blocks the induction of their downstream targets under low temperatures[J].Proc Natl Acad Sci,2002,99(11):7786-7791.
11.Qin F,Kakimoto M,Sakuma Y,et al.Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses inZeamaysL.[J].Plant J,2007,50(1):54-69.
12.Sakuma Y,Maruyama K,Qin F,et al.Dual function of anArabidopsistranscription factor DREB2A in water-stress-responsive and heat-stress-responsive gene expression[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(49):18822-18827.
13.Sato H,Mizoi J,Tanaka H,et al.Arabidopsis DPB3-1,a DREB2A interactor,specifically enhances heat stress-induced gene expression by forming a heat stress-specific transcriptional complex with NF-Y subunits[J].The Plant Cell,2014,26(12):4954-4973.
15.Jaglo-ottosen K R,Gilmour S J,Zarka D G,et al.ArabidopsisCBF1 overexpression inducesCORgenes and enhances freezing tolerance[J].Science,1998,280(5360):104-106.
16.Zhuang J,Chen J M,Yao Q H,et al.Discovery and expression profile analysis of AP2/ERF family genes fromTriticumaestivum[J].Molecular Biology Reports,2011,38(2):745-753.
17.Wei T,Deng K J,Gao Y H,et al.ArabidopsisDREB1B in transgenicSalviamiltiorrhizaincreased tolerance to drought stress without stunting growth[J].Plant Physiology and Biochemistry,2016,104:17-28.
18.Stockinger E J,Gilmour S J,Thomashow M F.ArabidopsisthalianaCBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(3):1035-1040.
19.Du C F,Hu K N,Xian S S,et al.Dynamic transcriptome analysis reveals AP2/ERF transcription factors responsible for cold stress in rapeseed(BrassicanapusL.)[J].Molecular Genetics and Genomics,2016,doi:10.1007/s00438-015-1161-0.
20.Li J H,Sima W,Ouyang B,et al.TomatoSlDREBgene restricts leaf expansion and internode elongation by downregulating key genes for gibberellin biosynthesis[J].Journal of Experimental Botany,2012,63(18):6407-6420.
21.Xu Z S,Ni Z Y,Li Z Y,et al.Isolation and functional characterization ofHvDREB1-agene encoding a dehydration-responsive element binding protein inHordeumvulgare[J].Journal of Plant Research,2009,122(1):121-130.
22.Liu S X,Wang X L,Wang H W,et al.Genome-wide analysis ofZmDREBgenes and their association with natural variation in drought tolerance at seedling stage ofZeamaysL[J].PLoS Genetics,2013,9(9):e1003790.
23.Challam C,Ghosh T,Rai M,et al.Allele mining acrossDREB1AandDREB1Bin diverse rice genotypes suggest a highly conserved pathway inducible by low temperature[J].Journal of Genetics,2015,94(2):231-238.
24.Yang Y F,Wu J,Zhu K,et al.Identification and characterization of two chrysanthemum(Dendronthema×moriforlium) DREB genes,belonging to the AP2/EREBP Family[J].Molecular Biology Reports,2009,36(1):71-81.
25.Liu L Q,Zhu K,Yang Y F,et al.Molecular cloning,expression profiling and trans-activation property studies of aDREB2-like gene from chrysanthemum(Dendranthemavestitum)[J].Journal of Plant Research,2008,121(2):215-226.
26.高越峰,朱祯,肖桂芳,等.大豆Kunitz型胰蛋白酶抑制剂基因的分离及其在抗虫植物基因工程中的应用[J].植物学报,1998,40(5):405-411.
Gao Y F,Zhu Z,Xiao G F,et al.Isolation of soybean Kuntz trypsin inhibitor gene and its application in plant insect-resistant genetic engineering[J].Acta Botinica Sinica,1998,40(5):405-411.
27.冯冬霞,施生锦.叶面积测定方法的研究效果初报[J].中国农学通报,2005,21(6):150-152,155.
Feng D X,Shi S J.Research on night measurement methods of leaf area[J].Chinese Agricultural Science Bulletin,2005,21(6):150-152,155.
28.李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
Li H S.Principles and techniques of plant physiological biochemical experiment[M].Beijing:Higher Education Press,2000.
29.Nakashima K,Yamaguchi-shinozaki K,Shinozaki K.The transcriptional regulatory network in the drought response and its crosstalk in abiotic stress responses including drought,cold,and heat[J].Frontiers in Plant Science,2014,5:170.
30.Zhang X,Liu X X,Wu L,et al.The SsDREB transcription factor from the succulent halophyteSuaedasalsaenhances abiotic stress tolerance in transgenic tobacco[J].International Journal of Genomics,2015,2015:875497.
31.Zhang X X,Tang Y J,Ma Q B,et al.OsDREB2A,a rice transcription factor,significantly affects salt tolerance in transgenic soybean[J].PLoS One,2013,8(12):e83011.
32.Bouaziz D,Pirrello J,Charfeddine M,et al.Overexpression of StDREB1 transcription factor increases tolerance to salt in transgenic potato plants[J].Molecular Biotechnology,2013,54(3):803-817.
33.Zhou M L,Ma J T,Zhao Y M,et al.Improvement of drought and salt tolerance inArabidopsisand Lotus corniculatus by overexpression of a novel DREB transcription factor fromPopuluseuphratica[J].Gene,2012,506(1):10-17.
34.刘卫群,石永春,胡亚杰,等.DREB类转录因子介导的烟草抗非生物胁迫特性研究[J].武汉植物学研究,2007,25(3):222-225.
Liu W Q,Shi Y C,Hu Y J,et al.The tolerance to abiotic stresses mediated by DREB-like transcription factors inNicotianatabacum[J].Journal of Wuhan Botanical Research,2007,25(3):222-225.
35.马刘峰.棉花(Gossypiumhirsutum)DREB/CBF基因的筛选鉴定及其在植物抗逆应答中的功能研究[D].武汉:华中师范大学,2015.
Ma L F.Screening and fuctional analysis of cottonDREB/CBFgenes that are involved in plant response and defense to abiotic stress[D].Wuhan:Central China Normal University,2015.
36.潘澜,薛立.植物淹水胁迫的生理学机制研究进展[J].生态学杂志,2012,31(10):2662-2672.
Pan L,Xue L.Plant physiological mechanisms in adapting to waterlogging stress:a review[J].Chinese Journal of Ecology,2012,31(10):2662-2672.
37.贾小霞,齐恩芳,马胜,等.转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析[J].草业学报,2015,24(11):58-64.
Jia X X,Qi E F,Ma S,et al.Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressing DREB1A/Bar[J].Acta Prataculturae Sinica,2015,24(11):58-64.
38.Zhang P,Yang P Z,Zhang Z Q,et al.Isolation and characterization of a buffalograss(Buchloedactyloides) dehydration responsive element binding transcription factor,BdDREB2[J].Gene,2014,536(1):123-128.
39.Yang J S,Wang R,Meng J J,et al.Overexpression ofArabidopsisCBF1 gene in transgenic tobacco alleviates photoinhibition of PSⅡ and PSⅠ during chilling stress under low irradiance[J].Journal of Plant Physiology,2010,167(7):534-539.
40.Gilmour S J,Sebolt A M,Salazar M P,et al.Overexpression of theArabidopsisCBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J].Plant Physiology,2000,124(4):1854-1865.
41.Hong B,Tong Z,Ma N,et al.Heterologous expression of theAtDREB1Agene in chrysanthemum increases drought and salt stress tolerance[J].Science in China Series C:Life Sciences,2006,49(5):436-445.
Partly supported by National Natural Science Foundation of China(31300567);National non-profit Research Institutions of Chinese Academy of Forestry(CAFYBB2014QB001)
introduction:YANG Yan-Fang(1978—),female,Ph.D,Major in plant second metabolic engineering.
date:2016-04-19
OverexpressionofDmDREBaGeneSignificantlyEnhancesLowTemperatureToleranceinTransgenicTobacco
YANG Yan-Fang1WU Jian2ZHU Kai2LIU Li-Qing4CHEN Fa-Di3YU De-Yue2*
(1.Research Institute of Forestry,Chinese Academy of Forestry,State Key Laboratory of Tree Genetics and Breeding,Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration,Beijing 100091;2.National Center for Soybean Improvement,National Key Laboratory of Crop Genetics and Germplasm Enhancement,Nanjing Agricultural University,Nanjing 210095;3.College of Horticulture,Nanjing Agricultural University,Nanjing 210095;4.Fujian Provincial Key Lab of Subtropic Plant Physiology and Biochemistry,Fujian Institute of Subtropical Botany,Xiamen 361009)
Many environmental factors such as drought, salt stress, hormones and low/high temperature influence the growth and development of plants. It has been found that DREB transcription factors play important roles in plants against different abiotic stresses. In this study,DmDREBa(GenBank accession No.EF490996), aDREB-like gene isolated from chrysanthemum was overexpressed in tobacco plants by mediation ofAgrobacteriumtumefaciensunder the control of the constitutive promoter CaMV 35S, and 43 transgenic tobacco plants were obtained by PCR method. 9 transgenic tobacco plants were randomly selected to perform RT-PCR investigation and 7 plants indicated RNA transcripts accumulation. The southern blot result showed that 1-3 copies ofDmDREBawere randomly inserted. The tolerance of transgenic tobacco plants was increased comparing with the wild type tobacco plants under low temperature condition. The water loss of transgenic tobacco was less than wild type plants after natural transpiration. Moreover, the density of the stomata in the epidermis was observed. The result showed that the numbers of stomata in upper or lower epidermis of transgenic plants were reduced comparing to wild type tobacco. The result ofttest demonstrated that the differences between the upper and lower epidermis of transgenic plants and wild type were significant. Furthermore, the content of malondialdehyde(MDA) in transgenic plants was lower than that in wild type tobacco plants at lower temperature condition, which indicated the tolerance ability of transgenic plants was increased. All these results indicated thatDmDREBaimproved tolerance ability of trangenic tobacco plants to the lower temperature stress. This research will provide a very useful reference for functional analysis of DREB genes in chrysanthemum in the future.
chrysanthemum;DREB;Agrobacterium-mediated transformation;transgenic tobacco(Nicotianatabacum‘Xantbine’);tolerance
国家自然科学基金项目(31300567);中央级公益性科研院所基本科研业务费专项(CAFYBB2014QB001)
杨艳芳(1978—),女,副研究员,现主要从事植物次生代谢工程研究。
* 通信作者:E-mail:dyyu@njau.edu.cn
2016-04-19
* Corresponding author:E-mail:dyyu@njau.edu.cn
Q943.2
A
10.7525/j.issn.1673-5102.2016.05.013
