2种高山海棠营养器官的解剖结构及其生态适应性研究
2016-11-10陈小红李慧敏丁银鹏康喜坤
徐 扬 陈小红* 李慧敏 丁银鹏 康喜坤 李 倩
(1.四川农业大学林学院,温江 611130; 2.开江县园林管理所,达州 636250)
2种高山海棠营养器官的解剖结构及其生态适应性研究
徐 扬1陈小红1*李慧敏1丁银鹏2康喜坤1李 倩1
(1.四川农业大学林学院,温江 611130;2.开江县园林管理所,达州 636250)
采用NaOCl法、石蜡切片法对分布于海拔3 000 m的川西高原野生变叶海棠和花叶海棠的叶、茎、根进行了研究,旨在分析2种高山海棠营养器官的解剖构造,并探讨其解剖特征与川西高原干旱贫瘠地区的生态适应关系。结果表明:变叶海棠和花叶海棠的解剖构造极为相似,这可能与二者在起源及地理分布等的密切联系有关:二者叶的上下表皮细胞均具有厚的角质层,且上表皮气孔缺失、下表皮气孔密集,栅栏组织较厚,叶柄中具有分化出栅栏组织和海绵组织的纵棱脊结构;二者茎中的栓内层细胞壁较厚,次生木质部发达,导管周围分布着细胞壁木质化的木薄壁组织细胞,髓的外围有一圈细胞壁增厚的环髓带细胞;2种海棠的细根中已出现典型的次生结构,木质部占有极大的比例,主要以单管孔的形式存在的导管密集,无髓结构。变叶海棠和花叶海棠的上述解剖结构特征体现了二者对川西高原地区干旱环境都具有较强的适应能力。
川西高原;变叶海棠;花叶海棠;解剖结构;生态适应性
变叶海棠(Malustoringoides(Rehd.) Hughes)和花叶海棠(Malustransitoria(Batal.) Schneid.)同为蔷薇科(Rosaceae)苹果属(Malus)陇东海棠系(Ser.Kansuenses(Rehd.)Rehd.)植物,主要分布于以川西青藏高原东南沿的炉霍县为代表四川西部甘孜州的高海拔地区。变叶海棠和花叶海棠都为落叶灌木或小乔木,树形美观,秋季红果满树,具有较高的观赏价值。不仅可作园林用树,也可作为苹果砧木利用,是极珍贵的苹果种质资源[1~2]。此外,二者都具有极强的适应性和抗逆性[3],是川西高原干旱贫瘠地区的重要建群种和生态树种。研究发现变叶海棠和花叶海棠的果实和叶片含有丰富的营养成分,果实可作为果品直接食用或加工成果酱、饮料等天然绿色食品;变叶海棠的叶片可制茶,具有降血糖、血脂、血压,养颜、活血化瘀等保健功效[4]。总之,变叶海棠和花叶海棠都是值得开发利用的珍贵高山植物资源。
川西高原地区昼夜温差大、气压低、日照辐射强且干旱少雨,加之经常出现霜雪、大风等极端天气,致使植物的适宜生长季节十分短暂。变叶海棠和花叶海棠仍能在如此恶劣的生态环境中成为优势种,其必有一套由相应的解剖结构及生理代谢等形成的生态适应机制。大量研究表明,变叶海棠和花叶海棠表现为地理替代分布[5],在形态学、起源及遗传多样性等各方面都具有密切的联系[6~7]。
本文对分布于炉霍县的野生变叶海棠和花叶海棠的营养器官进行了形态解剖学研究,以探讨2种高山海棠的结构特征与其生存环境之间的适应渠道,阐明其生态适应机制,以期为川西高原2种珍贵高山植物资源的进一步研究累积资料,同时也为保护及可持续利用2种高山海棠提供重要的理论依据。
1 材料与方法
1.1 试验材料
炉霍县干季雨季分明,干季雨量奇小,干旱严重,雨季集中,且干旱季节可长达8个月,年平均降水量为652.3 mm,平均降水最多出现在6月,降雨量为135.3 mm,最少是12月,仅为1.9 mm,年平均蒸发量为1 629.4 mm;年平均日照百分率为59%。本研究所用材料均采自甘孜州炉霍县任达乡易日沟(31°11′24″N,100°47′24″E),海拔高度3 096 m,选取生境和长势较一致的变叶海棠、花叶海棠代表性健康植株各5株,剪取植株的叶(选取植株中部的成熟健康叶片)、茎(直径为2~3 mm)、根(取自5~20 cm的土壤层,直径为3~4 mm),切成5 mm长的小段备用。
1.2 试验方法
叶的气孔观测采用NaOCl法[8]。将叶片放入20% NaOCl溶液中浸泡至完全发白呈透明状,经上下表皮剥离后,用1%番红染色制片,于OLMPUS显微镜下成像,同时测量气孔的长度、宽度和密度等指标。每项指标重复测定25次,求其平均值。
叶、茎、根的解剖结构观测采用石蜡制片法[9]。将材料投入FAA溶液中固定,切片厚度为10~15 μm,番红—固绿双重染色,中性树胶封片,使用OLYMPUS显微镜成像系统成像,测定各部分数据,即叶片中上、下表皮角质层和表皮细胞厚度,栅栏组织厚度等;茎中韧皮部、木质部、髓的比例及导管孔径;根中韧皮部、木质部的比例及导管孔径等指标。每项指标重复测定50次,取平均值。
2 结果与分析
2.1 变叶海棠和花叶海棠叶的解剖结构
植物的叶片通过光合作用和蒸腾作用等代谢活动与周围环境直接进行水分和气体的交换,可较灵敏的反映植物内部构造和生态环境之间的适应关系。变叶海棠和花叶海棠均为异面叶(图版Ⅰ:1;图版Ⅱ:1),叶片上下表皮均分布有表皮毛,且上表皮的表皮毛少于下表皮。变叶海棠下表皮的表皮毛只在中脉及侧脉处分布较多,而花叶海棠的下表皮密被绒毛。二者叶片的上下表皮层均由一层细胞构成,上表皮细胞排列紧密,互相嵌合,其中叶肉组织处的表皮细胞呈不规则多边形,叶脉处的表皮细胞呈不规则圆形;下表皮细胞排列也较紧密,位于叶肉组织处的多边形表皮细胞明显小于上表皮,叶脉处的表皮细胞也呈不规则圆形。两种海棠叶片的上下表皮细胞外切向壁上附有一层平滑的角质层结构,变叶海棠的上表皮角质层厚度(4.28 μm)大于花叶海棠(3.70 μm),下表皮角质层厚度相差不大,且叶脉处的上下表皮角质层都厚于叶脉间(图版Ⅰ:1;图版Ⅱ:1)。
变叶海棠和花叶海棠的气孔均只分布在下表皮,多数呈椭圆形,6~8个副卫细胞沿保卫细胞的半径方向呈辐射状排列(图版Ⅰ:2;图版Ⅱ:2),且变叶海棠的角质膜分别在两个保卫细胞上延伸而成尖刺状凸起(图版Ⅰ:1)。变叶海棠的气孔密度(261.45 个·mm-2)小于花叶海棠(286.38 个·mm-2),但其气孔长(29.81 μm)、宽(20.36 μm)均大于花叶海棠的气孔长(24.64 μm)、宽(17.75 μm)。
变叶海棠和花叶海棠叶近上表皮的栅栏组织由2~3层长圆柱细胞构成,排列紧密而整齐。第一层栅栏细胞最长(图版Ⅰ:1;图版Ⅱ:1),变叶海棠为63.77 μm,花叶海棠为48.26 μm,靠近海绵组织的栅栏细胞较短,并逐渐向海绵组织的形态过渡,栅栏组织中叶绿体含量较多;二者的海绵组织由不规则的细胞组成,且排列较疏松,细胞空隙较大,叶绿体含量较少。2种高山海棠的栅栏细胞和海绵细胞间均有少量含晶细胞存在,变叶海棠的栅栏组织与海绵组织厚度比达1.27,大于花叶海棠(0.98)。
2种高山海棠的主脉维管束为外韧维管束,呈月牙型,发达的木质部位于靠上表皮的一侧,在横切面上30~40列导管整齐的径向排列,导管为不规则多边形,有时近圆形(图版Ⅰ:3、4;图版Ⅱ:3、4)。染色较深的为韧皮部,其外围为数层次生细胞壁发达的韧皮纤维,韧皮纤维以外是4~6层薄壁组织细胞,细胞体积较大,个别细胞含有草酸钙簇晶,且细胞间常出现空腔,紧邻下表皮细胞的是2~3层的厚角组织。变叶海棠叶片主脉的维管束厚度为273.35 μm,小于花叶海棠(288.61 μm)。
变叶海棠和花叶海棠的叶柄近轴面有两条明显的纵棱脊,使得叶柄的横切面呈Y型,整个叶柄结构由一层表皮细胞包裹,排列紧密且整齐,除纵棱脊处的表皮细胞呈扁平近方形外,其余表皮细胞多近圆形,表皮外的角质层较厚(图版Ⅰ:5;图版Ⅱ:5),变叶海棠的叶柄角质层厚度为4.72 μm,花叶海棠为4.94 μm。表皮细胞以内分布着2~5层近圆形且较小的厚角组织细胞,细胞间几无间隙,位于厚角组织细胞内侧分布着排列较疏松的薄壁细胞,且部分薄壁细胞内含有晶体。两条纵棱脊类似叶片的横切面结构,有栅栏组织和海绵组织的分化,纵棱脊的近轴面分布着1~2层栅栏组织,叶绿体含量丰富,且栅栏组织和表皮细胞之间有一层较大的薄壁细胞,形态与表皮细胞相似,多被染成红褐色,这是由于这些细胞中普遍存在单宁,而单宁可氧化成红褐色鞣酐[10],纵棱脊的远轴面分布着不规则的海绵细胞,细胞间隙较大,叶绿体含量也较丰富,海绵组织和表皮细胞之间无薄壁细胞的分化。叶柄的中央有一个大的月牙型外韧维管束,结构与叶片中主脉维管束相似,均由木质部、形成层、韧皮部组成,变叶海棠叶柄的中央维管束厚度为236.47 μm,花叶海棠为243.38 μm;叶柄的两个纵棱脊处以及纵棱脊与主脉维管束相接的地方常分布着小维管束(图版Ⅰ:5;图版Ⅱ:5)。
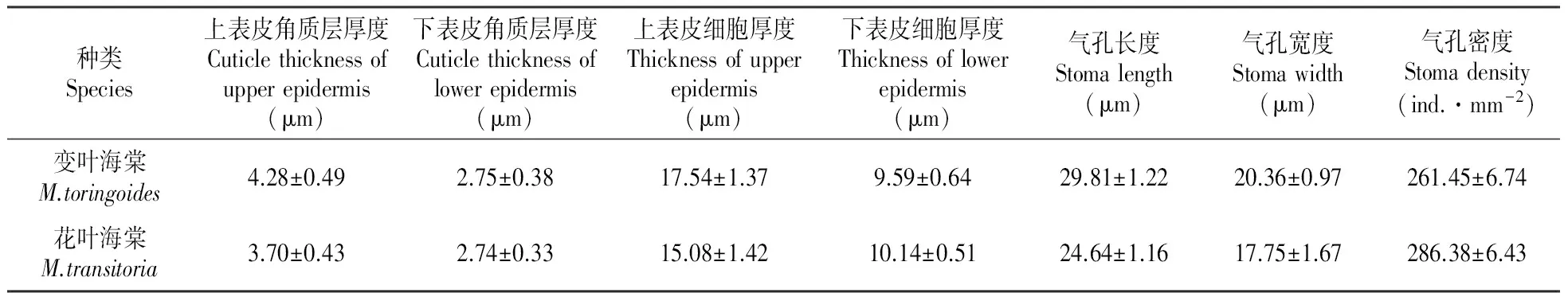
表1 2种高山海棠叶的解剖结构量化参数
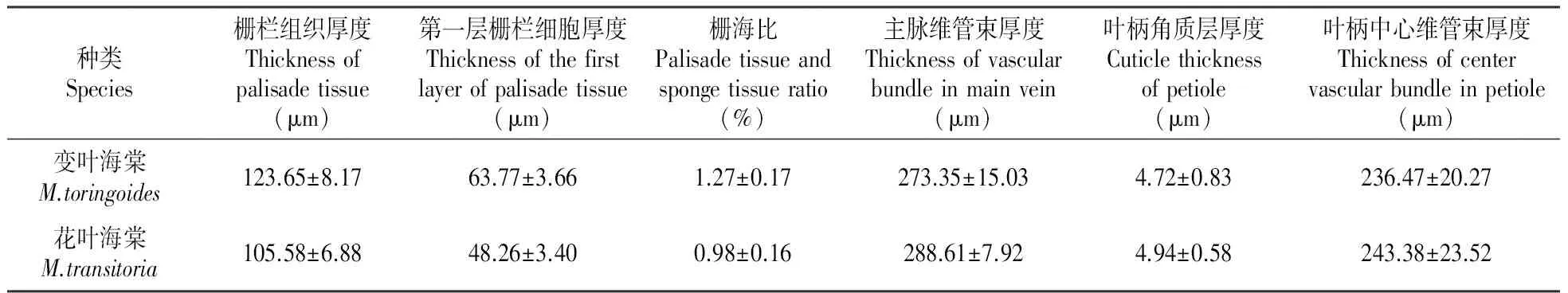
表2 2种高山海棠叶的解剖结构量化参数
2.2 变叶海棠和花叶海棠茎的解剖结构
变叶海棠和花叶海棠茎的结构均为典型的双子叶木本植物茎的结构,横切面呈圆形。最外层的表皮细胞部分脱落,表皮细胞外可见被染成红色的角质层结构。表皮层内侧为由木栓层细胞、木栓形成层细胞和栓内层细胞构成的周皮结构,染色后呈深褐色。其中木栓细胞排列紧密,无胞间隙,呈径向纵行排列,栓内层细胞较皮层薄壁细胞小,排列较紧密,且细胞壁较厚,加强了茎的机械支持功能,而皮层薄壁细胞较大,形状不规则,细胞群之间有狭长的空腔出现(图版Ⅰ:6~7;图版Ⅱ:6~7)。
维管柱在整个茎横切面中占有较大的比例,最外围是较狭窄的呈梯形排列的次生韧皮部,变叶海棠的次生韧皮部在横切面中所占比例为30.71%,大于花叶海棠(26.25%);次生韧皮部和次生木质部之间的维管形成层细胞呈压扁的方形,次生木质部由导管、木射线、木纤维和木薄壁组织细胞组成,变叶海棠的次生木质部在横切面中所占比例为42.21%,花叶海棠为38.35%,导管密集,且导管周围分散着较多细胞壁木质化的木薄壁组织细胞;髓心不规则,由染色丰富的薄壁细胞组成,髓的外缘有一圈比髓细胞直径小、染色较深且细胞壁增厚的细胞,称为环髓带(图版Ⅰ:8;图版Ⅱ:8),变叶海棠的髓在横切面中占9.02%的面积,花叶海棠为11.00%;维管射线在茎的横切面上呈放射状,在韧皮部处膨大成漏斗状结构(图版Ⅰ:6;图版Ⅱ:6),连结皮层和髓,是横向运输的通道。
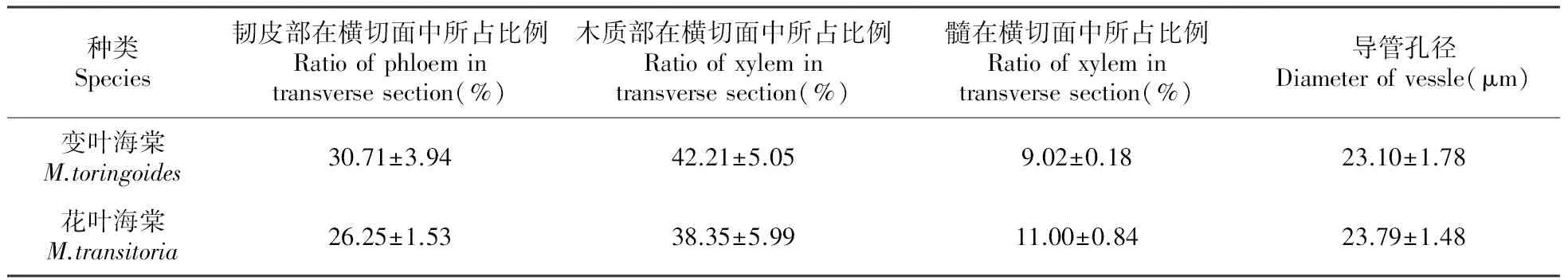
表3 2种高山海棠茎的解剖结构量化参数
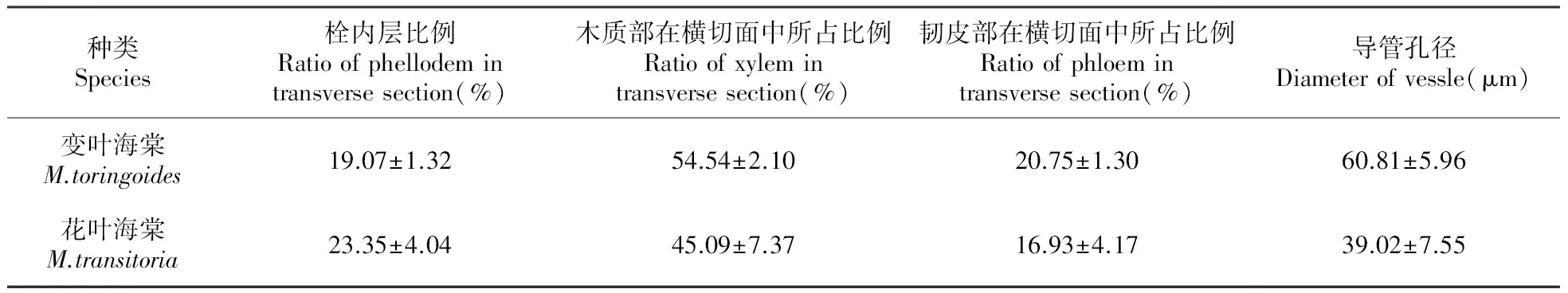
表4 2种高山海棠根的解剖结构量化参数
2.3 变叶海棠和花叶海棠根的解剖结构
两种高山海棠的细根呈现了典型的次生结构,最外层的表皮细胞和皮层细胞脱落,取而代之的是次生保护组织周皮,由木栓层、木栓形成层和栓内层组成。木栓层由5~7层的木栓细胞构成,木栓细胞扁平,排列紧密整齐,呈放射状的同心环形,细胞壁栓质化,具有不透水性,从而增强了对根的保护作用。栓内层细胞较木栓层细胞大,形状不规则,细胞壁较薄,内含物较多,是一种贮藏组织,代替初生结构的皮层组织和髓行使贮藏功能,变叶海棠的栓内层比例为19.07%,花叶海棠为23.35%。木栓形成层位于木栓层和栓内层之间,因被挤压成扁平带状而难以辨认。
周皮组织以内是依次为次生韧皮部、维管形成层、次生木质部及狭窄的初生木质部,二者均无髓结构。次生韧皮部主要由筛管、伴胞、韧皮薄壁组织细胞、韧皮纤维、韧皮射线组成,其中变叶海棠的部分韧皮薄壁组织细胞中观察到淀粉粒的存在,韧皮纤维含量较少,细胞横切面呈不规则圆形,细胞壁显著加厚并染色呈鲜红色,韧皮射线由1~2列较大的细胞构成,具内含物。维管形成层不明显。木质部在根的横切面中均占据相当大的比例,变叶海棠的木质部在横切面比例高达54.54%,花叶海棠也达到45.09%;导管主要以单管孔的形式存在,管孔周围被具有强烈木质化的次生壁的木薄壁组织细胞包围,管孔腔内未见侵填体,导管口径大小不一,变叶海棠导管的平均孔径为60.81 μm,远大于花叶海棠(39.02 μm)。木射线明显,多由1列细胞构成,但部分根中观察到木射线细胞增宽为6~8列细胞(图版Ⅰ:9、10;图版Ⅱ:9、10)。
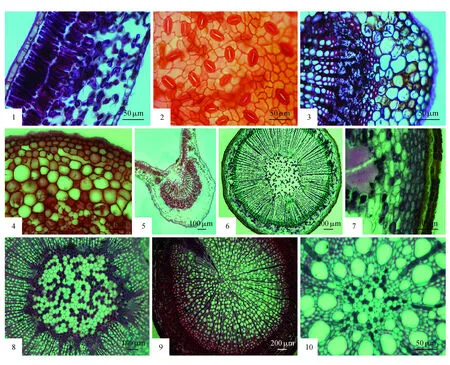
图版Ⅰ 1.变叶海棠叶片横切(示角质层、表皮细胞、栅栏组织、海绵组织及下表皮上角质膜在两个保卫细胞上延伸形成的尖刺状凸起);2.变叶海棠叶下表皮(示气孔)3.变叶海棠叶片横切(示主脉中外韧维管束的木质部、韧皮部、韧皮纤维、皮层薄壁细胞);4.变叶海棠叶片横切(示皮层薄壁细胞间的空腔);5.变叶海棠叶柄横切(示纵棱脊结构中的栅栏组织和海绵组织以及维管束);6.变叶海棠茎横切(示周皮组织、皮层、次生韧皮部、次生木质部、髓、维管射线);7.变叶海棠茎横切(示木栓层、栓内层细胞、厚角组织、皮层薄壁组织、韧皮纤维);8.变叶海棠茎横切(示髓及髓周围的厚壁细胞);9.变叶海棠根横切(示周皮组织、次生韧皮部、次生木质部及特化的木射线);10.变叶海棠根横切(示原生木质部和后生木质部)PlateⅠ 1.The leaf transverse view of M.toringoides(showing cuticle,epidermis cell,palisade tissue,sponge tissue,and the spininess preiection formed by cuticular membrane on the two guard cells); 2.The leaf lower epidermis view of M.toringoides(showing stoma);3.The leaf transverse view of M.toringoides(showing xylem,phloem,bast fiber,cortex parenchyma cells of collateral vascular bundle); 4.The leaf transverse view of M.toringoides(showing the cavum cells); 5.The leaf petiole transverse view of M.toringoides(showing the longitudinal ridges structure with palisade and sponge tissues and vascular bundle); 6.The stem transverse view of M.toringoides(showing the periderm,cortex,secondary phloem,secondary xylem,pith,and vascular ray); 7.The stem transverse view of M.toringoides(showing the phellem layer,phelloderm,collenchyma,cortex parenchyma,bast fiber); 8.The stem transverse view of M.toringoides(showing the pith and sclerenchyma cells); 9.The root transverse view of M.toringoides(showing periderm,secondary phloem,secondary xylem and specialized wood rays); 10.The root transverse view of M.toringoides(showing the primary xylem and metaxylem)
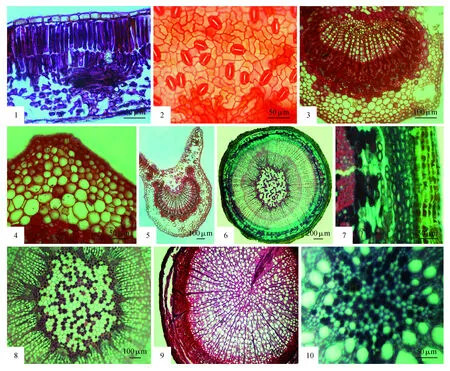
图版Ⅱ 1.花叶海棠叶片横切(示角质层、表皮细胞、栅栏组织、海绵组织);2.花叶海棠叶下表皮(示气孔)3.花叶海棠叶片横切(示主脉中外韧维管束的木质部、韧皮部、韧皮纤维、皮层薄壁细胞);4.花叶海棠叶片横切(示皮层薄壁细胞间的空腔及含晶细胞);5.花叶海棠叶柄横切(示纵棱脊结构中的栅栏组织和海绵组织以及维管束);6.花叶海棠茎横切(示周皮组织、皮层、次生韧皮部、次生木质部、髓、维管射线);7.花叶海棠茎横切(示木栓层、栓内层细胞、厚角组织、皮层薄壁组织、韧皮纤维);8.花叶海棠茎横切(示髓及髓周围的厚壁细胞);9.花叶海棠根横切(示周皮组织、次生韧皮部、次生木质部及特化的木射线);10.花叶海棠根横切(示原生木质部和后生木质部)PlateⅡ 1.The leaf transverse view of M.transitoria(showing cuticle,epidermis cell,palisade tissue,sponge tissue); 2.The leaf lower epidermis view of M.transitoria(showing stoma); 3.The leaf transverse view of M.transitoria(showing xylem,phloem,bast fiber,cortex parenchyma cells of collateral vascular bundle); 4.The leaf transverse view of M.transitoria(showing the cavum cells and crystal cells); 5.The leaf petiole transverse view of M.transitoria(showing the longitudinal ridges structure with palisade and sponge tissues and vascular bundle); 6.The stem transverse view of M.transitoria(showing the periderm,cortex,secondary phloem,secondary xylem,pith,and vascular ray); 7.The stem transverse view of M.transitoria(showing the phellem layer,phelloderm,collenchyma,cortex parenchyma,bast fiber); 8.The stem transverse view of M.transitoria(showing the pith and sclerenchyma cells); 9.The root transverse view of M.transitoria(showing periderm,secondary phloem,secondary xylem and specialized wood rays); 10.The root transverse view of M.transitoria(showing the primary xylem and metaxylem)
3 讨论
生存环境的类型塑造了植物的外部形态和内部结构,野生的变叶海棠和花叶海棠多生长于海拔3 000多米的川西高原贫瘠地区。它们之所以能在这样的环境中繁衍生息,是因其具有适应该生境一系列途径。
3.1 降低蒸腾速率,抵抗强日照辐射
强日照辐射及其引起的大量蒸腾失水,是二者成为当地建群种所面临的首要难题。发达的角质层和木栓层结构、叶片上表皮气孔的缺失及叶背的表皮毛等特征正是变叶海棠和花叶海棠营养器官的表皮系统对这一首要难题的一系列适应进化。角质层结构不仅可以有效降低叶表的水分流失,还可反射强光避免内部细胞的灼伤,同时在控制病菌孢子的附着和萌发上具有一定的作用[11],且上表皮的角质层对植物的抗旱性起着尤其重要的作用[12]。变叶海棠和花叶海棠的叶片上下表皮均被有发达的角质层,其中变叶海棠的上表皮角质层厚度达到4.28 μm,杨静慧等人[13]的研究表明,变叶海棠的角质层厚度在春夏季都明显厚于其余7种苹果属植物,具有较强的抗春旱和伏旱能力,此外花叶海棠的角质层厚度在夏季表现也较优,具有一定的抗伏旱能力。本文结果显示,2种高山海棠的茎和根已出现典型的次生结构,表皮以及表皮外的角质层结构已脱落,由次生保护组织周皮代替行使相关功能,其中与叶表皮角质层功能相似的结构是周皮最外层的木栓层细胞,该结构细胞壁完全栓质化,不透气、不透水,既有效的防止了体内水分的流失,又隔绝了外界的不利因素,保证了植物茎、根的生理代谢活动的正常进行[14~15]。植物叶片的上表皮因其接受日照辐射较多,而成为水分散失的主要渠道。变叶海棠和花叶海棠同大多数蔷薇科植物[16]一样只在叶片下表皮分布气孔,上表皮气孔缺失,这样的结构可控制强日照辐射下的水分散失,起到自我保护的作用,同时变叶海棠的角质膜在2个保卫细胞上延伸成尖刺状的凸起,有利于其有效保持水分[10]。此外,变叶海棠和花叶海棠叶背的白色绒毛通过反射一定的强光照降低叶表温度,以及减少叶表空气流动等,也在一定程度上降低了蒸腾作用[17],杨美娟等人[18]认为表皮毛在贴近表皮处形成了一个空气环流速度相对稳定的特殊小区域,以便自动调节叶片的蒸腾强度。
3.2 提高光合效率,储备物质和能量
川西高原地区土壤瘠薄,分布于该地区的植物不仅要控制水分散失,维持正常的水分代谢,还需通过提高光合效率储备物质和能量,以利于在逆境中更好的生存。变叶海棠和花叶海棠是典型的异面叶,叶肉分为明显的栅栏组织和海绵组织,属中生植物。发达的栅栏组织、较长的第一层栅栏细胞、高栅海比以及丰富的叶绿体含量等是高山海棠提高光合效率,增大光合生产力,并且有效阻止强光灼伤的一系列适应特征[19]。此外,气孔也是与光合作用密切相关的结构,变叶海棠的叶片下表皮气孔密度为261.45 个·mm-2,花叶海棠的气孔密度更是达到了286.38 个·mm-2,密集的气孔有助于植物体与外界的气体交换,促进光合效应[20]。变叶海棠和花叶海棠的叶柄具有明显的纵棱脊,且纵棱脊处有栅栏组织和海绵组织的分化,这种特殊的结构表明在恶劣的生长环境下,2种海棠的叶柄特化成可进行一定光合作用的结构,为植株更好的抵抗干旱环境积累有机产物。
3.3 提高输导效率,保证水分吸收和运输
在干旱环境中,植物体内的输导系统是影响自身水分供应和生理代谢活动正常进行的关键因素。变叶海棠和花叶海棠的叶片主脉维管束和叶柄中心维管束均为一个较大的外韧维管束,大大提高了输水效率。此外,变叶海棠和花叶海棠茎、根的维管束中,木质部均占有极大的比例,导管密集,且部分根中的木射线细胞特化增宽至6~8列,保证了植物体在干旱环境中的水分吸收和水分运输。
除上述适应性特征之外,2种高山海棠在川西高原长期生长的过程中还形成了其它的适应途径。较厚的叶表皮细胞、茎中占有较大比例的皮层组织和髓以及根中的栓内层和部分韧皮薄壁细胞均是作为贮藏水分和养分的结构,给养干旱环境中的植物体[21];叶肉细胞及皮层组织中的含晶细胞也可增强植物体对水分的吸收利用及抗饥饿能力[22];变叶海棠和花叶海棠的叶片、叶柄中均含有发达的厚角组织和韧皮纤维,茎中具有特化的栓内层、环髓带等厚壁细胞,这些结构均有助于植物体抵抗干旱引起的萎蔫以及强风引起的各种机械损伤[23],成为植物体的支撑系统。此外,二者的叶脉维管束两侧的薄壁组织以及茎中皮层组织细胞间均发现较多的空腔。闫成才等人[24]认为这种结构均是植物体内良好的通气组织和贮气组织,以适应高原地区低氧和低二氧化碳的环境。
综上,变叶海棠和花叶海棠经过川西高原地区强日照辐射、干旱贫瘠、低氧等恶劣环境的长期作用,形成了一系列高度适应的典型结构特征,其借助这些特征成为当地的重要建群种、生态树种以及经济树种。2种高山海棠营养器官的解剖构造极为相似,这与二者在起源、遗传多样性以及地理分布等的密切联系较为一致。有研究[25]认为叶柄结构在植物分类学上有着重要的意义,因此在今后的研究中,可加大样本量和样本分布范围,为解剖学特征在陇东海棠系植物分类学上的应用打开突破口。
1.石胜友,成明昊,梁国鲁.苹果优良砧木资源——变叶海棠[J].西南农业大学学报:自然科学版,2004,26(1):51-54.
Shi S Y,Cheng M H,Liang G L.Malustoringoides(Rehd.) Hughes-A promising stock for apple trees[J].Journal of Southwest Agricultural University:Natural Science,2004,26(1):51-54.
2.成明昊,李晓林,张云贵.苹果优良种质——花叶海棠区系地理学研究[J].西南农业大学学报,2000,22(4):287-289.
Cheng M H,Li X L,Zhang Y G.Studies on the flora ofMalustransitoria-an excellent germplasm of apple[J].Journal of Southwest Agricultural University,2000,22(4):287-289.
3.徐扬,陈小红,赵安玖.川西高原4种苹果属植物叶片解剖结构与其抗旱性分析[J].西北植物学报,2015,35(11):2227-2234.
Xu Y,Chen X H,Zhao A J.Drought resistance evaluation and leaf anatomical structures of four species ofMalusplants in western Sichuan plateau[J].Acta Botanica Boreali-Occidentalia Sinica,2015,35(11):2227-2234.
4.王海英,徐庆,柴成忠,等.川西2种高山海棠果实和叶片的营养成分[J].林业科学,2010,46(8):157-161.
Wang H Y,Xu Q,Chai C Z,et al.Nutritional components of fruits and leaves ofMalustoringoidesandMalustransitoriain western Sichuan[J].Scientia Silvae Sinicae,2010,46(8):157-161.
5.成明昊,李晓林,曾维光.变叶海棠变异类型的研究[J].园艺学报,1992,19(3):233-239.
Cheng M H,Li X L,Zeng W G.A study on the variant types ofMalustoringoides(Rehd.) Hughes[J].Acta Horticulturae Sinica,1992,19(3):233-239.
6.石胜友.变叶海棠起源及其遗传多样性分化研究[D].重庆:西南大学,2005.
Shi S Y.Studies on the origin and differentiation of genetic diversity inMalustoringoides(Rehd.) Hughes[D].Chongqing:Southwest University,2005.
7.邓洪平.变叶海棠遗传多样性起源研究[D].重庆:西南农业大学,2002.
Deng H P.Studies on the oringin of genetic diversity inMalustoringoidesHughes[D].Chongqing:Agricultural University of Southwest,2002.
8.张亚冰,王秀云,洪亚平.植物叶表皮制片方法改进[J].安徽农业科学,2008,36(29):12683,12689.
Zhang Y B,Wang X Y,Hong Y P.Improvement of slices technique of plant epidermis[J].Journal of Anhui Agricultural Sciences,2008,36(29):12683,12689.
9.张宝华.聚焦植物石蜡切片制作[J].吉林省教育学院学报,2013,29(4):153-154.
Zhang B H.Focus on the manufacture of paraffin section [J].Journal of Educational Institute of Jilin Province,2013,29(4):153-154.
10.吴细,叶昌辉,韩维栋.5种红树科植物叶片的比较解剖及其生态适应研究[J].植物研究,2012,32(2):143-146.
Wu X,Ye C H,Han W D.Leaf anatomical structure and its ecological adaptability of five species of Rhizophoraceae plants[J].Bulletin of Botanical Research,2012,32(2):143-146.
11.强胜.植物学[M].北京:高等植物出版社,2006.
Qiang S.Botany[M].Beijing:Higher Education Press,2006.
12.王勋陵,王静.植物的形态结构与环境[M].兰州:兰州大学出版社,1989:57-87.
Wang X L,Wang J.The morphological structure of the plants and environment[M].Lanzhou:Lanzhou University Press,1989:57-87.
13.杨静慧,杨焕婷.苹果属植物叶片角质层厚度与抗旱性[J].天津农学院学报,1996,3(3):27-29.
Yang J H,Yang H T.The cuticle thickness of leaves and drought-resistance in severalMalusspecies[J].Journal of Tianjin Agricultural College,1996,3(3):27-29.
14.王桂芹,赵岩,段亚军.高山红景天解剖学研究[J].植物研究,2004,24(1):93-95.
Wang G Q,Zhao Y,Duan Y J. Anatomy structure study ofRhodiolasachalinensis[J].Bulletin of Botanical Research,2004,24(1):93-95.
15.刘静,马淼.青藏高原地区刺山柑解剖特征研究[J].植物研究,2012,32(4):392-396.
Liu J,Ma M.Anatomical characteristics ofCapparisspinosaL.in Tibet[J].Bulletin of Botanical Research,2012,32(4):392-396.
16.尹秀玲,温静,刘欣,等.蔷薇科12属代表植物叶片气孔密度研究[J].北方果树,2008(1):4-6.
Yin X L,Wen J,Liu X,et al.Study on leaf stoma density of 12 representative genus of Rosaceae family[J].Northern Fruits,2008,(1):4-6.
17.Sun C Q,Chen F D,Teng N J,et al.Interspecific hybrids betweenChrysanthemumgrandiflorum(Ramat.)Kitamura andC.indicum(L.)Des Moul. and their drought tolerance evaluation[J].Euphytica,2010,174(1):51-60.
18.杨美娟.荆条叶片解剖结构及其生态适应性研究[J].湖北农业科学,2014,53(10):2356-2358,2361.
Yang M J.Anatomical structure ofVitexnegundoL.var.heterophylla(Franch.) Rehd.leaves and its ecology adaptation[J].Hubei Agricultural Sciences,2014,53(10):2356-2358,2361.
19.Rhizopoulou S,Psaras G K.Development and structure of drought-tolerant leaves of the Mediterranean shrubCapparisspinosaL.[J].Annals of Botany,2003,92(3):377-383.
20.何涛,吴学明,贾敬芬.青藏高原高山植物的形态和解剖结构及其对环境的适应性研究进展[J].生态学报,2007,27(6):2574-2583.
He T,Wu X M,Jia J F.Research advances in morphology and anatomy of alpine plants growing in the Qinghai-Tibet plateau and their adaptations to environments[J].Acta Ecologica Sinica,2007,27(6):2574-2583.
21.刘捷平.植物形态解剖学[M].北京:北京师范学院出版社,1991:310-311.
Liu J P.Plant morphology and anatomy[M].Beijing:Beijing Normal University Press,1991:310-311.
22.燕玲,李红,贺晓,等.阿拉善地区9种珍稀濒危植物营养器官生态解剖观察[J].内蒙古农业大学学报,2000,21(3):65-71.
Yan L,Li H,He X,et al.Ecological anatomy of nine priority species in Alashan area[J].Journal of Inner Mongolia Agricultural University,2000,21(3):65-71.
23.王桂芹,刘艳然.都支杜鹃茎、叶解剖特征与环境的适应性[J].植物研究,2012,32(5):532-536.
Wang G Q,Liu Y R.Anatomy features and environment flexibility ofRhododendronshanii Fang[J].Bulletin of Botanical Research,2012,32(5):532-536.
24.闫成才,刘晓娟,田青,等.藏荠营养器官解剖结构及其与环境的关系[J].西北植物学报,2013,33(5):946-951.
Yan C C,Liu X J,Tian Q,et al.Anatomical and morphological structure of nutritive organs inHediniatibetica(Thoms.) Ostenf and its adaptation to ecological environment[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(5):946-951.
25.王涛,刘世勇,王龙.11种鼠尾草属叶片和叶柄解剖特征及其分类学意义[J].中国中药杂志,2014,39(14):2629-2634.
Wang T,Liu S Y,Wang L,et al.Anatomical characteristics of laminae and petioles of 11 species ofSalviaand their taxonomic significance[J].China Journal of Chinese Materia Medica,2014,39(14):2629-2634.
National Sci-Tech Support Plan(2011BAC09B05)
introduction:XU Yang(1991—),female,current Master Students,mainly engaged in research of physiology and anatomical of landscape plants.
date:2016-05-31
AnatomicalCharacteristicsofVegetativeOrgansofTwoAlpineCrabapplesandTheirEcologicalAdaptation
XU Yang1CHEN Xiao-Hong1*LI Hui-Min1DING Yin-Peng2KANG Xi-Kun1LI Qian1
(1.College of Forestry,Sichuan Agricultural University,Wenjiang 611130;2.Landscape management of Kaijiang,Dazhou 636250)
The experiment was conducted to study the anatomical characteristics of alpine wild crabapples and their ecological adaptation, the vegetative organ structures ofMalustoringoidesandMalustransitoriafrom 3 000 m altitude in western Sichuan Plateau with paraffin sectioning and NaOCl. The two crabapples had similar anatomical structures. The possible reason might be their closed relationships of origins and geographic distribution between them. Both of the two plants had thick cuticle and epidermis cells. There was not stomata on the upper epidermis, while a dense stomata distribution was observed on the lower epidermis. The collateral vascular bundle was rich in palisade tissues on the lower epidermis. The longitudinal ridges structure with palisade and sponge tissues existed in the petiole. The phelloderm cells were crassexinous. The secondary xylem was rather rich in the stem. There were some wood parenchyma cells with lignified cell wall in the vicinity of the vessels. Around the pith there were crassexinous cells, called perimedullary zone. The secondary structure existed in the thin roots of both of the two crabapples, in which there was a large proportion of xylem and no pith. The vessels were dense, in the form of solitary pore. Therefore, the two alpine crabapples adapted well to the dry environment of western Sichuan Plateau.
western Sichuan Plateau;Malustoringoides;Malustransitoria;anatomical structure;ecological adaptability
国家科技支撑计划(2011BAC09B05)
徐扬(1991—),女,在读硕士研究生,主要从事园林植物生理、解剖研究。
* 通信作者:E-mail:493491274@qq.com
2016-05-31
* Corresponding author:E-mail:493491274@qq.com
Q944.53
A
10.7525/j.issn.1673-5102.2016.05.005
