干旱胁迫对红松主要次生代谢产物的含量及其DPPH清除能力的影响
2016-11-10刘红梅王慧梅
张 丹 任 洁 刘红梅 王慧梅*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 2.阜新市林业局,阜新 123000)
干旱胁迫对红松主要次生代谢产物的含量及其DPPH清除能力的影响
张 丹1任 洁1刘红梅2王慧梅1*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.阜新市林业局,阜新 123000)
以红松为材料,研究了干旱及复水对红松针叶和树皮绿色组织的黄酮、单宁和原花青素这三种次生代谢产物的含量及其提取物对DPPH清除能力的影响。结果表明:干旱胁迫下,红松树皮绿色组织黄酮、单宁和原花青素含量均显著下降,复水后黄酮和单宁含量持续降低,三种含量均未恢复到对照水平;针叶黄酮和原花青素含量明显降低,单宁含量明显升高,复水后均未恢复到对照水平。干旱胁迫使红松针叶和树皮绿色组织IC50值均明显升高,相对应提取物的DPPH清除能力均明显下降,复水后针叶和树皮绿色组织提取物对DPPH清除能力恢复至对照水平。本研究结果表明干旱胁迫对红松针叶和树皮绿色组织次生代谢产物及抗氧化活性均产生一定影响,但针叶和树皮绿色组织的反应存在一定差异。
干旱胁迫;针叶;树皮绿色组织;黄酮;单宁;原花青素;DPPH自由基
干旱严重影响了植物生长,是一种最主要、最常见的非生物胁迫[1]。植物要响应并且适应这些胁迫条件从而在逆境中生存,会导致一些代谢物质发生变化。对于植物而言,次生代谢物质的产生与机体的防御、信号传导、适应调节和生长发育等息息相关[2]。次生代谢产物在植物提高自身保护和生存竞争能力、协调与环境关系上充当着重要角色,其产生和变化比初生代谢产物与环境有着更强的相关性[3]。黄酮、单宁和原花青素是植物中广泛存在的具有抗氧化作用的次生代谢产物,它们的形成积累受环境的影响较大。近年来,有关植物次生代谢产物与环境的关系受到关注。当外界环境改变时,黄酮类化合物可以作为植物抵抗外界不利环境的重要保护机制。许多研究表明,植物当遭遇冻害、干旱、重金属胁迫时,黄酮类化合物和一些酚类物质可以起到保护细胞膜的作用。黄酮类化合物的抗氧化活性在植物抗旱胁迫适应中发挥了重要作用已经被许多研究证明[4~5]。
极端环境下,植物通常通过形态变化、生理调节、遗传变异和次生代谢物质等抵御极端环境的胁迫[6],关于形态、生理和遗传方面的研究比较深入,但是对于植物通过次生代谢物质在分子水平上的生态防御机制研究还不多,而恰恰是这些次生物质构成植物防御极端环境的分子基础[7]。红松(Pinuskoraiensis)为松科(Pinaceae)松属(Pinus)植物,又名海松、新罗松、果松等。在我国分布在东北的长白山到小兴安岭一带,国外主要分布在日本、朝鲜和俄罗斯的部分地区。干旱胁迫对红松生长、光合特性及抗氧化酶活性的影响已见研究报道[8~9],但对红松针叶和树皮绿色组织的次生代谢产物及提取物的DPPH清除能力的影响的研究目前尚未见报道。本研究通过对红松进行干旱胁迫处理,来探讨干旱胁迫对红松针叶和树皮绿色组织次生代谢产物(黄酮、单宁及原花青素)含量及抗氧化活性的影响,探究次生代谢产物和抗氧化活性与干旱胁迫的变化关系,这将对植物体内黄酮及多酚类物质在干旱环境下生态防御机制的研究产生有益的补充作用。
1 材料与方法
1.1 实验材料与处理
实验材料为三年生红松,选择生长状况一致的红松分为对照、干旱和复水三组进行处理,对照组正常浇水,土壤含水量保持在40%左右,干旱组实行自然干旱处理,待土壤含水量在10%左右时,再对其进行复水处理。分别收集针叶和树皮绿色组织,作相应处理后进行各项生理指标的检测。
1.2 实验试剂
芦丁标准品、儿茶素标准品、原花青素标准品购于上海源叶生物科技有限公司;DPPH(C18H12N5O6购于美国Sigma-Aldrich公司。
1.3 含水量测定
1.3.1用称重法测定土壤含水量[10]
测定时取表层以下10 cm处的土壤若干,准确称重(鲜土质量)后,于60℃烘箱中烘干至恒重(烘干土质量)。每处理测定3个重复后取平均值。计算公式如下:
土壤含水量=(鲜土质量-烘干土质量)/烘干土质量×100%
(1)
1.3.2叶片相对含水量采用烘干法称重测定[11]
剪取测定植株当年生针叶后立即称重(记为鲜生物量),称重后将针叶放入有蒸馏水的三角瓶,密封后静置24 h,使针叶充分吸水(期间晃动三角瓶几次,使叶片充分浸入水中),取出针叶后,用滤纸吸干表面水分并称重(记为饱和鲜生物量)。称重后将针叶放入烘箱中,60℃烘干至恒重(记为干生物量)。每处理测定3个重复后取平均值。计算公式如下:
叶片相对含水量=[(鲜叶重-干叶重)/(饱和鲜叶重-干叶重)]×100%
(2)
1.4红松针叶和树皮绿色组织次生代谢产物含量的测定
1.4.1 黄酮含量的测定
标准曲线的绘制:配置浓度为10 mg·mL-1芦丁标准品溶液,作为贮备液备用。精密量取上述溶液0、0.2、0.4、0.6、0.8、1、1.2 mL于50 mL离心管中,分别加水至3 mL,加5%亚硝酸钠试液0.5 mL,放置6 min,加10%硝酸铝试液0.5 mL,放置5 min,加5%氢氧化钠试液2.5 mL,加蒸馏水定容至10 mL,摇匀,放置15 min以上,于500 nm处测定吸光度,以对照品浓度为横坐标,吸光度为纵坐标做标准曲线[12]。
样品的测定:将红松针叶和树皮绿色组织干燥并粉碎,过100目筛。精确称定样品粉末0.5 g左右,置于50 mL容量瓶中,加95%乙醇40 mL,在超声波发生器提取45 min(提取3次),静置冷却,加95%乙醇至刻度,摇匀,静置3~4小时吸取样品提取液0.2 mL,测吸光度值。每处理测定3个重复。由标准曲线计算出总黄酮含量。
1.4.2 单宁含量的测定
标准曲线的绘制:配置浓度为10 mg·mL-1儿茶素标准品溶液,作为贮备液备用。精确吸取0、0.2、0.4、0.6、0.8、1、1.2 mL于50 mL离心管中,分别加入4%香草醛的甲醇溶液3 mL,浓盐酸1.5 mL,定容至10 mL。用铝箔遮光并摇匀,放入20℃的水浴锅中水浴20 min,然后在510 nm波长测吸光度,以对照品浓度为横坐标,吸光度为纵坐标做标准曲线[13]。
样品的测定:将红松针叶和树皮绿色组织阴干,粉碎,2 mm标准筛过筛。准确称取样品50 mg,放入具塞试管中,然后在试管中加入70%甲醇5 mL(提取3次),封口摇匀,在室温下放置24 h,然后5 000 r·min-1,离心10 min,取上清液0.5 mL,按标准曲线下操作进行,测吸光度值。每处理测定3个重复。由标准曲线计算出单宁含量。
1.4.3 原花青素含量的测定
标准曲线的绘制:配置浓度为10 mg·mL-1原花青素标准品,作为贮备液备用。精确吸取0、0.1、0.2、0.3、0.4、0.5、0.6 mL于50 mL离心管中,分别加入2.5 mL质量浓度为3%的香草醛—甲醇,2.5 mL体积分数为30%的硫酸—甲醇,定容至10 mL。摇匀,避光,30℃,恒温水浴保持20 min。取出,在500 nm波长下测定其吸光度,以对照品浓度为横坐标,吸光度为纵坐标做标准曲线[14]。
样品的测定:将红松各部位干燥并粉碎,过20目筛。用60%乙醇提取3次,合并提取液。3 000 r·min-1离心30 min,将上清液定容后,取1 mL显色分析。取样品0.5 mL,测吸光度值。每处理测定3个重复。由标准曲线计算出原花青素含量。
1.5红松针叶和树皮绿色组织的提取物清除DPPH自由基能力的测定
将红松各部位干燥并粉碎,过20目筛。精密称取样品10 g于500 mL圆底烧瓶中加入80%乙醇溶液100 mL在80℃水浴中提取4 h,趁热抽滤。提取3次,合并滤液。DPPH用少量的无水乙醇溶解,制成0.004%溶液。将0.1 mL不同浓度的样品提取物溶液加入1 mL DPPH溶液中,迅速混匀,置于紫外分光光度计中,70 min后在517 nm处测定溶液的吸光度。每处理测定3个重复。以抗坏血酸为对照[15]。样品清除自由基的能力由下面的公式得出:
抗氧化能力(IP)=[(AB-AA)/AB]×100%
(3)
式中:AB及AA为70 min后空白及待测样的吸光值。
1.6 数据处理
采用Excel 2010计算实验数据,SPSS 17.0进行统计分析,Duncan多重比较法对数据进行比较分析。
2 结果与分析
2.1 土壤含水量和器官含水量
如表1所示,干旱胁迫对红松针叶和树皮绿色组织含水量产生重要影响。针叶含水量由对照的58.7%下降到56%,复水后恢复到58%;树皮绿色组织由对照的47.7%下降到46.7%,复水后恢复到46.8%。干旱胁迫结束时土壤含水量由38.2%显著降低到13.5%,复水后恢复至37.7%。
表1干旱及复水对土壤和器官含水量的影响
Table1Theinfluencesofdroughtstressandrewateringonsoilandorganwatercontent

处理Treatment含水量Watercontent(%)土壤Soil树皮Bark针叶Needle对照Control38.2±3.33a47.7±0.11a58.7±0.14a干旱Drought13.5±2.85b46.7±0.1b56±0.99b复水Rewatering37.7±3.09a46.8±0.11b58±1.41ab
注:同行不同小写字母表示处理间差异显著(P<0.05),下同。
Note:Different letters in the same row meant significant difference at 0.05 level,the same as below.
2.1干旱胁迫对红松针叶和树皮绿色组织次生代谢产物的影响
2.1.1 标准曲线的绘制
以浓度为横坐标X,吸光度为纵坐标Y,经行回归,得芦丁浓度—吸光度方程:
Y=0.483X+0.001
(4)
相关系数R2=0.998,根据方程得出如下黄酮浓度计算公式:
X=(Y-0.001)/0.483
(5)
式中:Y为吸光度;X为黄酮浓度(mg·mL-1)。
以浓度为横坐标X,吸光度为纵坐标Y,经行回归,得儿茶素浓度—吸光度方程:
Y=0.514X+0.014
(6)
相关系数R2=0.994,根据方程得出如下儿茶素浓度计算公式:
X=(Y-0.014)/0.514
(7)
式中:Y为吸光度;X为儿茶素浓度(mg·mL-1)。
以浓度为横坐标X,吸光度为纵坐标Y,经行回归,得原花青素浓度—吸光度方程:
Y=2.513X+0.008
(8)
相关系数R2=0.997,根据方程得出如下原花青素浓度计算公式:
X=(Y-0.008)/2.513
(9)
式中:Y为吸光度;X为原花青素浓度(mg·mL-1)。
图1 芦丁标准品吸光度—浓度标准曲线Fig.1 Standard rutin curve of absorbance-concentration

图2 儿茶素标准品吸光度—浓度标准曲线Fig.2 Standard rutin curve of catechin-concentration

图3 原花青素标准品吸光度—浓度标准曲线Fig.3 Standard rutin curve of procyanidin-concentration
2.1.2干旱胁迫对红松针叶和树皮绿色组织黄酮、单宁、原花青素含量的影响
在正常情况下,红松树皮绿色组织和针叶黄酮含量分别为10.3%和5.78%(表2),经过干旱处理后,红松树皮绿色组织和针叶黄酮含量都显著降低,含量分别为9.27%和5.03%,与对照相比分别降低了10%和13%,复水后树皮绿色组织黄酮含量继续降低,达到显著,而针叶黄酮含量没有变化,二者均未恢复到对照水平。
表2干旱及复水对红松针叶和树皮绿色组织黄酮、单宁、原花青素含量影响
Table2Theinfluencesofdroughtstressandrewateringonflavonoidscontent,tannincontent,procyanidincontentinneedlesandbarkchlorenchymaofKoreanpine
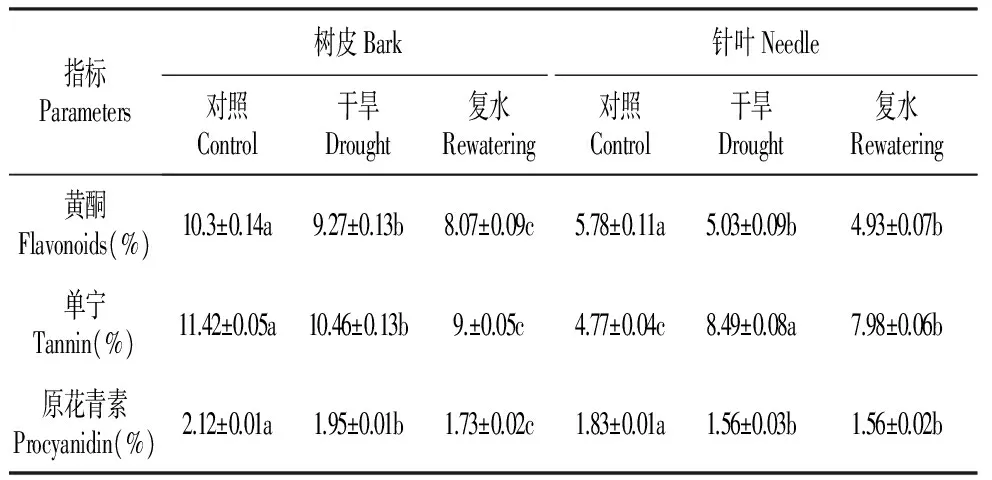
指标Parameters树皮Bark针叶Needle对照Control干旱Drought复水Rewatering对照Control干旱Drought复水Rewatering黄酮Flavonoids(%)10.3±0.14a9.27±0.13b8.07±0.09c5.78±0.11a5.03±0.09b4.93±0.07b单宁Tannin(%)11.42±0.05a10.46±0.13b9.±0.05c4.77±0.04c8.49±0.08a7.98±0.06b原花青素Procyanidin(%)2.12±0.01a1.95±0.01b1.73±0.02c1.83±0.01a1.56±0.03b1.56±0.02b
在干旱胁迫下,树皮绿色组织单宁含量明显降低(P<0.05),下降至10.46%(表2),复水后单宁含量继续下降但没有恢复到对照水平。红松针叶单宁含量在干旱胁迫下显著升高,升高至8.49%,复水后单宁含量略微降低但未达到对照水平。干旱胁迫对红松针叶和树皮绿色组织的影响存在差异。
干旱胁迫下,红松树皮绿色组织和针叶原花青素含量均明显降低(表2),与对照相比,树皮绿色组织降低了8%,针叶降低了14.8%。复水后,树皮绿色组织原花青素含量继续降低,而针叶没有变化,二者均未恢复到对照水平。表明干旱胁迫抑制红松树皮绿色组织和针叶原花青素的合成。
2.2干旱胁迫对红松针叶和树皮绿色组织的提取物清除DPPH自由基能力影响
在干旱胁迫下,红松树皮绿色组织和针叶IC50值均明显升高,分别升高至7.25和8.69 mg·mL-1(表3),复水后树皮绿色组织和针叶IC50值均恢复到对照水平。干旱胁迫使树皮绿色组织和针叶提取物抗氧化活性明显降低,同时树皮绿色组织提取物抗氧化活性要高于针叶,干旱胁迫对二者产生明显影响。
表3干旱及复水对红松针叶和树皮绿色组织的提取物清除DPPH自由基能力影响
Table3TheinfluencesofdroughtstressandrewateringonDPPHfreeradicalscavengingactivityofneedlesandbarkchlorenchymaofKoreanpineextractives
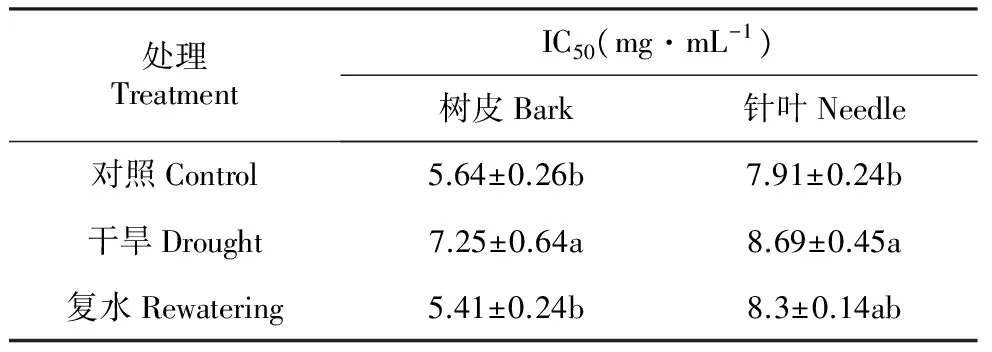
处理TreatmentIC50(mg·mL-1)树皮Bark针叶Needle对照Control5.64±0.26b7.91±0.24b干旱Drought7.25±0.64a8.69±0.45a复水Rewatering5.41±0.24b8.3±0.14ab
3 讨论
植物对环境条件的适应可能发生在形态结构上,也可能发生在生理代谢上,而次生代谢产物则成为后一种适应的物质基础之一,很多次生代谢产物都会因环境的影响而变化[16]。干旱胁迫可以诱导植物体产生氧化胁迫,由于黄酮类物质和酚类物质本身具有较强的抗氧化活性,因此黄酮类物质和酚类物质的积累可以增加植物对干旱胁迫的耐受性,可帮助机体适应不良环境[17]。干旱胁迫下,红松针叶和树皮绿色组织黄酮和原花青素含量均显著降低,可能与干旱胁迫程度有关,有相关研究表明,中度干旱胁迫使植物组织中次生代谢产物的浓度常常上升,而在重度干旱胁迫下,会抑制其含量的增加[18],本研究中土壤含水量在13%左右,属于重度干旱胁迫,抑制了黄酮和原花青素含量升高,这与Zahir[19]等研究相类似。红松树皮绿色组织单宁含量降低,针叶单宁含量升高,二者表现出明显差异,可能是因为针叶含有的酚类物质分子中芳环带有大量亲水的酚羟基或其他亲水基团,使整个分子显示较强的亲水性[20],从而降低针叶的水分蒸腾作用,减少水分散失,红松针叶能够合成和调节体内酚类次生代谢物质的含量以适应干旱环境的变化。有相关报道表明,在干旱胁迫下,植物组织中包括单宁在内的次生代谢产物的浓度常常升高[21],但也有研究得出相反的结论,即干旱胁迫降低了植物体内的单宁含量[22]。干旱胁迫下,红松针叶和树皮绿色组织的3种次生代谢产物含量均存在一定差异,表明这些次生代谢产物在红松不同器官中的生物合成、运输、积累和消耗均具有相对的独立性[23]。树皮绿色组织黄酮、单宁和原花青素含量均高于针叶,可以看出,干旱胁迫虽对树皮绿色组织和针叶产生一定影响,但3种次生代谢产物在树皮绿色组织中合成和积累较多,主要由树皮绿色组织合成。
DPPH已广泛用于测定单一化合物以及不同植物提取物抗氧化活性。DPPH清除率检测法是一种简单、快速、灵敏的抗氧化检测手段,在天然植物提取物体外抗氧化能力检测和抗氧化片段筛选中被广泛应用。干旱胁迫下红松提取物对DPPH自由基清除能力的研究尚未见报道,但相关研究表明干旱对植物抗氧化活性产生一定的影响[24]。Rebey等[25]研究表明干旱环境与孜然芹种子提取物抗氧化活性密切相关,在干旱条件下种子有更高的抗氧化活性。本实验中,红松针叶和树皮绿色组织在正常条件下,二者的IC50值分别为7.91和5.64 mg·mL-1,干旱条件下分别为8.69和7.25 mg·mL-1,干旱胁迫使针叶和树皮绿色组织的IC50显著升高,但相对应的二者提取物DPPH自由基清除能力明显低于对照水平,抗氧化活性受到抑制。这与Rebey等[25]研究结果不同,可能与不同物种有关。但可以看出干旱胁迫对红松树皮绿色组织和针叶提取物抗氧化活性产生明显影响,同时树皮绿色组织提取物抗氧化活性高于针叶。
干旱胁迫抑制了红松树皮绿色组织3种次生代谢产物含量的升高,针叶除了单宁含量升高外,其余2种次生代谢产物含量也受到抑制,针叶和树皮绿色组织在干旱胁迫下表现出一定差异。同时,干旱胁迫使红松针叶和树皮绿色组织提取物DPPH自由基清除能力明显低于正常水平,表明红松针叶和树皮绿色组织次生代谢产物抗氧化活性受到干旱胁迫的抑制。
1.Chen J W,Zhang Q,Li X S,et al.Gas exchange and hydraulics in seedlings ofHeveabrasiliensisduring water stress and recovery[J].Tree Physiology,2010,30(7):876-885.
2.Shao H B,Chu L Y,Jaleel C A,et al.Understanding water deficit stress-induced changes in the basic metabolism of higher plants-biotechnologically and sustainably improving agriculture and the eco-environment in arid regions of the globe[J].Critical Reviews in Biotechnology,2009,29(2):131-151.
3.Shao H B,Chu L Y,Shao M A.Calcium as a versatile plant signal transducer under soil water stress[J].Bio Essays,2008,30(7):634-641.
4.Dicko M H,Gruppen H,Barro C,et al.Impact of phenolic compounds and related enzymes in sorghum varieties for resistance and susceptibility to biotic and abiotic stresses[J].Journal of Chemical Ecology,2005,31(11):2671-2687.
5.Oh M M,Trick H N,Rajashekar C B.Secondary metabolism and antioxidants are involved in environmental adaptation and stress tolerance in lettuce[J].Journal of Plant Physiology,2009,166(2):180-191.
6.Ghahfarokhi M G,Mansurifar S,Taghizadeh-mehrjardi R,et al.Effects of drought stress and rewatering on antioxidant systems and relative water content in different growth stages of maize(ZeamaysL.) hybrids[J].Archives of Agronomy and Soil Science,2015,61(4):493-506.
7.Paulsen J,Kleinwaechter M,Selmar D,et al.Beneficial impacts of drought stress on the contents of secondary metabolites in plant-derived commodities[J].Journal of Medicinal & Spice Plants,2014,19(4):193-195.
8.阎秀峰,李晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,1999,19(6):850-854.
Yan X F,Li J,Zu Y G.Effect of drought stress on activity of cell defense enzymes and lipid peroxidation in korean pine seedlings[J].Acta Ecologica Sinica,1999,19(6):850-854.
9.吕海亮,毛子军,李娜.干旱对红松和蒙古栎幼苗生长的影响及种间竞争[J].植物研究,2014,34(3):364-371.
Liu H L,Mao Z J,Li N.Response of growth and interspecific competition ofPinuskoraiensisandQuercusmongolicaseedlings to drought[J].Bulletin of Botanical Research,2014,34(3):364-371.
10.金微微,王炎,张会慧,等.茉莉酸甲酯对干旱及复水条件下烤烟幼苗叶绿素荧光特性的影响[J].应用生态学报,2011,22(12):3157-3162.
Jin W W,Wang Y,Zhang H H,et al.Effects of foliar spraying methyl jasmonate on leaf chlorophyll fluorescence characteristics of flue-cured tobacco seedlings under drought and re-watering[J].Chinese Journal of Applied Ecology,2011,22:3157-3162.
11.马富举,李丹丹,蔡剑,等.干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响[J].应用生态学报,2012,23(3):724-730.
Ma F J,Li D D,Cai J,et al.Responses of wheat seedlings root growth and leaf photosynthesis to drought stress[J].Journal of Applied Ecology,2012,23:724-730.
12.吕欣,付玉杰,王微,等.紫外分光光度法测定甘草黄酮含量[J].植物研究,2003,23(2):192-194.
Lü X,Fu Y J,Wang W,et al.Determination of flavonoids inGlycyrrhizauralensisfisch with ultraviolet spectrophotometry[J].Bulletin of Botanical Research,2003,23(2):192-194.
13.武予清,郭予元.棉花植株中的单宁测定方法研究[J].应用生态学报,2000,11(2):243-245.
Wu Y Q,Guo Y Y.Determination of tannin in cotton plant[J].Chinese Journal of Applied Ecology,2000,11(2):243-245.
14.Deshpande S S,Cheryan M.Determination of phenolic compounds of dry beans using vanillin,redox and precipitation assays[J].Journal of Food Science,1987,52(2):332-334.
15.段琦梅,梁宗锁,聂小妮,等.黄芪和党参提取物的抗氧化活性研究[J].西北植物学报,2010,30(10):2123-2127.
Duan Q M,Liang Z S,Nie X N,et al.Antioxidant activity detection ofAstragalusmembranaceusandCodonopsispilosulaethanol extracts by DPPH method[J].Acta Bot Boreal-Occident Sin,2010,30(10):2123-2127.
16.Wahid A,Gelani S,Ashraf M,et al.Heat tolerance in plants:An overview[J].Environmental and Experimental Botany,2007,61(3):199-223.
17.Castellarin S D,Pfeiffer A,Sivilotti P,et al.Transcriptional regulation of anthocyanin biosynthesis in ripening fruits of grapevine under seasonal water deficit[J].Plant,Cell & Environment,2007,30(11):1381-1399.
18.阎秀峰,王洋,李一蒙.植物次生代谢及其与环境的关系[J].生态学报,2007,27(6):2554-2562.
Yan X F,Wang Y,Li Y M.Plant secondary metabolism and its response to environment[J].Acta Ecologica Sinica,2007,27(6):2554-2562.
19.Zahir A,Abbasi B H,Adil M,et al.Synergistic effects of drought stress and photoperiods on phenology and secondary metabolism ofSilybummarianum[J].Applied Biochemistry and Biotechnology,2014,174(2):693-707.
20.程春龙,刘松,廖容苏,等.额济纳绿洲胡杨(Populuseuphratica)酚类物质含量和分布及其与土壤水分的关系[J].生态学报,2008,28(1):69-75.
Cheng C L,Liu S,Liao R S,et al.Concentration and distribution of phenolic compounds inPopuluseuphraticain Ejina oasis and their correlation with soil water contents[J].Acta Ecologica Sinica,2008,28(1):69-75.
21.Alonso-amelot M E,Oliveros-bastidas A,Calcagno-pisarelli M P.Phenolics and condensed tannins of high altitudePteridiumarachnoideumin relation to sunlight exposure,elevation,and rain regime[J].Biochemical Systematics and Ecology,2007,35(1):1-10.
22.Cobb N S,Mopper S,Gehring C A,et al.Increased moth herbivory associated with environmental stress of pinyon pine at local and regional levels[J].Oecologia,1997,109(3):389-397.
23.杨蓓芬,金则新,邵红,等.七子花不同器官次生代谢产物含量的分析[J].植物研究,2007,27(2):229-232.
Yang P F,Jin Z X,Shao H,et al.Analysis of secondary metabolites contents in the different organs ofHeptacodiummiconioides[J].Bulletin of Botanical Research,2007,27(2):229-232.
24.Said E M,Mahmoud R A,Al-akshar R,et al.Drought stress tolerance and enhancement of banana plantlets in vitro[J].Austin Journal of Biotechnology & Bioengineering,2015,2(2):1040.
25.Rebey I B,Jabri-karoui I,Hamrouni-sellami I,et al.Effect of drought on the biochemical composition and antioxidant activities of cumin(CuminumcyminumL.) seeds[J].Industrial Crops and Products,2012,36(1):238-245.
投稿须知
1.投稿前请登陆本刊网站(http://bbr.nefu.edu.cn/)认真阅读本刊投稿中心中的各项说明,并按照本刊要求修改和补充论文中的有关内容,使论文符合本刊要求。投稿时请附作者单位介绍信或全体作者签名,说明无泄密、署名无误和未一稿多投,网上投稿请签订版权转让协议。作者自留底稿及软盘备份。
2.投稿时,请登陆本刊网站在线提交论文。投稿后,可随时登陆查询稿件处理状况。
3.稿件如初审通过,请作者按要求邮寄已签名的《版权转让协议》。
4.稿件经过外审和编审后,如符合我刊要求,须交寄发表费,待发表费收到后,作者可登陆本刊网站后,在发稿状态下打印《稿件录用通知》。
5.作者文责自负。本编辑部对来稿可做必要修改。
6.稿件一经发表,酌致稿酬,并赠样刊2本。
7.凡在本刊发表的论文,如荣获省部级以上成果奖,请及时通知本编辑部,并提供获奖证书复印件。
《植物研究》编辑部
This research is supported by Special Funds for basic research of Central University(DL13EA03-03);Natural Science Foundation of China(NSFC)(31100457);Natural Science Foundation of Heilongjiang Province(C2015051)
introduction:ZHANG Dan(1990—),female,master,mainly engaged in stress physiology of medicinal plant.
date:2016-03-01
ResponsesofMainSecondaryMetabolitesandDPPHFreeRadicalScavengingActivityoftheKoreanPinetoDroughtStress
ZHANG Dan1REN Jie1LIU Hong-Mei2WANG Hui-Mei1*
(1.Key Laboratory of Forest Plant Ecology,Northeast Forestry University,Harbin 150040;2.Forestry Bureau of Fuxin City,Fuxin 123000)
The Korean pine were tested to study the effects of drought stress and rehydration on flavonoids content, tannin content, procyanidin content and DPPH free radical scavenging activity of needles and bark chlorenchyma. Flavonoids, tanninand procyanidin content of bark chlorenchyma decreased significantly under drought stress, flavonoids and tannin content continue to decrease after rehydration, and three kinds of content were not returned to control levels. Flavonoids and procyanidin content of needles decreased and tannin content significantly increased, after rehydration they were not returned to control levels. IC50values of needles and bark chlorenchyma significantly increased under drought stress, and DPPH free radical scavenging activity of extract was significantly decreased, after rehydration DPPH free radical scavenging activity of needle and bark chlorenchyma were returned to control levels. Secondary metabolites and antioxidant activity of needles and bark chlorenchyma were significantly affected by drought stress, but there were some different responses to drought stress between needles and bark chlorenchyma.
drought stress;needles;bark chlorenchyma;flavonoids;tannin;procyanidin;DPPH free radical
中央高校基本科研业务费专项资金(DL13EA03-03);国家自然科学基金(31100457);黑龙江省自然科学基金(C2015051)
张丹(1990—),女,硕士研究生,主要从事药用植物逆境生理研究。
* 通信作者:E-mail:whm0709@163.com
2016-03-01
* Corresponding author:E-mail:whm0709@163.com
S791.247
A
10.7525/j.issn.1673-5102.2016.04.009
