线叶忍冬开花动态特征与繁育系统研究
2016-11-10李亚兰梁凤丽
李亚兰 梁凤丽
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
线叶忍冬开花动态特征与繁育系统研究
李亚兰 梁凤丽*
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
为了解线叶忍冬(Loniceraalberti)的开花特性及繁育系统,本研究通过野外调查,记录其花部特征、开花进程及访花昆虫特性,采用TTC、MTT、联苯胺-α萘酚和醋酸洋红四种染色方法测定花粉活力,采用联苯胺—过氧化氢法和MTT两种方法测定其柱头可授性,运用花粉/胚珠比率、杂交指数、人工授粉试验等方法检测线叶忍冬的繁育系统。结果表明:线叶忍冬花朵有花冠裂片逐一展开和花冠裂片同时展开两种开放方式;花粉在散粉后6 h活力达到最高值,柱头可授性在花朵开放后不断增强;膜翅目蜜蜂科意蜂(ApismelliferaL.)在传粉过程中起重要作用;P/O值为583.43±99.9;杂交指数为4;人工授粉套袋试验中人工异株异花授粉结实率为79.17%,自花授粉情况下结实率为9.52%。其繁育系统为混合交配系统,异花传粉需要传粉者。
线叶忍冬;开花动态;繁育系统;花粉活力;柱头可授性
线叶忍冬(Loniceraalberti)系忍冬科(Caprifoliaceae)忍冬属(Lonicera)植物,又名沼生忍冬,为亚洲中部特有的高山小灌木[1],在中国生长于昭苏、察布查尔县的河谷岸边灌丛,外观不同于其它新疆园林中应用的忍冬属植物,其花朵繁密、颜色鲜艳美丽,浆果球形似白色玉珠,观赏价值较高,但目前仅见对其地理分布和植物学形态的描述,并未有其他具体相关报道。对线叶忍冬花部特征和繁育系统的研究,能够了解线叶忍冬对生态环境的适应性,对保护和利用该野生资源有重要意义。植物繁育系统的研究是了解植物生活史及开展其生物学相关研究的前提和基础。目前国内对不同植物的繁育系统研究报道较多,包括对野生观赏植物、园林观赏植物和药用植物等[2~9],为这些植物的保护和利用提供了一定的理论指导和基础资料,但关于忍冬属植物繁育系统的相关研究则相对较少[10~11],且尚未见关于线叶忍冬的相关报道。本研究通过对线叶忍冬开花及授粉过程的连续观察,拟了解其花部构造、花朵开放规律、访花者特性及繁育系统类型,增进对线叶忍冬生物学特性方面的认识,为实现线叶忍冬野生植物资源的保护和可持续利用提供重要参考资料。
1 材料与方法
1.1 材料
线叶忍冬(Loniceraalberti)为小灌木,高0.5~1.2 m,叶片线性或长圆状线性;花朵成对着生,淡紫至粉红色,一般于5月下旬开始开花,花期持续到6月下旬;浆果球形,白绿色;种子细小。
供试线叶忍冬样株生长于新疆维吾尔自治区伊犁哈萨克自治州昭苏县夏塔乡(42°52′N,80°31′E)。平均海拔为1 704 m,年平均温度2.9℃,年极端最高温度33.5℃,最低温度-32℃,年均降雨量达576.83 mm,年水蒸发量为1 261.6 mm。气候特点是冬长夏短,没有明显的四季之分[12]。本文中所有试验均在2014~2015年进行。
1.2 研究方法
1.2.1 线叶忍冬开花动态特征观测
在线叶忍冬生长地设置样地,在样地中选择线叶忍冬样株,然后在其花期时(分别在2014年、2015年的6月)选择四个方向上尚未开放的花蕾,每天观察1次,直至花朵开放。花开放当天,每隔1 h观察1次,记录花朵开放过程,直至花朵花药散尽、花瓣萎蔫。并摘取不同时期(花蕾期、欲开花、半开花、盛开花)的花朵用游标卡尺分别进行观察、测量、记录花冠筒长宽度、花瓣长宽度、花冠直径及其颜色,以及雄蕊和雌蕊各部分长度、颜色、形状等[13],实验所得数据采用“平均值±标准差”表示。
1.2.2 花粉活力与柱头可授性检测
采用联苯胺-α萘酚、0.5%氯化三苯基四氮唑(TTC)、醋酸洋红和四甲基偶氮唑(MTT)4种染色方法测定不同开花物候期的花粉活力[14~17]。将不同散粉时间的花粉置于载玻片上,分别滴入上述4种溶液,混合均匀后放入25℃的恒温箱内,联苯胺-α萘酚处理15 min;0.5% TTC处理20 min;醋酸洋红处理2~3 min;MTT处理5 min。以经过高温杀死后的无活力花粉为对照。以花粉的染色率代表花粉活力,计算花粉活力百分率。花粉活力试验每个处理重复3次,每张片观察时随机选取3个视野在10×10倍光学显微镜(Motic 2000)下统计着色花粉数,每个视野花粉粒数不少于30。试验所得数据采用“平均值±标准差”表示。
花粉活力百分率按照如下公式:
花粉活力(%)=(有活力的花粉数/花粉总数)×100%
(1)
采用联苯胺—过氧化氢[18]和四甲基偶氮唑(MTT)[14]2种方法测定不同开花物候期的柱头可授性。按照划分的不同时期(花蕾期、欲开花、半开花、盛开花)取样,将每个时期5个柱头放入含有染色液的培养皿中(3个重复),约10 min后观察柱头的颜色变化。
1.2.3 花粉/胚珠比率(P/O)测定
随机选取将要开放的花朵30朵,取下花药,每朵花药放入一小瓶中,自然晾干,加入1 mL蒸馏水,充分摇匀后,取1 μL于显微镜下数出花粉粒数,每一小瓶重复10次,统计数取平均值,然后计算每朵花粉量。然后取15朵花的子房在体式显微镜下解剖,数出胚珠数,即可计算P/O值,所得数据同样采用“平均值±标准差”来表示。
1.2.4 杂交指数(OCI)的估算
按照Dafni的标准[19]对样枝上的花朵进行花序直径、花朵大小的测量及开花行为的观测,由OCI值对其繁育系统进行评判。
1.2.5 人工授粉检测
选择5个10 m×10 m的样方,每个样方中选择有代表性的5株线叶忍冬,同时采集经测定有活力的线叶忍冬花粉后,按照下述方法进行处理:(1)对照:不套袋、不去雄,任其自由传粉;(2)开花前套袋,不去雄;(3)去雄,套袋,不传粉;(4)去雄,同株异花传粉,套袋;(5)去雄,异株异花传粉,套袋;(6)去雄,不套袋,自由传粉[19]。
每个方法套5个纸袋(挂牌)/株,对不同处理进行结实率统计:
结实率(%)=(果实数/花蕾数)×100%
(2)
其中套袋选用的纸袋为自制的圆柱形硫酸纸袋,不套袋的处理选择用号签进行挂牌标记。
1.2.6 昆虫访花情况观测
在样地内选取有代表性的5棵植株,在开花后根据忍冬的开花时间,晴朗天气下5 d连续观察访花者。每天10:00~20:00每隔2 h观测一次,从访花者的种类、访花时间、访花频率、访花行为等指标进行观测记录。同时将样地中昆虫捕捉并用乙酸乙酯制成标本用以鉴定种类。
2 结果与分析
2.1 线叶忍冬花朵形态特征及开花动态
2.1.1 花形态
线叶忍冬的花成对着生成聚伞花序,两性花,花期5月下旬~6月下旬。单花为管状钟形,花冠上部5浅裂(少数为4裂),基部联合为花冠筒,淡紫色至粉红色;具5枚等长的雄蕊,花丝下部与花冠筒内壁合生,上部至花冠裂开处与其分开。花丝平均长度为(15.16±0.64) mm,花药长椭圆形,以其背部贴着在花丝上,其颜色变化为:未散粉前为黄色,散粉时为淡黄色,散粉后为深黄色。雌蕊1,绿色,稍长于雄蕊(少数有短于雄蕊的情况出现),具头状3浅裂的柱头。
2.1.2 单花开花过程
花朵开放方式有两种。方式一分为5个时期(图1):①花蕾逐渐膨大,花瓣未张开,上部裂片松动。②花冠裂片的1~2瓣略微张开,雄蕊彼此分开,雌蕊仍藏于未裂开的花瓣中。③上一时期已张开的1~2瓣花冠裂片完全张开平展,剩余花冠裂片缓慢张开,花药开始散粉。④所有花冠裂片完全展开,花药完全伸出花冠,继续散粉。⑤花瓣萎蔫,颜色变为淡粉色,花药中花粉散尽。
花朵开放方式二,分为5个时期(图2):①花蕾逐渐膨大,花瓣未张开,上部裂片松动。②花冠裂片全部微张开,2~3个花药露出花冠,其余花药及雌蕊藏于花瓣中。③花冠裂片张开角度加大,花药与柱头全部露出花冠,花药开始散粉。④花瓣完全平展,颜色变为淡粉色,花药中花粉散尽。

图1 线叶忍冬单花开花动态一Fig.1 The first of single flower blooming dynamics of L.alberti

图2 线叶忍冬单花开花动态二Fig.2 The second of single flower blooming dynamics of L.alberti
开花受天气影响较大,晴天时花冠裂片展开速度较快,花冠裂片全部张开后花药开始散粉,整个开花过程时间相对较短。阴天或雨天时,花冠裂片展开速度较慢,时常出现花药散粉先于花冠裂片张开,即花瓣未张开时就开始散粉,开花过程时间相对较长。
2.2 花粉活力与柱头可授性
2.2.1 花粉活力
采用联苯胺-α萘酚、TTC、醋酸洋红和MTT4种染色方法测定不同时期花粉活力发现,醋酸洋红法与TTC法两种方法在测定线叶忍冬花粉活力过程中,处理与对照之间无显著性差异,未得到能够鉴定花粉活性的有效特征,无法辨识花粉是否存在活力,因此TTC和醋酸洋红2种方法不适用于线叶忍冬的花粉活力检测。而采用MTT和联苯胺-α萘酚处理后的花粉,有活力的被染色,而无活力的与对照均未被染色,这两种方法在测定线叶忍冬花粉活力过程中,处理与对照之间存在显著性差异,能够较容易辨识花粉是否存在活力(图3)。因此,MTT和联苯胺-α萘酚适宜于线叶忍冬的花粉活力检测。
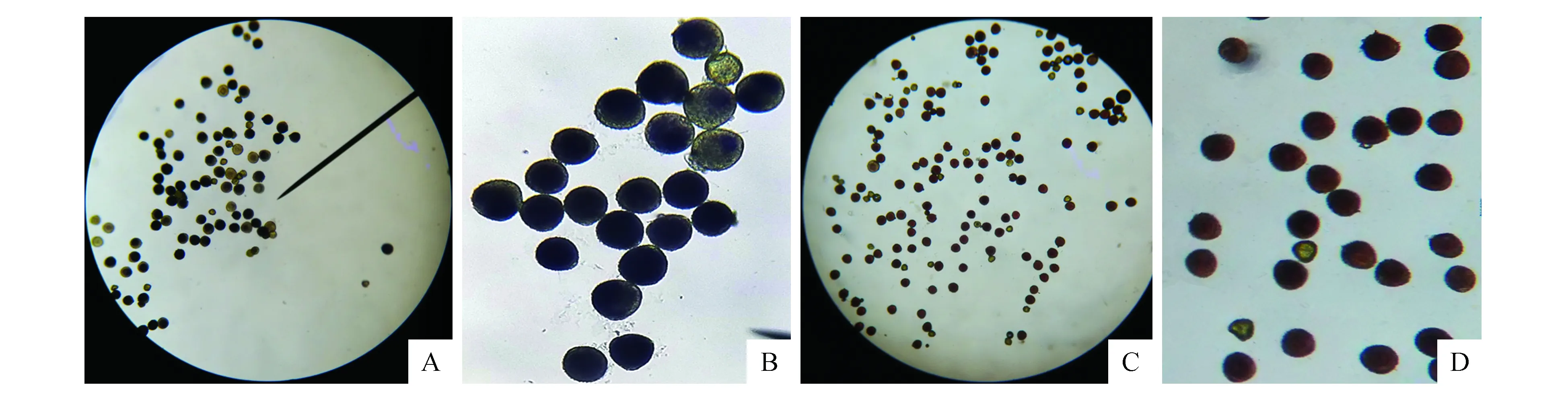
图3 不同染色方法测定线叶忍冬花粉活力 A~B. MTT染色法;C~D.联苯胺-α萘酚法Fig.3 L.alberti pollen viability determination by staining in different ways A-B. MTT staining; C-D. Benzidine α-naphthol staining
Table1Thevitalityofpollenstainingunderthedifferentphenophaseofblooming(%)

散粉时间Sheddingtime(h)测定花粉染色活力的不同方法ThedifferentmethodsofmeasuringthevitalityofpollenstainingMTT法MTTstaining联苯胺⁃α萘酚法Benzidineα⁃naphtholstaining161.59±2.52Ff65.61±3.79Ff280.24±4.41Dd83.69±3.82CDcd485.68±2.07BCDc91.65±4.74ABb695.76±5.40Aa96.53±4.75Aa890.62±3.88ABb89.95±4.68BCb1287.06±5.87BCbc88.67±2.91BCDbc2487.91±2.37BCbc87.28±2.81BCDc3683.75±2.66CDcd81.82±3.70Dd4870.25±4.68Ee74.30±4.43Ee
注:数据为“平均值±标准差”,不同大写字母表示同列差异极显著(P<0.01);不同小写字母表示同列差异显著(P<0.05)。
Note:The data is expressed as“means±SD”, and the capital and small letters represent significant difference at 0.01 and 0.05, respectively, in the same column.
经MTT染色的花粉为蓝色或浅蓝色,花粉着色率显示散粉1~6 h内花粉活力逐渐升高,散粉1和6 h的花粉活力分别为(61.59±2.52)%和(95.76±5.40)%。平均花粉活力超过90%的时间为散粉后6~8 h内,散粉后12 h后花粉活力与散粉后24、36 h的花粉活力间不存在显著差异(P>0.05)。
经联苯胺-α萘酚染色的花粉着色为红色或深红色,着色率显示散粉1~6 h内花粉活力逐渐升高,散粉1和6 h的花粉活力分别为(65.61±3.79)%和(96.53±4.75)%。平均花粉活力超过90%的时间为散粉后4~6 h内,散粉后12 h后花粉活力与散粉后24、36 h的花粉活力间同样不存在显著差异(P>0.05)。两种方法测定结果一致(表1)。
2.2.2 柱头可授性
采用联苯胺—过氧化氢和四甲基偶氮唑(MTT)2种方法测定不同时期柱头可授性,结果发现MTT处理后不同时期线叶忍冬柱头均被染为深紫色,较难区分各个时期的柱头是否具有可授性,因此这种方法不适用于线叶忍冬柱头可授性检测。经联苯胺—过氧化氢处理后,具可授性的柱头周围会出现由少至多气泡并且柱头会被染成由浅至深的蓝色。因此,可采用联苯胺—过氧化氢法对线叶忍冬柱头可授性进行检测。
当线叶忍冬花朵为现蕾期和深紫色花蕾时,柱头经联苯胺—过氧化氢处理后未有气泡和染色情况出现,说明此时柱头没有可授性。当线叶忍冬花朵为欲开花(花冠裂片松动)时,柱头经联苯胺—过氧化氢处理后开始有气泡和染色情况出现,说明此时柱头具有可授性。花朵开放后,其柱头可授性逐渐增强,一直持续至开花末期。
2.3 杂交指数(OCI值)
按照Dafni的标准[19]对花序直径、花朵大小及开花行为的测量结果进行记录(表2)。首先,线叶忍冬花冠的直径为(17.24±3.17) mm,记为3。其次,线叶忍冬为两性花,雌蕊先于雄蕊成熟,记为0。然后是花朵开放后其柱头与花药位置空间分离,记为1。根据以上三项记录,其杂交指数(OCI)等于4,表示其繁育系统为部分自交亲和,异交,需要传粉者。
2.4 花粉/胚珠比率(P/O)
线叶忍冬单花的花粉量为4947.50±334.22,每朵花其胚珠数平均值为8.48±0.99,其花粉/胚珠比率(P/O)为583.43±99.90。根据Cruden的标准[20],线叶忍冬的有性繁育系统为兼性异交型(表2)。

表2 线叶忍冬OCI值与P/O值观测结果
注:数据为“平均值±标准差”。
Note:The data is expressed as “means±SD”.
2.5 人工授粉结果
按照6种不同授粉方法进行套袋(挂牌),每个方法套5个纸袋(挂牌)/株,共有100个纸袋,50个挂牌。对不同处理进行结实率统计时共回收完整纸袋数共86个,回收挂牌数共42个。

表3 线叶忍冬人工授粉后结实情况
对剩余套袋(挂牌)结果率进行统计(表3)发现,对线叶忍冬花朵进行不去雄、不套袋处理后结果数为8,即其自然条件下结果率为34.78%;对线叶忍冬花朵进行不去雄、套袋处理后结果数为2,其自花授粉情况下结果率为9.52%,相对较低;对线叶忍冬花朵进行去雄、套袋、不授粉处理处理后其结果率为0;人工异株异花和同株异花授粉结果率分别为71.43%和79.17%。对线叶忍冬花朵进行去雄,不套袋处理后结果数为7,即其自然授粉结果率为36.84%。
2.6 访花者特性
线叶忍冬样地中访花昆虫种类较多,包括蜻蜓目(Odonata)、直翅目(Orthoptera)、鞘翅目(Coleoptera)、双翅目(Diptera)、膜翅目(Hymenoptera)的昆虫。其中膜翅目中的意蜂(Apismellifera)为主要的访花昆虫,其数量较多,访花频率较高,且其身上携带的花粉量较大。而榨蚕马蜂(Polistesgallicus)、天山熊蜂(Bombustianshanicus)、明亮熊蜂(Bombuslucorum)、苔状熊蜂(Bombusmuscorum)在样地中出现数量十分少,访花频率较低,所以其传粉效率较低。金龟甲、瓢虫、蝇类、蚂蚁类大多是啃食花部器官或仅在花部停留,接触花药及柱头少,传粉效果也较差;蝶类昆虫在生境中更是十分罕见,对线叶忍冬传粉作用有限(图4)。
因线叶忍冬生长地的海拔较高,花期时气温较低,一般情况下12:00~17:00的访花者数量较多,种类也较多。其中意蜂访花在15:00~17:00左右最盛,每株线叶忍冬的访花者数量达到27只·h-1,其单花访问时间为2~11 s不等。当线叶忍冬花朵为欲开花时,意蜂利用前足和头部将花瓣扒开,再将其口器探入到花冠筒内采集花蜜,此时花瓣受到外力打开时会有部分花粉散落在意蜂身上;线叶忍冬花朵为盛开花时意蜂会将其头部直接探入已开放的花朵的花冠筒内,其身体会将雌雄蕊压在身下,此时身上的绒毛会沾染很多花粉,也能同时将身上已携带的花粉与柱头接触,从而完成传粉。

图4 线叶忍冬访花昆虫 A.膜翅目蜜蜂科昆虫访花;B.膜翅目蜜蜂科昆虫访花;C.鞘翅目昆虫访花;D.鞘翅目金龟甲科昆虫访花;E.鞘翅目昆虫访花;F.膜翅目蚁科昆虫访花Fig.4 The visiting insect of L.alberti A. A visiting insect of Hymenoptera(Apidae); B. A visiting insect of Hymenoptera(Apidae); C. A visiting insect of Coleoptera; D. A visiting insect of Coleoptera(Scarabaeoidea); E. A visiting insect of Coleoptera; F. A visiting insect of Hymenoptera(Formicidae)
3 讨论
植物繁育系统即以“生殖”为核心的影响植物后代遗传特性的全部有性特征[21~23],这些有性特征中花朵是较为重要的一部分,它是被子植物的繁殖器官,其特征会对传粉及交配产生影响[11]。线叶忍冬花朵较大、颜色鲜艳、花香较浓,这些特征对样地中主要访花昆虫意蜂来说是较为吸引的,则对线叶忍冬的异花传粉起促进作用。线叶忍冬花朵为欲开花时,意蜂常利用身体碰触花朵,将开花进程提前进行采蜜,此时花冠裂片会因外力全部张开,此时柱头已具有可授性,意蜂其身上已携带的花粉与柱头接触,增加异花传粉机率。另花朵开放后其雌雄蕊空间分离,同样为柱头接受异花花粉提供机会。而线叶忍冬花朵其中一种开放进程中,前期花冠裂片的其中1~2瓣略微张开,雄蕊彼此分开,雌蕊仍藏于未裂开的花瓣中但已具有可授性,此时花药开裂则会增加自花授粉的机率。
有活力的花粉到达具有可授性的柱头才能完成有效传粉过程[24],所以研究花粉活力及柱头可授性成为必不可少的内容。综合联苯胺-α萘酚法与MTT法2种测定方法的试验结果,认为线叶忍冬的花粉活力最高值在花朵开放散粉后6 h左右,而柱头在花朵未开放(即为欲开花)时已具备可授性,说明雌蕊先于雄蕊成熟。同时,不同种类的植物其花粉活力和柱头可授性检验方法存在可选择性[25~26],单一方法测定并不能客观反映花粉活力和柱头可授性,经过试验证明联苯胺-α萘酚法与MTT法适用于线叶忍冬的花粉活力检测,联苯胺—过氧化氢法适用于线叶忍冬的柱头可授性检测。
对于植物繁育系统的判定方法,一般是由杂交指数、花粉/胚珠比率、人工授粉套袋试验结果综合来得出[27~29]。将线叶忍冬花朵的观察数据,按照Dafni的标准进行杂交指数(OCI)估算,结果显示线叶忍冬繁育系统为部分自交亲和,异交,需要传粉者。将线叶忍冬花粉量和胚珠数比值按照Cruden的标准进行评判,结果显示线叶忍冬繁育系统为兼性异交。人工授粉套袋试验中,不去雄、套袋的处理结果表明自交亲和,但自花授粉结果率相对较低。人工授同株异花花粉和人工授异株异花花粉的处理及去雄、不套袋的处理结果则显示异花授粉其结果率相对较高,即在自然条件下以异花传粉为主。由OCI值、P/O比率、套袋试验结果三者对线叶忍冬繁育系统的判断结果基本一致。结合对其花朵、访花者的观测与三项试验检测认为线叶忍冬属于混合交配系统。
综上所述,线叶忍冬花期为5~6月,花朵开放方式有两种,且受天气影响较大,阴雨天花朵开放时间相对较长。由OCI、P/O比率、人工授粉套袋试验3种检测方法得到的结论基本一致,可以看出,线叶忍冬属于混合交配系统,以异交为主,较依赖传粉媒介,小部分自交亲和。且线叶忍冬是以膜翅目蜜蜂科意蜂(Apismellifera)为主要传粉媒介进行异花传粉的。
致谢感谢新疆大学黄仁鑫教授为本文所做的昆虫鉴定。
1.杨昌友.新疆树木志[M].北京:中国林业出版社,2012:438-440.
Yang C Y.Sylva Xinjiangensis[M].Beijing:China Forestry Press,2012:438-440.
2.李金霞,苏雪,刘玉国,等.黄花角蒿(Incarvilleasinensisvar.przewalskii)开花动态及繁育系统的研究[J].植物研究,2011,31(2):147-151.
Li J X,Su X,Liu Y G,et al.Flowering dynamics and breeding system ofIncarvilleasinensisvar.przewalskii[J].Bulletin of Botanical Research,2011,31(2):147-151.
3.牟勇,张云红,娄安如.稀有植物小丛红景天花部综合特征与繁育系统[J].植物生态学报,2007,31(3):528-535.
Mu Y,Zhang Y H,Lou A R.A preliminary study on floral syndroma and breeding system of the rare plantRhodioladumulosa[J].Journal of Plant Ecology,2007,31(3):528-535.
4.宋玉霞,郭生虎,牛东玲,等.濒危植物肉苁蓉(Cistanchedeserticola)繁育系统研究[J].植物研究,2008,28(3):278-282,287.
Song Y X,Guo S H,Niu D L,et al.A study on breeding system of the endangered plantCistanchedeserticola[J].Bulletin of Botanical Research,2008,28(3):278-282,287.
5.肖宜安,何平,李晓红.濒危植物长柄双花木的花部综合特征与繁育系统[J].植物生态学报,2004,28(3):333-340.
Xiao Y A,He P,Li X H.Floral syndrome and breeding system of the endangered plantDisanthuscercidifoliusMaxim var.longipes[J].Acta Phytoecologica Sinica,2004,28(3):333-340.
6.王迎春,马虹,征荣.四合木繁殖特性的研究[J].西北植物学报,2000,20(4):661-665.
Wang Y C,Ma H,Zheng R.Studies on the reproductive characteristics ofTetraenamongolicaMaxim[J].Acta Botanica Boreali-Occidentalia Sinica,2000,20(4):661-665.
7.张圣芸,陆婷,叶远荣,等.假龙头的花部特征及繁育系统研究[J].新疆农业科学,2014,51(4):696-700.
Zhang S Y,Lu T,Ye Y R,et al.Floral traits and breeding system ofPhysostegiavirginiana[J].Xinjiang Agricultural Sciences,2014,51(4):696-700.
8.陈香,胡雪华,肖宜安,等.紫茉莉的花部综合特征与繁育系统[J].生态学杂志,2008,27(10):1653-1658.
Chen X,Hu X H,Xiao Y A,et al.Floral syndrome and breeding system ofMirabilisjalapaL.[J].Chinese Journal of Ecology,2008,27(10):1653-1658.
9.李鹂,党承林.短葶飞蓬(Erigeronbreviscapus)的花部综合特征与繁育系统[J].生态学报,2007,27(2):571-578.
Li L,Dang C L.Floral syndrome and breeding system ofErigeronbreviscapus[J].Acta Ecologica Sinica,2007,27(2):571-578.
10.孙年喜,李隆云,崔广林.灰毡毛忍冬开花特性及繁育系统的研究[J].西南农业学报,2013,26(3):1178-1183.
Sun N X,Li L Y,Cui G L.Study on flowering characteristics and breeding system ofLoniceranuwranthoidesHand.-Mazz.[J].Southwest China Journal of Agricultural Sciences,2013,26(3):1178-1183.
11.刘献凯.五种忍冬属植物繁殖和传粉生物学研究[D].长春:东北师范大学,2012:1-2.
Liu X K.Research on reproduction and pollination biology of five species ofLonicera[D].Changchun:Northeast Normal University,2012:1-2.
12.王丽芳.昭苏县植被景观生态研究[D].乌鲁木齐:新疆大学,2007:3-4.
Wang L F.Ecology research in the vegetation landscape of Zhaosu county[D].Urumqi:Xinjiang University,2007:3-4.
13.张大勇.植物生活史进化与繁殖生态学[M].北京:科学出版社,2004:148-152.
Zhang D Y.Plant life history evolution and breeding ecology[M].Beijing:Science Press,2004:148-152.
14.Rodriguez-riano T,Dafni A.A new procedure to asses pollen viability[J].Sexual Plant Reproduction,2000,12(4):241-244.
15.李和帅,王承民,王波超,等.我国几个主要椰子品种花粉生活力研究[J].江西农业学报,2013,25(9):11-14.
Li H S,Wang C M,Wang B C,et al.Study on pollen viability of several major coconut(Cocosnucifera) varieties in China[J].Acta Agriculturae Jiangxi,2013,25(9):11-14.
16.左丹丹,明军,刘春,等.植物花粉生活力检测技术进展[J].安徽农业科学,2007,35(16):4742-4745.
Zuo D D,Ming J,Liu C,et al.Advance in technique of plant pollen viability[J].Journal of Anhui Agricultural Sciences,2007,35(16):4742-4745.
17.王钦丽,卢龙斗,吴小琴,等.花粉的保存及其生活力测定[J].植物学通报,2002,19(3):365-373.
Wang Q L,Lu L D,Wu X Q,et al.Pollen preservation and its viability test[J].Chinese Bulletin of Botany,2002,19(3):365-373.
18.Dafni A,Maués M M.A rapid and simple procedure to determine stigma receptivity[J].Sexual Plant Reproduction,1998,11(3):117-180.
19.Dafni A.Pollination ecology[M].New York:Oxford University Press,1992:1-57.
20.Cruden R W.Intraspecific variation in pollen-ovule ratios and nectar secretion-preliminary evidence of ecotypic adapation[J].Annals of the Missouri Botanical Garden,1976,63(2):277-289.
21.Wyatt R.Pollinator-Plant interactions and the evolution of breeding systems[M].//Real L.Pollination Biology.Orlando:Academic Press,1983:51-95.
22.Heinrich B,Raven P H.Energetics and pollination ecology[J].Science,1972,176(4035):597-602.
23.何亚平,刘建全.植物繁育系统研究的最新进展和评述[J].植物生态学报,2003,27(2):151-163.
He Y P,Liu J Q.A review on recent advances in the studies of plant breeding system[J].Acta Phytoecologica Sinica,2003,27(2):151-163.
24.刘林德,陈磊,张丽,等.华北蓝盆花的开花特性及传粉生态学研究[J].生态学报,2004,24(4):718-723.
Liu L D,Chen L,Zhang L,et al.Flowering characteristics and pollination ecology ofScabiosatschiliensis[J].Acta Ecologica Sinica,2004,24(4):718-723.
25.孙春丽,潘延云.拟南芥花粉活力的测定及其在花粉发育研究中的应用[J].植物学通报,2008,25(3):268-275.
Sun C L,Pan Y Y.Testing pollen character during pollen development inArabidopsis[J].Chinese Bulletin of Botany,2008,25(3):268-275.
26.汪妮,张志轩,董自梅.韭菜花粉生活力测定方法的筛选研究[J].长江蔬菜,2009(2):53-55.
Wang N,Zhang Z X,Dong Z M.Studies on testing methods of the pollen vigour of Chinese chive[J].Journal of Changjiang Vegetables,2009(2):53-55.
27.张丙林,穆春生,王颖,等.五脉山黧豆开花动态及有性繁育系统的研究[J].草业学报,2006,15(2):68-73.
Zhang B L,Mu C S,Wang Y,et al.Study on floral dynamic and breeding system ofLathyrusquinquenervius[J].Acta Prataculturae Sinica,2006,15(2):68-73.
28.李昆,尹伟伦,罗长维.小桐子繁育系统与传粉生态学研究[J].林业科学研究,2007,20(6):775-781.
Li K,Yin W L,Luo C W.Breeding system and pollination ecology inJatrophacurcas[J].Forest Research,2007,20(6):775-781.
29.潘成臣,刘林德,侯月利,等.黑河中游花棒的开花特性与繁育系统研究[J].中国沙漠,2010,30(5):1099-1103.
Pan C C,Liu L D,Hou Y L,et al.Flowering characteristics and breeding system ofHedysarumscopariumin the middle reaches of Heihe River[J].Journal of Desert Research,2010,30(5):1099-1103.
Supported by the Innovation Team of Biodiversity Conservation and Restoration Ecology Research in Arid Area;University Student’s Innovation Project of Xinjiang Agricultural University(JQZTP72013174)
introduction:LI Ya-Lan(1989—) female,master student,mainly engaged in the research of propagation of seedlings.
date:2016-02-28
StamenDynamicsandBreedingSystemofLoniceraalberti
LI Ya-Lan LIANG Feng-Li*
(Collage of Forestry and Horticulture,Xinjiang Agricultural University,Urumqi 830052)
In order to study the flowering characteristics and breeding system ofLoniceraalberti, we observed flower characteristics, floral dynamic and pollination insects in the field during the flowering period. We tested the pollen viability by TTC staining, MTT staining, benzidine α-naphthol staining and carmine acetate dyeing, and estimated its stigma receptivity by benzidine-hydrogen peroxide and diphenyl tetrazolium bromide staining methods. We studied the breeding system ofL.albertiby the pollen-ovule ratio(P/O), the out-crossing index(OCI), and artificial pollination methods. There are two kinds ofL.albertiflowers opening:corolla lobes blooming one by one and corolla lobes simultaneous blooming. The pollen viability reached the maximum at 6 hours after anthers shedding, and stigma receptivity was increased after bloom; Apis mellifera played an important role in the process of pollination. P/O was 583.43±99.90 and the outcrossing index was 4. By artificial pollination testing, cross-pollination rate was 79.17%, and the self-fertility rate was 9.52%. The research suggested that the breeding system ofL.albertibelonged to mixed mating system and cross pollination requires pollinators.
Loniceraalberti;flowering dynamics;breeding system;pollen viability;stigma receptivity
干旱区生物多样性保育与恢复生态学科研创新团队资助;新疆农业大学大学生创新项目(JQZTP72013174)
李亚兰(1989—),女,硕士研究生,主要从事林木种苗繁育方面的研究。
* 通信作者:E-mail:xjliangfengli@163.com
2016-02-28
* Corresponding author:E-mail:xjliangfengli@163.com
Q949.781.2
A
10.7525/j.issn.1673-5102.2016.04.004
