干旱胁迫对入侵种大狼把草及本地伴生种山莴苣叶片光合特性的影响
2016-11-10闫小红胡文海尹增芳
闫小红 周 兵 胡文海 王 宁 尹增芳
(1.井冈山大学生命科学学院,吉安 343009; 2.南京林业大学生物与环境学院,南京 210037)
干旱胁迫对入侵种大狼把草及本地伴生种山莴苣叶片光合特性的影响
闫小红1,2周 兵1胡文海1王 宁1尹增芳2*
(1.井冈山大学生命科学学院,吉安 343009;2.南京林业大学生物与环境学院,南京 210037)
以入侵种大狼把草(Bidensfrondosa)和本地伴生种山莴苣(Lactucaindica)为试验材料,采用温室控制实验,设定轻度干旱(LD)、中度干旱(MD)、重度干旱(SD)和正常灌水(CK)4个处理,对两个物种的最大净光合速率(Pmax)、光饱和点(LSP)、暗呼吸速率(Rd)、潜在最大光合速率(Amax)、无CO2时的光下呼吸(RP)、Rubisco最大羧化速率(Vcmax)、RuBP最大再生速率(Jmax)等气体交换参数以及光合色素(叶绿素和类胡萝卜素)含量的变化进行了比较研究。结果表明,不同程度干旱胁迫下,两个物种各参数的变化趋势基本一致,但入侵种大狼把草大部分参数值的变化幅度显著低于伴生种山莴苣,甚至在重度干旱胁迫下,山莴苣地上死亡,并且复水后难以恢复。干旱胁迫下,大狼把草光合作用下降的主要原因为气孔限制,而山莴苣则为非气孔限制。相对于本地种山莴苣,入侵种大狼把草在相同的呼吸消耗(Rd)下具有更高的呼吸效率(RE),能够积累更多的光合作用产物;其更高的光呼吸速率(Rp),可保护光合机构免受伤害;在干旱胁迫下大狼把草能够保持更高的光化学反应和RuBP的羧化能力,可维持更高的光合作用能力。可见,入侵种大狼把草和本地种山莴苣的光合特征对干旱胁迫的响应趋势基本一致,但大狼把草具有更强的极端干旱耐受性和复水恢复能力,显示了更好的干旱适应性,将有助于其入侵。
入侵种; 大狼把草;干旱胁迫;光合特性;入侵力
成功的入侵植物常具有较强的适应性、繁殖力和散布力[1~2]。在入侵过程中,入侵植物常遭遇新的生态环境[3],如病原菌、虫害等生物胁迫,以及高温、干旱等非生物胁迫。其中,干旱胁迫是随着全球气候变暖加剧而存在的一种普遍的非生物胁迫。研究表明,在野外不同的生境条件下,加拿大一枝黄花(Solidagocanadensis)会随着土壤水势的变化表现出不同的气孔开度,在渗透系数和安全性中表现出更高的适应性[4]。在低水分胁迫下,入侵植物空心莲子草(Alternantheraphiloxeroides)通过其体内活性氧清除系统来解除活性氧的伤害[5],其根部的抗氧化酶活性比叶中的活性要高[6]。入侵植物假臭草(Eupatoriumcatarium)通过体内丙二醛、脯氨酸等含量的改变,来适应干旱胁迫[7]。但宋莉英等[8]的研究则表明,入侵植物三裂叶蟛蜞菊(Wedeliatrilobata)却容易受到干旱胁迫的限制,不利于其扩散。可见,大多数入侵植物对干旱胁迫具有较强的适应性,但不同物种对干旱胁迫的生理响应存在差异。
大狼把草(Bidensfrondosa)为菊科(Compositae)鬼针属(Bidenssp.)一年生草本植物,原产北美洲,最初为无意引入种,现在我国长江中下游地区广泛分布,常入侵荒地、路边、低洼的水湿地、缺水的稻田等不同生境,给入侵地生物多样性和农业生产带来严重危害[9]。作为入侵植物,大狼把草可产生大量的种子,具有灵活的种子传播方式[10~11],取食性天敌昆虫极少[12],同时,对其伴生植物的种子萌发和幼苗生长具有较强的化感抑制作用[13]。这些特性增强了大狼把草的适应性,提高了其竞争力,为其成功入侵创造了条件。近期,我们在野外调查中发现,相对于一些本地伴生种,大狼把草在夏季高温干旱的气候条件下,仍可以保持旺盛的生长力。说明大狼把草对干旱胁迫有一定的耐受性或适应性。理解大狼把草对干旱胁迫耐受性或适应性的生理机制,对于揭示大狼把草的生长发育的选择和繁殖策略具有重要的作用。为此,本文以入侵种大狼把草及其本地伴生种山莴苣(Lactucaindica)为研究对象,对不同干旱胁迫程度下两种植物的光合参数的变化趋势和变化幅度进行了比较研究,并探讨了这种变化与入侵植物适应性和入侵性的关系,为揭示大狼把草入侵的入侵机制和防治提供理论参考。
1 材料与方法
1.1 试验材料
前期的大狼把草入侵植物群落结构调查发现,山莴苣是样地中为出现频率较高的同科本地种,同时两者的物候期比较一致。为此,我们选择山莴苣作为对照种。大狼把草和山莴苣种子采集于井冈山大学校园内同一样地内。于2014年4月播于苗床中,当种苗大约20~30 cm高时,选择大小一致的种苗转移到21 cm×21 cm的黑色塑料营养钵中,栽培基质为V园土∶V草炭土∶V河沙=3∶1∶1。恢复2周后,进行试验处理。
1.2 试验方法1.2.1 试验材料处理
试验于2014年6~8月在井冈山大学生物园温室内进行,采用称重法控制土壤相对含水量,分为4个土壤水分处理,分别为正常水分处理:75%~80%相对含水量(CK);轻度干旱:55%~60%相对含水量(LD);中度干旱:40%~45%相对含水量(MD);重度干旱:30%~35%相对含水量(SD)。每处理重复4次,干旱处理10 d后,对照条件下恢复5 d。分别于处理0、1、5、10 d,以及恢复1、5 d测定叶片气体交换参数。处理5 d测定光合光响应曲线和CO2响应曲线,并计算相应参数。
1.2.2 光合作用测定
采用LI-6400XT便携式光合作用测定系统在1 600 μmol·m-2·s-1光强下测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(E)等气体交换参数,并计算气孔限制值Ls=1-Ci/Ca。
1.2.3光合作用对光强的响应曲线及CO2响应曲线的测定
采用LI-6400XT便携式光合作用测定系统进行光合作用对光强的响应曲线和CO2响应曲线的测定。光源采用LI-6400-02B光源(Li-Cor,USA),自动测量程序进行测定。光响应曲线测定时,利用CO2钢瓶控制CO2浓度为(390±2)μmol·mol-1,泵流速为500 μmol·s-1,叶片温度为(35±1)℃,空气相对湿度约为70%。样叶在每个光强下至少180 s记录一个点。光合有效辐射梯度设置为:2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、20和0 μmol·m-2·s-1,采用叶子飘等的直角双曲线修正模型[14~15]进行曲线拟合,获得最大净光合速率(Pmax)、光饱和点(LSP)、暗呼吸速率(Rd),计算呼吸效率RE=Pmax/Rd。CO2响应曲线测定时,利用CO2钢瓶来控制CO2浓度,CO2浓度设定为:390、300、260、220、180、140、100、80、50、390、500、600、800、1 000、1 200、1 500 μmol·mol-1,根据叶子飘等的方法[14~15]进行曲线拟合,并计算潜在最大光合速率(Amax),无CO2时光下呼吸(Rp),用McMurtrie和Wang的方法[16]计算Rubisco最大羧化速率(Vcmax)和RuBP最大再生速率(Jmax)。
1.2.4 色素含量测定
叶绿素含量测定参照Arnon[17]的方法加以改进。用直径5 mm的打孔器打15个圆片(避开叶脉),剪碎后置于离心管内,加入5 mL 80%丙酮,在黑暗处浸提24 h,用UV-2550紫外可见分光光度计(日本岛津)分别测定470、645、652、663 nm处的吸光度值,根据吸光度值计算单位面积的叶绿素和类胡萝卜素含量。每处理4次重复。
1.3 统计分析
为获得两物种在3种不同干旱胁迫程度下光合参数的变化幅度差异,参照王文杰等的计算方法[18],以正常水分管理为对照(CK),确定各参数值较对照下的变化幅度(Amplitude,A)为:A=(Ps-Pc)/Pc,式中,Ps表示干旱胁迫(轻度(LD),中度(MD),重度(SD))下测定的参数值,Pc表示正常水分管理(CK)下测定的参数值,Ps-Pc表示相对于对照的绝对变化幅度,与Pc的比值表示相对于对照的相对变化幅度,其绝对值越大,表示变化幅度越大。对同一测定参数的A进行统计分析,若差异显著,表明两物种对同一干旱胁迫程度的变化幅度差异显著,反之,则二者变化幅度差异不显著。
所有数据采用SPSS19.0(SPSS Inc.,Chicago,IL)进行统计分析。采用双因素方差分析比较物种与干旱处理间的影响。采用单因素方差分析比较相同物种不同胁迫程度下的变量值之间的差异,并用最小显著性差异法(LSD)检验数据之间的差异显著性(P<0.05)。采用独立样本t检验比较相同胁迫程度下两物种变量值之间的差异。文中所列数据均为平均值±标准误,n=4。采用OriginPro8.0软件作图。
2 结果与分析
对入侵种大狼把草和本地伴生种在4个不同干旱胁迫程度下的主要参数值的双因素方差分析结果表明,除暗呼吸速率(Rd)外,其它参数值在物种与干旱胁迫处理中均受到显著影响(表1)。物种与干旱处理间的交互作用只在潜在最大净光合速率(Amax)、叶绿素含量(Chl)和类胡萝卜素含量(Car)中存在显著性。
表1基于物种、干旱胁迫的各参数值的双因素方差分析及F值
Table1Atwo-wayANVOAandF-valueofdifferentparametersbasedonspeciesanddrougtstress(n=4)andspecies(n=2)
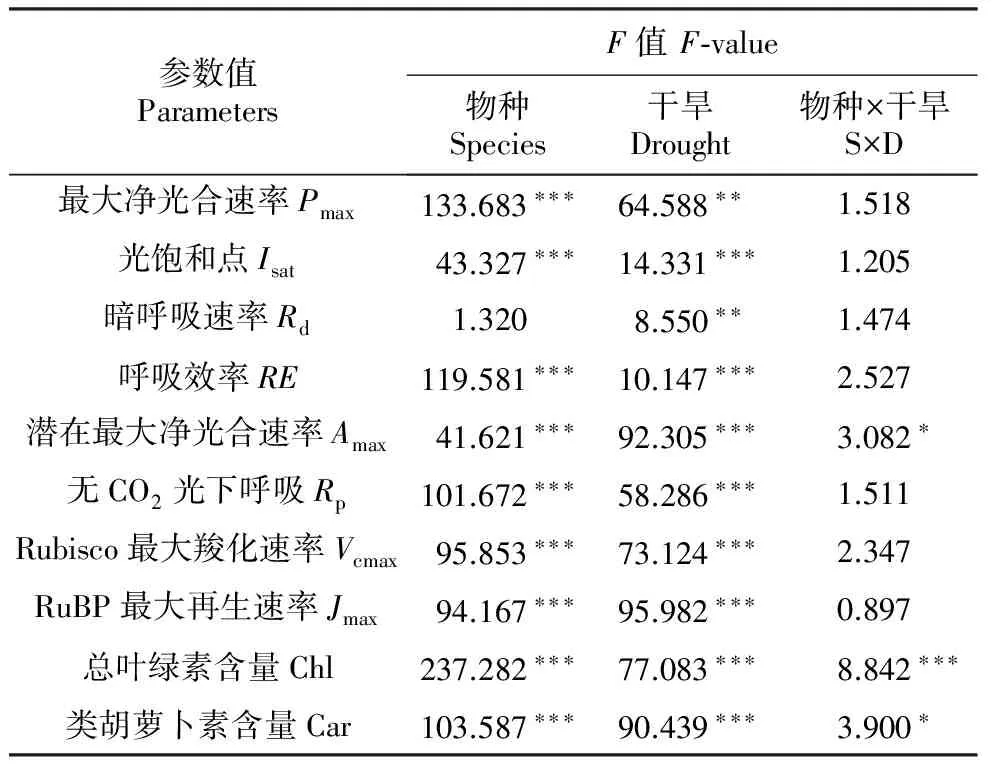
参数值ParametersF值F⁃value物种Species干旱Drought物种×干旱S×D最大净光合速率Pmax133.683∗∗∗64.588∗∗1.518光饱和点Isat43.327∗∗∗14.331∗∗∗1.205暗呼吸速率Rd1.3208.550∗∗1.474呼吸效率RE119.581∗∗∗10.147∗∗∗2.527潜在最大净光合速率Amax41.621∗∗∗92.305∗∗∗3.082∗无CO2光下呼吸Rp101.672∗∗∗58.286∗∗∗1.511Rubisco最大羧化速率Vcmax95.853∗∗∗73.124∗∗∗2.347RuBP最大再生速率Jmax94.167∗∗∗95.982∗∗∗0.897总叶绿素含量Chl237.282∗∗∗77.083∗∗∗8.842∗∗∗类胡萝卜素含量Car103.587∗∗∗90.439∗∗∗3.900∗
*P<0.05,**P<0.01,***P<0.001
2.1干旱胁迫对大狼把草和山莴苣光合作用的影响
图1为不同干旱胁迫处理下,随处理时间延长,入侵种大狼把草和伴生种山莴苣的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(E)的变化趋势。由图1可知,除山莴苣在重度干旱胁迫(SD)下出现Ci值急剧上升外,两物种4个参数值随时间变化的趋势基本一致,都表现为随处理时间延长逐渐降低。处理10 d后,在随后的复水恢复过程中,各参数值表现为逐渐上升、最后稳定的趋势,但山莴苣在重度干旱胁迫(SD)下植株已死亡,而大狼把草在恢复期的Pn可恢复到对照水平,表现出很强的复水能力(图1)。

图1 干旱胁迫下大狼把草及山莴苣Pn、Gs、Ci、E的变化趋势 A.大狼把草;B.山莴苣Fig.1 Pn,Gs,Ci,E variation trend of B.frondosa and L.indica under drought stress A.B.frondosa; B.L.indica
根据叶片气体交换参数中Ci值,进一步计算出气孔限制值Ls(图2)。两物种的Ls维持在0.2左右。干旱导致大狼把草的Ls迅速上升,并随干旱时间的延长,继续上升,在干旱第10 d,重度干旱下的Ls上升到0.75,约为对照的3.75倍(图2A)。而山莴苣在干旱处理过程中Ls先缓慢上升,然后又逐渐下降,且在重度干旱胁迫下,Ls值反而迅速下降,并远低于对照水平(图2B)。

图2 干旱胁迫对大狼把草(A)和山莴苣(B)气孔限制值(Ls)的影响Fig.2 Effects of drought stress on stomatal limitation(Ls) in B.frondosa(A) and L.indica(B)
2.2干旱胁迫下大狼把草和山莴苣光响应曲线拟合参数变化趋势及变化幅度差异
干旱处理5 d光合作用对光强的响应曲线如图3所示。不同程度的干旱胁迫下,两物种净光合速率随光强的变化趋势基本一致,并且显著低于对照。二者在重度干旱胁迫下,出现了较明显的光抑制。

图3 干旱胁迫5 d大狼把草(A)和山莴苣(B)光合光响应曲线Fig.3 Response of Pn to light intensity in B.frondosa(A) and L.indica(B) after 5 day treatment by drought stress
通过拟合两个物种的光响应曲线,得到最大净光合速率(Pmax)、光饱和点(LSP)、暗呼吸速率(Rd)等参数值(图4)。入侵种大狼把草Pmax无论是在对照还是在干旱胁迫下,均显著高于伴生种山莴苣,表明其在正常的环境条件下,就具有更高的光合能力;在不同程度干旱胁迫下,光饱和点也高于山莴苣,说明它对光的利用能力也较强(图4)。但Rd在两物种间没有明显差异。在不同程度干旱胁迫下,相对于山莴苣,大狼把草表现出更高的呼吸效率(RE)。

图4 干旱胁迫5 d对大狼把草和山莴苣叶片光曲线气体交换参数的影响 *表示相同干旱胁迫下不同物种之间差异显著(P<0.05);不同小写字母表示同一物种不同干旱胁迫处理之间差异显著(P<0.05),下同。Fig.4 Effects of drought stress for 5 days on light curve gas exchange parameters of leaves in B.frondosa and L.indica * indicated significant differences(P<0.05) between species at the same drought stress;Different small letters indicated significant differences(P<0.05) among drought stress for the same species,the same as below.
对两物种上述参数值在不同程度干旱胁迫下的变化幅度差异的比较发现(表2),轻度胁迫下,大狼把草的Pmax和LSD较对照分别降低了13%和22%,而山莴则降低了21%和41%,二者间达差异显著或极显著水平(P<0.05,P<0.01);中度胁迫下,大狼把草两参数值降幅为28%和27%,山莴苣降幅为51%和50%,二者间差异达显著水平(P<0.05);重度胁迫下,大狼把草两参数值降幅为55%和48%,山莴苣降幅为66%和70%,达差异显著或极显著水平(P<0.05,P<0.01)。大狼把草Rd值从轻度到重度胁迫下,降幅分别为:30%,11%,45%,山莴苣降幅为:5%,15%,38%,二者的Rd在轻度和重度胁迫下的降幅达差异显著或极显著水平(P<0.05,P<0.01)。由此可知,与对照相比,在不同程度干旱胁迫下大狼把草Pmax和LSD比山莴苣具有更低的变化幅度,而Rd则比山莴苣具有更高的变化幅度。
表2干旱胁迫下大狼把草和山莴苣光响应曲线参数较对照处理的变化幅度
Table2ChangesoflightcurveparametersamplitudebetweenB.frondosaandL.indicacomparedwithcontroltreatmentunderdroughtstress

参数Parameters物种Species变化幅度Amplitudetocontrol轻度胁迫LD中度胁迫MD重度胁迫SD最大净光合速率Pmax大狼把草B.frondosa-0.13-0.28-0.55山莴苣L.indica-0.21-0.51-0.66∗∗∗∗光饱和点LSP大狼把草B.frondosa-0.22-0.27-0.48山莴苣L.indica-0.41-0.50∗-0.70∗∗∗∗∗∗∗∗暗呼吸速率Rd大狼把草B.frondosa-0.30-0.11-0.45山莴苣L.indica-0.05-0.15-0.38∗∗ns∗
注:*表示两物种间在相同胁迫程度下差异显著(P<0.05);**表示两物种间在相同胁迫程度下差异极显著(P<0.01);ns表示两物种间在相同胁迫程度下无显著差异,下同。
Note:*indicated significant differences(P<0.05) between species at the same drought stress;**indicated significant differences(P<0.01) between species at the same drought stress; ns indicated no significant differences between species at the same drought stress,the same as below.
2.3干旱胁迫下大狼把草和山莴苣CO2响应曲线拟合参数的变化趋势及变化幅度差异
干旱胁迫5 d,两物种的光合作用对CO2的影响均随胁迫的加重呈现逐渐下降的趋势(图5),但很明显,无论在对照水平,还是在不同干旱胁迫程度下,大狼把草在不同CO2浓度下的净光合速率均高于山莴苣。

图5 干旱胁迫5 d大狼把草(A)和山莴苣(B)光合CO2响应曲线Fig.5 Response of Pn to CO2 concentrations in B.frondosa(A) and L.indica(B) after 5 days treatment by drought stress
拟合获得的CO2响应曲线参数表明,两物种的潜在最大光合速率(Amax)、无CO2时的光下呼吸(RP)、Rubisco最大羧化速率(Vcmax)、RuBP最大再生速率(Jmax)随干旱胁迫程度的加重而逐渐下降。并且无论是对照水平,还是不同胁迫水平,大狼把草各参数值均高于山莴苣(图6)。
对两物种上述参数值在不同程度干旱胁迫下的变化幅度的差异比较表明(表3),两物种在中度胁迫下的RP下降幅度分别为38%和48%;重度胁迫下的Vcmax下降幅度分别为66%和75%;轻度和中度胁迫下的Jmax下降幅度7%、14%和24%和32%,两物种间达差异显著或极显著水平(P<0.05,P<0.01)。但Amax以及其它胁迫水平下的RP和Vcmax在两物种间则不存在显著差异。
表3干旱胁迫下大狼把草和山莴苣CO2响应曲线参数较对照处理的变化幅度
Table3ChangesofCO2responsecurveparametersamplitudebetweenB.frondosaandL.indicacomparedwithcontroltreatmentunderdroughtstress

参数Parameters物种Species变化幅度Amplitudetocontrol轻度胁迫LD中度胁迫MD重度胁迫SD潜在最大净光合速率Amax大狼把草B.frondosa-0.11-0.35-0.59山莴苣L.indica-0.16-0.31-0.55nsnsns无CO2光下呼吸Rp大狼把草B.frondosa-0.27-0.38-0.49山莴苣L.indica-0.24-0.48-0.53ns∗nsRubisco最大羧化速率Vcmax大狼把草B.frondosa-0.22-0.50-0.66山莴苣L.indica-0.26-0.55-0.75nsns∗RuBP最大再生速率Jmax大狼把草B.frondosa-0.07-0.24-0.50山莴苣L.indica-0.14-0.32-0.55∗∗∗ns

图6 干旱胁迫5 d对大狼把草和山莴苣叶片CO2气体交换参数的影响Fig.6 Effects of drought stress for 5 days on CO2 gas exchange parameters of leaves in B.frondosa and L.indica

图7 干旱胁迫5 d大狼把草和山莴苣色素含量Fig.7 Pigment contents in B.frondosa and L.indica after 5 day treatment by drought stress
2.4干旱胁迫下大狼把草和山莴苣色素含量的变化趋势及变化幅度的差异
由图6可知,干旱胁迫显著影响两物种的叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chl)和类胡萝卜素(Car)含量。随着干旱胁迫程度的增大,大狼把草的Chla、Chlb以及Chl含量呈现先升高后降低的趋势(图7:A~C)。轻度胁迫下,大狼把草的叶绿素含量显著高于对照水平,为对照的1.17倍,但中度和重度胁迫下,叶绿素含量显著低于对照水平,分别为对照的84.5%和51.5%;而大狼把草的Car含量随着干旱胁迫程度的增大,逐渐降低,在中度和重度胁迫下,显著低于对照水平,分别为对照的68.8%和42.1%(图7A)。山莴苣的Chla、Chlb、Chl和Car含量随干旱胁迫程度的增大而逐渐降低(图7B)。在重度胁迫下,Chl和Car含量下降至最低,分别为对照的3.4%和14.4%。两个物种间在相同的干旱胁迫程度下,Chla、Chlb、Chl和Car含量也存在差异。无论是在对照水平下,还是在不同程度的干旱胁迫下,山莴苣的Chl和Car都低于大狼把草,并且差异显著(图7)。
对两物种上述参数值在不同程度干旱胁迫下的变化幅度的差异做比较(表4),山莴苣在各胁迫水平下的参数值的下降幅度均明显高于大狼把草,二者间各参数值达差异极显著(P<0.01)。山莴苣在重度干旱胁迫下的色素含量降幅达到80%以上,说明山莴苣在重度胁迫下,光合色素已受到严重伤害。
表4干旱胁迫下大狼把草和山莴苣色素含量较对照处理的变化幅度
Table4ChangesofpigmentcontentsamplitudebetweenB.frondosaandL.indicacomparedwithcontroltreatmentunderdroughtstress

参数Parameters物种Species变化幅度Amplitudetocontrol轻度胁迫LD中度胁迫MD重度胁迫SD叶绿素aChla大狼把草B.frondosa0.17-0.17-0.48山莴苣L.indica-0.41-0.53-0.97∗∗∗∗∗∗叶绿素bChlb大狼把草B.frondosa0.19-0.11-0.50山莴苣L.indica-0.32-0.43-0.96∗∗∗∗∗∗总叶绿素Chl大狼把草B.frondosa0.17-0.15-0.49山莴苣L.indica-0.39-0.51-0.97∗∗∗∗∗∗类胡萝卜素Car大狼把草B.frondosa-0.01-0.31-0.58山莴苣L.indica-0.32-0.45-0.86∗∗∗∗∗∗
3 讨论
光合作用是受非生物胁迫影响的最主要过程之一[19]。植物的净光合速率会随相对含水量和叶片水势的降低而下降[20]。变化趋势和变化幅度可用于不同因素水平和不同变量间的横向和纵向比较的依据[18]。如变化趋势可作为植物对不同胁迫水平的差异性比较的依据;而在变化趋势一致时,变化幅度可作为不同物种对同一因素水平的响应差异比较的依据。因此,本研究对入侵种大狼把草和本地伴生种山莴苣的较为重要的光合参数随干旱胁迫程度加剧的变化趋势和变化幅度做了横向和纵向比较,来探讨其与入侵力的关系。
各参数值在物种和干旱胁迫水平上大部分存在显著差异(表1)。两物种各参数值在不同胁迫水平下的变化趋势基本一致(图4,6~7)。但两物种在相同胁迫水平下的参数值变化幅度存在明显差异,入侵种大狼把草大部分参数的变化幅度明显低于本地伴生种山莴苣(表2~4)。如反映植物光合能力的最大净光合速率(Pmax)以及反映植物对光能利用能力的光饱和点(LSP)等参数的变化幅度均较低。在不利的环境条件下,高等植物的光合性能很大程度上取决于物种,不同的物种在特定的胁迫条件下,能够引发不同的适应机制[20]。为了维持足够的光合速率,植物表现出一套适应策略来响应高温、干旱、高光等非生物胁迫[19,22~23]。在本研究中,干旱胁迫下,入侵种大狼把草各参数值的降幅大部分低于本地伴生种山莴苣,表明两物种对干旱胁迫的响应机制不同,入侵种大狼把草对干旱胁迫具有更强的耐受性和适应性。
呼吸是植物重要的生理过程之一,呼吸除可提供代谢中间产物和能量来维持细胞活动及生长外,也可消耗有机质,减少生物量累积。研究发现,Pmax与Rd之间存在正相关关系[24]。本研究表明,干旱胁迫下,大狼把草比山莴苣具有更高的呼吸效率(RE),而两者的Rd没有显著差异(图4)。可见,入侵种在相同的呼吸消耗下,能够积累更多的光合作用产物。Zheng等[25]对入侵植物紫茎泽兰的研究也得到了类似的结果。
干旱胁迫下,植物受到氧化伤害。为了避免氧化伤害,其中的一种作用机制便是气孔关闭[26]。气孔关闭引起Pn、Gs、Ci和E的变化。我们的结果表明,干旱胁迫下,两物种的Gs均表现为下降,这与Boureima等[27]的研究结果一致。Gs下降的同时,大狼把草的Pn、Ci和E也随之下降(图1)。随胁迫程度的加剧,山莴苣Ci与大狼把草呈现相反的变化趋势(图1)。Ci是光合生理生态研究中的一个重要参数。在光合作用的气孔限制分析中,Ci的变化方向是确定光合速率变化的主要原因是否为气孔因素的必不可少的判断依据[28~29]。通过Ci,计算获得了气孔限制值Ls,大狼把草胁迫程度越严重,其Ls越高,而山莴苣的Ls则持续下降到对照或低于对照水平(图2)。表明不同程度的干旱胁迫下,大狼把草光合作用下降的主要原因为气孔限制,而山莴苣则为非气孔限制[30]。
研究发现,干旱胁迫下,气孔的关闭会影响1,5-二磷酸核酮糖羧化酶(Rubisco)的活性[31]和1,5-二磷酸核酮糖(RuBP)的再生[32]等。Rubisco是光合作用中决定碳同化速率的关键酶,其数量与活性将直接影响到Pmax和Vcmax的大小[33],Amax与Jmax则反映了RuBP再生速率和电子传递过程中同化力的多少[34]。干旱处理导致两物种的Pmax、Amax、Vcmax、Jmax的显著下降(图4,6),说明干旱胁迫抑制了Rubisco的活性和RuBP的再生速率。两物种Vcmax和Jmax的变化幅度的差异,表明入侵种大狼把草在干旱胁迫下可保持高于本地种山莴苣的Rubisco羧化能力和RuBP再生速率,从而具有更高的光合作用能力,提高了其对干旱的适应性,有利于在干旱生境中的定殖和扩散。
光呼吸是一种重要的光保护途径[35]。在不同程度的干旱胁迫下,与山莴苣相比,大狼把草具有更高的光呼吸速率,可能会减少过剩光能的累积,维持较高的光合活性,保护光合机构免遭破坏。这与Zhang等[36]的研究结果较为一致。叶绿素和类胡萝卜素在光合机构中在对光能的吸收、传递和转化过程中起着重要的作用[37]。干旱胁迫下,Chla和Chlb含量的减少意味着叶绿素的合成减缓或快速分解,并且被认为是受到氧化伤害的典型症状,是叶绿体对光能吸收最小化的一种响应机制[38]。本试验中,大狼把草的Chla和Chlb和Chl在轻度干旱胁迫下,反而升高,说明轻度干旱,大狼把草的叶绿素合成加快,不足以引起氧化伤害,表明大狼把草对轻度干旱胁迫有很好的耐受性和适应性。但在中度和重度胁迫下,则逐渐降低。对于本地种山莴苣,无论是在轻度胁迫下,还是在中度和重度胁迫下,叶绿素含量持续降低,且降幅明显高于大狼把草,说明干旱胁迫减缓了山莴苣叶绿素的合成或加快了叶绿素的分解。两物种在中度和重度胁迫下Chla和Chlb含量变化与Ghobadi等[39]、Liu等[40]和Tambussi等[41]的研究结果一致。但随着干旱胁迫程度的加剧,两物种的类胡萝卜素含量逐渐下降,并没有在光保护中发挥很大的作用,这与某些研究结果相悖[39,42]。
综上所述,不同程度的干旱胁迫下,大狼把草光合作用下降的主要原因为气孔限制,而山莴苣为非气孔限制;在相同的呼吸消耗(Rd)下,大狼把草具有更高的呼吸效率(RE),能够积累更多的光合作用产物;其更高的光呼吸速率(Rp)可保护光合机构免受伤害;同时,在干旱胁迫下,大狼把草能够保持更高的光化学反应和RuBP的羧化能力,维持更高的光合作用能力。可见,入侵种大狼把草较山莴苣具有更强的干旱适应性,有助于其入侵。
1.Prentis P J,Wilson J R U,Dormontt E E,et al.Adaptive evolution in invasive species[J].Trends in Plant Science,2008,13(6):288-294.
2.Pyšek P,Richardson D M.Traits associated with invasiveness in alien plants:where do we stand?[M].//Nentwig W.Biological invasions,section Ⅱ.Berlin Heidelberg:Springer,2007.
3.Novak S J.The role of evolution in the invasion process[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(10):3671-3672.
4.Nolf M,Pagitz K,Mayr S.Physiological acclimation to drought stress inSolidagocanadensis[J].Physiologia Plantarum,2014,150(4):529-539.
5.许凯扬,叶万辉,段学武,等.PEG诱导水分胁迫下喜旱莲子草的生理适应性[J].浙江大学学报:农业与生命科学版,2004,30(3):271-277.
Xu K Y,Ye W H,Duan X W,et al.Physiological adaptation ofAlternantheraphiloxeroidesunder water stress condition induced by polyethylene glycol[J].Journal of Zhejiang University:Agriculture & Life Sciences,2004,30(3):271-277.
6.肖强,高建明,罗立廷,等.干旱胁迫对空心莲子草抗氧化酶活性和组织学的影响[J].生物技术通讯,2006,17(4):556-559.
Xiao Q,Gao J M,Luo L T,et al.Effects of drought stress on the activities of anti-oxidant enzymes and histology inAlternantheraphiloxeroides[J].Letters in Biotechnology,2006,17(4):556-559.
7.阚丽艳,谢贵水,王纪坤.干旱胁迫对入侵植物假臭草幼苗生长和生理生态指标的影响[J].热带作物学报,2009,30(5):608-612.
Kan L Y,Xie G S,Wang J K.Effect of drought stress on the growth and eco-physiologic characteristics of invasive plantEupatoriumcatariumseedlings[J].Chinese Journal of Tropical Crops,2009,30(5):608-612.
8.宋莉英,孙兰兰,舒展,等.干旱和复水对入侵植物三裂叶蟛蜞菊叶片叶绿素荧光特性的影响[J].生态学报,2009,29(7):3713-3721.
Song L Y,Sun L L,Shu Z,et al.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics in leaves of invasiveWedeliatrilobata[J].Acta Ecologica Sinica,2009,29(7):3713-3721.
9.徐海根,强胜.中国外来入侵物种编目[M].北京:中国环境科学出版社,2004.
Xu H G,Qiang S.Inventory invasive alien species in China[M].Beijing:China Environmental Science Press,2004.
10.Brändel M.Dormancy and germination of heteromorphic achenes ofBidensfrondosa[J].Flora-Morphology,Distribution,Functional Ecology of Plants,2004,199(3):228-233.
11.Coʂkunçelebi K,Terziolu S,Vladimirov V.A new alien species for the flora of Turkey:BidensfrondosaL.(Asteraceae)[J].Turkish Journal of Botany,2007,31(5):477-479.
12.Han Y G,Cho Y,Kim Y,et al.Insect herbivores associated with the introduced weedBidensfrondosaL.(Asteraceae) in Korea,and their potential role as augmentative biological control agents[J].Entomological Research,2009,39(6):394-400.
13.闫小红,曾建军,周兵,等.外来入侵植物大狼把草提取物的化感潜力[J].扬州大学学报:农业与生命科学版,2012,33(2):88-94.
Yan X H,Zeng J J,Zhou B,et al.Allelopathic potential of the extracts from alien invasive plantBidensfrondosa[J].Journal of Yangzhou University:Agricultural and Life Science Edition,2012,33(2):88-94.
14.Ye Z P,Robakowski P,Suggett D J.A mechanistic model for the light response of photosynthetic electron transport rate based on light harvesting properties of photosynthetic pigment molecules[J].Planta,2013,237(3):837-847.
15.Ye Z P,Suggett J D,Robakowski P,et al.A mechanistic model for the photosynthesis-light response based on the photosynthetic electron transport of photosystem Ⅱ in C3and C4species[J].New Phytologist,2013,199(1):110-120.
16.Mcmurtrie R E,Wang Y P.Mathematical models of the photosynthetic response of tree stands to rising CO2concentrations and temperatures[J].Plant,Cell and Environment,1993,16(1):1-13.
17.Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenol oxidases inBetavulgaris[J].Plant Physiology,1949,24:1-15.
18.王文杰,李文馨,祖元刚,等.紫茎泽兰茎和叶片色素及叶绿素荧光相关参数对不同温度处理的响应差异[J].生态学报,2009,29(10):5424-5433.
Wang W J,Li W X,Zu Y G,et al.Differences in pigments and chlorophyll fluorescence parameters between stems and leaves ofEupatoriumadenophorumunder different temperature treatments[J].Acta Ecologica Sinica,2009,29(10):5424-5433.
19.Liu X Z,Huang B R.Photosynthetic acclimation to high temperatures associated with heat tolerance in creeping bentgrass[J].Journal of Plant Physiology,2008,165(18):1947-1953.
20.Lawlor D W,Cornic G.Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants [J].Plant,Cell and Environment,2002,25(2):275-294.
21.Cousins A B,Johnson M,Leakey A D B.Photosynthesis and the environment[J].Photosynthesis Research,2014,119(1-2):1-2.
22.Chaves M M,Flexas J,Pinheiro C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Annals of Botany,2008,103(4):551-560.
23.González-Cruz J,Pastenes C.Water-stress-induced thermotolerance of photosynthesis in bean(PhaseolusvulgarisL.) plants:the possible involvement of lipid composition and xanthophyll cycle pigments[J].Environmental and Experimental Botany,2012,77:127-140.
24.Mcdowell S C L.Photosynthetic characteristics of invasive and noninvasive species ofRubus(Rosaceae)[J].American Journal of Botany,2002,89(9):1431-1438.
25.Zheng Y L,Feng Y L,Lei Y B,et al.Comparisons of plastic responses to irradiance and physiological traits by invasiveEupatoriumadenophorumand its native congeners[J].Journal of Plant Physiology,2012,169(9):884-891.
26.Ozkur O,Ozdemir F,Bor M,et al.Physiochemical and antioxidant responses of the perennial xerophyteCapparisovataDesf.to drought[J].Environmental and Experimental Botany,2009,66(3):487-492.
27.Boureima S,Oukarroum A,Diouf M,et al.Screening for drought tolerance in mutant germplasm of sesame(Sesamumindicum) probing by chlorophyll a fluorescence[J].Environmental and Experimental Botany,2012,81:37-43.
28.许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241-244.
Xu D Q.Some Problems in stomatal limitation analysis of photosynthesis[J].Plant Physiology Communications,1997,33(4):214-244.
29.Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
30.杨帆,苗灵凤,胥晓,等.植物对干旱胁迫的响应研究进展[J].应用与环境生物学报,2007,13(4):586-591.
Yang F,Miao L F,Xu X,et al.Progress in research of plant responses to drought stress[J].Chinese Journal of Applied and Environmental Biology,2007,13(4):586-591.
31.Medrano H,Parry M A J,Socias X,et al.Long term water stress inactivates Rubisco in subterranean clover[J].Annals of Applied Biology,1997,131(3):491-501.
32.Lawlor D W.Limitation to photosynthesis in water-stressed leaves:stomata vs.metabolism and the role of ATP[J].Annals of Botany,2002,89(6):871-885.
33.Mueller-cajar O,Stotz M,Bracher A.Maintaining photosynthetic CO2fixation via protein remodelling:the RuBisCO activases[J].Photosynthesis Research,2013,119(1):191-201.
34.Long S P,Bernacchi C J.Gas exchange measurements,what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error[J].Journal of Experimental Botany,2003,54(392):2393-2401.
35.Kozaki A,Takeba G.Photorespiration protects C3plants from photooxidation[J].Nature,1996,384(6609):557-560.
36.Zhang C,Zhan D X,Luo H H,et al.Photorespiration and photoinhibition in the bracts of cotton under water stress[J].Photosynthetica,2016,54(1):12-18.
37.Zhuang T J,Sasaki S I,Ikeuchi T,et al.Natural-photosynthesis-inspired photovoltaic cells using carotenoid aggregates as electron donors and chlorophyll derivatives as electron acceptors[J].RSC Advances,2015,5(57):45755-45759.
38.Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation[J].New Phytologist,1993,125(1):27-58.
39.Ghobadi M,Taherabadi S,Ghobadi M E,et al.Antioxidant capacity,photosynthetic characteristics and water relations of sunflower(HelianthusannuusL.) cultivars in response to drought stress[J].Industrial Crops and Products,2013,50:29-38.
40.Liu C C,Liu Y G,Guo K,et al.Effect of drought on pigments,osmotic adjustment and antioxidant enzymes in six woody plant species in karst habitats of southwestern China[J].Environmental and Experimental Botany,2011,71(2):174-183.
41.Tambussi E A,Bartoli C G,Beltrano J,et al.Oxidative damage to thylakoid proteins in water stressed leaves of wheat(Triticumaestivum)[J].Physiologia Plantarum,2000,108(4):398-404.
42.Elsheery N I,Cao K F.Gas exchange,chlorophyll fluorescence,and osmotic adjustment in two mango cultivars under drought stress[J].Acta Physiologiae Plantarum,2008,30(6):769-777.
National Natural Science Foundation of China(31240015;31360090);Project of the Priority Academic Program Development of Jiangsu Higher Education Institutions(PAPD);Science and Technology Research Project of Education Ministry of Jiangxi Province(GJJ10689)
introduction:YAN Xiao-Hong(1977—),female,PhD student,senior experimentalist,mainly engaged in the research of plant ecophysiology.
date:2016-03-17
EffectsofDroughtStressonPhotosyntheticCharacteristicsinLeavesofInvasiveBidensfrondosaanditsNativeAssociatedLactucaindica
YAN Xiao-Hong1,2ZHOU Bing1HU Wen-Hai1WANG Ning1YIN Zeng-Fang2*
(1.School of Life Sciences,Jinggangshan University,Ji’an 343009;2.College of Biology and Environment,Nanjing Forestry University,Nanjing 210037)
We comparatively studied the changes of the gas exchange parameters including the maximum net photosynthetic rate(Pmax), light saturation point(LSP), dark respiratory rate(Rd), potential maximum photosynthetic rate(Amax), light photorespiration(RP), the maximum carboxylation rate of rubisco(Vcmax), the maximum rate of RuBP regeneration(Jmax) and the contents of photosynthetic pigments of invasiveBidensfrondosaand its native associatedLactucaindicato the drought stress including light drought stress(LD), moderate drought stress(MD), severe drought stress(SD) and normal irrigation(CK) in a greenhouse pot experiment. The variation trends of different parameters of two plants were in substantial agreement, however the changing amplitude for invasiveB.frondosawas significantly lower than that for its associatedL.indica, and even the aboveground part ofL.indicadied and couldn’t recover after rehydration under severe drought stress. Under drought stress, the main reason of the photosynthesis decrease was stomata limitation forB.frondosa, but non-stomata limitation forL.indica. Compared withL.indica,B.frondosahad higher respiration efficiency(RE), which was helpful for more accumulation of photosynthetic products, the higher light photorespiration(RP) could protect photosynthetic apparatus from harm, and it could hold higher abilities of photochemical reaction and carboxylation rate of RuBP under drought stress, maintaining higher photosynthetic ability. The responding trends of invasiveB.frondosaand its native associatedL.indicawere in substantial agreement, butB.frondosahad stronger extreme drought tolerance ability and watering revovery ability with better adaptation to drought, which would be helpful for its invasion.
invasive species;Bidensfrondosa;drought stress;photosynthetic characteristics;invasiveness
国家自然科学基金项目(31240015,31360090);江苏省高校优势学科建设项目(PAPD);江西省教育厅科学技术研究项目(GJJ10689)
闫小红(1977—),女,博士研究生,高级实验师,主要从事植物生理生态学方面的研究。
* 通信作者:E-mail:yinzengfang1966@126.com
2016-03-17
* Corresponding author:E-mail:yinzengfang1966@126.com
S685.26
A
10.7525/j.issn.1673-5102.2016.06.018
