烟草化学诱导表达系统的建立
2016-11-10代丽娟郑唐春刘彩霞由香玲曲冠证
代丽娟 郑唐春 刘彩霞 刘 轶 由香玲 曲冠证
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.东北林业大学生命科学学院,哈尔滨 150040)
烟草化学诱导表达系统的建立
代丽娟1郑唐春1刘彩霞1刘 轶1由香玲2*曲冠证1
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;2.东北林业大学生命科学学院,哈尔滨 150040)
化学诱导表达系统对植物功能基因的研究及植物基因工程应用有重要意义。XVE是以雌激素为基础的用于诱导转基因植物中目的基因表达的一种系统,能够在可调控方式下诱导基因的表达。目前,以烟草为遗传转化材料进行XVE系统研究的详细报道还未见发表。本文以烟草作为研究对象,利用PCR技术从本实验保存的质粒pROKII-GFP中扩增出GFP基因。构建雌激素诱导型植物表达载体(pER8-GFP)并利用农杆菌介导的叶盘法将外源基因导入野生型烟草中;经潮霉素抗性筛选出转化植株后,用PCR鉴定出阳性转化植株,将阳性转化植株利用不同浓度和不同时间的雌激素进行处理,并结合定量PCR和NightSHADE植物活体成像系统对转基因植株的表达水平进行检测。结果表明诱导pER8-GFP载体在烟草中表达的最适雌激素浓度为25 μmol·L-1,最适时间为48 h;同时在烟草胚轴与根尖细胞中检测到荧光信号,表明XVE化学诱导系统在烟草中也可以高效、严格的依赖雌激素的诱导来控制目的基因表达。本研究将为烟草相关的化学诱导表达研究提供技术支持与解决方案。
雌激素诱导;基因表达;XVE;烟草
植物转基因技术是研究植物基因功能强有力的工具。至今,转基因的策略已经从组成型表达策略转换成更精确的时空控制策略[1]。Zuo等[2]建立了一个基于ER的诱导系统,命名为XVE系统。在植物生物学研究和生物技术的应用中,化学诱导表达系统(XVE)在一个可调控方式下对于基因的表达是非常可取的。与组成型启动子相比,诱导型启动子在各种应用中提供了许多优点和潜力[3~5]。XVE是以雌激素为基础的用于诱导转基因物种目的基因表达的一种系统,属于嵌合式转录激活剂。它由3个转录单元组成,第一个转录单元是人工合成的G10-90强组成型启动子[6],它能调控XVE融合转录因子的转录。XVE由细菌阻遏物LexA的DBD(X),VP16的酸性反式激活结构域(V)和人雌激素受体调控区(E)所融合而成。第二个转录单元是选择性抗性标记基因;最后一个转录单元是最小-46 35S启动子与8拷贝的LexA操纵子融合来控制目的基因的转录[7]。XVE诱导系统仅受化学诱导剂(17-β-雌二醇)严格而特定的诱导和调控,对植物无毒害和生理影响,并且在无雌激素时,存在于细胞质中,目的基因不表达;雌激素存在时,与受体结合,进入细胞核内,结合到嵌合启动子上,激活下游基因的表达。因此,XVE系统是比较理想的操纵基因表达和研究基因功能的化学调控系统。
目前,XVE诱导系统已经在拟南芥[2,8~10]、长春花[11]、水稻[12~13]、柑橘[14]等植物的研究中被使用。在拟南芥中,Zuo等人[15~16]发现的这种高效的、严格依赖于动物雌激素诱导的植物表达系统(XVE),已经通过化学诱导激活系统成功发现并分离了AP2和AGAMOUS的等位基因,这为后期的筛选突变体和鉴定其功能奠定了基础。并且现已证明,XVE系统除严格依赖于雌激素外,还可根据雌激素的使用剂量来严格控制下游基因的表达水平[2]。李霞等[17]利用雌激素诱导Cre/loxP重组系统非常高效地实现了转基因烟草的无标记。同时,在水稻的研究中,Sreekala等[13]利用β-雌二醇诱导的Cre/loxP重组系统获得了无选择标记基因。李琳洁等[14]将XVE系统和Cre/loxP位点特异性重组系统用于无性繁殖的木本植物柑橘,以建立无选择标记转基因转化体系。李芳等[10]用雌二醇诱导表达的XVE启动子超量表达细胞周期蛋白CYCD3;1,结果表明该蛋白在拟南芥中的超量表达不仅能抑制初生根的伸长,而且还能抑制初生根对重力刺激的反应能力。这与前人用组成型超量表达研究CYCD3;1相比,能更好地对基因的功能进行定位。Xu等[11]将Bcl-2家族的一个哺乳类凋亡成员Bax转入长春花细胞中让其过表达,诱导表达后能够产生超敏反应,因此用来研究植物细胞体内在临床上产生的重要次生代谢产物。Petrasek等[18]利用XVE系统对PIN蛋白的功能进行了相应的研究。
综上所述,Zuo等[2]2000年建立的XVE系统是一种高效严格依赖于动物β-雌二醇诱导的植物表达载体,已经应用于植物基因功能研究的多方面。但以往对于烟草中的诱导表达系统的功能性研究尚不全面,到目前为止,关于雌激素诱导转基因烟草表达最适宜的诱导体系还未见报道。因此,本研究对烟草中XVE系统应答β-雌二醇诱导的模式进行了研究,以期建立一个实用型的烟草诱导表达系统。以GFP为报告基因,参照Zuo等[2]人的相关研究报道,利用qRT-PCR和NightSHADE植物活体成像系统对转基因植株在烟草中的表达特异性进行分析,来验证转基因烟草最佳的雌激素诱导浓度和时间,为以后进行烟草XVE系统应用研究提供了技术支持与理论依据。
1 材料与方法
1.1 试验材料
野生型烟草(NicotianatabacumL.)组培苗,由本实验室保存。
1.2 菌株及主要试剂
大肠杆菌感受态(Trans1-T1)购自Transgene biotech有限公司;农杆菌EHA105由本实验室保存;pROKII-GFP质粒为本实验室保存;pER8质粒,由东北林业大学李成浩教授惠赠;17-β-雌二醇,潮霉素(hygromycin,Hy),奇霉素(Spectinomycin,Spe)均购自Sigma公司;DNA marker DL5000、PCR相关试剂、限制性内切酶XhoⅠ和SpeⅠ、rTaq酶、ExTaq酶,DNA ligase kit,dNTP Mixture、SYBR® Premix ExTaqTMⅡ均购自TaKaRa公司(大连);EasyPure® Plant RNA Kit、Plasmid mini Kit I、Gel extraction kit均购自OMEGA生物技术公司(美国);其他实验试剂为进口或国产分析纯。
1.3 实验方法1.3.1 植物表达载体pER8-GFP的构建
以pROKII-GFP质粒为模板,利用引物GFP-XhoⅠ-F和GFP-SpeⅠ-R(表1)进行PCR扩增反应,反应程序:10×ExTaqPCR Buffer 5.0 μL,dNTP Mix(10 mmol·L-1)2.0 μL,Primer-F(10 μmol·L-1)2.0 μL,Primer-R(10 μmol·L-1)2.0 μL,ExTaq(5 U·μL-1)0.25 μL,pROKII-GFP质粒1.0 μL,加ddH2O至终体积50 μL。反应条件:95℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,35个循环;72℃ 7 min。PCR反应完成后,吸2 μL进行1%琼脂糖凝胶电泳分析。将得到的PCR扩增产物进行胶回收,然后用限制性内切酶XhoⅠ和SpeⅠ分别酶切目的片段和pER8载体,酶切体系:XhoⅠ 1.0 μL,SpeⅠ 1.0 μL,10×H buffer 2.0 μL,质粒1 μg,加ddH2O至终体积20 μL。反应条件:37℃ 2.5 h。酶切完成后用1%的琼脂糖凝胶电泳,用胶回收试剂盒回收酶切后的目的片段,然后进行目的片段连接重组,重组体系:Solution I 8.0 μL,pER8线性片段4.0 μL,GFP目的片段4.0 μL,终体积16 μL。16℃ 1 h,连接反应完成后,立即转化大肠杆菌Trans1-T1感受态细胞,涂布于含有奇霉素(Spe)的LB平板上培养,37℃过夜培养10~15 h。然后挑取单克隆进行菌液PCR验证,并将阳性转化子送博仕生物技术有限公司测序鉴定。最后采用液氮冻融法将pER8-GFP质粒转入农杆菌EHA105中,随机挑取单克隆进行菌液PCR验证转化子。
表1本实验中用到的引物(下划线:酶切位点)
Table1Primersusedinthisstudy(Underline:restrictionsite)

引物名称Primers引物序列Sequences用途UsageGFP⁃XhoⅠ⁃F5′⁃ATCCTCGAGATGGTGAGCAAGGGCGAGGAGC⁃3′GFP⁃SpeⅠ⁃R5′⁃ATCACTAGTTTACTTGTACAGCTCGTCCATGCC⁃3′GFP基因克隆CloningofGFPgenepER8⁃F5′⁃CATCCCCTCGACGTACTGTAC⁃3′GFP基因验证VerificationofGFPgeneGFP⁃RT⁃F5′⁃ACAACGTCTATATCATGGCCG⁃3′GFP⁃RT⁃R5′⁃GTGCTCAGGTAGTGGTTGTC⁃3′实时定量PCR检测RealtimeRT⁃PCRofGFPNtactin⁃RT⁃F5′⁃TGTGTTGGACTCTGGTGATG⁃3′Ntactin⁃RT⁃R5′⁃CGCTCGGTAAGGATCTTCATC⁃3′实时定量内参基因RealtimeRT⁃PCRofNtactin
1.3.2 烟草的遗传转化
参考Horsch等[19]的烟草遗传转化方法,并修改如下:将长势较好,生长大约20 d左右的野生型烟草(WT)叶片,切成约1 cm2×1 cm2大小放在MS培养基上培养,(25±2)℃、12 h·d-1光照下培养1 d;在超净工作台下,将EHA105[pER8-GFP]的菌种接种到20 mL含Spe抗生素的液体LB培养基中(50 mg·L-1Spe,50 mg·L-1Rif),28℃,180 r·min-1振荡培养至OD600=0.6~0.8;4 000 r·min-1离心5 min,浓缩菌体,让终浓度为OD600=0.2~0.3,即可作为侵染用菌液;然后,将预培养2 d的烟草叶片侵染3~7 min,放置在不含抗生素的分化培养基(MS+0.5 mg·L-16-BA+0.05 mg·L-1NAA)上培养,25±2℃下共培养2 d后,转置含有30 mg·L-1潮霉素(Hy)和500 mg·L-1特美汀的MS分化培养基上,直至分化出抗性芽。待芽长到约1 cm左右时,转置到MS生根培养基上培养备用。
1.3.3 转基因烟草的PCR检测
为筛选阳性转化子株系,用CTAB法提取筛选后T1代抗性植株叶片的DNA,并将其作为模板利用表1中引物进行PCR扩增。反应条件:95℃ 4 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 7 min,PCR反应完成后,取2 μL扩增产物,在1%琼脂糖凝胶中检测扩增结果。
1.3.4 化学诱导处理
诱导剂17-β-雌二醇溶于二甲基亚砜(DMSO)中,以1 mmol·L-1的储存液放于-20℃保存备用。将在不含诱导物的培养基上筛选获得的T2代生长10 d大的3个转基因株系的幼苗转移至含有雌激素(17-β-雌二醇)终浓度分别为0、0.008、0.04、0.2、1、5、25及50 μmol·L-1培养基中(含Hy)培养16 h。同时,也将筛选获得的T2代生长10 d大的3个转基因株系的幼苗分别在雌激素(17-β-雌二醇)终浓度为2 μmol·L-1培养基中分别培养0、0.5、1、3、6、12、24、48和96 h。设置3个生物学重复,快速用锡箔纸包好并作标记,立即置于液氮中,冻于-80℃冰箱中保存。
1.3.5 实时荧光定量PCR检测
利用EasyPure®Plant RNA Kit试剂盒分别提取经雌激素诱导处理的相同时间不同浓度及相同浓度不同时间的转基因株系烟草幼苗的总RNA。并通过PrimeScript® RT reagent Kit Perfect Real Time试剂盒将总RNA反转录为cDNA,将合成的第一链cDNA用ddH2O稀释10倍后用作模板。反应总体系为20 μL;10 μL SYBR Green,0.4 μL ROX Dye II,cDNA模板2 μL,正、反向引物各0.8 μL。引物如表1所示。以烟草Ntactin基因作为内参。反应程序为:95℃ 30 s;95℃ 5 s,60℃ 35 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品进行3次重复,并通过2-ΔΔCt法进行数据分析。
1.3.6 诱导植株的表达情况观察
为了进一步研究雌激素(17-β-雌二醇)对GFP基因诱导的表达情况,选取表达量较高的转基因植株用于荧光观察。将生长10 d大的幼苗在雌激素浓度为25 μmol·L-1培养基中培养48 h,然后,放置于载玻片上,在激光共聚焦显微镜下观察其叶片、胚轴和根尖的表达情况,同时,并将植株转移至NightSHADE植物活体成像系统中,选择Luminescence(发光检测),输出伪彩色图像,进而分析GFP基因的表达特异性,拍照保存。
2 结果与分析
2.1 植物表达载体pER8-GFP的构建
XVE载体的示意图如图1所示,为了研究这个系统,我们在XVE载体(pER8)的靶基因表达盒插入了一个cDNA编码的绿色荧光蛋白(GFP),具体构建步骤如下:利用PCR技术从pROKII-GFP载体中扩增出带有XhoⅠ和SpeⅠ酶切位点的目的片段(图2:A),利用限制性内切酶分别对PCR扩增出的目的片段和pER8载体双酶切(图2:B),酶切产物进行胶回收,然后用DNA ligase kit进行连接。随后,在含有Spe抗生素的平板上随机挑选8个转化子进行菌液PCR检验(图2:C),并将阳性转化子进行测序,结果表明插入序列未发生碱基突变,至此植物表达载体pER8-GFP构建完成。随后将pER8-GFP的质粒转入EHA105菌液中,随机挑取单菌落进行PCR验证(图2:D)。
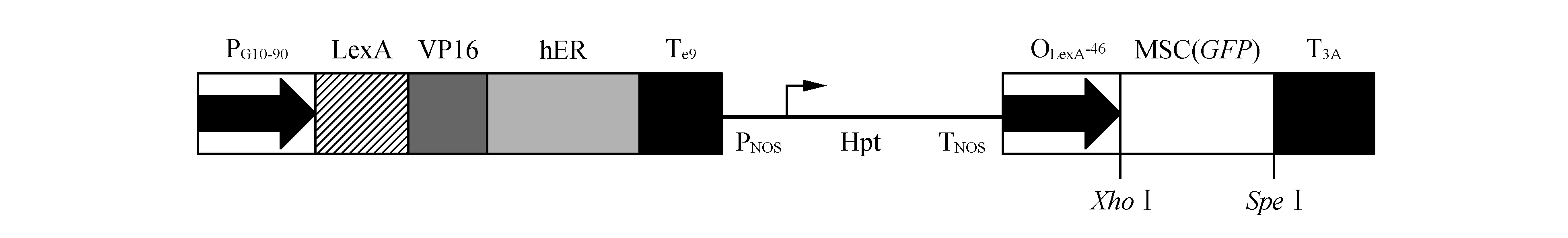
图1 XVE载体的示意图 PG10-90.组成型强启动子;LexA. DNA结合域;VP16.转录激活域;hER.人类雌激素受体调节域;TE9. rbcS E9 ploy(A)尾巴;PNOS.胭脂碱合酶启动子;Hpt.潮霉素抗性基因;TNOS.胭脂碱合酶终止子;OLexA. LexA操纵基因序列的8个拷贝;-46. -46 35S最小启动子;MCS.靶基因的多克隆位点;T3A. rbcsS 3A ploy(A)尾巴 箭头表示转录的方向Fig.1 Schematic of plant expression vector pER8 PG10-90. A strong constitutive promoter; LexA. DNA binding domain; VP16. Transcription activation domain; hER. Regulatory region of the human estrogen receptor; TE9. rbcS E9 ploy(A) addition sequence; PNOS. Nopaline synthase promoter; Hpt. Hygromycin resistance gene; TNOS. Nopaline synthase terminator; OLexA. Eight copies of the LexA operator sequence; -46. The -46 35S minimal promoter; MCS. Multiple cloning sites for target genes; T3A. rbcsS 3A ploy(A) addition sequence Arrows indicate the direction of transcription.

图2 植物表达载体pER8-GFP的构建 A.GFP基因的克隆:M. DNA marker DL5000;1. GFP基因的PCR产物 B.GFP片段和pER8载体的双酶切:M. DNA marker DL5000;1. PCR扩增产物的酶切结果;2. pER8载体的酶切结果 C.植物表达载体pER8-GFP菌液PCR产物:M. DNA marker DL5000;1~7. pER8-GFP转化子的菌液PCR检测;8.阴性对照 D. pER8-GFP在农杆菌中的菌液PCR验证:M. DNA marker DL5000;1~7. pER8-GFP转化农杆菌的菌液PCR产物;8.阴性对照Fig.2 The construction of pER8-GFP vector A. The cloning of GFP gene: M. DNA marker DL5000; 1. PCR product of GFP geneB. Double enzyme analysis of GFP fragments and pER8 vectors: 1. Digested result of GFP fragments; 2. Digested result of pER8 vector C. PCR products of plant expression vector pER8-GFP: M. DNA marker DL5000; 1~7. PCR detection of pER8-GFP transformants; 8. negative control D. PCR validation of pER8-GFP transformants in EHA105: M. DNA marker DL5000; 1~7. PCR products of pER8-GFP transformants in EHA105; 8. Negative control
2.2 pER8-GFP在烟草中的遗传转化及PCR鉴定
将生长大约3周左右的野生型烟草组培苗叶片切成约1 cm2×1 cm2大小,然后对烟草进行遗传转化。经过2 d的共培养后将叶片放入含有30 mg·L-1Hy的MS分化培养基上进行抗性筛选(图3:A),经过大约15 d左右的筛选,等抗性芽长出叶片后,将其切下放在含有抗生素的分化培养基上进行二次筛选分化(图3:B)。经过多次筛选后,将伸长至1 cm左右的茎段转移到生根培养基中,进行生根培养(图3:C)。待生根培养20 d后,提取不同株系的幼叶DNA,利用表1中的pER8-F和GFP-SpeⅠ-R引物进行PCR检测(图3:D)。最后,在所有抗性苗中共获得了12株转基因植株。

图3 pER8-GFP在烟草中的遗传转化及PCR鉴定 A.烟草叶片的抗性筛选;B.抗性芽的二次筛选;C.抗性芽的生根培养;D.抗性苗的PCR检测;M. DNA marker DL5000;1~12. 12株抗性苗的PCR产物;13.阴性对照Fig.3 Genetic transformation and identification of GFP in tobacco A. Resistance screening of tobacco leaves; B. Resistance screening of resistant buds; C. Rooting of resistant seedlings; D. PCR detection of resistant seedlings; M. DNA marker DL5000; 1~12. 12 PCR products of resistant seedlings; 13.Negative control
2.3 诱导植株的qRT-PCR检测
为了研究烟草GFP基因的诱导表达水平,分别提取不同浓度和不同时间用雌激素诱导处理的3个独立的转基因株系(L1、L2和L3)烟草幼苗的总RNA,利用qRT-PCR检测GFP基因的表达水平,结果如图4所示。不同浓度的雌激素诱导处理24 h后,3个转基因株系均对不同的诱导剂浓度处理产生应答反应,而未被诱导的转基因株系和野生型植株中没有检测到GFP的表达。此外,GFP在0.008 μmol·L-1的雌激素诱导下开始表达,至25 μmol·L-1时达到饱和,当继续增大诱导浓度,表达水平没有显著的增加(图4:A)。不同时间处理下,GFP的诱导表达随着处理时间的延长,表达量显著上调,但处理时间至48 h时达到最高水平,随后GFP的转录水平随着处理时间的延长开始下降(图4:B)。上述结果表明化学诱导表达系统pER8-GFP在烟草中表达的最适雌激素浓度为25 μmol·L-1,最适时间为48 h。

图4 GFP基因在烟草中对雌二醇的应答情况 A. GFP基因对雌二醇浓度的响应;B. GFP基因对雌二醇(浓度为2 μmol·L-1)时间的响应;35S-1,35S-2.两个独立的转基因株系(35S::GFP);WT.野生型Fig.4 Response of GFP gene to estradiol in tobacco A. Response of GFP gene to estradiol concentrations; B. Response of GFP gene to estradiol(concentration 25 μmol·L-1) times; 35S-1,35S-2. Two independent transgenic lines(35S::GFP); WT. Wild type
2.4 GFP基因在烟草中的诱导表达分析
为了进一步研究雌激素(17-β-雌二醇)对GFP基因诱导的表达情况,选取3个生长10 d左右在雌激素浓度为25 μmol·L-1培养基中培养48 h后的幼苗,放置于载玻片上进行镜检观察,均出现了相似的表达结果。图5则表明了转基因株系L3表达结果。结果表明GFP基因在叶片、胚轴和根尖均有较强的荧光(图5)。同时,将诱导后的幼苗转移至NightSHADE植物活体成像系统中,输出伪彩色图像,进而分析GFP基因的表达特异性。图6显示,在GFP基因烟草植株的下胚轴及根尖均有荧光信号检出,其中根尖区荧光信号最高。
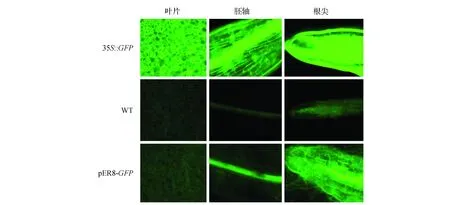
图5 雌二醇诱导转基因烟草中GFP表达 35S::GFP.阳性对照;WT.阴性对照;pER8-GFP.经雌二醇诱导的转基因植株Fig.5 Estradiol-induced GFP expression in transgenic tobacco 35S::GFP. Positive control; WT. Negative control; pER8-GFP. Transgenic plants induced by estradiol
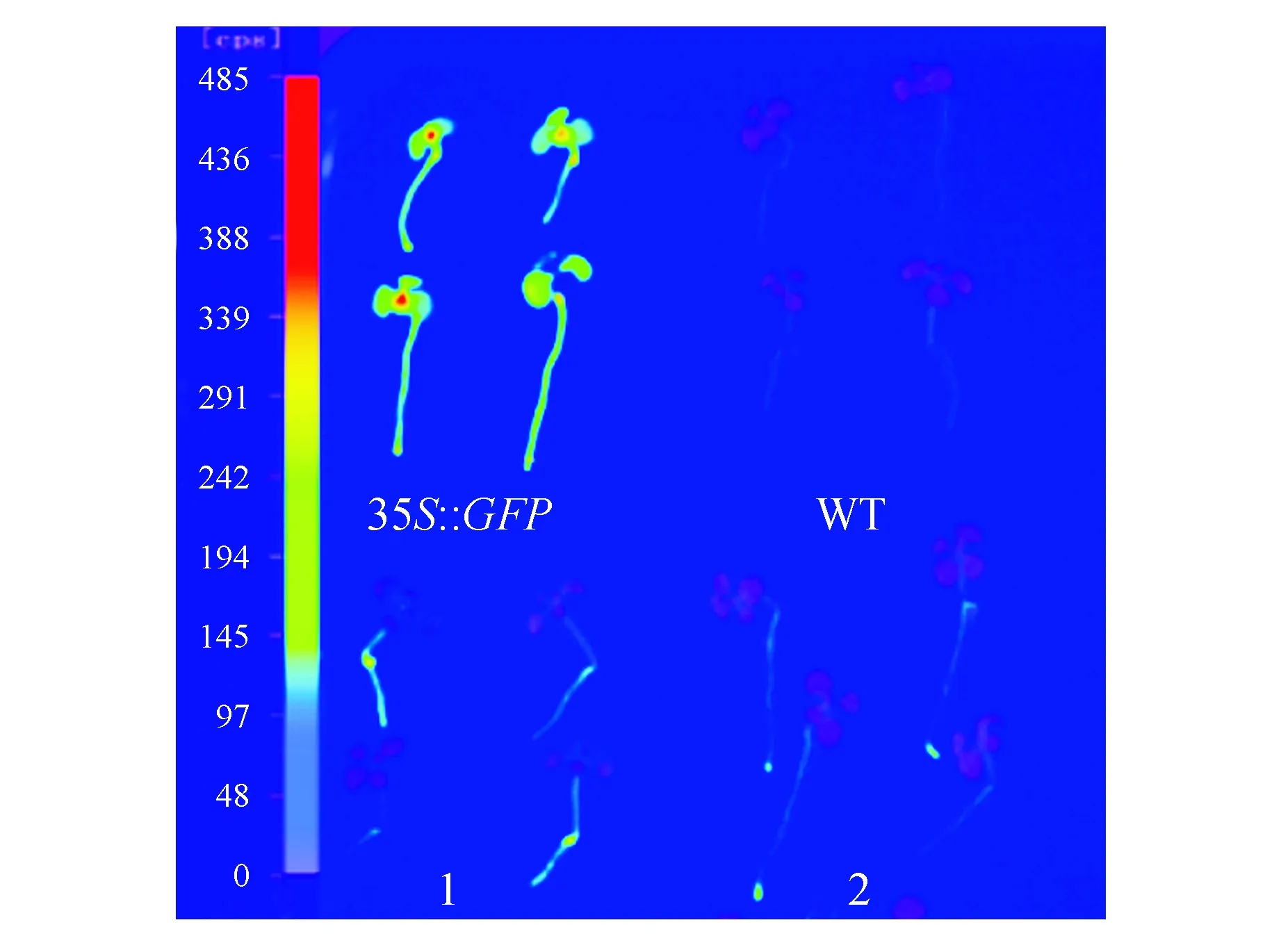
图6 GFP基因的表达特性分析 35S::GFP.阳性对照;WT.阴性对照;1,2.经雌二醇诱导的转基因株系Fig.6 Expression characteristics analysis of GFP gene 35S::GFP. Positive control; WT. Negative control; 1,2. Transgenic plants induced by estradiol
3 讨论
随着植物生物技术的发展,转基因技术以其巨大的应用价值,正逐步成为一种常规育种手段。传统方法是将目的基因在转基因植株中过量表达或抑制基因表达,但是组培过程中产生的体细胞自身突变或目的基因的随机插入都可能引起表型变化,进而干扰对目的基因的功能鉴定。化学诱导表达系统通过诱导处理与非诱导处理的对比,可以区分基因引起的表型变化的原因,方便、准确地鉴定研究基因的功能。诱导表达系统还可以解决组成型表达所引起的致死或不育等问题,经诱导后进而研究这些相关基因的功能。化学诱导表达系统具有广阔的应用范围,例如应用XVE化学调控系统的质粒pER8,Zuo等[2]建立的XVE化学诱导系统是对GVG诱导系统的改善,GVG在多种植物中都会引起生长缺陷。而XVE系统不存在与GVG相似的生长缺陷。本研究采用了相似的XVE诱导系统和Cre/loxP重组系统。Cre重组酶为雌激素诱导表达型,其启动子采用LexA+35S(-46区)启动区,LexA调控区受XVE蛋白的调控,在无雌激素的情况高效阻遏基因的表达,但有雌激素存在时,它与雌激素结合又可高效启动基因表达[8]。Zuo等2000年在拟南芥中研究证明,该化学诱导表达系统可用于改善转基因植物引起生长缺陷的问题[2]。Curtis[20]等使用XVE系统建立了的克隆载体用于植物中高通量基因功能分析。Zuo等[8,21~23]使用依赖雌二醇诱导的XVE系统激活标签,建立了拟南芥突变体库,获得大量拟南芥功能性突变体。Arroyo-Herrera等[24]利用该系统在转基因可可(Coffea canephora)中建立体细胞胚胎的重复发生和生产体系,并从可可的子叶中诱导产生异源分生组织;另外,Bruce等报道了另一个以ER为基础的诱导系统,利用ER-C嵌合因子,使两个转录因子CRC(C1和R的融合因子)和P过表达,进而鉴定出大量的下游靶基因[25]。此外,将XVE诱导系统用于转基因水稻的研究中却发现,基因不能在整株植株中表达,只能在根部才能检测到报告基因的表达,表明此系统在转基因水稻中经诱导剂诱导后表达不具有稳定性[26]。而与其相比,本文在转基因烟草中的研究所用的雌激素诱导的启动子能定时定量、严谨高效地表达报告基因,同时通过诱导与非诱导的转基因植株相比,排除了转基因操作本身对植株的影响,能更加清晰准确地研究烟草中XVE系统应答β-雌二醇诱导的模式。
目前,使用化学诱导系统的研究多集中在拟南芥等植物中,但以往对于烟草中的诱导表达系统的功能性研究尚不全面,到目前为止,关于雌激素诱导转基因烟草表达最适宜的诱导体系还未见报道。GFP是水母体内一种天然蛋白质,能在多种植物体内表达绿色荧光蛋白(green fluorescent protein,GFP),可以用来作为报告基因在活体细胞中进行图像分析[27]。在本研究中,我们用GFP基因作为报告基因进行XVE系统在烟草中的应用研究。首先,利用qRT-PCR技术对GFP基因在烟草中的表达特异性进行分析,验证转基因烟草最佳的雌二醇诱导浓度和时间。研究发现,雌激素浓度达到0.008 μmol·L-1时,目的基因开始表达,当雌激素浓度达到25 μmol·L-1时达到饱和。这个结果与早期研究的最适宜诱导浓度2 μmol·L-1略有不同,这可能是不同的物种之间存在的差异导致的。同时,GFP的转录在诱导48 h时达到最高水平,然后GFP的转录水平开始逐渐的下降。最后,我们采用NightSHADE植物活体成像系统对其进一步的分析。结果表明在转GFP基因的烟草植株胚轴和根尖均有荧光信号检出,但荧光信号弱于35S组成型启动子,这可能是由于XVE系统自身特点及雌激素浓度和处理时间上的差异所导致的。此外,转基因烟草根尖区荧光信号最高,这可能是因为根尖部位接触培养基中的雌激素,最先激活诱导表达有关。综上,通过本实验的初步研究,建立了适用于烟草转基因的XVE系统研究,筛选出在烟草中雌激素诱导的最佳诱导浓度和诱导时间,这为以后进行外源基因的可控性表达分析提供了依据。
1.Moore I,Samalova M,Kurup S.Transactivated and chemically inducible gene expression in plants[J].The Plant Journal,2006,45(4):651-683.
2.Zuo J R,Niu Q W,Chun N H.An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants[J].The Plant Journal,2000,24(2):265-273.
3.Gatz C.Chemical control of gene expression[J].Annual Review of Plant Physiology and Plant Molecular Biology,1997,48(4):89-108.
4.Gatz C,Lenk I.Promoters that respond to chemical inducers[J].Trends in Plant Science,1998,3(9):352-358.
5.Zuo J R,Niu Q W,Nishizawa N,et al.KORRIGAN,anArabidopsisendo-1,4-β-glucanase,localizes to the cell plate by polarized targeting and is essential for cytokinesis[J].The Plant Cell,2000,12(7):1137-1152.
6.Ishige F,Takaichi M,Foster R,et al.A G-box motif(GCCACGTGCC)tetramer confers high-level constitutive expression in dicot and monocot plants[J].The Plant Journal,1999,18(4):443-448.
7.Benfey P N,Ren L,Chua N H.Tissue-specific expression from CaMV 35S enhancer subdomains in early stages of plant development[J].EMBO Journal,1990,9(6):1677-1684.
8.Zuo J R,Niu Q W,Møller S G,et al.Chemical-regulated,site-specific DNA excision in transgenic plants[J].Nature Biotechnology,2001,19(2):157-161.
9.Sun J Q,Niu Q W,Tarkowski P,et al.TheArabidopsisAtIPT8/PGA22 gene encodes an isopentenyl transferase that is involved in De Novo cytokinin biosynthesis[J].Plant Physiology,2003,131(1):167-176.
10.李芳,许颖,张姣,等.超量表达细胞D型周期蛋白CYCD3;1影响拟南芥根的发育[J].植物生理学通讯,2008,44(3):431-435.
Li F,Xu Y,Zhang J,et al.Overexpression of D-type cyclin CYCD3;1 affects root development inArabidopsisthalianaL.[J].Plant Physiology Communications,2008,44(3):431-435.
11.Xu M J,Dong J F.Enhancing terpenoid indole alkaloid production by inducible expression of mammalian Bax inCatharanthusroseuscells[J].Science in China Series C:Life Sciences,2007,50(2):234-241.
12.Okuzaki A,Konagaya K I,Nanasato Y,et al.Estrogen-inducible GFP expression patterns in rice(OryzasativaL.)[J].Plant Cell Reports,2011,30(4):529-538.
13.Sreekala C,Wu L,Gu K,et al.Excision of a selectable marker in transgenic rice(OryzasativaL.)using a chemically regulated Cre/loxP system[J].Plant Cell Reports,2005,24(2):86-94.
14.李琳洁,杨莉,李芳,等.柑橘无标记转基因转化体系的建立[J].湖南农业大学学报:自然科学版,2010,36(6):649-652.
Li L J,Yang L,Li F,et al.Marker-free transgenic system ofCitrus[J].Journal of Hunan Agricultural University:Natural Sciences,2010,36(6):649-652.
15.Kang H G,Fang Y W,Singh K B.A glucocorticoid-inducible transcription system causes severe growth defects inArabidopsisand induces defense-related genes[J].The Plant Journal,1999,20(1):127-133.
16.Zhang S P,Chen L L,Goff S A.Regulation of gene expression by small molecules in rice[J].Novartis Foundation Symposium,2001,236:85-99.
17.李霞,翁海波,韩绍印,等.转基因植物高效删除标记基因的实用型双元转化载体[J].生物工程学报,2006,22(4):550-554.
Li X,Weng H B,Han S Y,et al.A novel binary vector to get marker-free transgenic plant[J].Chinese Journal of Biotechnology,2006,22(4):550-554.
18.Petrášek J,Mravec J,Bouchard R,et al.PIN proteins perform a rate-limiting function in cellular auxin efflux[J].Science,2006,312(5775):914-918.
19.Horsch R B,Fry J E,Hoffmann N L,et al.A simple and general method for transferring genes into plants[J].Science,1985,227(4691):1229-1231.
20.Curtis M D,Grossniklaus U.A gateway cloning vector set for high-throughput functional analysis of genes in Planta[J].Plant Physiology,2003,133(2):462-469.
21.张健,徐金相,孔英珍,等.化学诱导激活型拟南芥突变体库的构建及分析[J].遗传学报,2005,32(10):1082-1088.
Zhang J,Xu J X,Kong Y Z,et al.Generation of chemical-inducible activation tagging T-DNA insertion lines ofArabidopsisthaliana[J].Acta Genetica Sinica,2005,32(10):1082-1088.
22.Zuo J R,Niu Q W,Frugis G,et al.TheWUSCHELgene promotes vegetative-to-embryonic transition inArabidopsis[J].The Plant Journal,2002,30(3):349-359.
23.Wang X C,Niu Q W,Teng C,et al.Overexpression ofPGA37/MYB118 andMYB115 promotes vegetative-to-embryonic transition inArabidopsis[J].Cell Research,2009,19(2):224-235.
24.Arroyo-Herrera A,Gonzalez A K,Moo R C,et al.Expression of WUSCHEL inCoffeacanephoracauses ectopic morphogenesis and increases somatic embryogenesis[J].Plant Cell,Tissue and Organ Culture,2008,94(2):171-180.
25.Bruce W,Folkerts O,Garnaat C,et al.Expression profiling of the maize flavonoid pathway genes controlled by estradiol-inducible transcription factors CRC and P[J].The Plant Cell,2000,12(1):65-79.
26.程倩倩.水稻化学诱导表达系统的建立[D].福州:福建农林大学,2013.
Cheng Q Q.Development of chemical-inducible gene expression system in rice[D].Fuzhou:Fujian Agriculture and Forestry University,2013.
27.张俊莲,王蒂,张金文,等.用绿色荧光蛋白和洋葱表皮细胞检测拟南芥rd29A基因启动子活性的方法[J].植物生理学通讯,2005,41(6):815-819.
Zhang J L,Wang D,Zhang J W,et al.Determination of promoter activity ofrd29Agene ofArabidopsisthalianausing green fluorescent protein and onion epidermal cell[J].Plant Physiology Communications,2005,41(6):815-819.
Program for New Century Excellent Talents in University(No.NCET-12-0808);The National Natural Science Foundation of China(No.31370661)
introduction:DAI Li-Juan(1988—),female,master student,mainly engaged in the study of tree genetics and breeding.
date:2016-06-06
EstablishmentofAChemical-inducibleGeneExpressionSysteminTobacco
DAI Li-Juan1ZHENG Tang-Chun1LIU Cai-Xia1LIU Yi1YOU Xiang-Ling2*QU Guan-Zheng1
(1.State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040;2.College of Life Science,Northeast Forest University,Harbin 150040)
Chemical-inducible expression system is a powerful tool for plant functional genomics and plant genetic engineering applications. XVE is a chemical-inducible expression system using estrogen for chemical induction. The detailed report about XVE using tobacco as plant material was not available yet. In this study,GFPwas amplified from the plasmid pROKII-GFPthat was preserved in this experiment by PCR. Estrogen inducible plant expression vector(pER8-GFP) was constructed and transformed into wild-type tobacco byAgrobacterium-mediated leaf disc transformation. The positive transformants were screened with hygromycin followed by a further PCR identification. The transformants were induced with different concentrations and different times of estrogen. The expression ofGFPin transgenic tobacco was tested by using qRT-PCR and NightSHADE plantsinvivoimaging system, and the results showed that the best suitable concentration of estrogen which induced the expression of pER8-GFPin tobacco was 25 μmol·L-1, and the best suitable period was 48 h. At the same time, theGFPgene appeared in the hypocotyl and root tip cells of transgenic tobacco. It showed that the XVE chemical induction system in tobacco could also be used to control the expression of the target gene efficiently by the induction of estrogen. Our study will contribute to the XVE study of tobacco in future.
estradiol-inducible;gene expression;XVE;Nicotianatabacum
教育部新世纪优秀人才支持计划项目(No.NCET-12-0808);国家自然科学基金项目(No.31370661)资助
代丽娟(1988—),女,博士研究生,主要从事林木遗传育种研究。
* 通信作者:E-mail:yxiangling@yahoo.com
2016-06-06
* Corresponding author:E-mail:yxiangling@yahoo.com
Q943
A
10.7525/j.issn.1673-5102.2016.06.016
