野生扇脉杓兰植株生长特性及大孢子超微结构的研究
2016-11-10闫晓娜王彩霞
闫晓娜 田 敏 王彩霞 张 莹
(1.中国林业科学研究院亚热带林业研究所,富阳 311400; 2.国家林业局哈尔滨林业机械研究所,哈尔滨 150086; 3.浙江省林木育种技术研究重点实验室,富阳 311400)
野生扇脉杓兰植株生长特性及大孢子超微结构的研究
闫晓娜1,2田 敏1,3*王彩霞1张 莹1
(1.中国林业科学研究院亚热带林业研究所,富阳 311400;2.国家林业局哈尔滨林业机械研究所,哈尔滨 150086;3.浙江省林木育种技术研究重点实验室,富阳 311400)
为了解扇脉杓兰的生长特性,本研究以浙江省西天目山国家级自然保护区内的两个野生居群为试材,对其休眠芽形态结构、植株生长过程和胚珠发育等特征进行定期观察。结果表明:扇脉杓兰一个生长周期包括萌芽期、开花展叶期、结实期和衰亡期4个阶段,历时1年,以分株繁殖为主,有性生殖能力差。扇脉杓兰每个基株分化一个休眠芽,当年10月露出地面。充分发育的休眠芽产生花芽,第二年4月形成花结构;未充分发育的个体不能产生花芽,无生殖器官发育。胚珠超微结构显示:孢原细胞核占据多半的细胞空间,细胞质和细胞器丰富。大孢子母细胞位于珠孔端,细胞质中液泡、线粒体和质体分布密集。在大孢子囊中,液泡所占空间变大,细胞核相对变小,细胞质分布稀疏,细胞器以线粒体和质体为主,在胚珠发育阶段蛋白质和多糖一直存在,淀粉染色逐渐加深,无脂质存在。
扇脉杓兰;芽发育;生长周期;大孢子超微结构
兰科(Orchidaceae)是被子植物的第二大科,有花植物最大的科之一,在系统演化上属于最高级、最进化的类群,全世界约1 000属近20 000余种,广泛分布于全球除极端地区之外的陆地生态系统中,是生物多样性的重要组成部分[1]。杓兰属(CypripediumL.)植物花大艳丽,唇瓣大而显著,特化为深囊状,是兰科名贵的观赏属花卉之一[2]。扇脉杓兰(CypripediumjaponicumThunb.)是杓兰属温带地生兰,主要分布于中国陕西、浙江、安徽、江西、四川、台湾等地[3],境外仅见日本、韩国、缅甸有分布。扇脉杓兰植株挺拔,叶型圆润,花型独特,具有很高的观赏价值,同时其根状茎和带根全草入药,对治疗跌打损伤、祛风镇痛有显著疗效,是珍贵的野生药用和观赏植物[3~5]。
野外生境下,扇脉杓兰结实率仅为5%[6],有性生殖能力低下,主要依靠无性生殖繁衍后代。然而,由于自身更新能力差及生境的人为采挖破坏,野生扇脉杓兰居群数量锐减,分株繁殖已不足以维持其种群的稳定。目前,扇脉杓兰已被《国家重点保护野生植物(第二批)》列为一级保护植物,被世界自然保护联盟(IUCN)濒危物种红色目录列为“濒危”物种[7]。因此,开展野生扇脉杓兰植物资源的保育工作迫在眉睫。本研究通过对野生植株生长动态的观察,旨在揭示扇脉杓兰植株整个生长过程、芽发育、胚珠发育等特征,系统地掌握扇脉杓兰的生长特性,进一步了解野生植株的天然更新方式和有性生殖困难的原因,为野生扇脉杓兰的濒危保护和合理开发利用提供理论依据。
1 材料与方法
1.1 试验材料
供试材料选自浙江省临安市境内西天目山国家级自然保护区(119°23′47″~119°28′27″E,30°18′30″~30°24′55″N)内两个数量较多的野生扇脉杓兰居群,分别记为居群1、居群2。居群1约90株,地理坐标为东经119°25′35.2″,北纬30°18′30″,海拔1 033 m,主要伴生植物为牛蒡(Arctiumlappa)、箬竹(Indocalamustessellatus)等;居群2位于东经119°27′6.4″,北纬30°23′36.3″,海拔1 018 m,约50株,伴生有六角莲(Dysosmapleiantha)、交让木(Daphniphyllummacropodum)等。试验地属亚热带季风气候,年均降雨量为1 390~1 870 mm,空气相对湿度为76%~81%[6]。土壤成分以有机质为主,含氮、磷、钾等微量元素,土壤pH为4.45~5.38。
1.2 研究方法1.2.1 扇脉杓兰生长过程及芽形态观察
于2013年10~12月,每隔20天采集一次扇脉杓兰的休眠芽8~10个,对芽进行外观特征的观察和比较,并在Olympus SZ61型光学显微镜下进行解剖观察,再经过FAA固定过夜,采用石蜡切片法,在Olympus CX41型光镜下观察芽的显微结构并拍照。于2014年3月初,每隔10天对野生扇脉杓兰植株的生长动态进行观察和拍照,直至植株凋亡为止。
1.2.2 扇脉杓兰胚珠中大孢子超微结构的观察
2014年4月盛花期人工授粉之后,每10天采集一次发育过程中的果实4~6个,切成2~3 mm的小段,去掉果皮,置于2.5%戊二醛溶液中4℃下固定过夜,磷酸缓冲液冲洗3次后(每次间隔15 min),1%的锇酸溶液再固定1~2 h,再次用磷酸缓冲液冲洗3次,经梯度酒精脱水(30%,50%,70%,85%,95%,100%),环氧丙烷过渡,用树脂浸透和包埋。将处理好的样品先用玻璃刀作半薄切片(厚2 μm)以确定位置,再用钻石刀作超薄切片(厚80 nm),铜网收集,经醋酸双氧铀50%乙醇饱和溶液和柠檬酸铅双染,在Hitachi H-7650型透射电镜下观察、拍照。
1.2.3 胚珠组织化学成分的测定
组织化学染色方法参照《植物显微技术》[8]。将授粉后每隔10天采回的果实切成3~4 mm的小段,用FAA固定过夜,制作组织切片。多糖鉴定采用PAS反应(高碘酸-Schiff反应),颜色由无色变为紫红色;淀粉采用碘—碘化钾法,变为紫色;蛋白质亦采用碘—碘化钾法,药品配方与前者不同,含蛋白质的细胞呈现亮黄色;脂肪测定用苏丹Ⅲ,颜色变为橙黄色。
2 结果与分析
2.1 扇脉杓兰花芽形态及发育
扇脉杓兰根状茎沿土层方向平行生长,地下深度约10~15 cm。根状茎细长且分节,顶端长有一个休眠芽(图1:A)。休眠芽在当年植株枯落前开始生长,第一年10月中下旬露出地面,随后进入休眠状态,于第二年3~4月复苏生长。当年生休眠芽浅黄绿色(图1:B),有3~4层互生的芽鞘包被。在Olympus SZ61型光镜下观察芽的纵切面,可看到花芽呈乳白色,其左右对称分布着两块胶粘物质(图1:C),它们可能是花粉块的前身。第二年春季,休眠芽颜色逐渐变绿,并突破芽鞘(图1:D)。
同一时期的休眠芽在芽长等外观形态上略有差异(图1:E,F),这是不同个体对养分吸收和利用的潜力不同所导致的。通过石蜡切片观察当年生休眠芽显微结构,结果显示花芽由芽鞘包围,周围已分化出2~3枚幼叶,且解剖结构不随当年采样时间的推移而发生变化(图1:G,H),这说明随着气温下降,植株开始越冬休眠,花芽组织不再分化。
在当年同一采样时期,有些个体能充分发育产生花芽,而有的个体无花芽产生,只有鲜黄色的幼叶(图1:I,J)。花芽发育的个体幼叶在芽休眠之前逐渐转绿,而无花芽的个体幼叶颜色无明显变化(图1:K)。有无花芽的发育直接决定花器官能否形成,无花芽的植株最终只分化出扇形叶片,不能形成繁殖器官,更不能产生后代。

图1 扇脉杓兰的芽 A~B.休眠芽;C.芽纵切面;D.休眠芽转绿;E~F.同一时期芽形态比较;G~H.不同时期花芽显微结构;I~J.有花芽和无花芽的个体;K.有花芽的个体幼叶变绿Fig.1 Bud of C.japonicum A-B. Dormant buds;C. Longitudinal section of bud;D. Dormant buds turned green;E-F. Comparation of bud morphology at the same stage;G-H. Microstructure of buds at different stages;I-J. Individuals of buds and non-buds;K. The leave of individuals that have buds turned green
2.2 扇脉杓兰植株生长发育周期
野生扇脉杓兰主要通过分株的方式繁殖后代。与无距虾脊兰(Calanthetsoongiana)每个基株当年可形成多个分株不同[9],在扇脉杓兰一个生长周期内,每个基株根状茎上只有一个休眠芽发育,有花芽分化的休眠芽在翌年春天抽葶开花并结果,随后果实衰老开裂,叶片枯萎,种子散尽。随着根状茎上新芽的分化,一个新的生长周期开始。
通过对野生植株生长发育特征的观察,扇脉杓兰大致可分为萌芽期、开花展叶期、结实期和衰亡期4个生长阶段。
(1)萌芽期:从当年10月开始到次年4月初,根状茎上的休眠芽伸长生长并露出地面(图1:B),经过一个冬季的休眠,芽在3~4月继续生长,颜色由浅黄绿色变为嫩绿色(图1:D)。含有花芽的植株向上生长,随后形成花、果等生殖结构,不含花芽的个体成熟期只有叶片发育,不能产生生殖器官。在植株生境范围内,未发现有实生幼苗的存在,当年种子散落后无萌发迹象。
(2)开花展叶期:次年4~5月,芽鞘逐渐脱落,花芽周围包裹的幼叶裸露在外(图2:A)。展叶初期,外部的2枚幼叶从底部逐渐向四周展开,叶片纵横径快速增长。随着展叶的进行,花芽在叶内侧形成花蕾,单花花蕾与叶片近等高,由浅绿色的花萼和花瓣包被,先端呈闭合状态[6](图2:B)。展叶中期,叶片开展角度逐渐增大,花梗伸长,花蕾膨大,叶状花苞片逐渐开展,单花花序俯垂,其水平位置高于叶片,此时茎基部也略见伸长生长(图2:C)。展叶末期,茎生长显著,直立挺拔,扇形叶生长达到最大程度,位于整个植株近中部,2枚叶近对生,水平开展角度近180°,扇形辐射状叶脉直达叶边缘。花梗和子房生长,顶生单花开放,2枚花瓣位于唇瓣的两侧,披针形,花瓣基部有紫色斑点分布(图2:D)。未充分发育形成花芽的植株在展叶期结束也无花器官的形成(图2:E)。
(3)结实期:次年6~8月,子房逐渐膨大形成果实。扇脉杓兰花期持续14天左右[10],在盛花期授粉后,子房开始增粗伸长,随后花完全枯萎(图2:F)。授粉后前20天,子房进入迅速增长期,初期果实为浅绿色(图2:G),随着果实体积的逐渐增长,成熟期蒴果深绿色,具果棱(图2:H)。
(4)衰亡期:9~10月,果皮细胞木栓化,果实由深绿色变为褐色[6],果棱开裂,深棕色种子散出。叶片老化,枯黄脱落,植株衰亡(图2:I)。
自然状态下,扇脉杓兰植株一个生长周期历时1年,以分株繁殖的方式维持种群的更替,种子繁殖能力差。每一基株上的休眠芽不能全部发育为花器官,从萌芽阶段起就导致了部分个体不具有生殖发育的能力。
2.3 扇脉杓兰胚珠中大孢子超微结构的变化
扇脉杓兰子房壁上着生成千上万个胚珠,成熟时发育为大量的种子。胚珠是雌性生殖细胞形成的场所。在大多数兰科植物中,授粉作用可启动大孢子发生过程[11]。扇脉杓兰授粉后胚珠原基开始发育,珠心细胞经过减数分裂和有丝分裂过程,最终形成8核成熟胚囊,具体发育时间段见表1。
表1扇脉杓兰授粉后胚珠发育各阶段
Table1Post-pollinationdevelopmentaleventsinovulesofC.japonicum
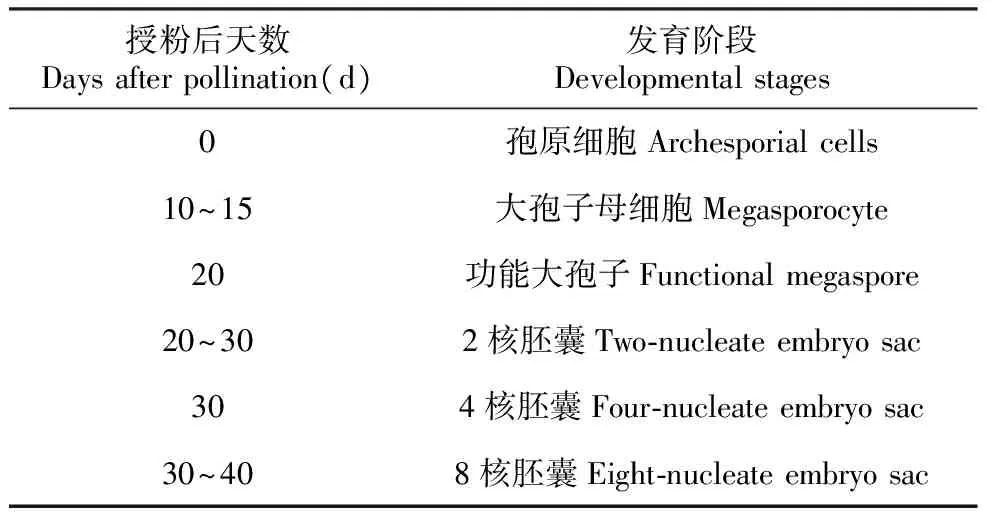
授粉后天数Daysafterpollination(d)发育阶段Developmentalstages0孢原细胞Archesporialcells10~15大孢子母细胞Megasporocyte20功能大孢子Functionalmegaspore20~302核胚囊Two⁃nucleateembryosac304核胚囊Four⁃nucleateembryosac30~408核胚囊Eight⁃nucleateembryosac
扇脉杓兰胚珠中大孢子超微结构显示:授粉当天,胚珠原基细胞代谢旺盛,孢原细胞位于胚珠原基的顶端且有一层表皮细胞包围,细胞呈长方形,体积较其他细胞大,细胞核占据大部分的细胞空间,核仁结构明显。与细胞核相对的一端细胞质丰富,内含一个大液泡和多种细胞器(图3:A)。细胞核周围也分布着密集的细胞质,质体、线粒体、内质网等细胞器含量丰富,液泡较为缺乏(图3:B),这一时期细胞分裂旺盛,细胞器种类多,线粒体为细胞代谢提供充足的能量。
授粉后10~20 d,孢原细胞进一步分裂(图3:C),生成的细胞最后只有一个形成大孢子母细胞。大孢子母细胞呈不规则菱形,位于珠孔端,核仁逐渐消失,核膜尚存。合点端液泡含量丰富,分布着大量线粒体和质体(图3:D),这为大孢子的活动提供了充分的养料和能源。此后,大孢子母细胞经过两次减数分裂,最终只有一个细胞形成功能大孢子,其余三个细胞退化。功能大孢子细胞质空间内分布大量质体,质体上逐渐积累淀粉粒(图3:E),成为主要的贮藏物质。在大孢子囊中,液泡所占细胞空间逐渐变大,细胞核相对较小,细胞质分布稀疏,内含丰富的线粒体和质体(图3:F),细胞代谢旺盛,为随后的胚囊发育奠定了物质条件。组织化学成分分析显示,在大孢子发生的过程中蛋白质和多糖一直存在,无脂质成分,淀粉染色逐渐加深且集中在细胞膜周围,这与超微结构质体分布区域一致。细胞内稳定的化学成分组成保证了代谢过程中充足的营养物质供给,这对大孢子母细胞充分发育最终生成雌配子体至关重要。
3 讨论
3.1 花芽发育
花芽是花分化的早期形态,是植物从营养生长向生殖生长的转折点。野生扇脉杓兰的芽着生于根状茎顶端,分节处基本无芽宿生。休眠芽越冬后开始分化,只有部分个体充分发育成花芽,它们可以进行生殖生长;而未充分发育的芽只能分化出叶片,随植株衰老而枯落。这种花芽发育的差异现象可能是自然状态下养分和空间的限制所导致的。群体内发生选择性败育现象,优势个体能够适应生境,充分利用营养和空间产生花芽,而其他个体则发育不良。只有部分植株可产生生殖器官,这严重影响了扇脉杓兰的结实量。黄花杓兰(Cypripediumflavum)虽然也是濒危物种,但其花芽生殖机制对生境适应性更强。在黄花杓兰根状茎上每节有一个芽,翌年分化为充分发育的二年芽和未充分发育的二年芽,此时又有新的一年芽产生和多年休眠芽宿存,这3种花芽发育途径同时进行,体现了植物适应环境的灵活性[12]。
3.2 植物生长周期
扇脉杓兰一个生长周期包括萌芽期、开花展叶期、结实期和衰亡期4个阶段,历时1年,生长各
阶段与季节变化相适应。地上部分借助根状茎进行营养繁殖,根状茎皮层发达,富含淀粉粒,是营养物质的储备场所[13]。虽然每一个生长周期内都有新的分株产生,但是,扇脉杓兰每个基株只产生一个休眠芽,且休眠芽不能全部发育为具有生殖器官的个体,这就导致了在有限的居群个体数量范围内有性繁殖能力的减弱。在杏黄兜兰(Paphiopedilumarmeniacum)中,既可营养繁殖也可种子繁殖,其中分蘖芽形成的分株较为持久,与母株连接较为紧密,而根状茎形成的分株较为短暂,因为根状茎繁殖需要良好的资源和条件,其代价就是母株的死亡[14]。扇脉杓兰就是以根状茎的形式分株,在母株彻底衰亡前分株已开始萌芽,其分株通过营养生长所积累的能量和物质最终是要最大限度的实现有性生殖的成效。
扇脉杓兰开花期唇瓣深囊状,为传粉昆虫提供了驻足空间。孙海芹等[15]研究认为,扇脉杓兰主要的传粉昆虫是熊峰。刘芬等[10]对天目山地区扇脉杓兰繁育系统的研究中发现,其自然结实率较低,而人工授粉后自交和异交均亲和,且结实率大大提高,说明该地区传粉过程受限制或缺少有效的传粉者。传粉的成败直接决定种子能否形成,因此,在盛花期进行人工授粉将有助于推进扇脉杓兰野生植株的生殖发育过程。
3.3 胚珠发育
胚珠中形成的成熟胚囊是有性繁殖的雌配子体,其结构发育的程度直接影响雌性细胞的生成、花粉管伸长和受精作用。扇脉杓兰大孢子超微结构显示,有些细胞发育不完全,核结构扭曲紊乱或产生空腔,但这些异常细胞占总数的比重较小,不影响胚珠的正常发育。刘芬等[6]对扇脉杓兰胚囊结构进行显微观察发现,雌配子体形成过程中胚囊发生败育,败育率为12%,属于正常的败育频率。可见,扇脉杓兰雌配子败育不是导致种子败育和有性生殖困难的直接原因。
在大孢子发生过程中,细胞骨架和内含物质也相应地发生变化。墨兰(Cymbidiumsinense)大孢子发生和雌配子形成过程伴随着微管系统的重组,在初始发育阶段,微管系统分布在皮层下部和细胞质中,随后微管结构重组,并逐渐向细胞核周围靠拢,合点端的微管较珠孔端分布密集,这使得大孢子母细胞产生极性[16]。有一些植物的孢原细胞起大孢子母细胞的作用,细胞质在大孢子母细胞形成过程中的改组被认为是孢子体向配子体转化的信号[17]。在五唇兰(Doritispulcherrima)功能大孢子壁上存在发达的胞间连丝,它是物质交换和信息交流的重要通道[18]。而在扇脉杓兰大孢子发育过程中,未见胞间连丝,也没有微管系统,细胞骨架组成简单,细胞质不停地发生重组,细胞器种类和含量也不断变化。细胞内大量的线粒体以及蛋白质和多糖等营养物质维持着细胞生命进程。
综上所述,野生扇脉杓兰的更新方式以根状茎分株繁殖为主,在一个生长周期内分株萌生休眠芽,母株凋亡,休眠芽是个体发育的起点,经过展叶、开花、结实等完成生长过程。虽然扇脉杓兰具有有性生殖和无性生殖两种繁殖方式,但有性生殖能力较差,自然结实率低。作为有性生殖的补偿机制,无性繁殖保证了物种的繁衍[19~20]。休眠芽充分发育形成花芽是有性生殖的先决条件,但是扇脉杓兰的休眠芽不能全部产生生殖器官,这就导致了部分植株有性生殖困难。胚珠作为雌配子的载体发育正常,花粉发育和受精过程良好[21],但所形成的种子只能发育到球形胚时期,不再进一步分化[6],导致扇脉杓兰种子大量败育。鉴于扇脉杓兰的濒危现状,应首先考虑就地保护,使其生境免遭破坏,保证无性繁殖的延续,再进一步探索促进种子繁殖的有效方法。
1.陈心启,吉占和.中国兰花全书[M].北京:中国林业出版社,2003:1-3.
Chen X Q,Ji Z H.The orchids of China[M].Beijing:China Forestry Publishing House,2003:1-3.
2.陈俊愉.中国花卉品种分类学[M].北京:中国林业出版社,2001:287-288.
Chen J Y.Systematics for Chinese flower cultivars[M].Beijing:China Forestry Publishing House,2001:287-288.
3.郎楷永.中国植物志[M].北京:科学出版社,1999:41-42.
Lang K Y.Flora reipublicae popularis sinicae[M].Beijing:Science Press,1999:41-42.
4.林泉.浙江植物志[M].杭州:浙江科学技术出版社,1993:489-490.
Lin Q.Flora of Zhejiang[M].Hangzhou:Zhejiang Science and Technology Press,1993:489-490.
5.丁炳扬,李根有,傅承新,等.天目山植物志[M].杭州:浙江大学出版社,2010:225-227.
Ding B Y,Li G Y,Fu C X,et al.Flora of Tianmu mountain[M].Hangzhou:Zhejiang University Press,2010:225-227.
6.刘芬,田敏,王彩霞,等.扇脉杓兰果实生长动态及胚胎发育过程观察[J].植物资源与环境学报,2012,21(1):28-35.
Liu F,Tian M,Wang C X,et al.Observation on fruit growth dynamics and embryo development process ofCypripediumjaponicum[J].Journal of Plant Resources and Environment,2012,21(1):28-35.
7.Rankou H.Cypripediumjaponicum.The IUCN red list of threatened species[EB/OL].2014,http://www.iucnredlist.org.
8.李和平.植物显微技术[M].北京:科学出版社,2009:106-109.
Li H P.Plant microtechnique [M].Beijing:Science Press,2009:106-109.
9.连静静,钱鑫,王彩霞,等.中国特有植物无距虾脊兰生物学特性及花部形态观察[J].植物资源与环境学报,2013,22(3):100-106.
Lian J J,Qian X,Wang C X,et al.Observation of biological characteristics and floral morphology of Chinese endemic speciesCalanthetsoongianaTang et Wang[J].Journal of Plant Resources and Environment,2013,22(3):100-106.
10.刘芬,李全健,王彩霞,等.濒危植物扇脉杓兰的花部特征与繁育系统[J].林业科学,2013,49(1):53-60.
Liu F,Li Q J,Wang C X,et al.Floral characteristics and breeding systems of an endangered speciesCypripediumjaponicum[J].Scientia Silvae Sinicae,2013,49(1):53-60.
11.Tsai W C,Hsiao Y Y,Pan Z J,et al.The role of ethylene in orchid ovule development[J].Plant Science,2008,175(1):98-105.
12.翁恩生,胡虹,李树云,等.黄花杓兰的花芽发育[J].云南植物研究,2002,24(2):222-228.
Weng E S,Hu H,Li S Y,et al.Differentiation of flower bud ofCypripediumflavum[J].Acta Botanica Yunnanica,2002,24(2):222-228.
13.钱鑫,李全健,连静静,等.珍稀植物扇脉杓兰营养器官的解剖学研究[J].植物研究,2013,33(5):540-545.
Qian X,Li Q J,Lian J J,et al.Vegetative anatomy of the rare plantCypripediumjaponicumThunb.[J].Bulletin of Botanical Research,2013,33(5):540-545.
14.刘仲健,刘可为,陈利君,等.濒危物种杏黄兜兰的保育生态学[J].生态学报,2006,26(9):2791-2800.
Liu Z J,Liu K W,Chen L J,et al.Conservation ecology of endangered speciesPaphiopedilumarmeniacum(Orchidaceae)[J].Acta Ecologica Sinica,2006,26(9):2791-2800.
15.孙海芹.独花兰和扇脉杓兰的传粉生态学[D].北京:中国科学院研究生院,2005.
Sun H Q.Pollination ecology of two sympatric orchids,ChangnieniaamoenaandCypripediumjaponicum[D].Beijing:University of Chinese Academy of Sciences,2005.
16.Zee S Y,Ye X L.Changes in the pattern of organization of the microtubular cytoskeleton during megasporogenesis inCymbidiumsinense[J].Protoplasma,1995,185(3):170-177.
17.丁常宏.被子植物大孢子发生的超微结构研究[J].牡丹江师范学院学报:自然科学版,2006(4):3-4.
Ding C H.Ultrastructure of megasporogenesis in angiosperms[J].Journal of Mudanjiang Normal University,2006(4):3-4.
18.伍成厚,李冬妹,梁承邺,等.五唇兰大孢子发生的超微结构观察[J].热带亚热带学报,2005,13(1):45-48.
Wu C H,Li D M,Liang C Y,et al.Ultrastructural observations on megasporogenesis inDoritispulcherrima(Orchidaceae)[J].Journal of Tropical and Subtropical Botany,2005,13(1):45-48.
19.Sun H Q,Cheng J,Zhang F M,et al.Reproductive success of non-rewardingCypripediumjaponicumbenefits from low spatial dispersion pattern and asynchronous flowering[J].Annals of Botany,2009,103(8):1227-1237.
20.Bae K H,Choi Y E.The effect of pollination on fruit formation and in vitro culture ofCypripediumjaponicumThunb.seeds[J].Propagation of Ornamental Plants,2013,13(1):12-18.
21.闫晓娜,田敏,王彩霞.扇脉杓兰花粉超微结构及花粉管生长的观察[J].西北植物学报,2014,34(12):2439-2445.
Yan X N,Tian M,Wang C X.Ultrastructure of pollen and observation on pollen tube growth inCypripediumjaponicum[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(12):2439-2445.
National Natural Science Foundation of China “Studies on conservation biology of endangered speciesCypripediumjaponicumThunb”(31370553)
introduction:YAN Xiao-Na(1989—),female,Master,Assistant Engineer,mainly engaged in seed biology research of trees.
date:2016-05-18
PlantGrowthCharacteristicsandUltrastructureofMegasporeoftheWildCypripediumjaponicum
YAN Xiao-Na1,2TIAN Min1,3*WANG Cai-Xia1ZHANG Ying1
(1.Research Institute of Subtropical Forestry,Chinese Academy of Forestry,Fuyang 311400;2.Harbin Research Institute of Forestry Machinery,the State Forestry Administration,Harbin 150086;3.Key Laboratory of Tree Breeding of Zhejiang Province,Fuyang 311400)
We used two wild populations ofCypripediumjaponicumfrom West Tianmu Mountain National Nature Reserve in Zhejiang Province to study the growth characteristics ofC.japonicum. The dormant bud morphology, plant growth process and ovule development were observed regularly. The growth cycle ofC.japonicumcomprised budding, flowering and leaf stage, fruiting and decline stage, which lasted for one year. The division propagation was the main reproductive pattern, and the sexual reproduction was poor. Each plant ofC.japonicumproduced a dormant bud which grew above the ground within the first year of October. Dormant buds that developed fully would flower within the second year of April. While, dormant buds which could not develop well only produced fan-shaped leaves in the second year, and there were no floral organs. Ultrastructure of ovules showed that the archesporial cell’s nucleus occupied most of the space, with dense cytoplasm and organelles. Megasporocyte located at the micropyle end, and the vacuoles, mitochondria and plastids densely distributed. In megasporangium, vacuole occupied a large space, and the nucleus was relatively small, with sparse cytoplasm and organelles. Mitochondria and plastids were visible. During the ovule developmental stage, protein and polysaccharide existed all the way. The staining of starch gradually deepened, without the presence of lipids.
Cypripediumjaponicum;bud development;growth cycle;ultrastructure of megaspore
国家自然科学基金“濒危植物扇脉杓兰的保护生物学研究”(31370553)
闫晓娜(1989—),女,硕士,助理工程师,主要从事林木种子生物学研究。
* 通信作者:E-mail:tmin115@163.com
2016-05-18
* Corresponding author:E-mail:tmin115@163.com
S682.31
A
10.7525/j.issn.1673-5102.2016.06.006
