乙肝表面抗原阴性恶性肿瘤患者化疗后乙肝病毒再激活的影响因素
2016-11-10蒋雪花陈志勇
杨 阳,魏 燕,蒋雪花,陈 坚,陈志勇,杨 龙
乙肝表面抗原阴性恶性肿瘤患者化疗后乙肝病毒再激活的影响因素
杨 阳1,魏 燕2,蒋雪花1,陈 坚2,陈志勇1,杨 龙1
目的 探讨乙肝表面抗原(hepatitis B surface antigen,HBsAg)阴性恶性肿瘤患者化疗后乙肝病毒(hepatitis B virus,HBV)再激活的相关危险因素。方法 收集2006-01至2014-12在武警上海总队医院接受化疗的HBsAg阴性恶性肿瘤患者570例。根据化疗后HBV是否出现再激活将患者分为再激活组25例及未被激活组545例,回顾性分析两组患者一般情况、化疗方案及实验室检查指标,对HBV再激活的潜在影响因素进行χ2检验及Logistic回归分析。结果 单因素分析表明两组患者在性别、乙肝表面抗体状态、e抗体状态、核心抗体状态及是否使用免疫抑制药方面差异有统计学意义(P<0.05),将其纳入多因素非条件Logistic回归分析,结果提示男性(OR=7.700,P<0.001)、乙肝表面抗体阴性(OR=0.056,P<0.001)、核心抗体阳性(OR=4.670,P<0.01)及使用免疫抑制药(OR=7.978,P<0.01)是导致化疗后HBV再激活的独立危险因素。结论 对于男性、乙肝表面抗体阴性、核心抗体阳性及使用免疫抑制药的HBsAg阴性的恶性肿瘤患者行化疗时,应密切监测HBV是否出现再激活或及早采取抗病毒治疗防止HBV再激活。
乙肝表面抗原;恶性肿瘤;化疗;乙肝病毒;再激活
化疗后乙肝病毒(hepatitis B virus,HBV)再激活是引起化疗后肝损伤的重要因素之一,重症者可表现为肝衰竭甚至死亡,因此,目前临床上对于乙肝表面抗原(hepatitis B surface antigen,HBsAg)阳性的恶性肿瘤患者化疗后HBV再激活的问题已经得到了广泛的重视。近年来,国外已有多项研究表明,无论是对于HBsAg阳性的恶性实体肿瘤患者[1-5],还是HBsAg阳性的血液系统恶性肿瘤患者[6-8],化疗期间预防性抗乙肝病毒治疗都可以有效地减少HBV再激活,从而降低肝损伤的发生率;国内关于这方面的几项研究也得到了相似的结论[9,10];而关于HBsAg阴性的恶性肿瘤患者化疗后HBV再激活的临床资料目前还比较缺乏。国外已有零星报道[11,12],但总体来说对于HBsAg阴性的恶性肿瘤患者化疗前是否应行抗HBV治疗尚存在许多争议。本研究回顾性分析了570例HBsAg阴性恶性肿瘤患者化疗后HBV再激活的影响因素,旨在为临床工作提供更多循证医学依据。
1 资料与方法
1.1 资料来源 收集2006-01至2014-12于我院肿瘤科及感染科就诊的570例资料。纳入标准:(1)原发恶性肿瘤均经病理学检查确诊,包括肺癌、结直肠癌、胃癌、宫颈癌及鼻咽癌等;(2)HBsAg阴性患者,血清HBV DNA<500 U/ml;(3)临床相关资料完整;(4)化疗次数大于4次,末次化疗日期距患者死亡时间超过3个月。排除标准:(1)既往曾行抗病毒、化疗或放射治疗;(2)合并慢性肝病包括丙型肝炎、丁型肝炎、自身免疫性肝病、胆汁淤积性肝硬化、乙醇性肝病及人类免疫缺陷病毒(human immuno deficiency virus,HIV)感染。
1.2 治疗方法 所有患者均行全身静脉化疗,采用的化疗药有顺铂、卡铂、奥沙利铂、多西他赛、氟尿嘧啶、希罗达、阿霉素及泼尼松等。所有患者治疗前均行血常规及肝肾功能等检测排除化疗禁忌证,化疗过程中定期检测患者血常规、肝功能、乙肝血清标志物及血清HBV DNA等相关检查,末次化疗结束后3个月内患者每月至医院行上述指标检测,肝功能出现异常即行保肝治疗。
1.3 观察指标 采用回顾性的方法,收集患者性别、年龄、原发肿瘤部位、化疗方案等一般资料,以及化疗前至化疗后3个月内血清乙肝标志物、血清HBV DNA水平。HBV再激活定义为血清HBsAg转阳或血清HBV DNA由不可测变为可测[13]。
1.4 统计学处理 采用SPSS 17.0统计软件进行分析,计数资料采用绝对数和百分率表示,采用χ2检验及Logistic回归分析相关危险因素,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 共纳入570例患者,其中男263例,女307例;年龄38~62岁,中位年龄45.9岁;肺癌157例,结直肠癌46例,胃癌117例,宫颈癌130例,鼻咽癌83例,其他恶性肿瘤37例。根据化疗后HBV是否再激活将患者分为再激活组25例及未激活组545例。
2.2 单因素分析结果 再激活组与未激活组在年龄、原发肿瘤部位、是否联用化疗药物、化疗疗程、是否使用免疫调节药方面差异无统计学意义,但在性别、乙肝表面抗体状态、e抗体状态、核心抗体状态及是否使用免疫抑制药方面,差异有统计学意义(P<0.05,表1)。

表1 乙肝表面抗原阴性恶性肿瘤患者化疗后乙肝病毒是否再激活两组患者一般资料 (n;%)
2.3 多因素分析结果 将单因素分析结果有统计学差异的自变量进行非条件Logistic回归分析,结果提示男性、表面抗体阴性、核心抗体阳性及使用免疫抑制药是导致化疗后HBV再激活的独立危险因素(表2)。
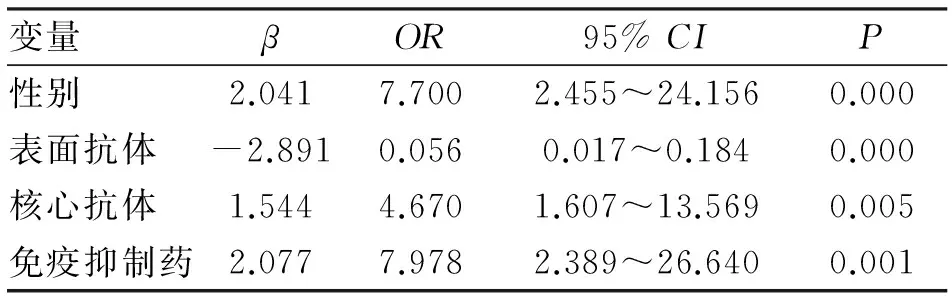
表2 乙肝表面抗原阴性恶性肿瘤患者化疗后乙肝病毒再激活多因素Logistic回归分析
3 讨 论
HBV再激活可发生于化疗中及化疗后,临床表现也轻重不一,主要取决于肝功能损伤的程度,肝功能轻度异常可无明显临床症状,中到重度肝功能损伤患者,除影响其化疗疗程的连续性,导致抗肿瘤治疗的延误或中断,急性肝衰竭甚至危及患者生命。
本研究表明,男性、乙肝表面抗体阴性、核心抗体阳性及应用免疫抑制药是导致HBsAg阴性患者化疗后HBV再激活的独立危险因素,得出了与国外学者相似的研究结论[11,12]。鉴于HBV再激活是引起化疗后肝损伤的重要因素,因此笔者认为,有上述危险因素的患者在化疗前、化疗过程中及化疗后应密切监测患者肝功能、乙肝标志物及血清HBV DNA水平变化,一旦出现肝功能异常或再激活应积极采取抗病毒及保肝治疗,防止因肝功能损伤影响化疗疗程及抗肿瘤疗效;或在与患者进行有效的沟通后,在化疗开始前即予患者行抗病毒治疗以防止HBV再激活。
本研究共纳入570例HBsAg阴性恶性肿瘤患者,化疗前经检测血清HBV DNA水平均为阴性(HBV DNA<500 U/ml),但在化疗后仍有25例患者出现血清HBsAg转阳或血清HBV DNA转阳,可能与患者肝细胞内HBV DNA阳性或血清中存在低水平的HBV有关,但通过肝穿刺活检检测肝细胞内HBV DNA在临床实际工作中难以广泛开展,因此笔者建议对于存在HBV再激活高危因素的患者化疗前可行高灵敏度血清HBV DNA检测,检测下限一般为15~20 U/ml,检测结果阳性患者化疗前即行抗病毒治疗对预防HBV再激活将起到重要作用。
本研究也存在一些不足之处,主要是纳入样本量不大,导致检验效能偏低;另外因部分肿瘤患者生存时间较短和部分患者的失访,本次研究仅回顾性分析了患者化疗前至末次化疗后3个月的资料,3个月后可能仍有患者出现HBV再激活的情况。因此下一步将收集多中心、大样本资料进行这方面的研究,并延长随访时间,给临床工作提供更为可靠的循证医学依据。
[1] Chen W C, Cheng J S, Chiang P H,etal. A comparison of entecavir and lamivudine for the prophylaxis of hepatitis B virus reactivation in solid tumor patients undergoing systemic cytotoxic chemotherapy [J]. PLoS One, 2015, 10(6): e0131545.
[2] Ho E Y, Yau T, Rousseau F,etal. Preemptive adefovir versus lamivudine for prevention of hepatitis B reactivation in chronic hepatitis B patients undergoing chemotherapy [J]. Hepatol Int, 2015, 9(2): 224-230.
[3] Tang W, Chen L, Zheng R,etal. Prophylactic effect of lamivudine for lhemotherapy-induced hepatitis B reactivation in breast cancer: a Meta-analysis [J]. PLoS One, 2015, 10(6): e0128673.
[4] Liu J Y, Sheng Y J, Ding X C,etal. The efficacy of lamivudine prophylaxis against hepatitis B reactivation in breast cancer patients undergoing chemotherapy: a meta-analysis [J]. J Formos Med Assoc, 2015, 114(2):164-173.
[5] Yang Y, Du Y, Luo WX,etal. Hepatitis B virus reactivation and hepatitis in gastrointestinal cancer patients after chemotherapy [J]. Cancer Chemother Pharmacol, 2015, 75(4): 783-790.
[6] Totani H, Kusumoto S, Ishida T,etal. Reactivation of hepatitis B virus (HBV) infection in adult T-cell leukemia-lymphoma patients with resolved HBV infection following systemic chemotherapy[J]. Int J Hematol, 2015, 101(4): 398-404.
[7] Chen K L, Chen J, Rao H L,etal. Hepatitis B virus reactivation and hepatitis in diffuse large B - cell lymphoma patients with resolved hepatitis B receiving rituximab-containing chemotherapy: risk factor and survival [J]. Chin J Cancer, 2015, 34(1): 18.
[8] Law M F, Lai H K, Chan H N,etal. The impact of hepatitis B virus(HBV) infection on clinical outcomes of patients with diffuse large B-cell lymphoma[J]. Eur J Cancer Care(Engl), 2015, 24(1): 117-124.[9] 吴盛喜,许鸿鹞,黄河澄,等.HBsAg阳性恶性肿瘤患者化疗后肝损伤及HBV再激活的临床分析[J].临床肝胆病杂志,2016,32(1):110-113.
[10] 杨小舟,崔铁军,解 莹,等. 核苷类药物对恶性肿瘤患者化疗后乙型肝炎病毒再激活的研究[J]. 中华医院感染学杂志,2016,26(2):289-297.
[11] Chen K L, Chen J, Rao H L,etal. Hepatitis B virus reactivation and hepatitis in diffuse large B-cell lymphoma patients with resolved hepatitis B receiving rituximab-containing chemotherapy: risk factors and survival [J]. Chin J Cancer, 2015, 34(5): 225-234.
[12] Elbedewy T A, Elashtokhy H E, Rabee E S,etal. Prevalence and chemotherapy-induced reactivation of occult hepatitis B virus among hepatitis B surface antigen negative patients with diffuse large B-cell lymphoma: significance of hepatitis B core antibodies screening[J]. J Egypt Natl Canc Inst, 2015, 27(1): 11-18.
[13] 中华医学会血液学分会,中国抗癌协会淋巴瘤专业委员会,中华医学会肝病学分会. 中国淋巴瘤合并HBV感染患者管理专家共识[J].中华血液学杂志,2013,34(11):988-993.
(2016-04-26收稿 2016-06-28修回)
(责任编辑 武建虎)
Influencing factors of hepatitis B virus reactivation after chemotherapy in hepatitis B surface antigen negative patients with malignant carcinoma
YANG Yang1, WEI Yan2, JIANG Xuehua1, CHEN Jian2, CHEN Zhiyong1, and YANG Long1.
1.Department of Infectious Diseases, 2. Department of Oncology, Shanghai Municipal Corps Hospital of Chinese People’s Armed Police Force, Shanghai 201103, China
Objective To investigate the occurrence of the related risk factor hepatitis B virus (HBV) reactivation after chemotherapy in hepatitis B surface antigen (HBsAg) negative patients with malignant carcinoma. Methods A total of five hundred and seventy HBsAg-negative patients with malignant carcinoma who received chemotherapy were recruited during the period of 2006-01 to 2014-12 in Shanghai Corps Hospital of Chinese People’s Armed Police Force. The patients were divided into reactivation group (n=25) and inactivation (n=545) group according to whether the virus was reactivated after chemotherapy. The general information, chemotherapy regimen and index of laboratory examination in both groups were analyzed retrospectively,2 test and logistic regression analysis were performed on potential influencing factors for HBV reactivation. Results The univariate analysis indicated that gender, hepatitis B surface antibody status, e antibody status, core antibody status and whether or no application of immune suppression were statistically significantly different between the two groups. The multivariate non-conditioned logistic regression analysis of these five factors indicated that male (OR=7.700,P<0.001), hepatitis B surface antibody negative (OR=0.056,P<0.001), E antibody positive (OR=4.670,P<0.01) and application of immune suppression (OR=7.978,P<0.01) were independent risk factors for HBV reactivation after chemotherapy. Conclusions For male, surface antibody negative, core antibody positive and application of immune suppression of HBsAg negative patients with malignant carcinoma, chemotherapy should closely monitor HBV whether reactivation or take early antiviral treatment to prevent HBV reactivation.
hepatitis B surface antigen; malignant carcinoma; chemotherapy; hepatitis B virus; reactivation
杨 阳,硕士研究生,主治医师。
201103,武警上海总队医院:1.感染科,2.肿瘤内科
杨 龙,E-mail:yyandcg@sina.com
R735
