阻塞性睡眠呼吸暂停低通气综合征与勃起功能障碍的相关性研究
2016-11-09胡海翔孙梯业方红颜伟徐少强刘红明沈传运孙哲张启龙韦仕福
胡海翔 孙梯业 方红 颜伟 徐少强 刘红明 沈传运 孙哲 张启龙 韦仕福
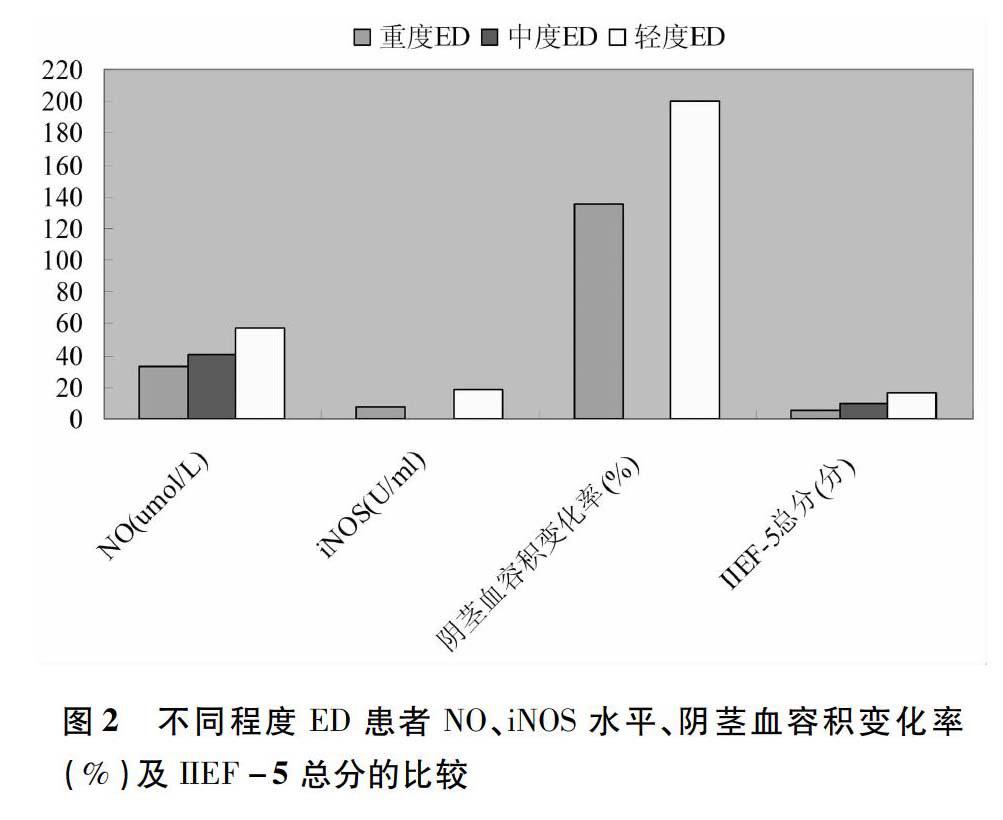

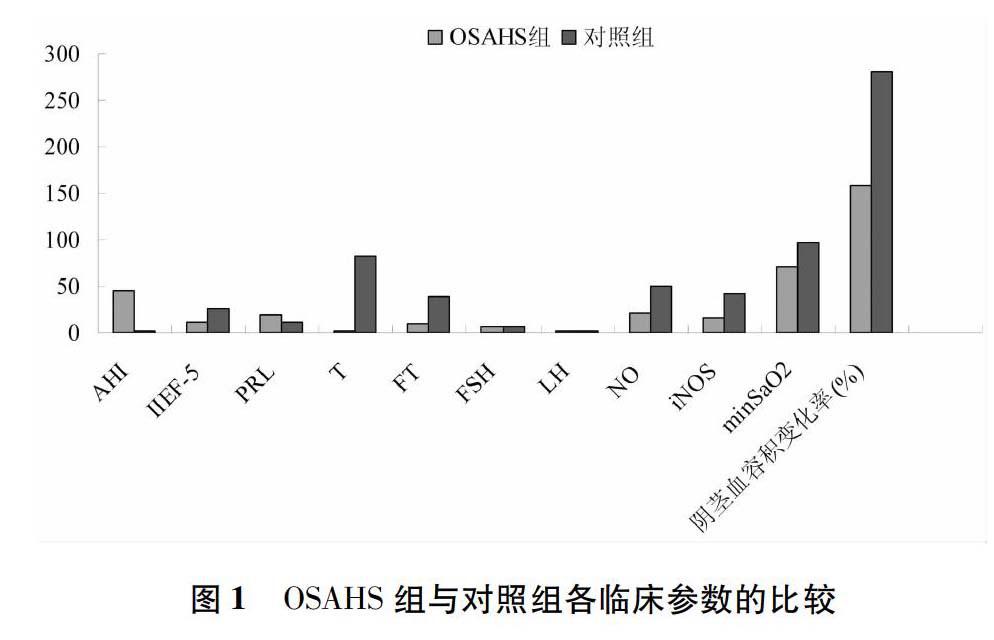
【摘要】目的:探讨阻塞性睡眠呼吸暂停低通气综合征(OSAHS)患者与勃起功能障碍(ED)之间的相关性。方法:OSAHS患者60例,纳入观察组;门诊体检健康志愿者60例,纳入对照组,采用PSG睡眠监测仪和NPT同步监测两组患者睡眠状态及阴茎勃起情况,包括呼吸暂停低通气指数(AHI)、最低动脉血氧饱和度(minSaO2)和阴茎血容积变化率(%)。硝酸还原酶法、比色法分别检测NO、iNOS浓度,ECLIA法检测血清睾酮(T)、游离睾酮(FT)、卵泡刺激素(FSH)、黄体生成激素(LH)、催乳素(PRL)水平,国际勃起功能指数评分5项(IIEF-5)评估男性OSAHS患者ED的发病率,并对数据进行相关分析。结果:OSAHS组T(2.10±2.42)、FT(9.76±2.33)、NO(72.51±11.74)、iNOS(25.32±11.57)、minSaO2(71.23±5.71)、阴茎血容积变化率(158.36±32.87),与对照组相比,差异有非常显著的统计学意义(P<0.01),OSAHS组AHI(45.75±11.92)显著高于对照组(P<0.05)。OSAHS患者ED的发生率显著高于对照组(P<0.01),重度ED患者NO(32.57±6.33)、iNOS(8.06±1.01)、阴茎血容积变化率(135.56±16.92)及IIEF-5总分(5.3±2.3)明显低于轻中度ED患者(P<0.01)。结论:OSAHS与ED有明显的相关性,NO升高、低氧血症、T降低可能是OSAHS患者导致ED的机制。
【关键词】阻塞性睡眠呼吸暂停低通气综合征;勃起功能障碍;相关性;研究
Correlation between obstructive sleep apnea-hypopnea syndrome and erectile dysfunctionHU Haixiang1, SUN Tiye1, FANG Hong2, YAN Wei3, XU Shaoqiang1, LIU Hongming1, SHEN Chuanyun1, SUN Zhe1, ZHANG Qilong1, WEI Shifu1. 1. Department of Integrated Traditional and Western Medicine Andrology, General Hospital of PLA Airforce, Beijing 100142, China; 2. Department of Radiology, General Hospital of PLA Airforce, Beijing 100142, China; 3. Forth Cadres Ward, General Hospital of PLA Airforce, Beijing 100142, China
【Abstract】Objectives: To investigate the correlation of obstructive sleep apnea-hypopnea syndrome (OSAHS) with erectile dysfunction. Methods: 60 OSAHS patients were selected as observation group and 60 healthy subjects as controls group. The dormancy and penile erection of two groups were determined synchronously by polysomnography and nocturnal penile tumeascence, including appnea hypopnea index (AHI), minimal arterial blood oxygen saturation (minSaO2) and change rate of penis blood volume (%). NO was measured by nitrate reduction enzymatic method, and iNOS by colorimetric assay, testosterone, T, FT, FSH, LH, PRL by electrochemiluminescence immunoassay (ECLIA), and the incidence of erectile dysfunction among OSAHS patients was evaluated by 5-item version of the international index of erectile function (IIEF-5). Results: For OSAHS group, the results included testosterone (2.10±2.42), flow testosterone (9.76±2.33), nitric oxide (72.51±11.74), inducible nitric oxide synthase (25.32±11.57), minimal arterial blood oxygen saturation (71.23±5.71) and change rate of penis blood volume (158.36±32.87), with significant difference from the control group (P<0.01); the appnea hypopnea index of OSAHS group was significantly higher than that in control group (P<0.05). The incidence rate of OSAHS with erectile dysfunction was higher than the control group (P<0.01), NO (32.57±6.33), iNOS (8.06±1.01), change rate of penis blood volume (135.56±16.92) and IIEF-5 (5.3±2.3) in patients with severe erectile dysfunction were significantly less than those in patients with slight and midrange erectile dysfunction (P<0.01). Conclusions: There is apparent correlation between OSAHS and erectile dysfunction, and the increase in NO, hypoxemia and decrease of testosterone may be the mechanism of OSAHS patient with erectile dysfunction.
【Key words】Obstructive sleep apnea-hypopnea syndrome (OSAHS); Erectile dysfunction; Correlation; Study
【中图分类号】R167【文献标志码】A
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是有各种原因导致的睡眠呼吸暂停指数(appnea hypopnea index,AHI)大于等于5次/h,从而引起低氧血症、高碳酸血症和睡眠结构紊乱等多脏器功能障碍的呼吸疾患症候群[1-3],严重影响患者的生活和生存质量,是全身多种疾患的独立危险因素[4],包括性功能障碍,而最常见的是勃起功能障碍(erectile dysfunction,ED)。一项流行病学调查资料显示,OSASH已成为一种发病率较高的慢性睡眠呼吸疾病,患病率为2%~4%,且多见于男性,表明该病已成为一种常见病[1]。ED是成年男性的常见病,美国MMAS对1290名40~70岁男性的研究表明ED患病率为52%,在中国ED发病率可能会更高,ED是男性OSAHS患者的常见症状,有时可能是就诊的主要症状。因此,我们对接受多导睡眠监测的60例OSAHS患者采用夜间阴茎勃起(nocturnal penile tumeascence, NPT)监测与国际勃起功能指数评分5项(5-item version of the international index of erectile function,IIEF-5)评估男性OSAHS患者ED的发病率,并检测OSAHS患者的呼吸暂停低通气指数(AHI)、最低动脉血氧饱和度(minimal arterial blood oxygen saturation,minSaO2)、血清睾酮(testosterone, T)、游离睾酮(flow testosterone, FT)、一氧化氮(nitric oxide, NO)、一氧化氮合酶(inducible nitric oxide synthase, iNOS)、卵泡刺激素(follicle stimulating hormonr, FSH)、黄体生成激素(luteinizing hormone, LH)、催乳素(prolactin, PRL)水平和阴茎血容积变化率(%),以探讨OSAHS与ED之间的相关性,并对可能的机制进行了初步研究。
1对象和方法
1.1对象
诊断依据中华医学会呼吸病学分会睡眠呼吸障碍学组提出的病情分度标准,按睡眠呼吸暂停低通气指数(AHI)标准(轻度:5~15次/h,中度:16~30次/h,重度>30次/h),随机抽取睡眠呼吸障碍门诊患者中经多导睡眠监测仪(polysomnography, PSG)检查确诊的男性OSAHS患者60例,年龄29~59岁,平均年龄(40.9±16.7)岁,作为OSAHS组;所有入选者经询问病史及体检,均为排除重要脏器疾病的先天发育正常男性。所有受试者均被告知试验内容,并签署知情同意书。我院门诊健康体检者60名,年龄24~50岁,平均年龄(35.7±14.2)岁,作为对照组。
1.2主要仪器和试剂
Alice 5多导睡眠仪(PSG)购自Philips Respironics公司,夜间阴茎勃起监测仪(NPT)购自美国AMS公司,7160全自动生化仪购自日本日立公司。NO、iNOS和ECLIA试剂盒由北京华英生物技术研究所提供。
1.3方法
所有利用PSG睡眠监测系统平台(PSG联合NPT)同步监测睡眠状态和阴茎勃起情况,采用IIEF-5对受试者的性功能情况进行评价,对得出的睡眠相关性阴茎勃起功能数据加以分析。
1.3.1PSG监测所有受试者均采用Alice 5多导睡眠仪检测系统进行多导睡眠监测,监测前排除影响睡眠、心率等因素。采用Alice 5多导睡眠仪检测系统,从23:00到次日6:00进行7h连续监测,通过系统综合分析得出受试者的睡眠呼吸暂停低通气指数(AHI)、最低氧饱和度(minSaO2)。
1.3.2NPT测定按照操作程序进行操作,次日早上6:00取回记录仪,根据Knoll标准作为诊断ED的定量依据,以NPT测定的阴茎血容积变化率作为ED主要的判断依据。阴茎血容积变化率>210%为正常,170%~210%为轻度异常,140%~170%为中度异常,<140%为重度异常。
1.3.3IIEF-5测评所有受试者均采用IIEF-5量表进行性功能状态自我测评,以总分<21分为性功能障碍,IIEF-5评分在12~21分为轻度、8~11分为中度、5~7分为重度。IIEF-5评估在行PSG检测后由受试者独立填写完成。
1.3.4T、FT、FSH、LH、PRL含量测定所有受试者均于结束PSG 监测后次日清晨空腹抽取静脉血3mL,4000r/min离心15min后取血清,-20℃保存标本,在电化学发光免疫分析仪(ECLIA)上进行T、FT、FSH、LH、PRL水平检测。严格按照试剂盒操作说明操作。
1.3.5NO、iNOS测定研究对象均在PSG检测和NPT监测结束后半小时内,空腹抽静脉血5mL,经15000r/min离心,15min后提取血清,在-70℃下保存。使用硝酸还原酶法检测NO,使用721分光光度计(比色法)检测iNOS浓度,试剂药盒厂家:北京华英生物技术研究所。
1.4统计学处理
所有数据以均数±标准差(±s)表示,采用SPSS17.0的软件进行统计分析,相关性比较采用Spearman等级相关判断,以P<0.05为差异有统计学意义。
2结果
2.1OSAHS组与对照组各临床参数比较
从两组各临床参数检测结果来看,OSAHS组T、FT、NO、iNOS、minSaO2和阴茎血容积变化率(%)显著低于对照组(P<0.01),OSAHS组AHI显著高于对照组(P<0.05),而OSAHS患者血清FSH、LH、PRL含量与对照组相比无显著差异(P>0.05)。见图1。图1OSAHS组与对照组各临床参数的比较
2.2OSAHS患者IIEF-5量表自我测评结果分析
经IIEF-5量表自我测评,OSAHS患者IIEF-5量表自我测评(12.7±1.5)分,存在ED者60例(100.00%);对照组IIEF-5量表自我测评(26.3±2.9)分。OSAHS患者ED的发生率显著高于对照组(P<0.01)。见表1。
2.3OSAHS患者AHI、minSaO2、T、IIEF-5之间的相关性分析
OSAHS患者IIEF-5与AHI之间呈负相关(r=-0.35,P=0.03),与minSaO2之间呈正相关(r=0.315,P=0.000);OSAHS患者血清T水平与AHI、minSaO2之间呈正相关(r=0.281,P=0.003、r=0.425,P=0.000)。
2.4不同程度ED患者NO、iNOS水平、阴茎血容积变化率(% )及IIEF-5总分的比较轻、中、重度ED患者NO和iNOS水平进行两两比较:重度ED患者NO、iNOS水平、阴茎血容积变化率(%)及IIEF-5总分明显低于轻、中度ED患者,差异具有非常显著的统计学意义(P<0.01)。见图2。
3讨论
随着社会的发展,人类对生活质量的要求不断提高,OSAHS并发ED也逐渐受到人们的重视。OSAHS作为一种疾病症候群,日益受到临床医师及社会的关注和重视。近年来国内外的相关研究均提示OSAHS有较高的患病率,上海市医学会呼吸病学分会睡眠呼吸疾病学组采用整群抽样的方法调查了上海市30岁以上居民8081人,OSAHS的患病率为3.62%。高雪梅对北京城区1622名居民进行调查和分析表明OSAHS患病率为3.1%。有研究指出,正常男性每晚大约有3~5次阴茎自发勃起,每次持续平均30 min,每晚因阴茎勃起导致阴茎海绵体处于高氧状态的时间为1.0~3.5h。OSAHS患者容易出现ED可能原因是患者睡眠时呼吸暂停,进而导致机体低氧血症和高碳酸血症,从而影响了阴茎的夜间勃起。尽管OSAHS引起ED涉及多种机制,但共同特征均是呼吸紊乱和间歇性缺氧。Hirshkowitz等[5]对1025名患有ED的OSAHS患者进行研究,结果表明AHI≥5占43.8%,AHI≥10占27.9%,AHI≥15占19.6%。本研究结果提示,OSAHS患者IIEF-5量表自我测评(12.7±1.5)分明显低于对照组(26.3±2.9)分(P<0.01),说明OSAHS患者伴有ED有较高的发病率,进一步证实OSAHS与ED有明显的相关性,与Levy研究结果相一致[6]。同时,我们的研究还发现,IIEF-5、NPT与NO、iNOS呈正相关,OSABS患者IIEF-5与AHI、T之间呈负相关,与minSaO2之间呈正相关,说明IIEF-5和NPT都是评价ED的有效手段。OSAHS患者睡眠时因反复发作的呼吸暂停,导致低氧血症的发生,并引起组织器官的缺血和缺氧,进一步加重了多系统、多器官功能的直接或间接损害[7]。结合我们的研究结果,我们推测OSAHS患者导致ED的机制可能与患者夜间低氧血症有关。
目前OSAHS伴ED的机制还不是很清楚。国内外的研究显示,ED的发生,本质上是一系列神经-血管活动,主要是依靠阴茎血管和海绵体平滑肌舒张。现代医学已证实NO是调节神经传导、扩张血管的生物活性物质[8],是诱发阴茎勃起的主要神经递质。NO不仅能够促进阴茎处于膨胀状态,还能够促进和维持阴茎的勃起,在阴茎勃起过程中起着决定性的作用,因此,NO被认为是阴茎勃起主要信号分子,NO的合成受氧分压高低的影响。iNOS是一种含有亚铁血红蛋白的合酶,是NO合成的唯一限速酶,是调节NO生成的重要环节[9],主要位于平滑肌细胞内,在阴茎海绵体中分布最丰富。最近临床研究表明,在人体内,NO是在iNOS的作用下,催化左旋精氨酸(L-ARG)生成NO和L-胍氨酸[10]。临床研究证实,阴茎海绵体血管内皮细胞上有iNOS,iNOS通过促进促性腺激素释放素(GnRH)的释放及直接调节垂体释放黄体生成素(LH),通过调节雄激素的水平,维持正常的性功能,且脑中NO也可调节性行为等[11],NO的外周神经递质与中枢神经递质作用,共同介导着阴茎的勃起生理机制。OSAHS伴ED的患者由于睡眠时呼吸暂停,导致机体出现低氧血症。而血管内皮细胞的反复缺血-再灌注,使NO随呼吸运动从鼻转运到肺发生障碍及降低了阴茎的夜间勃起和勃起时海绵体高氧状态, 导致内皮细胞能量代谢受损,内皮细胞分泌功能下降,同时iNOS减少,抑制了NO的合成[12,13],导致NO释放及环鸟苷酸(cGMP)生成减少,细胞内钙离子浓度增高,血管收缩导致阴茎血管内血流减少,进而出现ED。因此L-ARG-NO-cGMP通路在阴茎勃起中起着重要作用,而NO是调节阴茎海绵体肌肉松弛和勃起功能的重要神经递质,其中iNOS以左旋精氨酸(L-arginine, L-Arg)为底物催化生成NO[14],是引起海绵体舒张合成的主要信使,参与勃起的诱导和维持。研究表明,iNOS活性的降低,受神经支配的平滑肌功能下降能够导致阴茎勃起功能障碍,这是OSAHS患者发生ED的主要原因之一[15]。Fusetti等[16]研究表明,OSAHS导致的直接后果是长期的慢性低氧血症,低氧血症又可诱导iNOS及其基因表达增强,使NO合成和释放增加,然而,Bazan等[17]研究认为,慢性低氧血症又可抑制iNOS的合成,降低其活性,进一步减少NO的生成,两者变化的综合结果是内源性NO产生量明显减少。我们的研究表明,OSAHS伴ED患者的阴茎血容积变化率、IIEF-5总分与NO、iNOS均呈正相关,重度ED患者NO、iNOS水平、阴茎血容积变化率(%)及IIEF-5总分显著低于轻、中度ED患者(P<0.01)。因此,我们推测OSAHS患者血浆中NO含量升高可能是导致ED的机制之一。
睾酮(testosterone,T)是固醇类化合物,具有促进性器官发育成熟、维持正常性功能、促进精子生成发育等功能。男性性功能障碍以ED最为常见。男性阴茎勃起受到包括神经、血管以及体内内分泌水平的综合影响,其中对维持男性性欲以及自发勃起产生影响最大的是下丘脑-垂体-性腺轴,其调控分泌的雄激素是完成男性性活动所必需的物质。T是体内生物活性最强的雄激素,在促进性器官发育和维持性功能方面起着重要作用[18],而T水平的下降是男性性功能下降的主要原因之一。目前关于OSAHS患者导致ED的发病机制尚不是十分明确,有些学者认为是由于间歇性缺氧促进了血浆儿茶酚胺水平的升高,使交感神经的兴奋性增强,从而破坏阴茎勃起的生理机制。男性进入更年期后,睾酮水平逐步下降,ED发病率呈明显提高。本次研究通过对OSAHS患者体内T水平检测,结果显示T水平明显降低,说明OSAHS患者确实存在睾酮水平下降,这与国外的研究报道一致。OSAHS患者血清FSH、LH、PRL含量与对照组比较,无统计学差异(P>0.05),说明OSAHS患者体内的性激素水平并未受到明显的影响。血清T水平与OSAHS患者病情的严重程度呈正相关,与IIEF-5之间呈负相关,说明机体缺氧状态越严重则血清T水平下降越明显。对正常男性来说,睾酮分泌高峰早上6:00左右,而OSAHS患者睾酮分泌高峰时间延迟在上午10:00左右,OSAHS患者夜间呈低氧状态与其血中睾酮水平低、睾酮分泌高峰时间延迟有显著关系。因此,我们推测血清T降低可能是OSAHS患者导致ED发生的重要发病机制之一。我们认为,对OSAHS导致ED发生的发病机制的探索对于提高男性疾病的防控水平至关重要,但是否与患者本身的遗传易感性、肥胖和心脑血管有关,尚需进一步的深入研究。
参考文献
[1]Kendzerska T,Gershon AS,Hawker G,et al.Obstructive sleep apnea and risk of cardiovascular events and all-cause mortality:a decade-long historical cohort study.Plos Med,2014,11(2):e1001599.
[2]nüvar Doan F, Yosunkaya , Kuzu Okur H,et al.Relationships between obstructive sleep apnea syndrome,continuous positive airway pressure treatment,and inflammatory cytokines.Sleep Disord, 2014:518920.
[3]Mbata GC, Chukwuka JC. Obstructive sleep apnea hypopnea syndrome. Annals of Medical and Health Sciences Research, 2012, 2(1): 74-77.
[4]Sunitha C,Kumar SA.Obstructive sleep apnea and its management.Indian J Dent Res,2010,21(1):119-124.
[5]Hirshkowitz M, Karacan I, Arcasoy MO, et al. Prevalence of sleep apnea in men with erectile dysfunction. Urology, 1990, 36(3): 232-234.
[6]Levy P,Tamisier R,Arnausd C,et al.Sleep deprivation,sleep apnea and cardiovascular diseases.Front Biosci(Elite ED),2012(4):2007-2012.
[7]Sankri-Tarbichi AG.Obstructive sleep apnea-hypopnea syndrome:Etiology and iagnosis.Avicenna J Med,2012,2(1):3-8.
[8]Jelic S, Padeletti M, Kawut SM,et al.Inflammation,oxidative stress,and repair capacity of the vascular endothelium in obstructive sleep apnea.Circulation,2008,117(17):2270-2278.
[9]Forstermann U,Sessa WC.Nitric oxide synthases:regulation and function.Eur Heart J,2012,33(7):829-837.
[10]Gulati P,Singh N,Muthuraman A,et al.Pharmacologic evidence for role of endothelial nitric oxide synthase in neuroprotective mechanism of ischemic postconditioning in mice.J Surg Res,2014,188(1):349-360.
[11]Feng J,Zhang D,Chen BY.Endothelial mechanisms of endothelial dysfunction in patients with obstructive sleep apnea.Sleep Breath,2012,16(2):283-294.
[12]Fabio Di Domenico,Marzia Perluigi,Eugenio Barone.Biliverdin reductase-A correlates with inducible nitric oxide synthasein in atorvastatin treated aged canine brain.Neural Regeneration Research,2013,8(21):1925-1937.
[13]邓平荟,曾金雄,王如瑶.补肾益精方对实验性生精障碍大鼠精子质量及血清NO的影响.中国性科学,2006,15(9):20.
[14]Fleming I.Molecular mechanisms underlying the activation of eNOS.Pflug Arch,2010,459(6):793-806.
[15]徐少强,胡海翔.阻塞性睡眠呼吸暂停低通气综合征与勃起功能障碍的研究进展.中国性科学,2013,22(5):13-16.
[16]Fusetti M,Fioretti AB,Valenti M.Cardiovascular and metabolic comorbidities in patients with obstructive sleep apnea syndrome.Acta Otorhinolaryngological Ital,2012,32(5):320-325.
[17]Bazan V,Grau N,Valles E,et al.Obstructive sleep apnea in patients with typical atrial flutter:prevalence and impact on arrhythmia control outcome.Chest,2013,143(5):1277-1283.
[18]Saan F,Gooren LJ,Haider A, et al.A dise-response study of testosterone on sexual dysfunction and features of the metabolic syndrome using testosterone gel and parenteral testosterone undecanoate.J Androl,2008,29(1):102-105.
