毛白杨叶片再繁和遗传转化体系的优化
2016-11-09李春利王孝敬丁强强
李春利 王孝敬 丁强强 吴 寒
(南京农业大学园艺学院,南京 210095)
* 通信作者:E-mail:wuhan@ njau.edu.cn
毛白杨叶片再繁和遗传转化体系的优化
李春利 王孝敬 丁强强 吴 寒*
(南京农业大学园艺学院,南京 210095)
主要对毛白杨的叶片再繁和遗传转化体系进行了优化,通过对影响组织培养效率的叶片分化方式、生根培养基、激素组合等因素的筛选和影响遗传转化效率的外植体选材、菌液浓度两个主要因素的研究,得出以下主要结果:叶片通过直接分化培养的方式,20 d即可形成丛芽;6-BA和TDZ(Thidiazuron)激素混合使用可促进叶片分化,叶片分化率可达100%;增加芽伸长步骤提高了单片叶的繁殖系数;生根培养基凝固剂使用水晶洋菜(Gelrite)代替琼脂(Agar),幼芽8 d即可生根,侧根多、长,有二级侧根,根的生长状态良好。对于转化效率,不同茎段继代数的叶片外植体均可用于进行转化,但是继代次数越多,转化效率越低,选择初代培养植株的叶片作外植体,愈伤形成率83.5%,阳性植株得率100%,转化效率可达55%以上。这是一种明显不同于已发表过的具有高效率的毛白杨遗传转化方法。叶片再繁采用直接分化方式,6-BA和TDZ激素混合使用和增加芽伸长步骤,提高了叶片的组织培养效率;生根培养基使用水晶洋菜做凝固剂,无需添加促进生根的激素,有利于植株生长;初代培养植株的叶片外植体,更适合毛白杨的遗传转化。
毛白杨;叶片再繁;遗传转化;TDZ
毛白杨(PopulustomentosaCarriere)是我国特有的速生树种之一,树形高大,树姿优美,是北方普遍栽植的庭园绿化或行道树,是集观赏与用材于一身的优良树种。毛白杨作为木本植物具有生长周期长、遗传背景复杂的特点,利用传统育种技术会受到生物体间亲缘关系的制约,并因为其操作对象是整个基因组,使得目的性状的随机组合难以控制。而转基因技术具有目的性强、可操作性高、缩短育种周期等优点[1],已成为解决多细胞生物中重要生物学问题的一个强大工具,尤其是高等植物[2]。
如今许多新的育种方法都可以通过转基因技术来实现,而组织培养再生是多数植物能高效转化的关键步骤。利用组织培养进行毛白杨无性繁殖具有保持其优良特性、扩大繁殖系数、缩短育种周期、商业可行性高等优点[3]。组织培养多应用于农业、园艺工业化等方面[4],在植物基因工程改良中发挥着重要作用。毛白杨组织培养效率的提高受许多因子的影响,如外植体、培养基、外源激素等,通过对其影响因子的优化,以获得最佳的组培效果。本文对毛白杨叶片再繁方式、生根培养基和激素组合进行了筛选,并对影响遗传转化的外植体选材、菌液浓度等因素进行了优化,明显提高了毛白杨的遗传转化效率。
1 材料
1.1 植物材料
取毛白杨嫩枝萌芽经初代培养获得组培无菌苗。
1.2 菌种
遗传转化使用T01质粒载体,质粒携带有35S启动子驱动的GUS:NPT Ⅱ融合基因和Kan基因。毛白杨转化使用农杆菌菌株EHA105。
1.3 试剂和酶
主要的实验试剂和酶:预混型DNA聚合酶(Primix Taq version 2.0)(TaKaRa公司);DNA分子量标准(DNA Ladder Marker)(广州东盛生物科技有限公司);植物基因组DNA提取试剂盒(离心柱型)(TIANGEN公司);卡那霉素(Kan)、利福平(Rif)、乙酰丁香酮(AS)、特美汀(Ti)(南京寿德公司);引物合成由南京金斯瑞生物科技公司合成。
2 方法
2.1 建立叶片再繁体系
采用直接分化培养和经愈伤培养、分化培养出芽的方式进行叶片再繁,各培养基激素配比如表1。选取生长良好的无菌苗叶片,剪成1.0~1.5 cm大小的叶块,设计3种不同分化培养基,通过观察叶块不定芽分化的情况,选择出分化状态最好的培养基。20 d左右分化出丛芽,连带愈伤切下转入芽伸长培养基。
计算3种培养基的分化率和繁殖系数:
分化率=分化出芽的叶块数/叶块总数
(1)
繁殖系数指丛芽转入芽伸长培养基10 d后,以大于1.0 cm的可接芽作为有效芽计算繁殖系数:
繁殖系数=芽的个数/叶块总数
(2)
选取50个叶块计算分化率,3次重复,并随机选取20个叶块计算繁殖系数。
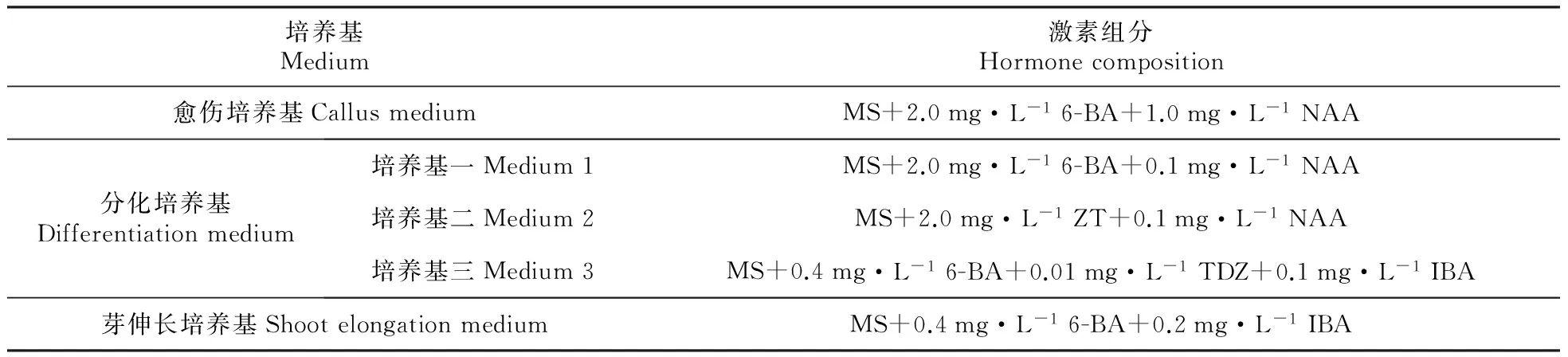
表1 各培养基激素组分
2.2 生根培养基的筛选
生根培养基分别添加水晶洋菜2.6 g·L-1和琼脂7.2 g·L-1,并分别加入0.4 mg·L-1IBA、0.1 mg·L-1NAA的生长素。观察根的生长状态,并记录生根时间和不定根及一级侧根的根数及总根长。
2.3 叶盘转化法优化后的主要步骤
选取生长良好,植株健壮的初代培养(由芽再生得到的植株)组培苗,选用生长状态基本一致的完全展开叶片,剪成1.0~1.5 cm大小的叶块;农杆菌侵染菌液摇至OD600值0.3左右,5 000 r·min-1离心5 min,用共培养液体培养基悬浮1 h,然后28℃,100 r·min-1侵染10~12 min;将叶块用无菌滤纸吸干转移至共培养培养基(MS+2.0 mg·L-16-BA+1.0 mg·L-1NAA+200 μmol·L-1AS),暗处共培养3 d;之后将叶片转移到愈伤培养基(MS+2.0 mg·L-16-BA+1.0 mg·L-1NAA+150 mg·L-1Ti+40 mg·L-1Kan),2 000 lx左右的弱光下培养15 d;叶片转移到同样含Ti和Kan的分化培养基(MS+0.4 mg·L-16-BA+0.01 mg·L-1TDZ+0.1 mg·L-1IBA);30 d左右分化出芽,转入含Ti和Kan的芽伸长培养基(MS+0.4 mg·L-16-BA+0.2 mg·L-1IBA);芽伸长2 cm左右转入含Ti和Kan的1/2MS生根培养。
2.4 转基因植株的检测
转基因植株采用GUS染色和DNA PCR验证判断目的基因是否导入,对照为未经转化的毛白杨。GUS染色选择2~3 cm的转基因幼芽,剪取叶片外植体置于X-Gluc染色液中,37℃水浴过夜,95%乙醇脱色3次,镜检观察。DNA PCR验证的特异性引物序列为:
上游引物:5′ATGTTACGTCCTGTAGAAACCCC3′;
下游引物:5′TCAGAAGAACTCGTCAAGAAGGCG3′,克隆长度2 658 bp。PCR反应程序(20 μL的反应体系):94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,进行30个循环;72℃延伸10 min;4℃保存。
3 结果
3.1 叶片再繁体系的建立
叶块直接分化培养20 d左右,丛芽即可转入芽伸长培养基,而经愈伤再分化培养形成丛芽则需40 d左右,所需时间较长。从表2中可以看出,3种分化激素处理的叶块分化率差异不显著,都可达到90%以上,6-BA和TDZ的混合使用未能明显提高分化率。形成的丛芽连带愈伤转入芽伸长培养基生长,与在平板里分化相对比(图1),大大提高叶块的繁殖系数,培养基三平板培养平均每个叶块3.4株幼芽,芽伸长培养每个叶块平均10.1株。据文献报道,TDZ促进芽的分化要强于其他分裂素,但抑制芽的伸长[5],因此增加芽伸长这一步骤能消除TDZ对芽伸长的抑制,提高毛白杨的繁殖系数。
表23种分化培养基的分化率和繁殖系数
Table2Thedifferentiationratesandpropagationcoefficientofleafblocksinthreedifferentiationmediums
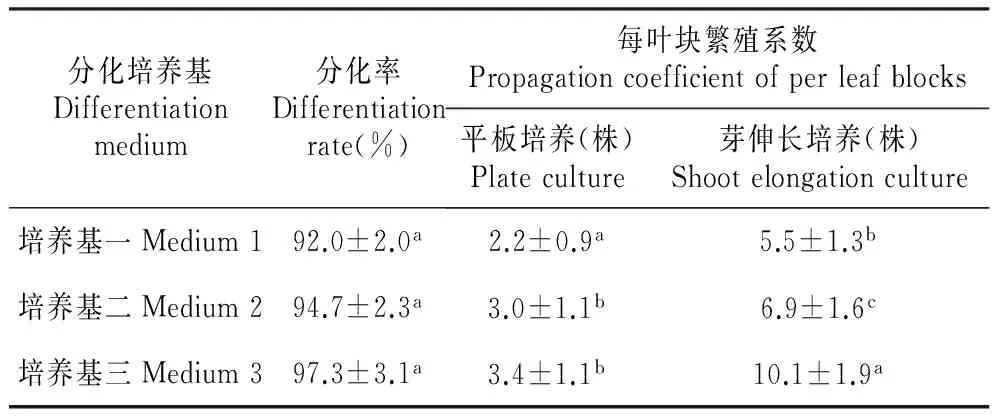
分化培养基Differentiationmedium分化率Differentiationrate(%)每叶块繁殖系数Propagationcoefficientofperleafblocks平板培养(株)Plateculture芽伸长培养(株)Shootelongationculture培养基一Medium192.0±2.0a2.2±0.9a5.5±1.3b培养基二Medium294.7±2.3a3.0±1.1b6.9±1.6c培养基三Medium397.3±3.1a3.4±1.1b10.1±1.9a
注:同列小写字母不同表示差异显著(P<0.05);繁殖系数同行小写字母不同表示差异显著(P<0.05)。
Note:Significant differences were denoted with different small letters(P<0.05) in the same column and propagation coefficient in the same line.

图1 叶片分化20 d的状态(A)和将分化出的幼芽连带愈伤移入芽伸长培养基(B)Fig.1 Leaf differentiated for 20 d(A),the differentiated buds and callus were transferred to shoot elongation medium(B)

图2 水晶洋菜(A)与琼脂培养基(B)根生长状态的对比Fig.2 Comparing of the root growth state between gelrite(A) and agar(B) culture mediums
3.2 生根培养基的筛选
由表3~4可看出,幼芽在以水晶洋菜做凝固剂的培养基中生根快,一周左右即可生根,与琼脂培养基相比不定根数量无明显差异,一级侧根的数量和长度明显高于琼脂培养基,且有二级侧根,根的生长状态良好,促进了植株的生长;而在琼脂培养基需两周左右生根,根易发黄、老化(图2)。是否添加激素对生根的影响不大,考虑到植株不宜长期生长在含外源激素的环境中,生根培养基选择不添加任何激素的1/2MS(水晶洋菜)培养基中。
表3不同生根培养基中幼芽的生根时间
Table3Timeforrootingofshootsondifferentrootingmediums

激素处理Hormonetreatment水晶洋菜培养基Gelritemedium(d)琼脂培养基Agarmedium(d)07~813~150.4mg·L-1IBA6~79~110.1mg·L-1NAA6~810~11
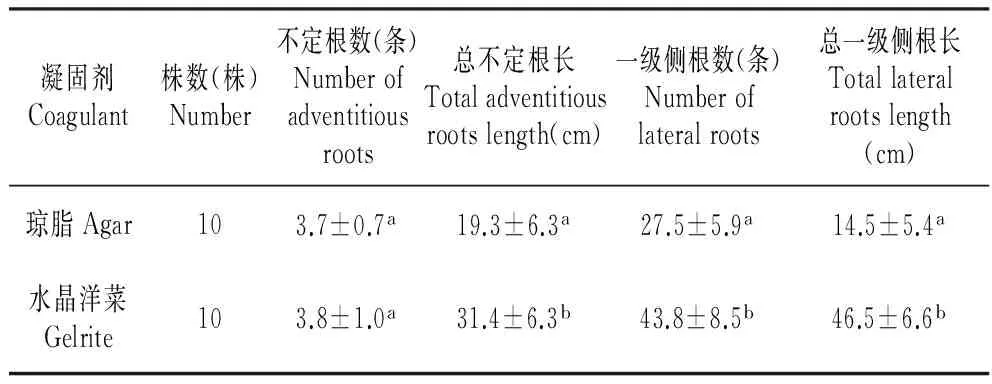
表4 凝固剂对幼芽生根的影响
注:同列小写字母不同表示差异显著(P<0.05 )。
Note:Different superscripts of small letters in the same column show significant difference(P<0.05).
3.3不同茎段继代数叶片外植体和侵染菌液浓度对遗传转化的影响
毛白杨遗传转化采用叶盘转化法。叶片进行农杆菌侵染时发现,若菌液浓度超过一定OD值,OD值越高,后期长菌时间越早,通过洗菌处理进行脱菌很难抑制,且重复洗菌过程对叶块伤害较大,造成叶片黄化、难以分化,如初代叶片外植体使用OD600=0.4的菌液侵染,45 d左右长菌,使用OD600=0.5的菌液侵染,15 d左右即大量长菌,重复洗菌使得转化叶片黄化、更难分化;不同茎段继代数叶片外植体对侵染菌液浓度的耐受性不同,初代叶片侵染菌液最适OD值0.3左右,继代1~2次叶片侵染菌液最适OD值0.4~0.5,多次继代(>8)叶片侵染菌液最适OD值0.7左右,表现出茎段继代数越多,所适应的菌液浓度越高;侵染时选择合适的菌液浓度和侵染时间,后期不需要重复洗菌(表5)。
表5不同茎段继代次数的植株叶片外植体对菌液浓度的适应性
Table5Theadaptabilityofdifferentsubculturedleafexplantsondifferentbacterialconcentrations

OD60000.20.30.40.50.60.70.8初代叶片Primarycultureleaf---+(叶片多不分化,45d左右染菌)(Mostoftheleaveswereundifferentiated,bacteriaappearedafterabout45d)+(叶片不分化,15d左右染菌)(Theleaveswereundif-ferentiated,bacteriaap-pearedafterabout15d)++++++继代<3次Subculture<3----+(部分正常分化,后期少量染菌)(Partoftheleavesweredifferentiation,andalit-tlebacteriaappeared)++++++继代>8次Subculture>8-------+
注:+.表示农杆菌生长;-.表示农杆菌未生长
Note:+.Show agrobacterium growth;-.Show without agrobacterium growth
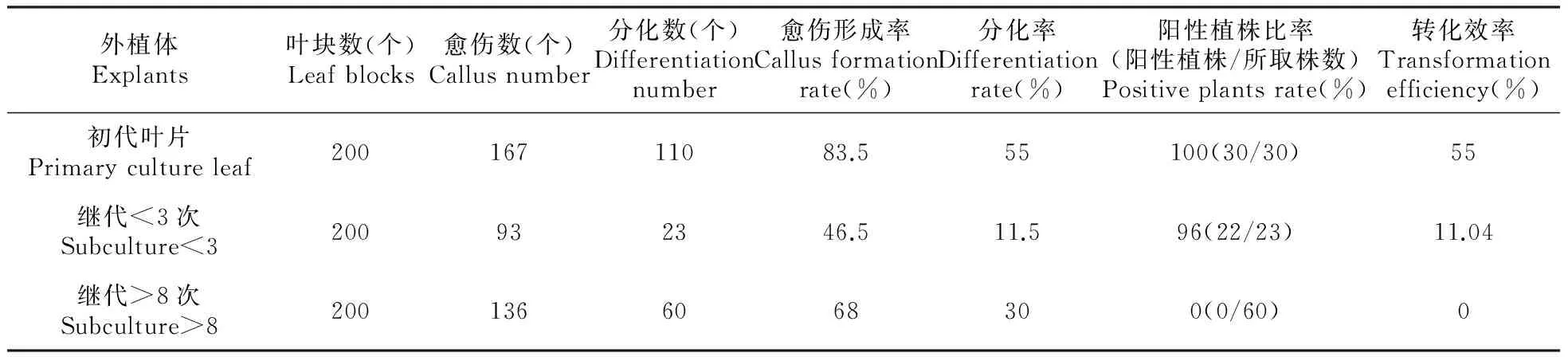
表6 茎段继代次数对植株叶片外植体的阳性植株比率和转化效率的影响
从转化获得的抗性植株中阳性植株所占的百分比作为阳性植株比率;总的叶块数中可分化出阳性芽的叶块数(每个叶块取单株芽)所占的百分比作为转化效率。通过表6可以明显看出,不同茎段继代数叶片外植体的转化效率相差很大,初代叶片转化效率高达55%,继代1~2次叶片转化效率仅11.04%,多次茎段继代的叶片很难转化成功,选择初代叶片外植体进行毛白杨遗传转化的阳性植株比率和转化效率远高于多次茎段继代植株的叶片外植体。采用初代培养的植株叶片进行转化,侵染菌液OD值0.3左右,叶片转化后生长状态良好,后期不需要洗菌处理,愈伤形成率可达83.5%,阳性植株比率高达100%,转化效率可达55%以上。
3.4 转基因植株的检测
通过GUS染色和DNA PCR的方法检测阳性转基因植株,结果如图3所示,转基因植株叶片通过GUS染色后均能显现蓝色(图3:B),同时通过PCR结果显示转GUS基因的抗性植株均能扩增出目的条带(大约为2 500 bp)(图3:C),因此可初步判断目的基因已导入毛白杨。
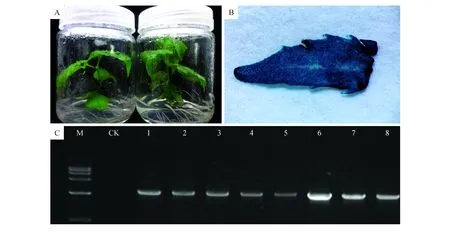
图3 转基因幼苗(A),幼芽GUS染色结果(B)及DNA PCR结果(C) M. Marker;CK.非转基因植株;1~8.转基因植株Fig.3 The transgenic seedlings(A),results of shoots GUS staining(B) and DNA PCR(C) M. Marker; CK. for non-transgenic plants; 1-8.Transgenic plants
4 讨论
4.1 叶片再繁体系的优化
叶片再繁采用直接分化的方式,很好的解决了经愈伤组织再分化不定芽获得完整植株所需时间较长、培养程序复杂的问题。TDZ已经应用于多种植物的组织培养,如小地榆[6]、魁芋[7]、香椿[8]、牡丹[9]、枣树[10]等。Song J Y等和陈宗礼等在文中提到多种激素的混合使用的效果要优于单个激素的使用,并且与6-BA的混合使用诱导芽分化时,用低浓度的TDZ代替价格昂贵的玉米素ZT,可达到或超过玉米素的效果[10~12]。低浓度的TDZ能够诱导丛生芽,而高浓度TDZ会导致芽畸形或者不生长[6],低浓度的TDZ不易使幼苗玻璃化[13],毛白杨叶片再繁体系幼苗玻璃化率为0%,但在遗传转化中存在玻璃化,玻璃化率可达3.7%(2/53),如何降低或消除遗传转化中的玻璃化现象有待进一步研究。增加芽伸长这一步骤能消除TDZ抑制芽生长的影响,并提高了毛白杨叶片的繁殖系数。培养基凝固剂用水晶洋菜代替琼脂可促进愈伤组织生长及向胚性愈伤组织转化[14],生根培养基使用水晶洋菜代替琼脂,缩短了生根时间,侧根多、长,根的生长状态良好,有利于根系吸收营养,加快植株生长。
4.2 影响遗传转化效率的因素
许多已发表的有关毛白杨转化文章中所述叶片侵染菌液最适OD值和转化效率差别较大,如Yang M S等在文中提到侵染菌液摇过夜,毛白杨的阳性植株比率可达到80%,而转化效率仅为18%[15];Li M等通过实验优化,侵染菌液OD600=0.4~0.6,毛白杨叶片转化效率能达到36.9%[16];龙萃等转化系统优化后的菌液OD600=0.3~0.5,但毛白杨阳性植株比率仅达到20.9%,转化效率为9.38%[17];Du N X等在文章中提到侵染菌液OD600=0.6~0.8[18];Jia Z C等菌液OD值0.8左右[19];本研究转化采用初代培养的植株叶片作为外植体,侵染菌液OD值0.3左右,阳性植株比率高达100%,每个转化叶块取单株芽,转化效率可达55%以上,若取转化叶块的全部芽,将会大大增加毛白杨阳性植株的数量。毛白杨转化相关文章对叶片外植体选择的植株材料描述不详,根据在本实验中发现不同茎段继代数的叶片外植体的侵染最适OD值和转化效率相差很大,多次继代的叶片外植体很难转化成功,并且侵染最适OD值偏高,可高达0.7左右,使用初代培养的叶片外植体侵染OD值偏低,只有0.3左右,推测原因可能是选择叶片外植体的植株材料不同所致。外植体的年龄和生理状态对转化效率有很大的影响,选择处于不同年龄、不同生理状态的外植体对农杆菌的耐受性不同[20],含有活跃细胞分裂的外植体对农杆菌的侵染较为敏感;幼嫩组织可能含有较少的抑制因子等因素[21~22],使得初代培养的叶片外植体最易转化,具体原因仍需更深入的探索与研究。当选择合适的菌液浓度和侵染时间时,转化叶片的生长状态良好,后期不需要重复洗菌,不仅简化实验,节省时间,而且减少重复洗菌对转化叶片的伤害,提高了毛白杨转化效率。
毛白杨遗传转化多采用Kan抗性筛选和头孢噻肟、羧苄青霉素等抑制农杆菌。Kan筛选多为25 mg·L-1[19]、30 mg·L-1[16]一次筛选或是30 mg·L-1(20 mg·L-1)、50 mg·L-1分两次进行筛选[17~18,23]。本研究中选择40 mg·L-1的Kan筛选压一次筛选,使得阳性植株比率可达100%,幼芽生根率100%,表明40 mg·L-1的Kan足够对毛白杨转化植株进行抗性筛选。Ti抑制农杆菌的效果良好,比头孢噻肟和羧苄青霉素对叶片的伤害要小[24~25],使用150 mg·L-1的Ti抑制农杆菌,转化叶片生长状态良好,且不易长菌。
杨树是研究林木遗传转化的模式植物。提高毛白杨叶片的分化率、再繁系数和转化效率,为毛白杨的品种改良和培育新品种奠定了基础,并为其他林木树种的遗传转化研究提供了新的切入点和奠定基础。
1.李少峰,苏晓华,张冰玉.林木基因克隆研究进展[J].植物学报,2011,46(1):79-107.
2.Deng W,Luo K M,Li Z G,et al.A novel method for induction of plant regeneration via somatic embryogenesis[J].Plant Science,2009,177(1):43-48.
3.Jain S M.Tissue culture-derived variation in crop improvement[J].Euphytica,2001,118(2):153-166.
4.Dagla H R.Plant Tissue Culture[J].Resonance,2012,17(8):759-767.
5.Huetteman C A,Preece J E.Thidiazuron:a potent cytokin in for woody plant tissue culture[J].Plant Cell Tissure and Organ Culure,1993,33(2):105-119.
6.Babaoglu M,Yorgancila M.TDZ-specific plant regeneration inSaladburnet[J].Plant Cell,Tissue and Organ Culture,2000,63(1):31-34.
7.崔瑾,朱月林,李式军.苯基噻二唑基脲(TDZ)在不同基因型芋组织培养中的生理效应[J].南京农业大学学报,2002,25(2):31-34.
8.张小红,张红燕,武军,等.TDZ对香椿愈伤组织诱导及芽增殖生长等的影响[J].西北农林科技大学学报:自然科学版,2002,30(5):35-38.
9.赵鑫,詹立平,邹学忠.牡丹组织培养研究进展[J].核农学报,2007,21(2):156-159.
10.陈宗礼,齐向英,张向前,等.TDZ和6-BA对枣树继代培养的影响[J].西北农业学报,2006,15(3):162-165.
11.Song J Y,Lu S F,Chen Z Z,et al.Genetic transformation ofPopulustrichocarpagenotype nisqually-1:A functional genomic tool for woody plants[J].Plant Cell Physiol,2006,47(11):1582-1589.
12.赵华燕,卢善发,晁瑞堂,等.杨树的组织培养及其基因工程研究[J].植物学通报,2001,18(2):169-176.
13.Li J J,Wu Y M,Wang T,et al.In vitro direct organogenesis and regeneration ofMedicagosativa[J].Biologia Plantarum,2009,53(2):325-328.
14.余桂红,马鸿翔,佘建明,等.草坪型高羊茅成熟种子胚性愈伤组织诱导及植株再生[J].江苏农业学报,2004,20(1):38-43.
15.Yang M S,Mi D,Ewald D,et al.Survival and escape ofAgrobacteriumtumefaciensin triploid hybrid lines of Chinese white poplar transformed with two insect-resistant genes[J].Acta Ecologica Sinica,2006,26(11):3555-3561.
16.Li M,Wang H F,Yin W L,et al.Improvement in salt tolerance ofPopulustomentosafrom transformation by a mtl-D gene[J].For Stud China,2006,8(4):20-24.
17.龙萃,庞晓明,曹冠琳,等.MdSPDS1基因导入毛白杨的遗传转化体系优化研究[J].北京林业大学学报,2010,32(5):21-26.
18.Du N X,Liu X,Li Y,et al.Genetic transformation ofPopulustomentosato improve salt tolerance[J].Plant Cell Tiss Organ Cult,2012,108(2):181-189.
19.Jia Z C,Gou J Q,Sun Y M,et al.Enhanced resistance to fungal pathogens in transgenicPopulustomentosaCarr.by overexpression of an nsLTP-like antimicrobial protein gene from motherwort(Leonurusjaponicus)[J].Tree Physiology,2010,30(12):1599-1605.
20.王永勤,肖兴国,张爱民.农杆菌介导的小麦遗传转化几个影响因素的研究[J].遗传学报,2002,29(3):260-265.
21.Raineri D M,Bottino P,Gordon M P,et al.Agrobacteriumtumefaciens transformation of rice(OryzasativaL.)[J].Nature Biotechnology,1990,8:33-38.
22.Vijayachandra K,Palanichelvam K,Veluthambi K,et al.Rice scutellum inducesAgrobacteriumtumefaciensvir genes and T-strand generation[J].Plant Molecular Biology,1995,29(1):125-133.
23.Hu L,Lu H,Liu Q L,et al.Overexpression ofmtlDgene in transgenicPopulustomentosaimproves salt tolerance through accumulation of mannitol[J].Tree Physiology,2005,25(10):1273-1281.
24.Nauerby B,Billing K,Wyndaele R,et al.Influence of the antibiotic timentin on plant regeneration compared to carbenicillin and cefotaxime in concentrations suitable for elimination ofAgrobacteriumtumefaciens[J].Plant Science,1997,123(1-2):169-177.
25.Oz M T,Eyidogan F,Yucel M,et al.Optimized selection and regeneration conditions forAgrobacteriummediated transformation of chickpea cotyledonary nodes[J].Pakistan Journal of Botany,2009,41(4):2043-2054.
OptimizationofLeafRegenerationandGeneticTransformationSystemofPopulustomentosa
LI Chun-Li WANG Xiao-Jing DING Qiang-Qiang WU Han*
(College of Horticulture,Nanjing Agricultural University,Nanjing 210095)
The experiment was conducted to optimize leaf regeneration and genetic transformation ofPopulustomentosa, and performed to select best leaf regenerative method, rooting medium, with an emphasis on hormone combination and compositions, and to select best explants and Agrobacterium concentration. We demonstrated that twenty days were needed for generation of cluster buds through direct differentiation of leaf tissues. With the mixed hormones of 6-BA and TDZ, we observed the 100% leaf differentiation. Further, the propagation coefficient of single leaf was improved by the step of shoot elongation. We also drastically improved root initiation and growth if gelrite was used when compared to commonly used agar, judging with the number and the length of the roots, and the shoots can root for about eight days. For genetic transformation efficiencies, our experiment showed that leaf explants after numerous subcultures can be infected by Agrobacterium but the transformation efficiency was reduced, if the primary cultured leaves were selected as explants and the concentration of bacteria liquid was OD600=0.3, transgenic callus formation was greater than 83.5%, all shoots survived the antibiotic selection were 100% transgenic, and the transformation efficiency was more than 55%. We report a highly efficient genetic transformation method forP.tomentosa, it is significantly different from the previously published methods. The regeneration of leaf discs through direct differentiation, the mixed use of hormone 6-BA and TDZ, and the step of shoot elongation can improve the efficiency of leaf tissue culture, also using gelrite as the coagulant in rooting medium without the addition of hormone promotes the initiation and growth of roots, and improves the plant growth as well. The primary cultured leaves are more suitable for genetic transformation ofP.tomentosa.
Populustomentosa;leaf regeneration;genetic transformation;TDZ
中央高校基本科研业务费自主创新重点项目(KYZ201309);作物遗传育种与种质创新国家重点实验室开放课题(ZW2014008)
李春利(1990—),女,硕士研究生,主要从事林木遗传育种工作。
2015-09-29
S792.117
A
10.7525/j.issn.1673-5102.2016.02.004
