超声萃取结合超高效液相色谱法测定皮革中10种防霉剂
2016-11-08吴玉銮罗海英冼燕萍韩婉清
吴玉銮,王 莉,罗海英,冼燕萍,董 浩,王 斌,韩婉清
(1.广州质量监督检测研究院,广东 广州 511447;2.国家皮革制品质量监督检验中心(广州),广东 广州 511447)
超声萃取结合超高效液相色谱法测定皮革中10种防霉剂
吴玉銮1,2*,王莉1,2,罗海英1,2,冼燕萍1,2,董浩1,2,王斌1,2,韩婉清1,2
(1.广州质量监督检测研究院,广东广州511447;2.国家皮革制品质量监督检验中心(广州),广东广州511447)
建立了皮革样品中10种防霉剂(氨基苯磺酰胺、苯并咪唑、BIT、MBT、IPBC、PCMC、水杨酰苯胺、OPP、TCMTB和OIT)的超高效液相色谱(UPLC)检测方法。样品经甲醇超声萃取,T3色谱柱分离后,甲醇和0.1%甲酸水为流动相梯度洗脱,二极管阵列检测器测定。在优化条件下,10种防霉剂在一定的浓度范围内线性关系良好,相关系数(r2)均不小于0.999 3,除IPBC的方法定量下限(S/N=10)为190.0 mg/kg外,其余9种防霉剂的方法定量下限为4.0~8.0 mg/kg,平均回收率为81.3%~104.9%,相对标准偏差(RSD,n=6)为4.7%~11.2%。该方法前处理简单、分离效果好,适用于皮革样品中10种防霉剂的同时测定。
皮革;防霉剂;超声萃取;超高效液相色谱(UPLC)
发霉是皮革及其制品最常见的质量问题。微生物的繁殖会引起原料皮、成品革的霉变,导致皮革的物理性能下降,严重影响皮革的销售和使用[1],因此防止皮革霉变是皮革行业的热点问题之一。添加防霉剂是防止皮革霉变的有效方法。目前用于皮革工业的防霉剂主要有无机类(包括次氯酸及其盐、亚硫酸盐、无机纳米材料等),有机类(有机酚、醛类、酰胺类、杂环化合物等)[2-3],如杂环化合物中的2-硫氰基甲基硫代苯并噻唑(TCMTB)、巯基苯并噻唑(MBT)、正辛基异噻唑啉酮(OIT)、1,2-苯并异噻唑-3-酮(BIT)和苯并咪唑等,有机酚及卤代酚中的4-氯-3-甲基苯酚(PCMC)、邻苯基苯酚(OPP)、五氯苯酚(PCP)等,酰胺类化合物中的水杨酰苯胺、氨基苯磺酰胺等,酯类化合物中的碘丙炔醇丁基氨甲酸酯(IPBC)等。多数防霉剂在有效防止霉变的同时,对人类、动物、环境带来负面影响[4],如异噻唑啉酮可引起皮肤灼伤或哮喘[5];IPBC可导致接触性皮炎[6];邻苯基苯酚等酚类防霉剂因生物毒性效应,在木材、食品接触材料和纺织品中被列为限用或禁用物质[7]。鉴于防霉剂对人体的潜在健康威胁,且国内标准未针对上述10种防霉剂在皮革中的使用进行规定,因此有必要开展皮革中氨基苯磺酰胺等10种防霉剂的检测方法研究。
目前国内外关于防霉剂检测的研究主要集中在化妆品[8-9]、食品[10-11]、酒[12]和水性涂料[13]等。有少量文献对皮革中TCMTB、OPP、BIT、水杨酰苯胺、IPBC和苯并咪唑等防霉剂进行了检测[5,14-18],其中ISO 13365-2011规定了皮革中TCMTB、PCMC、OPP、OIT的检测方法,但未给出明确的检出限。防霉剂的测定方法主要有高效液相色谱法、气相色谱法、气相色谱-质谱法、液相色谱-质谱法等[19-22],超高效液相色谱仪是化学实验室常配备的一种设备,在多残留组分分析中具有分离效率高和分析时间短的优点,可对防霉剂进行定性、定量测定。
本文针对皮革基质的特点,通过对色谱条件、萃取溶剂等实验条件的优化,采用超声萃取结合超高效液相色谱技术,首次建立了同时测定皮革中氨基苯磺酰胺、苯并咪唑、BIT、MBT、IPBC、PCMC、水杨酰苯胺、OPP、TCMTB及OIT共10种常用防霉剂的超高效液相色谱(UPLC)方法。
1 实验部分
1.1仪器、试剂与材料
ACQUITYTM超高效液相色谱仪配二极管阵列检测器(UPLC,美国Waters公司),MS2 Minshaker涡旋振荡器(德国IKA公司),KQ-500E超声波清洗器(昆山市超声仪器有限公司),N-EVAP 112水浴氮吹仪(美国OA公司),KDC-400低速离心机(科大创新公司),Milli-Q去离子水发生器(美国Millipore公司)。
氨基苯磺酰胺(纯度≥99.0%)、苯并咪唑(纯度≥98.0%)、1,2-苯并异噻唑-3-酮(BIT,纯度≥98.0%)、巯基苯并噻唑(MBT,纯度≥98.0%)、碘丙炔醇丁基氨甲酸酯(IPBC,纯度≥97.0%)及4-氯-3-甲基苯酚(PCMC,纯度≥99.0%)均购自上海阿拉丁试剂有限公司;水杨酰苯胺(纯度≥98.0%)、邻苯基苯酚(OPP,纯度≥97.0%)及正辛基异噻唑啉酮(OIT,纯度≥98.0%)均购自上海阿达玛斯试剂有限公司;2-硫氰基甲基硫代苯并噻唑(TCMTB,纯度≥90.0%,加拿大Toronto research chemicals公司)。甲醇、乙腈、丙酮、乙酸乙酯(色谱纯,美国Fisher公司)。
10个皮革样品(片状原料皮革,其中牛皮革5个,猪皮革3个,羊皮革2个),来源于广州本地市场。
1.2标准工作溶液的配制
分别准确称取各标准物质10.0 mg,配成1 000 mg/L的标准储备溶液,置于4 ℃冰箱冷藏保存。其中苯并咪唑、BIT、IPBC、水杨酰苯胺、OPP及OIT用甲醇溶解定容制得标准储备溶液;氨基苯磺酰胺、MBT及PCMC用少量丙酮溶解、甲醇定容制得标准储备溶液;TCMTB用少量乙腈溶解、甲醇定容制得标准储备溶液。使用时,以甲醇逐级稀释成所需浓度的混合标准工作液。
1.3样品前处理
将皮革样品剪成约5 mm×5 mm小片,称取0.5 g样品于50 mL离心管中,加入5 mL甲醇,涡旋振荡1 min,超声30 min,4 000 r/min离心3 min,收集上清液于20 mL玻璃试管中。重复提取1次,合并提取液。提取液置于40 ℃水浴中氮气吹干,加入1.0 mL甲醇复溶,涡旋摇匀,过0.22 μm滤膜待测。
1.4超高效液相色谱条件
色谱柱:ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);流动相:A为0.1%甲酸水溶液,B为甲醇;流动相梯度洗脱程序:0~2 min,90% A;2~4 min,90%~50% A;4~25 min,50%~30% A;25~27 min,30%~10% A;27~29 min,10%~90% A;29~32 min,90% A;流速:0.2 mL/min;进样量:1.0 μL;紫外检测波长:230,275,320 nm;柱温:30 ℃。
2 结果与讨论
2.1仪器条件的优化
2.1.1检测波长的选择利用PDA检测器在200~400 nm波长范围内对各物质的标准溶液进行全扫描,得到10种防霉剂的最大吸收波长分别为:氨基苯磺酰胺258 nm,苯并咪唑266 nm,BIT 318 nm,MBT 323 nm,IPBC 230 nm,PCMC 280 nm,水杨酰苯胺268 nm,OPP 284 nm,TCMTB 281 nm,OIT 278 nm。
综合各物质在不同波长下的响应值和不同波长对基线的影响,在减少干扰、保证有较大灵敏度的前提下,最终选取275 nm作为氨基苯磺酰胺、苯并咪唑、PCMC、水杨酰苯胺、OPP、TCMTB及OIT的定量检测波长,320 nm 作为BIT和MBT的定量检测波长,230 nm作为IPBC的定量检测波长。
2.1.2色谱柱的选择测定防霉剂常用的液相色谱柱为C18柱,因此本实验对UPLC 系统常用的 BEH C18(2.1 mm×500 mm,1.7 μm)和HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱进行了考察。结果显示,两种色谱柱均存在难分离的物质对(TCMTB与OPP),在 BEH C18柱上目标物的峰形较宽。调节梯度洗脱程序后,10种防霉剂在 HSS T3柱上得到很好的分离;但在BEH C18柱上,仅目标物质的保留时间有轻微变化,峰形无明显改善,TCMTB与OPP的色谱峰仍无法分开。这是由于HSS T3柱的理论塔板数高于BEH C18柱,因而峰形较尖锐;此外,HSS T3的填料是以高纯硅胶作为载体,其碳载量为11%,小于BEH C18(碳载量为17%),有利于极性较大的化合物分析,因而可将TCMTB与OPP分开。因此本文选用HSS T3柱作进一步的色谱条件优化。

图1 10种目标物混合标准溶液(50 mg/L)的色谱图(λ=275 nm)Fig.1 Chromatogram of 10 analytes mixed standard solution(50 mg/L,λ=275 nm) the number of compounds denoted is the same as that in Table 1

图2 不同提取溶剂对皮革样品中10种待测物的提取回收率Fig.2 Recoveries of 10 analytes in leather samples extracted by different kinds of solvent
2.1.3梯度洗脱条件的优化由于本文考察的10种物质极性范围较宽,采用等度洗脱程序无法将其完全分离,为提高极性相似化合物的分离度,改善化合物的峰形,比较了不同梯度洗脱程序对10种目标物质的洗脱效果。当初始有机相比例为20%时,苯并咪唑的色谱峰与杂质峰重合,OPP与TCMTB的色谱峰重叠;当初始有机相比例为10%时,缩短有机相比例由50%变为90%的时间,苯并咪唑色谱峰与杂质峰分开,且峰形较好,但OPP和TCMTB的色谱峰重叠,10种待测物质不能完全分开。采用“1.4”所示的梯度洗脱程序时,10种目标物质得到较好的分离,且响应较高。
在选定的仪器条件下,10种目标物质混合标准溶液的UPLC色谱图如图1所示,10种化合物获得了较好的分离。

图3 甲醇对皮革样品(A,B)与标准品(C)的提取对比Fig.3 Extraction effect of different leather matrix(A,B) and standard(C) by methanol the number of compounds denoted is the same as that in Table 1
2.2提取溶剂的优化
本研究的10种防霉剂均微溶或难溶于水,易溶于有机溶剂,因此比较了甲醇、乙腈、丙酮和乙酸乙酯4种溶剂对加标皮革样品中目标物的提取效果,其中BIT的添加浓度为10 mg/kg,其余9种防霉剂的添加浓度为25 mg/kg,回收率结果见图2。结果表明,因皮革中脂肪和染料的含量较高,用丙酮等弱极性有机溶剂提取,会同时萃取出皮革样品中的脂肪及染料,干扰目标物的提取,导致部分目标物质的提取回收率偏低;用乙酸乙酯作提取溶剂时,基质干扰较严重;用甲醇和乙腈提取时,脂肪和染料的溶解度较小,萃取液中的杂质较少,其中以乙腈萃取液中的杂质干扰最少,但与甲醇相比,差别不明显,且甲醇提取液中杂质与目标物的色谱峰分离度超过1.5,达到基线分离,不影响目标物的定性和定量。进一步比较两种提取溶剂对目标物的提取回收率(图2),甲醇的提取效率整体较好,对各目标物的提取率较为均衡,萃取效果最佳。
采用甲醇对两份阳性牛皮革样品进行提取,色谱图见图3。由图可知,杂质出峰时间集中在5~8 min和25~30 min,杂质的含量和种类因皮革的不同而不同,但对目标物均不产生干扰。综合以上因素,选取甲醇为提取溶剂。
2.3线性关系与检出限
按“1.2”方法配制10种待测物系列混合标准工作液,其中氨基苯磺酰胺、MBT和水杨酰苯胺的浓度分别为1.5,15.0,50.0,100.0,200.0 mg/L,苯并咪唑、BIT、PCMC、OPP、TCMTB和OIT的浓度分别为3.0,10.0,50.0,100.0,200.0,300.0 mg/L,IPBC的浓度分别为75.0,100.0,200.0,300.0,500.0,1 000.0 mg/L。按优化的仪器条件进行检测,以各待测物的峰面积(y)对相应的质量浓度(x,mg/L)绘制标准曲线。以各待测物3倍信噪比(S/N=3)的响应值对应的浓度作为仪器的检出限(LOD),在样品中添加混合标准溶液,于优化的实验条件下进行处理和测定,以10倍信噪比(S/N=10)计算方法的定量下限(MLOQ)。由表1可知,10种待测物在相应的浓度范围内线性关系良好,相关系数(r2)均不小于0.999 3,LOD为0.5~25.0 mg/L,MLOQ为4.0~190.0 mg/kg。

表1 10种待测物的线性方程、相关系数、检出限及方法定量下限Table 1 Linear equations,correlation coefficients(r2),detection limits (LODs) and method quantitation limits(MLOQs) of 10 analytes
2.4回收率与精密度
选取阴性皮革样品分别进行3个水平(MLOQ,2MLOQ,10MLOQ)的加标回收实验,6次平行实验的结果见表2。由表2可见,在加标浓度范围内,10种待测物的平均回收率为81.3%~104.9%,相对标准偏差(RSD,n=6)为4.7%~11.2%,说明该方法具有良好的回收率与精密度。
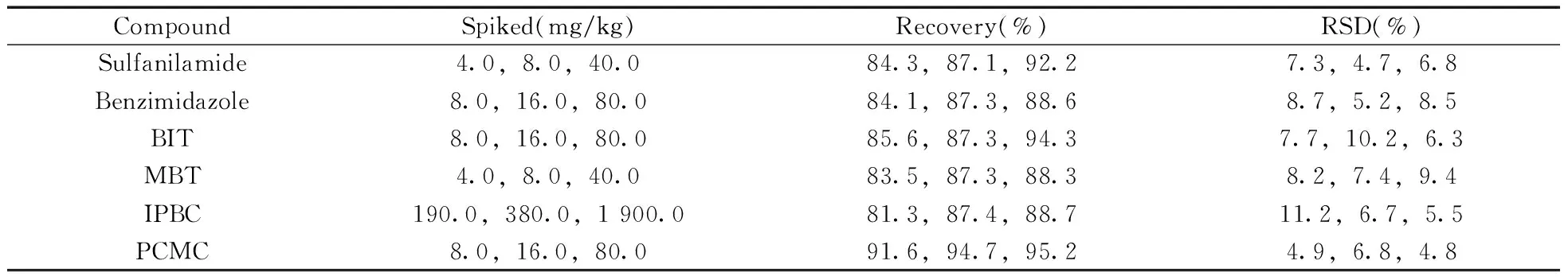
表2 回收率与精密度测定结果(n=6)Table 2 Determination results of recovery and precision(n=6)
(续表2)

CompoundSpiked(mg/kg)Recovery(%)RSD(%)Salicylanilide4.0,8.0,40.097.1,102.7,104.69.1,4.8,5.9OPP8.0,16.0,80.090.1,92.9,94.36.7,7.5,9.6TCMTB8.0,16.0,80.098.3,97.2,104.96.1,5.5,7.5OIT8.0,16.0,80.091.4,90.7,92.64.9,7.2,8.4
2.5实际样品的检测
采用本方法测定了购自市场的10个皮革样品。结果7个样品检出OPP,检出量为6.4~97.6 mg/kg;6个样品检出PCMC,检出量为17.4~131.5 mg/kg;3个样品检出OIT,检出量为10.6~126.7 mg/kg;其余防霉剂均未检出。
3 结 论
本文建立了超声萃取结合UPLC同时测定皮革中氨基苯磺酰胺、苯并咪唑、BIT、MBT、IPBC、PCMC、水杨酰苯胺、OPP、TCMTB及OIT 10种防霉剂的方法。本方法准确、灵敏,具有良好的回收率和精密度,可为定性定量分析皮革中防霉剂提供一种准确有效的检测方法。
[1]Peng H J,Sang J,Yu L Y,An R,Mu C D,Lin W.ChinaLeather(彭慧娟,桑军,俞凌云,安然,穆畅道,林炜.中国皮革),2014,43(15):48-50.
[2] Gu H B,Chen W Y.ChinaLeather(辜海彬,陈武勇.中国皮革),2005,34(1):12-15.
[3]Orlita A.Int.Biodeterior.Biodegrad.,2004,53(3):157-163.
[4]Konstantinou I K,Albanis T A.Environ.Int.,2004,30(2):235-248.
[5] Lin F,Mao S L,Chen B,Yu P F,Li Z J.ChinaLeather(林芳,毛树禄,陈斌,余鹏飞,李正军.中国皮革),2011,40(7):5-10.
[6] Liu F,Dai J J,Nie S F.Mod.Prevent.Med.(刘奋,戴京晶,聂绍发.现代预防医学),2006,33(5):839-840.
[7] Liu Z Q,Zhou C Z,Zhang R,Liang J L,Li J M,Xian L Y.J.Instrum.Anal.(刘卓钦,周长征,张瑞,梁金玲,黎嘉明,冼丽英.分析测试学报),2013,32(4):504-507.
[8] Borremans M,Van Loco J,Roos P,Goeyens L.Chromatographia,2004,59(1/2):47-53.
[9] Rastogi S C,Zachariae C,Johansen J D,Devantier C,Menné T.J.Chromatogr.A,2004,1031(1):315-317.
[10] Wang L L,Zhang M H,Zhang D F,Zhang L.FoodControl,2016,60:1-6.
[11] Bordagaray A,García-Arrona R,Millán E.Anal.Methods,2013,5(10):2565-2571.
[12] Liu Y.Anal.Lett.,2006,39(11):2333-2344.
[13] Niu Z Y,Bao Y,Ye X W,Tang Z X,Luo X.Chin.J.Anal.Lab.(牛增元,包艳,叶曦雯,汤志旭,罗忻.分析试验室),2008,27(3):48-51.
[14] Gong T S,Dong S M,Lin F,Lian X B.LeatherSci.Eng.(弓太生,董素梅,林芳,连小斌.皮革科学与工程),2011,21(6):43-46.
[15] Gong T S,Zhang S X,Zhou Y,Lin F,Mao S L.ChinaLeather(弓太生,张素璇,周越,林芳,毛树禄.中国皮革),2011,(12):118-121.
[16] Wu L,Lian X B,Li Y J,Weng C W,Xu C X.WestLeather(吴俐,连小彬,李亦军,翁城武,许彩霞.西部皮革),2014,36(20):37-40.
[17] Ma H W,Xiong Z,Chen Y,Xu Y.ChinaLeather(马贺伟,熊蒸,陈燕,徐晔.中国皮革),2010,39(7):45-47.
[18] Meneses E S,Arguelho Maria Lara P M,Alves José P H.Talanta,2005,67(4):682-685.
[19] Wasik A,Mccourt J,Buchgraber M.J.Chromatogr.A,2007,1157(1):187-196.
[20] Liu G,Zhao G,Wang X F.Chin.J.Chromatogr.(刘刚,赵刚,王小芳.色谱),2002,20(3):274-276.
[21] Caldow M,Sharman M,Kelly M,Day J,Hird S,Tarbin J A.J.Chromatogr.A,2009,1216(46):8200-8205.
[22] Rafoth A,Gabriel S,Sacher F,Brauch H J.J.Chromatogr.A,2007,1164(1):74-81.
Determination of 10 Kinds of Fungicides in Leather by Ultrasonic Extraction Combined with Ultrahigh Performance Liquid Chromatography
WU Yu-luan1,2*,WANG Li1,2,LUO Hai-ying1,2,XIAN Yan-ping1,2,DONG Hao1,2,WANG Bin1,2,HAN Wan-qing1,2
(1.Guangzhou Quality Supervision and Testing Institute,Guangzhou511447,China;2.National Center for Quality Supervision and Testing of Leather Product(Guangzhou),Guangzhou511447,China)
A new method was established to determine 10 kinds of fungicides(including sulfanilamide,benzimidazole,BIT,MBT,IPBC,PCMC,salicylanilide,OPP,TCMTB,OIT) in leather samples by ultrasonic extraction combined with ultrahigh performance liquid chromatography(UPLC).The leather samples were ultrasonically extracted with methanol,and separated with T3column,employing methanol and 0.1%(by volume) formic water as mobile phase by gradient elution.All of the samples were detected with diode-array detector.The 10 kinds of analytes presented favorable linearity in a certaim concentration range,with correlation coefficients(r2) not less than 0.999 3.The method quantitation limit(LOQ,S/N=10) of IPBC was 190.0 mg/kg,and the LOQs of other compounds were in the range of 4.0-8.0 mg/kg.The average recoveries(n=6) ranged from 81.3% to 104.9%,and the relative standard deviations (RSD,n=6) were in the range of 4.7%-11.2%.With the advantages of simple pre-treatment procedure and satisfactory separate effect,the developed method was suitable for the simultaneous determination of 10 kinds of fungicides in leather samples.
leather;fungicide; ultrasonic extraction;ultrahigh performance liquid chromatography(UPLC)
2016-03-15;
2016-04-06
广东省质量技术监督局科技项目(2015PZ06);广州市质量技术监督局科技项目(2015kj10)
吴玉銮,博士,教授级高级工程师,研究方向:色谱-质谱检测,Tel:020-82022303,E-mail:docwu@126.com
10.3969/j.issn.1004-4957.2016.09.007
O657.72; TQ572.41
A
1004-4957(2016)09-1116-05
