气相色谱-质谱联用法分析15N标记精氨酸发酵液中的氨基酸组分及其同位素丰度
2016-11-08杜晓宁岳韩笑
侯 捷,雷 雯,杜晓宁 ,任 征,岳韩笑
(上海化工研究院 上海稳定性同位素工程技术研究中心,上海 200062)
气相色谱-质谱联用法分析15N标记精氨酸发酵液中的氨基酸组分及其同位素丰度
侯捷,雷雯,杜晓宁*,任征,岳韩笑
(上海化工研究院上海稳定性同位素工程技术研究中心,上海200062)
建立了精氨酸、赖氨酸、丝氨酸、缬氨酸、亮氨酸等15种氨基酸的气相色谱-质谱联用(GC-MS)检测方法。以硅烷化试剂N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA)为衍生化试剂对氨基酸进行衍生化,在优化的色谱-质谱条件下,15种氨基酸均达到基线分离。结合混合阳离子(MCX)固相萃取柱对氨基酸发酵液实际样品进行净化,将所建立的方法用于15N标记精氨酸发酵液中的氨基酸组成(包括亮氨酸-15N、脯氨酸-15N、精氨酸-15N4、谷氨酰胺-15N和赖氨酸-15N2)分析,并根据EI图谱的离子碎片信息对15N标记精氨酸发酵液中的氨基酸同位素丰度进行计算。
气相色谱-质谱联用(GC-MS);衍生化;氨基酸;15N标记氨基酸;同位素丰度
稳定同位素15N标记的氨基酸作为一种安全、有效、方便的示踪工具[1],被用于医学、定量蛋白质组学等领域。在蛋白质定量组学领域,稳定同位素15N标记的亮氨酸、精氨酸、赖氨酸、甲硫氨酸、酪氨酸等[2]常用作细胞培养稳定同位素标记技术(SILAC)[3]的内标试剂,SILAC技术具有标记稳定,可动态研究蛋白质组的变化情况等优点[4]。目前,15N标记的氨基酸主要采用生物发酵法生产。由于菌体复杂的代谢过程,采用发酵法生产目标氨基酸的同时难免会产生其它氨基酸。因此,发酵液中15N标记目标氨基酸的含量及其它氨基酸种类的确定对菌种选育、发酵条件优化和后期纯化有着重要的指导作用[5]。传统的氨基酸检测方法常采用全自动氨基酸分析仪[6-8]、衍生化/高效液相色谱法[9-12]和液相色谱-串联质谱法[13-15]。然而,15N标记的氨基酸作为SILAC技术的示踪剂,其15N同位素丰度是除纯度外的另一关键指标[16],传统方法无法对其进行测定。采用生物发酵法生产15N-精氨酸,发酵液中的15N-精氨酸含量可由坂口反应法测得[17]。郑波等[16]采用电喷雾质谱结合质量重心法对试剂级15N标记氨基酸的同位素丰度进行了分析。由于发酵液的基质较为复杂,对其中的15N标记精氨酸及发酵液中非目标氨基酸的准确检测非常重要。本文采用GC-MS联用法测定了15N标记精氨酸发酵液中氨基酸的组成及相应15N标记氨基酸同位素的丰度。
1 实验部分
1.1仪器与试剂
气相色谱-质谱联用仪(GC-MS/MS,7890B-7000C,美国Agilent公司);HP-5 MS毛细管柱(30 m×0.25 mm×0.25 μm,美国Agilent公司);电子天平(美国OHAUS,精度0.01 mg);真空干燥箱(上海一恒科学仪器有限公司);冷冻干燥机(德国Marin Christ公司);固相萃取装置(德国CNW公司);低温高速离心机(韩国Heraeus公司);超纯水系统(美国Merck Millipore 公司)。
衍生化试剂:N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA,美国Regis Technologies公司);MCX固相萃取小柱(3 mL/60 mg,德国CNW公司);天然丰度氨基酸对照品:谷氨酸、丙氨酸、甘氨酸(纯度≥99%),精氨酸盐酸盐、亮氨酸、异亮氨酸、缬氨酸、天门冬酰胺、谷氨酸、谷氨酰胺、丝氨酸、苏氨酸(纯度≥98.5%),天冬氨酸、苯丙氨酸、脯氨酸(纯度≥98%),均购于上海惠兴生化试剂有限公司;稳定同位素15N标记氨基酸:精氨酸盐酸盐-15N4(丰度98.03 atom%15N)、谷氨酸-15N(丰度98.11 atom%15N)、天冬氨酸-15N(丰度98.72 atom%15N)、苯丙氨酸-15N(丰度95.22 atom%15N)、亮氨酸-15N(丰度92.5 atom%15N)、异亮氨酸-15N(丰度96.88 atom%15N)、丙氨酸-15N(丰度98.70 atom%15N)、脯氨酸-15N(丰度98.08 atom%15N)纯度均≥98%,缬氨酸-15N(丰度96.51 atom%15N)、天门冬酰胺-15N2(丰度99.53 atom%15N)、谷氨酸-15N(丰度98.11 atom%15N)、谷氨酰胺-15N2(丰度98.75 atom%15N)、丝氨酸-15N(丰度95.28 atom%15N)、苏氨酸-15N(丰度98.51 atom%15N)纯度均≥98.5%,甘氨酸-15N(纯度≥99%,丰度98.10 atom%15N),均为上海化工研究院稳定同位素研究中心研制产品,同位素15N丰度由气体同位素质谱仪MAT 271测定,作为高丰度对照品使用;天然丰度精氨酸发酵液,15N标记精氨酸发酵液(上海化工研究院稳定同位素研究中心提供);甲醇(HPLC级,Scharlab公司);吡啶(分析纯)、盐酸(分析纯)、氨水(试剂级)购自上海凌峰化学试剂有限公司。
1.2实验方法
1.2.1氨基酸对照品的配制 天然丰度氨基酸对照品:称取精氨酸1.2 mg,赖氨酸1.0 mg,谷氨酰胺1.0 mg,亮氨酸1.2 mg,异亮氨酸1.0 mg,天门冬酰胺1.4 mg,甘氨酸1.5 mg,丙氨酸1.5 mg,脯氨酸0.9 mg,苏氨酸1.0 mg,谷氨酸1.0 mg,丝氨酸1.2 mg,苯丙氨酸0.8 mg,天冬氨酸1.2 mg,缬氨酸1.2 mg于2.0 mL的气相进样瓶中。于40 ℃真空干燥2 h,依次加入800 μL吡啶和800 μL MSTFA,于60 ℃下反应2 h,待GC-MS分析。15N标记氨基酸对照品的处理方法与天然丰度氨基酸对照品相同。
1.2.2发酵液的处理15N标记精氨酸发酵液处理:取5 mL15N精氨酸发酵液于10 mL离心管中,4 000 r/min离心30 min,取上清液加入HCl调至pH 2.86,再以4 000 r/min离心10 min,取出上清液待净化。
活化处理固相萃取小柱,将待净化的发酵液1 mL转移至柱中,加5 mL去离子水淋洗,0.2 mol/L氨水进行洗脱,收集流出液。将收集液于-65 ℃的冷冻干燥机中进行冻干后,40 ℃真空干燥2 h,依次加入800 μL吡啶和800 μL MSTFA,60 ℃下反应2 h,待GC-MS分析。
1.2.3实验条件色谱条件:色谱柱:Agilent HP-5 MS毛细管柱(30 m×0.25 mm×0.25 μm);载气He气(纯度99.999%),流速1.0 mL/min;进样口温度290 ℃;升温程序:以5 ℃/min由80 ℃升至110 ℃,然后以10 ℃/min升至150 ℃,以5 ℃/min升至170 ℃,再以10 ℃/min升至250 ℃,最后以20 ℃/min升至300 ℃;进样量0.1 μL;分流比20∶1。
质谱分析条件:电子轰击离子源(EI),电离能量70 eV;全扫描(Scan)模式,扫描范围m/z50~500;离子源温度230 ℃;四极杆温度150 ℃;接口温度300 ℃。
2 结果与讨论
2.1固相萃取(SPE)条件的优化
2.1.1SPE小柱的选择对比了两种阳离子交换SPE小柱(SCX和MCX小柱)对精氨酸发酵液的纯化效果。选取MCX小柱和SCX小柱对1 mg/mL的氨基酸混合溶液(15种氨基酸)富集净化后进行测试,结果表明,MCX小柱所需洗脱液体积为4 mL,而SCX小柱则需9 mL,前者的回收率为83.4%~94.6%,后者的回收率为82.1%~95.4%。
SCX为最强的阳离子交换小柱,其官能团为苯磺酸,除了阳离子交换外,非极性的苯环在对精氨酸发酵液净化过程中也会产生非极性吸附的作用。MCX小柱的基质为苯乙烯-二乙烯苯共聚物,聚合物表面有亲水性和疏水性基团,具有良好的水浸润性。实验结果显示,SCX和MCX小柱对精氨酸发酵液具有相同的纯化效果,但由于SCX小柱对氨基酸的结合能力强,需要更多体积的氨水才可将氨基酸全部洗脱,实验时间较长。因此选择MCX小柱对精氨酸发酵液进行净化。
2.1.2发酵液的酸碱度调节氨基酸属于两性极性化合物,当氨基酸溶液的pH值低于其等电点时,氨基酸带正电。天冬氨酸为酸性最强的氨基酸,其等电点为2.85,当发酵液的pH值低于2.85时,发酵液中的氨基酸均带有正电荷,可被MCX固相萃取小柱所吸附,从而达到净化目的。为使全部的氨基酸带上正电荷进而与MCX小柱上的离子进行交换,在处理精氨酸发酵液实际样品时,将发酵液的pH值调至2.8左右。
2.1.3淋洗液、洗脱液的选择氨基酸发酵液经离心后,其组分均为可溶性物质但成分复杂。因此,在SPE上样后用超纯水进行淋洗。与NaOH和NH4Cl相比,使用氨水作为洗脱剂对保留在SPE小柱上的氨基酸进行洗脱,不会引入盐类杂质,且可有效保护GC-MS联用仪,根据离子交换树脂的交换机理,当精氨酸完全被洗脱时,其他氨基酸也完全被洗脱下来。
2.2氨基酸对照品的检测
2.2.1天然丰度氨基酸与15N标记氨基酸的GC-MS图谱分析图1为MSTFA与赖氨酸的反应示意图。MSTFA是一种硅烷化试剂,在硅烷化反应进程中,四甲基硅烷(TMS)将取代氨基酸中含有活性氢的基团,衍生后的氨基酸沸点降低,极性降低,具有更好的热稳定性。

图1 赖氨酸与MSTFA的衍生反应Fig.1 Derivatization reaction of lysine with MSTFA
在优化的气相色谱条件下,15种天然丰度氨基酸达到基线分离。将氨基酸衍生物的离子碎片信息在NIST谱库中进行匹配,其出峰顺序为:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甘氨酸、丝氨酸、苏氨酸、天冬氨酸、精氨酸、谷氨酸、苯丙氨酸、天门冬酰胺、谷氨酰胺、赖氨酸。天然丰度氨基酸对照品和15N标记氨基酸对照品衍生物的GC-MS总离子流图如图2所示。

图2 天然丰度氨基酸对照品(A)和15N标记氨基酸对照品(B)衍生物的GC-MS总离子流图Fig.2 Total ion chromatograms of natural abundance(A) and high abundance 15N labeling(B) reference substance derivatives 1:alanine;2:valine;3:leucine;4:isoleucine;5:proline;6:glycine;7:serine;8:threonine;9:aspartic acid;10:arginine; 11:glutamate;12:phenylalanine;13:asparagine;14:glutamine;15:lysine;*derivatization byproducts
通过对GC-MS的总离子流图做进一步解析,可得到每种氨基酸衍生物的EI图谱信息。根据氨基酸衍生物的出峰时间以及离子碎片信息,对15N标记的氨基酸衍生物进行定性分析。以亮氨酸为例,天然丰度的亮氨酸出峰时间为10 min,基峰为m/z158,EI质谱图如图3A所示;15N标记亮氨酸的出峰时间与天然丰度相同,且只有1个N被15N所取代,其基峰为m/z159,如图3B所示。


图3 天然丰度亮氨酸(A)和15N标记亮氨酸(B)的EI图谱Fig.3 Electron impact(EI) spectra of natural leucine(A) and high abundance 15N labeling leucine(B)
天然丰度氨基酸和15N标记氨基酸具有相同的色谱行为,出峰时间相同。由于氨基酸中的N被15N取代的个数不同,从而具有不同的特征离子碎片(见表1)。

表1 天然丰度氨基酸和15N标记氨基酸对照品的离子碎片信息和出峰时间Table 1 Characteristic fragment and retention time of natural amino acids and high abundance 15N labeling amino acids

图4 天然丰度精氨酸发酵液的TIC图Fig.4 Total ion chromatogram of natural abundance fermentation broth of arginine1:leucine;2:isoleucine;3:arginine;4:glutamine;5:lysine
2.3天然丰度精氨酸发酵液中的氨基酸组分分析
采用优化的SPE固相萃取条件,对天然丰度精氨酸发酵液进行前处理和衍生化后进样分析。天然丰度精氨酸发酵液的总离子流图如图4所示,根据氨基酸衍生物的出峰时间及NIST谱库匹配结果可以得出,天然丰度精氨酸发酵液中含有亮氨酸、异亮氨酸、精氨酸、谷氨酰胺和赖氨酸5种氨基酸。从图4可以看出,MCX固相萃取小柱对精氨酸发酵液的分离纯化效果较为理想。
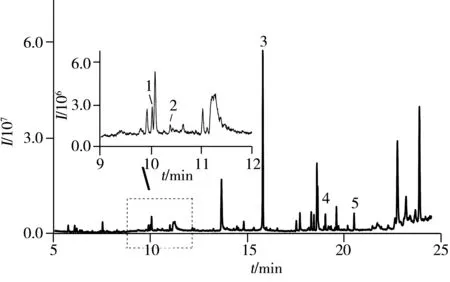
图5 15N标记精氨酸发酵液的TIC图 Fig.5 Total ion chromatogram of high abundance fermentation broth of labeling arginine1:leucine-15N;2:proline-15N;3:arginine-15N4;4:glutamine-15N;5:lysine-15N2
2.415N标记精氨酸发酵液中氨基酸组分分析及丰度计算
采用与天然丰度精氨酸发酵液相同的SPE固相萃取条件对15N标记精氨酸发酵液进行净化。图5为15N标记精氨酸发酵液的总离子流图。通过图2B的出峰时间以及表1的特征离子碎片进行定性,可知15N精氨酸发酵液中含有亮氨酸-15N、脯氨酸-15N、精氨酸-15N4、谷氨酰胺-15N和赖氨酸-15N25种氨基酸。
根据氨基酸衍生物EI图谱的特征碎片对15N标记氨基酸的同位素丰度进行计算[18],上述5种标记氨基酸的丰度依次为98.02%,96.36%,98.36%,95.28%以及98.53%。
3 结 论
通过优化固相萃取条件,成功建立了固相萃取-衍生化/GC-MS联用测定氨基酸发酵液实际样品中15种氨基酸的方法。根据EI图谱的离子碎片信息,对15N标记精氨酸发酵液中的亮氨酸-15N、脯氨酸-15N、精氨酸-15N4、谷氨酰胺-15N和赖氨酸-15N2的同位素丰度进行计算。该方法为氨基酸发酵液后期的分离纯化和高丰度氨基酸的回收提供了指导依据。此外,该方法还可应用于食品、生物等领域氨基酸的检测。
[1]Liu Z F,Yue H Y,Yuan Q P,Wang W C.Nucl.Technol.(刘占峰,岳海艳,袁其鹏,汪文川.核技术),2004,27(9):681-686.
[2]Shen G B,Xu Y H,Gong F M,Liang S F.Lett.Biotechnol.(沈国波,徐玉环,龚凤鸣,梁淑芳.生物技术通讯),2009,2(20):238-242.
[3]Ong S E,Blagoev B,Kratchmarova I,Kristensen D B,Steen H,Pandey A,Mann M.Mol.CellProteomics,2002,1(5):376-386.
[4]Liu W,He F C,Jiang Y.Chem.Life(刘伟,贺福初,姜颖.生命的化学),2009,29(3):427-430.
[5]Liang X H ,Zhao G L,Zhao R X.FoodFerment.Ind.(梁新红,赵功玲,赵瑞香.食品与发酵工业),2007,33(4):229-232.
[6]Qi J S,Tie S G,Han X H,Yue R Q,Yan S F,Lu C X.Chin.Agric.Sci.Bull.(齐建双,铁双贵,韩小花,岳润清,燕树锋,卢彩霞.中国农学通报),2014,30(30):199-202.
[7]Pu Y Y.Acad.Period.FarmProd.Process.(蒲云月.农产品加工),2014,9(9):35-38.
[8]Feng Z Q,Zhou F M,Huang Y L,Liao Q F,Sun W W.Chin.FoodAddit.(冯志强,周芳梅,黄永连,廖权丰,孙雯雯.中国食品添加剂),2013,12(5):198-206.
[9]Bosch L,Alegria A,Farre R.J.Chromatogr.B,2006,831(s1-2):176-183.
[10]Pasquale A,Luigi C,Mario V R.Anal.Lett.,2006,34(6):867-882.
[12]Guo M C,Shi T Y,Duan Y H,Zhu J L,Li J J,Cao Y S.J.FoodCompos.Anal.,2015,42:84-90.
[13]Rebane R,Herodes K.J.Chromatogr.A,2012,1245(13):134-142.
[14]Erina T,Tadashi H,Hideyuki Y,Osamu I,Masatoshi Y,Hitoshi N.J.Pharm.Biomed.Anal.,2015,115:201-207.[15]Yoshida H,Kondo K,Yamamoto H,Kageyama N,Ozawa S I,Shimbo K,Muramatsu T,Imaizumi A,Mizukoshi T,Masuda J,Nakayama D,Hayakawa Y,Watanabe K,Mukaibatake K,Miyano H.J.Chromatogr.B,2015,998/999:88-96.
[16]Zheng B,Du X N,Zhang W B,Song M M,Cai Y P.ShandongChem.Ind.(郑波,杜晓宁,张维冰,宋明鸣,蔡银萍.山东化工),2013,42(5):68-71.
[17]He X X,Sun Y,Chen H.FoodDrug(贺小贤,孙莹,陈合.食品与药品),2007,9(1):18-20.
[18]Lei W,Hou J,Du X N,Zhang W B.Chin.J.Anal.Chem.(雷雯,侯捷,杜晓宁,张维冰.分析化学),2015,10(43):1465-1471.
Determination of15N Labeled Arginine Fermentation Broth and Isotope Abundance by GC-M
SHOU Jie,LEI Wen,DU Xiao-ning*,REN Zheng,YUE Han-xiao
(Shanghai Research Institute of Chemical Industry,Shanghai Engineering and Technological Research Centre for Stable Isotope,Shanghai200062,China)
A method for the determination of arginine,lysine,serine,valine and other eleven amino acids was developed by MSTFA derivatization combined with gas chromatography-mass spectrometry(GC-MS),and fifteen amino acids reached the baseline separation.The arginine fermentation broth was purified by cationic exchange mixed-solid phase extraction(SPE), and then detected successfully by the developed method.Finally the15N isotope abundance was calculated by characteristic fragment.
gas chromatography-mass spectrometry(GC-MS);derivatization;amino acids;15N labeled amino acids;isotope abundance
2016-01-26;
2016-03-01
科技部“十二五”支撑计划项目(2015BAK45B-20);上海市科委标准专项(15DZ0504701);上海市科委地方攻关计划项目(14DZ0511800)
杜晓宁,教授级高工,研究方向:稳定同位素化学,Tel:13816255065,E-mail:xiaoningdu@163.com
10.3969/j.issn.1004-4957.2016.09.010
O657.63;O629.7
A
1004-4957(2016)09-1132-05
