基于HDT自组装金纳米粒子修饰电极的微囊藻毒素-LR电化学免疫传感器研究
2016-11-08张晶晶康天放李娜娜鲁理平程水源
张晶晶,康天放,李娜娜,鲁理平,程水源
(北京工业大学 区域大气复合污染防治北京市重点实验室,环境与能源工程学院,北京 100124)
基于HDT自组装金纳米粒子修饰电极的微囊藻毒素-LR电化学免疫传感器研究
张晶晶,康天放*,李娜娜,鲁理平,程水源
(北京工业大学区域大气复合污染防治北京市重点实验室,环境与能源工程学院,北京100124)
构建了一种新型的基于金纳米粒子(AuNPs)修饰金电极的微囊藻毒素-亮氨酸-精氨酸(MCLR)电化学免疫传感器。采用柠檬酸钠还原法制备了AuNPs溶胶,分别用透射电子显微镜和紫外-可见吸收光谱对其进行表征。将AuNPs组装到1,6-己二硫醇(HDT)自组装单分子层修饰的金电极表面,再将MCLR抗体(anti-MCLR)固定于该修饰电极上,利用扫描探针显微镜法、循环伏安法和电化学交流阻抗法(EIS)表征了自制化学修饰电极表面的形貌特征和电化学免疫传感器的电化学特征。通过辣根过氧化物酶标记的MCLR(MCLR-HRP)与MCLR竞争结合抗体,建立了检测MCLR的差分脉冲伏安法(DPV)。在最佳实验条件下,用DPV对MCLR检测的线性范围为0.01~25 μg/L,检出限为0.005 μg/L。对构建的免疫传感器的重现性、稳定性和选择性进行了考察。该方法对实际水样中MCLR的加标回收率为100%~102%,测定结果与高效液相色谱法的测定结果一致。
微囊藻毒素;金纳米粒子;自组装;免疫传感器
近年来,世界范围内由于微囊藻毒素引起的湖泊、水库等饮用水源的水体污染事件频发,已严重威胁到人类饮用水安全[1-2]。蓝藻水华释放出的藻毒素中微囊藻毒素(Microcystins,MCs)是出现频率最高、毒性最强的亚型[3-4],可引起皮肤刺激、过敏反应、肌肉和关节痛等症状[5],其毒性主要表现为强烈抑制蛋白磷酸酶PP1和PP2A的活性,导致肝肾损伤、肿瘤生成等[2]。目前已发现MCs有近90种同分异构体[4,6-7],其中微囊藻毒素-亮氨酸-精氨酸(MCLR)是最常见、毒性最强的微囊藻毒素[4,8-9],为保障饮用水安全,世界卫生组织(WHO)制定的《饮用水水质准则》中规定MCLR限值为1 μg/L[10]。目前检测MCLR的方法主要有高效液相色谱法(HPLC)[7-8]、高效液相色谱-质谱法(HPLC-MS)[3]、气相色谱-质谱法(GC-MS)[1,11],这些方法虽灵敏度高、稳定性好,但操作周期长,设备昂贵,对技术人员要求较高[1]。而生物测试法[12]和酶联免疫法[13-15]因耗时、灵敏度低而应用受限。电化学免疫传感器因具有灵敏度高、特异性好、操作简便[14]等优点而得到广泛应用[3,16-20]。金纳米粒子(AuNPs)则因比表面积大、吸附能力强、导电性和生物相容性好等优点[21-22],被广泛应用于生物传感器和化学传感器中[23-24]。本研究用1,6-己二硫醇(HDT)两端的巯基分别与金电极(GE)和AuNPs相连接,将AuNPs自组装到金电极表面,利用AuNPs固定微囊藻毒素抗体(anti-MCLR),用牛血清白蛋白(BSA)封闭非特异性吸附位点,构建了一种新型的微囊藻毒素免疫传感器。
1 实验部分
1.1仪器与试剂
CHI 660a电化学工作站(上海辰华仪器公司),实验采用三电极系统:金电极(Φ=2 mm)为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为辅助电极。2450型紫外-可见吸收光谱仪(岛津公司);SPM-9600型扫描电子显微镜(岛津公司);HT-7700型扫描探针显微镜(日本日立公司);1200型高效液相色谱仪(美国安捷伦科技有限公司)。
微囊藻毒素单克隆抗体、微囊藻毒素-亮氨酸-精氨酸 、微囊藻毒素-精氨酸-精氨酸(MC-RR)、微囊藻毒素-酪氨酸-精氨酸(MC-YR)、辣根过氧化物酶标记的MC-LR(MCLR-HRP)购自北京伊普瑞斯有限公司;氯金酸(HAuCl4·3H2O)、对苯二酚(HQ)和1,6-己二硫醇(HDT)购于北京百灵威科技有限公司,牛血清白蛋白购于Sigma有限公司,柠檬酸钠和双氧水购于福辰化学试剂有限公司。所有试剂均为分析纯及以上。实验用水为超纯水(Milli-QAdvantage A10超纯水系统,法国Millipore公司)。
1.2金溶胶的制备
将8 mL 1% 的柠檬酸三钠溶液迅速加至0.01% 100 mL沸腾状态下的HAuCl4溶液中,搅拌15 min后,混合溶液的颜色由浅黄变为酒红色。自然冷却至室温,即得金纳米粒子溶胶,将其置于4 ℃冰箱黑暗条件下保存备用[24-25]。
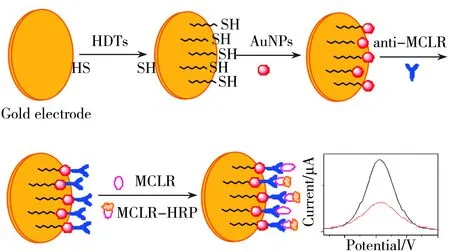
图1 免疫传感器的制备过程及响应原理示意图Fig.1 Illustration of fabrication process and response mechanism of the immunosensora:in blank solution;b:in the presence of MCLR
1.3免疫传感器的制备
免疫传感器的制备过程如图1所示。将金电极用粒径为0.02~0.05 μm的Al2O3悬浊液抛光成镜面后,用水清洗干净,浸泡于新制的piranha溶液即H2O2∶H2SO4(3∶7)中活化15 min,然后分别在乙醇和水中超声清洗5 min,氮气吹干。将金电极放入0.5% HDT溶液中浸泡过夜,通过Au-S键将HDT单分子层自组装于金电极表面,得到HDT/GE;再向HDT/GE表面滴加10 μL金纳米粒子溶胶,4 ℃下静置12 h,AuNPs通过Au-S与HDT相连接,即得Au/HDT/GE;然后将5 μL 20 μg/mL 的anti-MCLR滴加至Au/HDT/GE表面,湿盒中静置1 h,得到anti-MCLR/Au/HDT/GE;最后用10 μL 1% BSA溶液封闭特异性位点,将所制得的免疫传感器于4 ℃下储存备用。
1.4MCLR的检测方法
将5 μL不同浓度的MCLR溶液和5 μL 15 μg/mL的MCLR-HRP先后滴加至免疫传感器表面,室温下湿盒中孵育1 h。电化学测试底液为含有1.5 mmol/L H2O2和3 mmol/L HQ的0.1 mol/L 磷酸盐缓冲溶液(PBS,pH 7.4)。MCLR的测定采用差分脉冲伏安法(DPV)和安培法。DPV的电位扫描范围为-0.3~0.1 V,脉冲振幅50 mV,免疫反应后差分脉冲峰电流Ip随MCLR浓度的增加而减小,空白溶液的峰电流记作I0,通过空白溶液与MCLR溶液峰电流的差值ΔI(ΔI=I0-Ip)进行定量分析(见图1)。安培法是在+0.4 V(vs.SCE)恒电位下,待背景电流稳定后迅速加入HQ溶液,记录电极对HQ的电流响应。
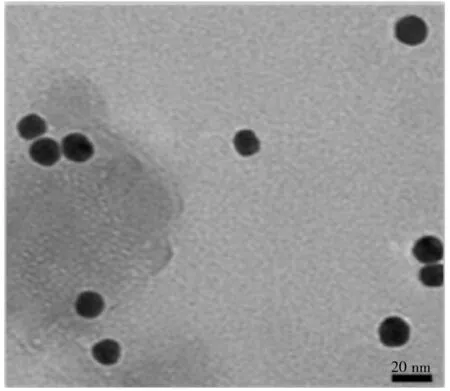
图2 金纳米粒子溶胶的透射电子显微镜图Fig.2 TEM image of colloidal Au nanoparticles
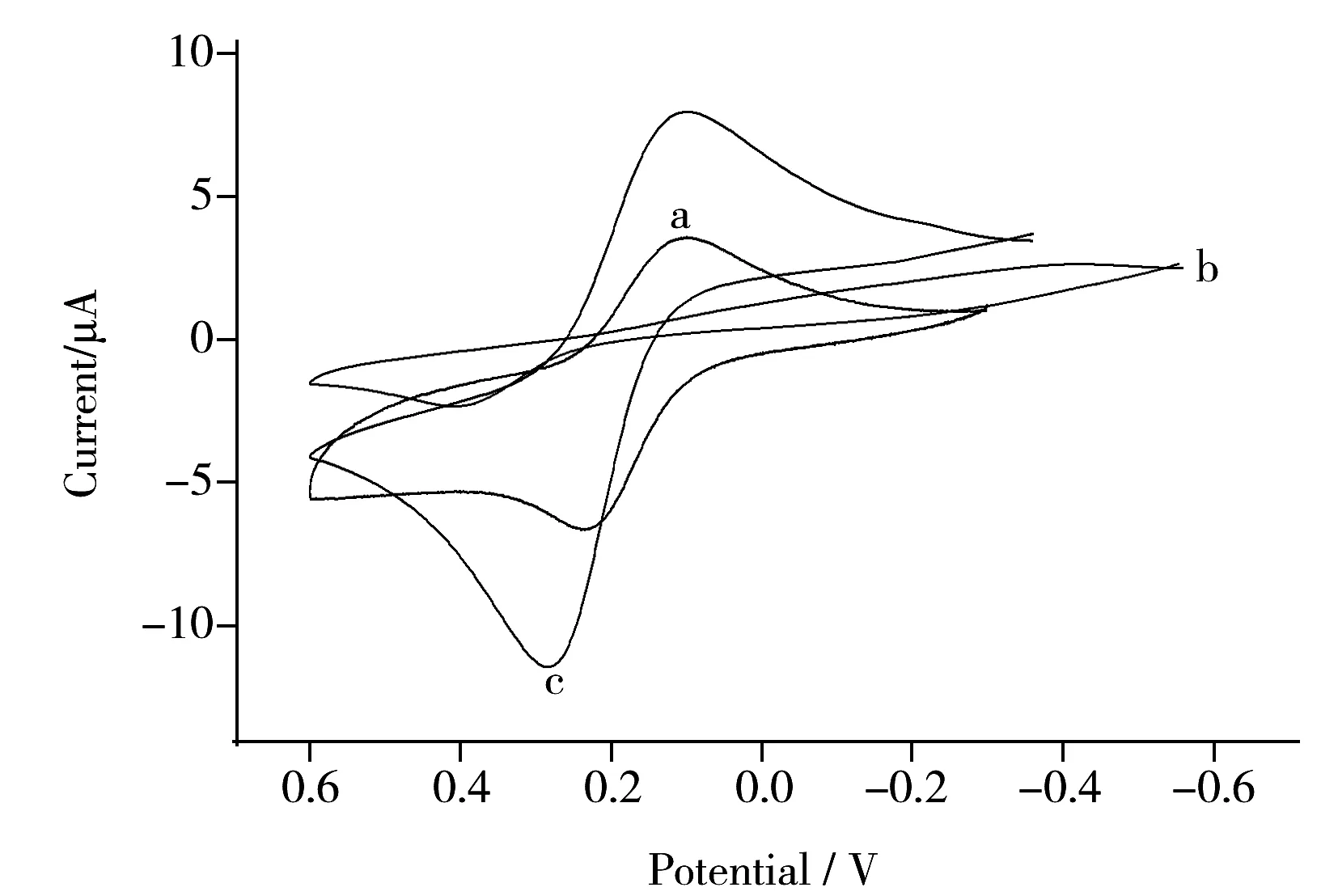
图3 不同电极的循环伏安图Fig.3 Cyclic voltammograms of different electrodesa.bare GE,b.HDTs/GE,c.AuNPs/HDTs/GE;solution:1 mmol/L [Fe(CN)6]3-/4-
2 结果与讨论
2.1金纳米粒子的表征
本研究对AuNPs进行了紫外-可见吸收光谱表征,结果显示其在518 nm左右出现强吸收峰,根据公式[24]λmax=507.1+8.68×ln[0.2×size(AuNPs)(nm)] 计算金纳米粒子的粒径约为17 nm。根据AuNPs的透射电子显微镜图(TEM)(图2),可观察到金纳米粒子呈球形分布,粒径为15~18 nm,无团聚现象。
2.2金纳米粒子修饰电极的表征
在电位扫描范围为-0.6~0.6 V,扫描速率为100 mV/s条件下,考察了裸金电极(a)、HDTs/GE(b)和AuNPs/HDTs/GE(c)在含1 mmol/L [Fe(CN)6]3-/4-的0.1 mol/L KCl 溶液中的循环伏安曲线(图3)。与裸金电极相比,由于HDT分子层对电子传递的阻碍作用,显著减小了电极的氧化还原峰电流;而当金纳米粒子结合到电极表面后,由于金纳米粒子良好的导电性,[Fe(CN)6]3-/4-的氧化还原峰电流明显增大,且大于裸电极上的峰电流,这说明AuNPs与HDT单分子层成功结合,且AuNPs的存在提高了电极的导电性能。
采用扫描探针显微镜(SPM)对AuNPs/HDTs/GE的表面形貌进行表征,结果显示,金纳米粒子修饰于金电极表面为免疫传感器提供了更大的表面积,从而使电极上可修饰更多的anti-MCLR,最终改善了免疫传感器的检测灵敏度。
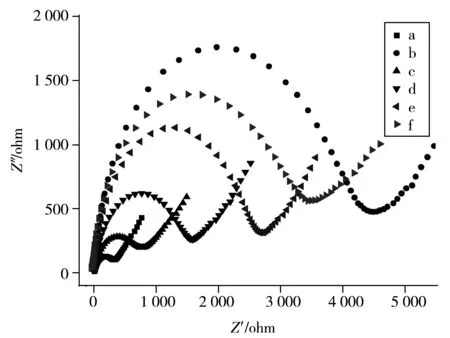
图4 不同电极的电化学交流阻抗图Fig.4 Electrochemical impedance spectra of different electrodes a.bare GE,b.HDTs/GE,c.AuNPs/HDTs/GE,d.anti-MCLR/AuNPs/HDTs/GE,e.BSA/anti-MCLR/AuNPs/HDTs/GE,f.MCLR-HRP/BSA/anti-MCLR/AuNPs-HDTs/GE;solution:5.0 mmol/L [Fe(CN)6]3-/4-
2.3电极在修饰过程中的电化学表征
采用电化学交流阻抗法(EIS)检测了修饰电极界面的特性。图4为电极修饰过程中的阻抗谱图,曲线高频部分呈半圆形,其直径等于界面电荷转移阻抗(Ret)值,低频部分受传质控制。裸金电极的交流阻抗图近似呈一个小半圆(曲线a),表明电极表面只受扩散控制;当电极表面修饰上HDT单分子层后,其阻抗值显著增大(曲线b),说明该分子层阻碍探针离子[Fe(CN)6]3-/4-在电极上的电子传输;当在电极表面修饰纳米金后,阻抗值明显降低(曲线c),说明纳米金具有极好的导电性;金电极表面依次修饰上anti-MCLR,BSA,MCLR-HRP后,电极的阻抗值逐渐增大(曲线d~f),这些物质增大了探针分子在通过膜时的阻力,表明其已被成功地固定到电极表面。
2.4实验条件的优化
2.4.1anti-MCLR浓度的优化 在5~30 μg/mL范围内,采用差分脉冲伏安法考察了anti-MCLR浓度对免疫传感器响应峰电流的影响。结果表明,随着anti-MCLR浓度的增大,免疫传感器的DPV峰电流先逐渐增大后趋于平缓。anti-MCLR浓度为20 μg/mL时,峰电流达到最大值,此后再增大anti-MCLR浓度,峰电流不再增大。因此选择anti-MCLR的最佳浓度为20 μg/mL。
2.4.2MCLR-HRP浓度的优化免疫传感器表面修饰的HRP对其响应灵敏度有直接影响。将不同浓度MCLR-HRP修饰于免疫电极BSA/anti-MCLR/AuNPs-HDTs/GE上,发现其峰电流随着MCLR-HRP浓度的增大而增大,当MCLR-HRP浓度达到15 μg/mL时,峰电流不再增大,表明此时免疫电极表面的特异性位点已完全结合MCLR-HRP,因此选择 MCLR-HRP的最佳浓度为15 μg/mL。
2.4.3测试底液中H2O2与HQ浓度的优化 底液中H2O2与HQ的浓度对免疫传感器的响应信号有重要影响。分别将免疫传感器MCLR-HRP/BSA/anti-MCLR/AuNPs-HDTs/GE浸入含0.5,1.0,1.5,2.0,2.5 mmol/L H2O2的测试底液中,测量DPV峰电流。结果显示,H2O2的浓度在0.5~1.5 mmol/L范围内,峰电流随着H2O2浓度的增加而增大,当H2O2浓度达到1.5 mmol/L时峰电流不再增大,故选择 H2O2的最佳浓度为1.5 mmol/L。同理,分别将免疫电极浸入含1.0,2.0,3.0,3.5,4.0 mmol/L HQ的测试底液中,结果显示,HQ的最佳浓度为3.0 mmol/L。
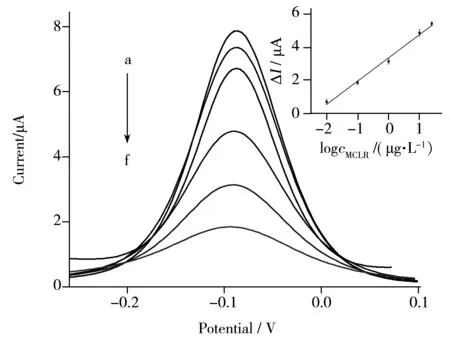
图5 传感器对不同浓度MCLR的差分脉冲伏安图Fig.5 Differential pulse voltammograms of different concentrations MCLR on the sensorsolution:0.1 mol/L PBS (pH 7.4) containing 3.0 mmol/L HQ and 1.5 mmol/L H2O2 ;insert:calibration curve,concentration of MCLR(a-f):0,0.01,0.10,1.0,10,25 μg/L
2.5MCLR的测定
在优化实验条件下,考察了MCLR-HRP/anti-MCLR/Au/HDT/GE免疫传感器对不同浓度MCLR的电流响应。如图5所示,差分脉冲伏安峰电流随MCLR浓度的增加而减小,且ΔI与MCLR浓度(μg/L)的对数在0.01~25 μg/L范围内呈良好线性关系,回归方程为ΔI(μA)=3.354+1.401lgc,相关系数为0.991 8,检出限(S/N=3)为0.005 μg/L。
采用安培法考察了MCLR-HRP/anti-MCLR/Au/HDT/GE免疫传感器的性能。在含1.5 mmol/L H2O2的0.1 mol/L PBS缓冲溶液中,工作电极的电位为+400 mV,在搅拌状态下,待电流稳定后迅速加入3 mmol/L HQ。结果显示,响应电流随MCLR浓度的增大而减小,电流差值ΔI与MCLR浓度的对数在0.010~10 μg/L范围内呈线性关系,回归方程为ΔI(μA) =-14.861+5.081 lgc,相关系数为0.992 8,检出限为0.004 6 μg/L。
2.6重现性、稳定性与选择性
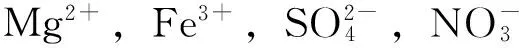
2.7实际水样的检测
将该免疫传感器用于北京市通惠河河水的检测,通过加标回收实验对MCLR浓度进行测定。水样预处理分为两步:经过3次-20 ℃冷冻萃取、20 ℃以上室温解冻、30 min以上超声处理;用孔径为0.45 μm的滤膜对上述水样进行抽滤。表1结果显示,原始水样中均未检出MCLR,对其进行10.00,15.00 μg/L浓度水平的加标回收实验,其回收率分别为102%和100%,检测结果与标准方法[7]结果相符。

表1 免疫传感器和HPLC法对实际水样测定结果的对比Table 1 Comparative determination of MCLR in real sample by the proposed immunosensor and HPLC method
3 结 论
本文将AuNPs组装到1,6-己二硫醇自组装单分子层修饰的金电极表面,再将MCLR抗体固定于该修饰电极上,构建了一种检测MCLR的免疫传感器。与交联反应固定抗体方法相比,本文固定anti-MCLR的方法不仅很好地保持了抗体的活性,而且固定在电极表面的传感层较薄,有利于分子、离子在电极表面的扩散。此外,AuNPs的加入增强了电极的导电性,并增大了抗体在免疫传感器上的固定量。该传感器的制作方法简单,测定重现性好、选择性高,具有较好的应用前景。
[1] Loyprasert S,Thavarungkul P,Asawatreratanakul P,Wongkittisuksa B,Limsakul C,Kanatharana P.Biosens.Bioelectron.,2008,24:78-86.
[2]Ma W,Chen W,Qiao R R,Liu C Y,Yang C H,Li Z K,Xu D H,Peng C F,Jin Z Y,Xu C L,Zhu S F,Wang L B.Biosens.Bioelectron.,2009,25:240-243.
[3] Li Y,Sun J D,Wu L Y,Ji J,Sun X L,Qian Y Z.Biosens.Bioelectron.,2014,62:255-260.
[4] Long F,He M,Zhu A N,Shi H C.Biosens.Bioelectron.,2009,24:2346-2351.
[5] Puerto M,Pichardo S,Jos A,Camean A M.Toxicon,2009,54:161-169.
[6] Welker M,Dohren H V.FEMSMicrobiol.Rev.,2006,30:530-563.
[7]GB/T 20466-2006.Determination of Microcystins in Water.National Standards of the People’s Republic of China(水中微囊藻毒素的测定.中华人民共和国国家标准).
[8] Zhao H,Tian J,Quan X.ColloidSurf.B,2013,103:38-44.
[9] Xu X,Yu R,Wang L P,Wu S,Song Q.Anal.Methods,2013,5:1799-1805.
[10]WHO.GuidelinesforDrinking-WaterQuality.3rd ed.Geneva:World Health Organization,2008:195-196.
[11]Draper W M,Xu D,Perera S K.Anal.Chem.,2009,81:4153-4160.
[12]Watanabe M F,Oishi S,Harada K I,Matsuura K,Kawai H,Suzuki M.Toxicon,1988,26:1017-1025.
[13]Khreich N,Lamourette P,Renard P Y,Clave G,Fenaille F,Creminon C,Volland H.Toxicon,2009,53:551-559.
[14]Kim Y M,Oh S W,Jeong S Y,Pyo D J,Choi E Y.Environ.Sci.Technol.,2003,37:1899-1904.
[15]Campas M,Marty J L.Biosens.Bioelectron.,2007,22:1034-1040.
[16]Xue R,Kang T F,Lu L P.J.Instrum.Anal.(薛瑞,康天放,鲁理平.分析测试学报),2012,31(8):940-944.
[17]Wang L,Kang T F,Zhang J J,Lu L P,Cheng S Y.J.Instrum.Anal.(王玲,康天放,张晶晶,鲁理平,程水源.分析测试学报),2015,34(5):552-557.
[18]Zhang J J,Kang T F,Hao Y C,Lu L P,Cheng S Y.Sens.ActuatorB,2015,214:117-123.
[19]Wang L,Kang T F,Lu L P,Zhang J G,Xue R,Cheng S Y.Anal.Lett.,2014,47(18):2939-2949.
[20]Zhang J G,Kang T F,Xue R,Sun X.Chin.J.Anal.Chem.(张金果,康天放,薛瑞,孙雪.分析化学),2013,41(9):1353-1358.
[21]Yang Y C,Dong S W,Shen T,Jian C X,Chang H J,Li Y,Zhou J X.Electrochim.Acta,2011,56:6021-6025.
[22]Rezaei B,Majidi N,Rahmani H,Khayamian T.Biosens.Bioelectron.,2011,26:2130-2134.
[23]Omidfar K,Khorsand F,Azizi M D.Biosens.Bioelectron.,2013,43:336-347.
[24]Zhou J,Du L,Zou L,Zou Y,Hu N,Wang P.Sens.ActuatorB,2014,197:220-227.
[25]Liu Z,Ma Z.Biosens.Bioelectron.,2013,46:1-7.
Study on Electrochemical Immunosenor for Microcystin-LR Based on HDT Self-assembly Au Nanoparticle Modified Electrode
ZHANG Jing-jing,KANG Tian-fang*,LI Na-na,LU Li-ping,CHENG Shui-yuan
(College of Environmental and Energy Engineering,Key Laboratory of Beijing on Regional Air Pollution Control,Beijing University of Technology,Beijing100124,China)
A novel electrochemical immunosensor for microcystin-(leucine-arginine)(MCLR) was developed based on gold electrode modified with Au nanoparticles(AuNPs).The AuNPs were prepared by the sodium citrate reduction method,and characterized by transmission electron microscopy(TEM) and UV-vis absorption spectroscopy.1,6-hexanedithiol(HDT) molecules were modified onto the surface of a gold electrode to form self-assembly monolayer,and then the AuNPs were assembled on the self-assembly monolayer of HDT.The immunosensor was constructed by immobilizing the antibody of microcystin-(leucine-arginine)(anti-MCLR) on the modified electrode.The surface morphology of the AuNPs modified electrode and the electrochemical behaviour of the immunosensor were characterized by scanning probe microscopy,cyclic voltammetry and electrochemical impedance spectroscopy(EIS),respectively.MCLR and horseradish peroxidase conjugated MCLR(MCLR-HRP) competitively combined with immobilizing anti-MCLR.The determination of MCLR using the immunosensor was investigated by differential pulse voltammetry(DPV).Under the optimized conditions,a linear range from 0.01 μg/L to 25 μg/L and a detection limit of 0.005 μg/L were obtained by DPV method.The reproducibility,stability and selectivity of the immunosensor for MCLR were investigated.The proposed method was applied in the determination of MCLR in real water samples with recoveries of 100%-102%,and the determination results of MCLR were consistent with those obtained by HPLC method.
microcystin;gold nanoparticles;self-assembly;immunosensor
2016-01-22;
2016-04-04
国家教育部博士点基金项目(20131103110011);国家科技支撑计划项目(2014BSC23B0204)
康天放,博士,教授,研究方向:化学生物传感技术及化学污染物快速检测应用,Tel:010-67391659,E-mail:kangtf@sina.cn,kangtf@bjut.edu.cn
10.3969/j.issn.1004-4957.2016.09.004
O657.1;S852.44
A
1004-4957(2016)09-1100-05
