碳纳米管修饰电极分子印迹传感器的制备及其对氧乐果的测定
2016-11-08赵永福陈振林
赵永福,陈振林
(1.郑州师范学院 化学化工学院,河南 郑州 450044;2.贺州学院 化学与生物工程学院,广西 贺州 542899)
碳纳米管修饰电极分子印迹传感器的制备及其对氧乐果的测定
赵永福1*,陈振林2
(1.郑州师范学院化学化工学院,河南郑州450044;2.贺州学院 化学与生物工程学院,广西贺州542899)
以氧乐果为模板分子,邻苯二胺为功能单体,在碳纳米管修饰的玻碳电极表面通过电聚合方法制成氧乐果分子印迹聚合物膜,用无水乙醇洗脱后制备出对氧乐果有特异响应的电化学传感器。通过循环伏安法和电化学阻抗法对分子印迹传感器的电化学性能进行表征。以K3Fe(CN)6为探针,采用差分脉冲伏安法研究了该分子印迹传感器的分析性能,建立了氧乐果的间接测定方法。结果表明,K3Fe(CN)6的相对峰电流与氧乐果浓度在1.0×10-7~2.0×10-6mol/L范围内呈良好的线性关系,检出限为3.6×10-8mol/L。
分子印迹;氧乐果;多壁碳纳米管;传感器
氧乐果是一种常用的高效、广谱性有机磷杀虫剂,属高毒杀虫剂,在农业生产中被广泛使用。但其残留会破坏生态环境,危害人类健康[1]。目前,氧乐果的检测方法主要有气相色谱法[2]、高效液相色谱法[3]、酶生物传感器法[4-5]、化学发光法[6]等。虽然这些方法能较准确地测定有机磷农药的含量,但其设备较为昂贵、处理分析样品过程繁杂、不适于现场快速检测。因此建立一种便捷且成本低的有机磷农药的检测新方法显得尤为重要。
分子印迹(Molecular imprinting)技术是近年发展起来的基于分子识别理论的高选择性分析方法,具有抗干扰能力强、亲和性高、使用寿命长、稳定等优点,因此被广泛用于电化学传感器的制备,并用于氨基酸[7]、药物[8-11]、兴奋剂[12-13]及残留毒物[14-16]等物质的测定。碳纳米管因其独特的中孔结构、较大的比表面积和较好的导电性能及催化性能,常被用于改善电化学传感器性能[17]。
本文采用多壁碳纳米管修饰玻碳电极,并以原位电聚合的方式制备氧乐果分子印迹聚合膜,通过去除模板分子获得氧乐果分子印迹传感器,可实现对无电活性氧乐果的测定。
1 实验部分
1.1仪器与试剂
RST5200F电化学工作站(郑州世瑞思仪器科技有限公司);三电极体系:玻碳电极、碳纳米管修饰电极(Ф=2 mm)、分子印迹电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极;KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司)。
氧乐果、敌敌畏、乐果、甲基对硫磷、杀螟硫磷标准品(纯度均>98.0%,天津农药质检中心);多壁碳纳米管(MWCNTs,南京吉仓纳米科技有限公司);邻苯二胺(分析纯,国药集团化学试剂公司)。其它试剂均为分析纯,实验用水为去离子水。
1.2实验方法
1.2.1碳纳米管修饰电极的制备玻碳电极经0.05 μm的Al2O3粉打磨,再依次用30%的硝酸、乙醇(95%)及水超声清洗3 min,最后在0.1 mol/L硫酸溶液中活化,室温下自然晾干,备用。称取10 mg 羧基化的CNTs加入10 mL N,N-二甲基甲酰胺,超声20 min 后,得到分散均匀的CNTs悬浮液。将7 μL CNTs悬浮液滴加至处理过的玻碳电极表面,室温下自然晾干,制得碳纳米管修饰电极(CNTs -GCE)[8]。
1.2.2分子印迹传感器的制备在含0.10 mmol/L氧乐果和10.0 mmol/L邻苯二胺的醋酸-醋酸钠缓冲液(ABS,pH 5.0)中,以CNTs-GCE 电极为工作电极,电位范围为0~0.8 V ,扫描速度为50 mV/s 时,以循环伏安法聚合20 圈,得到嵌有氧乐果分子的聚邻苯二胺及碳纳米管修饰电极(OM-POPD-CNTs-GCE)。将该电极置于95%乙醇溶液中浸泡,去除聚合膜中的氧乐果,得到氧乐果分子印迹传感器(MIP-POPD-CNTs -GCE)。
2 结果与讨论
2.1MIP-POPD-CNTs-GCE制备条件的优化
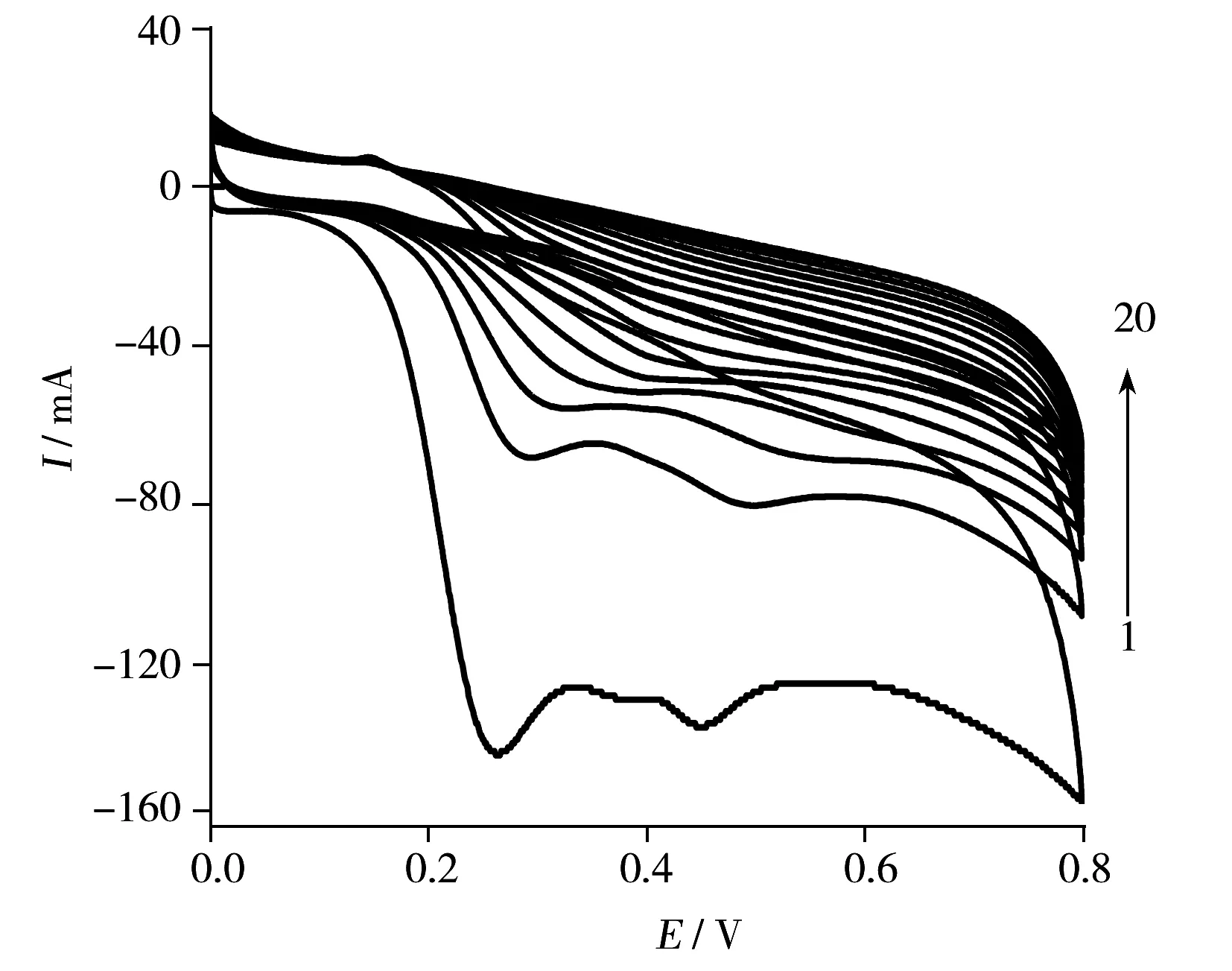
图1 氧乐果存在时邻苯二胺的聚合曲线Fig.1 Cyclic voltammograms for electropolymerization of o-phenylenediamine in the presence of 0.10 mmol/L omethoate acetate buffer(pH 5.0);scan rate:50 mV/s;sweep cycle:20
2.1.1邻苯二胺在CNTs-GCE上的聚合存在模板分子氧乐果时,邻苯二胺在CNTs-GCE上的电聚合曲线见图1。由图1可以看出,邻苯二胺的电聚合过程不可逆,并且随着扫描圈数的增加,邻苯二胺在CNTs-GCE电极上逐渐生成导电性较差的聚合膜,阻碍了聚合时的电子传递,聚合速度降低,氧化峰电流减小。当聚合20圈时,电流几乎为零,表明此时聚合完成。
2.1.2洗脱液及洗脱时间的选择研究了不同洗脱液对模板分子的去除效果,根据氧乐果的物理性质,实验分别使用40%甲醇、0.1 mol/L的NaOH、0.1 mol/L盐酸、乙腈-水(体积比4∶1)及95%乙醇5种洗脱液对镶嵌有氧乐果模板分子的聚合物进行洗脱,根据洗脱后修饰电极在K3Fe(CN)6溶液中的峰电流大小判断洗脱效果。结果表明,95%乙醇的洗脱效果较好,能迅速去除模板分子。
将OM-POPD-CNTs-GCE浸泡于95%乙醇溶液中进行不同时间的洗脱后,取出电极,用水洗涤,洗脱后的电极置于K3Fe(CN)6溶液中进行循环伏安扫描。结果显示,未经洗脱的OM-POPD-CNTs-GCE电极的电化学活性很低,在K3Fe(CN)6中的峰电流很小;随着浸泡时间的延长,由氧乐果溶出而留下的“空穴”逐渐增多,K3Fe(CN)6在电极表面的氧化还原电流逐渐增大;当浸泡时间达到20 min时,K3Fe(CN)6的氧化还原电流不再变化,表明此时聚合膜中的氧乐果已全部溶出。因此确定模板分子的洗脱时间为20 min。

图 2 不同电极在K3Fe(CN)6溶液中的循环伏安曲线Fig.2 Cyclic voltammograms of different electrodes in 0.01 mol/L K3Fe(CN)6 and 0.1 mol/L KCla.MIP-POPD-CNTs-GCE,b.OM-POPD-CNTs-GCE, c.CNTs -GCE;scan rate:50 mV/s;insert:electrochemical impedance spectra of 0.01 mol/L K3Fe(CN)6 and 0.1 mol/L KCl
2.2氧乐果分子印迹传感器的表征
为证实氧乐果在膜中的印迹效应,考察了不同电极(MIP-POPD-CNTs-GCE,OM-POPD-CNTs-GCE,CNTs-GCE)在0.01 mol/L K3Fe(CN)6溶液中的循环伏安图(图2)。结果表明,OM-POPD-CNTs-GCE上基本无电流响应,表明其表面被致密的不导电聚合物膜所覆盖,膜内镶嵌的氧乐果分子无电活性。氧乐果洗脱后,膜中留下了许多与模板分子结构匹配的“空穴”,使K3Fe(CN)6得以到达电极表面进行电子转移发生氧化还原反应,因此洗脱氧乐果后的MIP-POPD-CNTs-GCE上出现了明显的氧化还原峰。但K3Fe(CN)6在MIP-POPD-CNTs-GCE上的电流小于在CNTs-GCE上的电流,表明MIP-POPD-CNTs-GCE表面除了氧乐果溶出而留下的印迹“空穴”外,电极的其余部分均被非电活性的聚邻苯二胺膜所覆盖。CNTs-GCE因CNTs的催化性能及较大的比表面积,使K3Fe(CN)6的氧化还原峰电流很大。
进一步考察了MIP-POPD-CNTs-GCE,OM-POPD-CNTs-GCE及CNTs-GCE 3种电极的电化学阻抗谱图(EIS),阻抗谱中高频部分的半圆直径对应于电子转移阻抗(图2插图)。与MIP-POPD-CNTs-GCE相比,OM-POPD-CNTs-GCE的阻抗较大,这是因为镶嵌氧乐果分子的印迹膜结构阻碍了K3Fe(CN)6进入电极表面;MIP-POPD-CNTs-GCE的阻抗值明显降低,这是因为去除氧乐果后印迹膜表面产生了很多“空穴”,使K3Fe(CN)6进入电极表面的阻碍减小,表明洗脱氧乐果后的印迹传感器表面生成了印迹“空穴”;CNTs-GCE电极(曲线c)的阻抗较印迹传感器(曲线a)小,表明CNTs-GCE表面的电子转移相对容易,CNTs表现出良好的催化活性。
2.3实验条件的优化
2.3.1测试底液pH值的选择氧乐果在碱性溶液中易分解,在酸性和中性环境中稳定,故需在中性偏酸的介质中进行孵化。实验表明,在pH 5.0的酸性环境中进行孵化测试时峰电流的变化最灵敏,因此,实验选用pH 5.0的ABS作为测试底液。
2.3.2孵化时间的选择氧乐果为非电活性物质,在-0.2~1.0 V范围内无氧化还原峰,故选择K3Fe(CN)6为探针分子进行氧乐果的测定。将一定浓度的氧乐果溶液加入到ABS 缓冲溶液(pH 5.0)中,搅拌均匀后,将MIP-POPD-CNTs-GCE置于氧乐果溶液中进行孵化,取出,用水洗涤,置于K3Fe(CN)6溶液中进行循环伏安扫描。在孵化过程中氧乐果会通过氢键、疏水作用和空腔匹配作用等重新进入膜内与其结构相匹配的“空穴”,使得电极表面的“空穴”减少。因此将经氧乐果溶液孵化过的印迹电极再于K3Fe(CN)6溶液中扫描时,K3Fe(CN)6的峰电流下降。氧乐果浓度越大,电极表面聚合膜中的“空穴”被填补得越多,K3Fe(CN)6的峰电流越低。由此可建立氧乐果的分子印迹传感器间接分析法。
氧乐果重新嵌入聚合膜中“空穴”的过程会受到溶液的传质阻力及聚合膜骨架阻力的影响。随着孵化时间的延长,孵化后电极于K3Fe(CN)6中的峰电流逐渐下降。当MIP-POPD-CNTs-GCE于含1.0×10-6mol/L 氧乐果的ABS 溶液中孵化20 min 时,继续延长孵化时间,峰电流几乎不再变化,表明氧乐果在印迹膜中已达到饱和。因此选择最佳孵化时间为20 min。
2.4氧乐果浓度与K3Fe(CN)6峰电流的关系
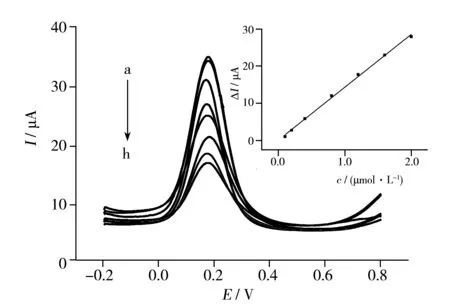
图3 在含有不同浓度氧乐果底液中孵化后,MIP-POPD-CNTs-GCE在K3Fe(CN)6中的差分脉冲伏安图Fig.3 Differential pulse voltammograms of imprinted sensor in 0.01 mol/L K3Fe(CN)6 after being incubated in different concentrations of omethoate insert:calibration curve of relative peak current versus omethoate concentration; concentration of omethoate(a-h):0,0.1,0.2,0.4,0.8,1.2,1.6,2.0 μmol/L
采用差分脉冲伏安法,测定了在不同浓度氧乐果溶液中孵化后,印迹传感器在K3Fe(CN)6溶液中的电流响应,结果如图3所示。当氧乐果浓度逐渐增大时,K3Fe(CN)6的峰电流逐渐减小。定量测定时,实验采用相对峰电流ΔI(ΔI=I0-I)描述峰电流的变化,I0为在无氧乐果的底液中孵化后测定的K3Fe(CN)6氧化峰电流,I为在含氧乐果的底液中孵化后测定的K3Fe(CN)6氧化峰电流。结果表明,随着氧乐果浓度的增加,K3Fe(CN)6的相对峰电流ΔI逐渐增大,ΔI与氧乐果浓度在1.0×10-7~2.0×10-6mol/L 范围内呈良好的线性关系(图3插图),其线性方程为ΔI(μA)=0.169 7+14.13c(μmol/L),r2=0.997 6。检出限(S/N=3)为3.6×10-8mol/L。
2.5分子印迹传感器的选择性
为了验证传感器的选择性,选择敌敌畏、甲基对硫磷、杀螟硫磷、乐果为干扰物质,测量在相同实验条件下,MIP-POPD/CNTs/GCE 对 浓度均为1.0×10-6mol/L的氧乐果和各干扰物质产生的 ΔI值。结果表明,敌敌畏、甲基对硫磷、杀螟硫磷对氧乐果的测定基本无干扰,这是因为上述3种物质与氧乐果的结构差异较大,无法进入分子印迹膜的“空穴”中;乐果在该印迹电极上有轻微响应,这是因为乐果的分子结构及尺寸与氧乐果相近;因此,制备的印迹电极具有特异选择性。
2.6实际样品的测定
称取剪碎的菠菜和小青菜各10.0 g, 用10.0 mL 甲醇振荡提取5 min, 再加 10.0 mL甲醇振荡提取 5 min, 合并提取液于25 mL容量瓶中,用甲醇定容,取适量提取液进行测试。结果在样品中未检出氧乐果。对两种蔬菜样品进行加标回收试验(n=5),加标浓度为0.50 mg/kg,菠菜和小青菜样品的回收率分别为96%和98%,相对标准偏差(RSD)分别为2.7%和3.1%,该方法满足实际分析的要求。
3 结 论
本文以氧乐果为印迹分子,采用原位电化学聚合方法于多壁碳纳米管修饰电极上制备分子印迹聚合膜作为模拟受体,构建了电化学传感器界面。循环伏安及电化学阻抗的表征结果确证了分子印迹膜中“空穴”的存在。采用差分脉冲伏安法,以K3Fe(CN)6为探针分子实现了对氧乐果的间接测定,其线性范围为1.0 ×10-7~2.0×10-6mol /L。该印迹传感器的制备过程简单,测定快速,具有良好的选择性和灵敏度,为氧乐果残留的检测提供了新的有效途径。
[1] Ji S J,Zhao L L,Feng H.FoodRes.Dev.(纪淑娟,赵丽丽,冯辉.食品研究与开发),2001,3:60-61.
[2] Qin G F,Li Y B,Chen Y,Sun Q Y,Zuo B,He F R,Shen N M,Ji G F,Ding G R.FoodRes.Int.,2015,72(6):161-167.
[3] Jardim A N O,Mello D C,Goes F C S,Junior E F F,Caldas E D.FoodChem.,2014,16:195-204.
[4] Oujji N B,Bakas I,Istamboulié G,Ihya A I,Elhabib A A,Régis R,Thierry N.FoodControl,2013,30(2):657-661.
[5] Sun X,Wang X Y.Biosens.Bioelectron., 2010, 25(12):2611-2614.
[6] Li B X,He Y Z,Xu C L.Talanta,2007,72(1):223-230.
[7] Ding Z Y,Li C Y,Song Q J.Chin.J.Anal.Chem.(丁照云,李春阳,宋启军.分析化学),2013,41(10):1543-1548.
[8] Qi Y B,Liu Y,Song Q J.Chin.J.Anal.Chem.(齐玉冰,刘瑛,宋启军.分析化学),2011, 39(7):1053-1057.
[9] Wang M J,Liu C L,Xie T P,Zhang X M,Zhang L,Yang Q.Chem.Res.Appl.(王茂君,刘成伦,谢太平,张晓敏,张柳,杨琦.化学研究与应用),2011,23(7):888-892.
[10] Bougrini M,Florea A, Criste C,Sandulescub R,Vocansonc F,Errachid A,Bouchikhie B,Barid N E,Nicole J R.FoodControl,2016,59:424-429.
[11] Han Q,Shen X,Zhu W Y,Zhu C H,Zhou X M,Jiang H J.Biosens.Bioelectron.,2016,79:180-186.
[12] Peng Y Y.J.Instrum.Anal.(彭友元.分析测试学报),2013,32(12):1427-1432.
[13] Shang Z Y,Han C F,Song Q J.Chin.J.Anal.Chem.(商哲一,韩超峰,宋启军.分析化学),2014,42(6):904-908.
[14] Liu H, Sun S X, Du R K, Gao B J.J.Instrum.Anal.(刘海,孙世雄,杜瑞奎,高保娇.分析测试学报),2015,34(10):1126-1133.
[15] Zhao J,Li J P,Jiang F Y.Chin.J.Anal.Chem.(赵钧,李建平,蒋复阳.分析化学),2009,37(8):1219-1222.
[16] Zhang H C,Liu G Y,Shang J.Chin.J.Anal.Chem.(张洪才,刘国艳,商璟.分析化学),2012,40(1):95-100.
[17] Guan H,Fan L Z,Qiao S Y.J.Univ.Sci.Technol.Beijing(关慧,范丽珍,乔素燕.北京科技大学学报),2011,33 (11):1387-1390.
Preparation of Molecularly Imprinted Sensor for Determination of Omethoate Based on Carbon Nanotube Modified Electrode
ZHAO Yong-fu1*,CHEN Zhen-lin2
(1. School of Chemistry and Chemical Engineering,Zhengzhou Normal University,Zhengzhou450044,China;2. School of Chemistry and Biology Engineering,Hezhou University,Hezhou542899, China)
An electrochemical sensor for omethoate detection based on electropolymerized molecularly imprinted polymers(MIPs) was fabricated.The sensitive layer was prepared by electropolymerizingo-phenylenediamine(OPD) on a glassy carbon electrode modified with multi-walled carbon nanotube in the presence of template(omethoate) which could be removed by ethanol.The electrochemical properties of the molecularly imprinted sensor were characterized by cyclic voltammetry and electrochemical impedance spectroscopy(EIS).The analytical characteristics of the sensor was investigated by differential pulse voltammetry, and an indirect analytical method based on the medium of K3Fe(CN)6was established.The result showed that a linear relationship between concentration of omethoate and relative peak current change of K3Fe(CN)6was obtained in the range of 1.0×10-7-2.0×10-6mol/L, and the detection limit was 3.6×10-8mol/L.
molecular imprinting; omethoate; multi-walled carbon nanotube; sensor
2016-01-06;
2016-02-14
广西自然科学基金项目(2013GXNSFAA019045)
赵永福,博士,副教授,研究方向:电分析化学、食品及药物分析,Tel:0371-65502309, E-mail:zhaoyongfu2008@163.com
10.3969/j.issn.1004-4957.2016.09.019
O657.1;S482.3
A
1004-4957(2016)09-1176-05
