顶空固相微萃取-气质联用法测定奶茶中的香兰素和乙基香兰素
2016-11-08彭飞进狄家卫赵浩军
徐 幸,彭飞进,舒 平,狄家卫,赵浩军,王 坤
(1.大理州质量技术监督综合检测中心,云南大理 671000;2.云南华测检测认证有限公司,云南昆明 650217)
顶空固相微萃取-气质联用法测定奶茶中的香兰素和乙基香兰素
徐幸1,彭飞进2,舒平1,狄家卫1,赵浩军1,王坤1
(1.大理州质量技术监督综合检测中心,云南大理 671000;2.云南华测检测认证有限公司,云南昆明 650217)
采用顶空固相微萃取(HS-SPME)和气相色谱质谱联用技术(GC/MS),建立了测定奶茶中香兰素和乙基香兰素的分析方法。选取了75 μm carboxen/聚二甲基硅氧烷(CAR/PDMS)萃取纤维,考察了萃取温度、萃取时间和盐浓度等因素对萃取效率的影响。采用3,4-亚甲二氧苯乙酮作为内标,对香兰素和乙基香兰素进行定量。结果表明,在检测范围0.5~25.0 μg内,该方法对香兰素(R2=0.9974)和乙基香兰素(R2=0.9987)具有良好的线性关系,固体样品中香兰素和乙基香兰素的检出限分别为0.5 mg/kg和0.3 mg/kg,液体样品中检出限分别为0.05 mg/kg和0.03 mg/kg,香兰素的平均回收率为88.99%~105.15%,相对标准偏差(RSDs)为2.40%~9.26%,乙基香兰素的平均回收率为91.57%~105.13%,相对标准偏差为2.35%~8.49%。该方法操作简便、准确可靠,适合于奶茶中香兰素和乙基香兰素的分析要求。
香兰素,乙基香兰素,顶空固相微萃取-气质联用法(HS-SPME-GC/MS),奶茶
香兰素(Vanillin),又名3-甲氧基-4-羟基苯甲醛,乙基香兰素(Ethyl vanillin),又名3-乙氧基-4-羟基苯甲醛,香兰素可从天然的香荚兰或水果中提取[1-2],也可人工合成,是食品中重要的香味添加剂。但其安全性仍存在争议,欧盟的研究曾报道,大量使用香兰素对人体具有危害性[3],奶茶是添加奶味香精的主要产品,日常消费量较大,有企业标准化生产的速溶固体奶茶,也有个体零售自调比例的液体奶茶,建立检测奶茶中香兰素与乙基香兰素的方法,既有利于生产企业对产品质量的控制,也利于监管部门对市场上零售的液体奶茶进行风险监测,保障食品安全。
目前食品中添加香兰素和乙基香兰素的产品主要涉及婴幼儿配方奶粉、饮料、蛋糕、牛奶等,检测方法包括液相色谱法[4-6]、液质联用法[7-9]、毛细管电泳法[10]、气相色谱法[11-12]和气质联用法等[13-15]。而前处理通常需富集净化,要使用大量有机溶剂提取,对环境及检验人员的健康不利[16],为减少污染以及保护操作人员,近年来发展出新的前处理方法,即固相微萃取技术(solid phase micro extraction,SPME),来萃取香兰素和乙基香兰素[17-18]。然而采用SPME检测时,由于顶空气化效率不稳定,外标法定量会影响检测结果的准确性,而添加与目标物性质类似的内标物,可保证定量的准确性。
本研究采用顶空固相微萃取和气质联用法,内标法定量,建立奶茶中香兰素与乙基香兰素的检测方法,并对市售的固体和液体奶茶产品进行检测,为生产企业对产品的质量控制,以及监管部门的风险监测,提供参考依据。
1 材料与方法
1.1材料与仪器
速溶固体奶茶、液体奶茶市售;香兰素标准品美国Sigma-Aldrich公司,纯度≥99.0%;乙基香兰素标准品美国Sigma-Aldrich公司,纯度≥99.0%;3,4-亚甲二氧苯乙酮德国CNW公司,纯度≥97.0%;无水乙醇德国Meker公司,色谱纯;氯化钠(NaCl)为国产分析纯。
1.2实验方法
1.2.1固相萃取条件的选择萃取时间为60 min,不添加NaCl,先考察30、40、50、60、70、80 ℃作为萃取温度,目标物峰面积随萃取温度变化的情况。萃取温度设定为70 ℃,不添加NaCl,考察在10、20、30、40、50、60 min萃取时间下香兰素与乙基香兰素峰面积的变化。萃取温度设定为70 ℃,萃取时间为30 min,研究每5 mL标准溶液中添加0.5、1.0、2.0、3.0、4.0、5.0 g NaCl添加量对萃取效果的影响。
1.2.2样品处理固体样品:称取0.50 g奶茶粉末置于20 mL的顶空瓶中,加入5 mL温度为40 ℃的超纯水,振荡溶解奶茶粉末,再加入50 μL的3,4-亚甲二氧苯乙酮标准储备液(100 mg/L的无水乙醇溶液)作为内标,加入2.0 g NaCl溶于水中,设定样品的预热温度为70 ℃。
液体样品:称取5.00 g奶茶溶液置于20 mL的顶空瓶中,加入50 μL的3,4-亚甲二氧苯乙酮标准储备液(100 mg/L的无水乙醇溶液)作为内标,加入2.0 g NaCl溶于液体样品中,设定样品的预热温度为70 ℃。
1.2.3气质联用分析的条件在预热温度为70 ℃的条件下,采用75 μm CAR/PDMS萃取头插入顶空瓶萃取30 min。萃取完成后,将萃取头插入温度为240 ℃的气质联用仪进样口,解吸5 min。分别考察了三种不同极性的色谱柱对目标物的分离效果:J&W DB-WAX石英毛细柱(30 m×0.25 mm,0.25 μm)、J&W DB-1701石英毛细柱(30 m×0.25 mm,0.25 μm)、J&W DB-5MS石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:70 ℃保持5 min,以10 ℃/min的速率升温至230 ℃,保持1 min;载气(He)流速为1.2 mL/min;不分流进样;质谱条件:电子轰击(EI)离子源;电子能量为70 eV;传输线温度240 ℃;离子源温度180 ℃;阱温为100 ℃;选择离子存储模式(SIS)扫描,特征离子及保留时间见表1。

表1 目标物的保留时间和特征离子
1.2.4香兰素和乙基香兰素含量的测定数据采集和后处理采用240离子阱质谱仪工作站软件进行,分别以香兰素和乙基香兰素对3,4-亚甲二氧苯乙酮的峰面积比值作为纵坐标,检测到的香兰素和乙基香兰素的含量作为横坐标进行线性回归,通过线性方程,计算出待测样品中香兰素和乙基香兰素的含量。计算公式如下:CS=m1×1000/(m2×1000)
其中,m1为仪器检测出的目标物的含量(μg),m2为样品的质量(g),CS为样品中目标物的质量浓度(mg/kg)。
(四)强化生态环境保护能力保障体系。增强科技支撑,开展大气污染成因与治理、水体污染控制与治理、土壤污染防治等重点领域科技攻关,
1.2.5方法验证配制香兰素和乙基香兰素的无水乙醇混合标准溶液,浓度为0.1、0.2、0.5、1.0、2.0、5.0 mg/L,以1.0 mg/L 3,4-亚甲二氧苯乙酮无水乙醇溶液为内标物,建立校准曲线,按照三倍信噪比(S/N)计算检出限,十倍信噪比(S/N)计算定量限。
回收率与精密度实验选择高、中、低三个水平的浓度进行测定,每个浓度进行六次平行测定。通过对市售液体与固体奶茶进行随机抽样检测来验证方法的可行性。
1.3数据处理
对标准溶液与待测样品试液进行两次平行测定,结果取算数平均值,采用Microsoft Office Excel 2010进行统计分析处理,计算相对标准偏差。
2 结果与分析
2.1仪器条件的选择
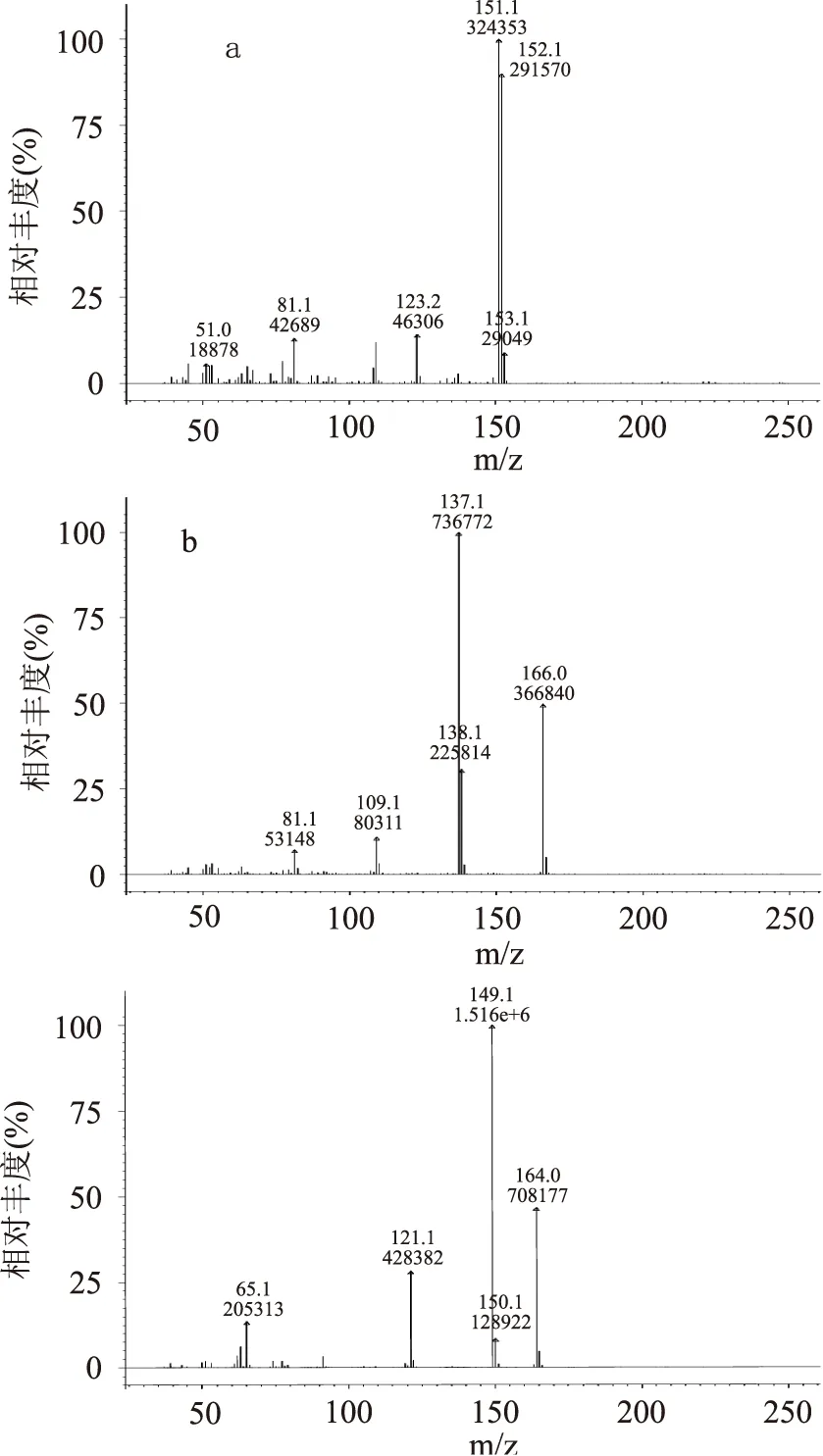
图1 香兰素(a)、乙基香兰素(b)和3,4-亚甲二氧苯乙酮(c)的全扫描质谱图Fig.1 Full scan mass spectrum of vanillin(a),ethyl vanillin(b)and 3′,4′-(methylenedioxy)acetophenone(c)
通过离子阱气质联用仪全扫描模式,获得了香兰素、乙基香兰素和3,4-亚甲二氧苯乙酮的质谱图,图1为本实验使用10 mg/L的标准溶液全扫描所得的质谱图,由质谱图可以看出目标物的特征离子,由此来选定目标物的定量与定性离子,采用选择离子存储模式(SIS)对特征离子进行扫描。
标准溶液的提取离子色谱图如图2所示,对于采用气相色谱或者气质联用的方法测定香兰素和乙基香兰素,有文献报道采用了毛细柱5MS[17]、1701[13]或WAX[19]作为分离柱,考虑到香兰素和乙基香兰素具有极性,在弱极性的DB-5MS色谱柱上保留时间较短,且拖尾现象严重,与文献报道结果一致[13]。在中等极性色谱柱DB-1701上,香兰素和乙基香兰素分离效果较好,但内标物3,4-亚甲二氧苯乙酮与香兰素的分离效果不佳,而在极性色谱柱DB-WAX上,三种组分的分离效果均较好,故本实验选择极性色谱柱DB-WAX作为分析柱。

图2 目标物在不同毛细柱上的色谱图:5MS(a)、1701(b)和WAX(c)Fig.2 Chromatograms of targets on different capillarycolumns:5MS(a),1701(b)and WAX(c)
2.2固相微萃取条件的选择
香兰素和乙基香兰素分子虽然含有苯环,但具有羟基和醛基等极性基团,根据有机物与溶剂“相似相溶”的原则,选择能吸附极性和弱极性物质的CAR/PDMS复合萃取头[20],且香兰素和乙基香兰素具有挥发性,适合采用顶空萃取法。此外,添加无机盐可降低挥发性物质在水中的溶解度[21],同时适当提高萃取温度和延长平衡时间可使目标物充分平衡[22],而达到提高萃取效率和方法稳定性的效果。
2.2.1温度对萃取效率的影响固相微萃取效率与温度之间具有正相关性,通常萃取温度升高,目标物峰面积随之升高[22]。由图3可知,随着萃取温度的升高,香兰素和乙基香兰素的灵敏度升高,在70 ℃时达到较高的响应值,鉴于目标物在80 ℃时没有明显高于70 ℃时的峰面积,因此选择萃取温度为70 ℃。

图3 萃取温度对香兰素和乙基香兰素萃取效果的影响Fig.3 Effect of temperature on the extraction of vanillin and ethyl vanillin
2.2.2时间对萃取效率的影响萃取时间也是影响萃取效率的重要因素,不同萃取时间下香兰素与乙基香兰素峰面积的变化情况如图4所示,30 min以内萃取头对目标物的吸附量,随着萃取时间的增加而增大,30 min时已基本达到平衡,继续增加萃取时间目标物的峰面积未明显增加,为节约分析时间,选择为30 min作为本实验的萃取时间。

图4 萃取时间对香兰素和乙基香兰素萃取效果的影响Fig.4 Effect of time on the extraction of vanillin and ethyl vanillin

表2 香兰素和乙基香兰素在奶茶基质中的回收率和精密度实验(n=6)
2.2.3无机盐对萃取效率的影响添加无机盐会降低目标物在溶剂中的溶解度,使其较易从水相中挥发出来[23],添加不同量的NaCl对萃取效果的影响结果如图5所示,添加NaCl的量在2.0 g以内时,目标物的峰面积随着加入NaCl量的增加而增大,但继续增加NaCl的量反而使目标物的峰面积减少,这可能是因为加入NaCl后,在降低目标物在溶剂中溶解度的同时,也增大了溶液的粘度,降低了目标物的扩散速率[24]。综合考虑,在本实验中选择每5 mL标准溶液中添加2.0 g的NaCl。

图5 NaCl的添加量对香兰素和乙基香兰素萃取效果的影响Fig.5 Effect of salt amounts on the extraction of vanillin and ethyl vanillin
2.3方法的线性范围与检出限
分别以香兰素和乙基香兰素对3,4-亚甲二氧苯乙酮的峰面积比值作为纵坐标,仪器检测到的香兰素和乙基香兰素的含量作为横坐标进行线性回归,结果表明香兰素和乙基香兰素在0.5~25.0 μg时,香兰素的回归方程为Y=0.0466X+0.1053(R2=0.9974),乙基香兰素的回归方程为Y=0.0914X+0.2264(R2=0.9987),相关系数良好。按三倍信噪比(S/N)计算检出限,在固体样品中香兰素和乙基香兰素的检出限分别为0.5 mg/kg和0.3 mg/kg,定量限为1.5 mg/kg和1.0 mg/kg。而在液体样品中检出限分别为0.05 mg/kg和0.03 mg/kg,定量限为0.15 mg/kg和0.10 mg/kg。在奶茶样品中添加与检出限浓度一致的香兰素和乙基香兰素,采用上述的检测方法验证可以检出。
2.4方法的回收率与精密度
分别在固体和液体奶茶基质中添加香兰素和乙基香兰素高、中、低三个水平的回收率实验,每份样品重复测定6次,结果见表2,香兰素的平均回收率为88.99%~105.15%,相对标准偏差为2.40%~9.26%,乙基香兰素的平均回收率为91.57%~105.13%,相对标准偏差为2.35%~8.49%。
2.5实际样品的测定
根据本实验所建立的方法对随机购买的10份速溶固体奶茶,以及8份液体奶茶进行检测,结果如表3所示,所有样品均检出香兰素和乙基香兰素,由检测结果可见奶茶中添加香兰素的量整体较乙基香兰素高,其中香芋味的固体奶茶中香兰素的添加量最高,含量达到804.98 mg/kg,固体奶茶中乙基香兰素添加量最高的为原味奶茶,含量为49.06 mg/kg,而液体奶茶中香兰素和乙基香兰素的添加量没有固定的规律,这可能由于液体奶茶没有经过标准化工业生产,仅由售卖人员现场配制,导致香精的添加量无法恒定。

表3 实际样品的检测结果(mg/kg)
3 结论
采用顶空固相微萃取和气质联用技术,添加3,4-亚甲二氧苯乙酮作为内标物,建立了奶茶中香兰素和乙基香兰素的检测方法。此方法前处理方式简单,香兰素和乙基香兰素在0.5~25.0 μg时,有良好的线性关系,相关系数分别为香兰素为R2=0.9974,乙基香兰素为R2=0.9987,添加三个浓度的回收率实验表明,香兰素的平均回收率为88.99%~105.15%,相对标准偏差为2.40%~9.26%,乙基香兰素的平均回收率为91.57%~105.13%,相对标准偏差为2.35%~8.49%。该方法提高了检测效率,且无需采用有机溶剂提取,对环境和操作人员都具有保护作用,同时本文还对市售的奶茶样品进行随机抽样检测,检测结果显示所抽检的奶茶中均检出香兰素和乙基香兰素,而香兰素的量整体较乙基香兰素高,检出范围为0.86~804.98 mg/kg,这可为今后的食品安全风险监测,以及企业对产品的质量控制,提供参考依据。
[1]卢金清,李雨玲,张锐,等. HS-SPME-GC-MS分析香荚兰豆中挥发性成分[J]. 中国实验方剂学杂志,2014,20(3):79-82.
[2]Goodner K L,Jella P,Rouseff R L. Determination of vanillin in orange,grapefruit,tangerine,lemon,and lime juices using GC-olfactometry and GC-MS/MS[J]. Journal of Agricultural and Food Chemistry,2000,48(7):2882-2886.
[3]Ni Y,Zhang G,Kokot S. Simultaneous spectrophotometric determination of maltol,ethyl maltol,vanillin and ethyl vanillin in foods by multivariate calibration and artificial neural networks[J]. Food Chemistry,2005,89(3):465-473.
[4]金海涛,马健瑜,王晓珣,等. 高效液相色谱法同时测定香兰素和邻位香兰素[J]. 分析测试学报,2011,30(2):222-224.
[5]Ma J,Zhang B,Wang Y,et al. Determination of flavor enhancers in milk powder by one-step sample preparation and two-dimensional liquid chromatography[J]. Journal of Separation Science,2014,37(8):920-926.
[6]Ning F,Peng H,Dong L,et al. Preparation and characterization of superparamagnetic molecularly imprinted polymers for selective adsorption and separation of vanillin in food samples[J]. Journal of Agricultural and Food Chemistry,2014,62(46):11138-11146.
[7]De Jager L S,Perfetti G A,Diachenko G W. Determination of coumarin,vanillin,and ethyl vanillin in vanilla extract products:liquid chromatography mass spectrometry method development and validation studies[J]. Journal of Chromatography A,2007,1145(1-2):83-88.
[8]罗冠中,刘祥,孟云彩. 液相色谱串联四级杆质谱法同时测定婴幼儿配方食品中甲基香兰素和乙基香兰素[J]. 分析实验室,2011,30(8):84-87.
[9]Shen Y,Han C,Liu B,et al. Determination of vanillin,ethyl vanillin,and coumarin in infant formula by liquid chromatography-quadrupole linear ion trap mass spectrometry[J]. Journal of Dairy Science,2014,97(2):679-686.
[10]Ohashi M,Omae H,Hashida M,et al. Determination of vanillin and related flavor compounds in cocoa drink by capillary electrophoresis[J]. Journal of Chromatography A,2007,1138(1-2):262-267.
[11]Chen S,Xu Y,Qian M. Aroma characterization of Chinese rice wine by gas chromatography-olfactometry,chemical quantitative analysis,and aroma reconstitution[J]. Journal of Agricultural and Food Chemistry,2013,61(47):11295-11302.
[12]Ibrahim M N M,Sipaut C S,Yusof N N M. Purification of vanillin by a molecular imprinting polymer technique[J]. Separation and Purification Technology,2009,66(3):450-456.
[13]彭飞进,徐幸,舒平,等. GC和GC-MS法测定饮料中香兰素和乙基香兰素含量[J]. 食品工业科技,2015,36(15):303-306.
[14]Shen Y,Hu B,Chen X,et al. Determination of four flavorings in infant formula by solid-phase extraction and gas chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2014,62(45):10881-10888.
[15]Ubeda C,Callejón R M,Troncoso A M,et al. Characterization of odour active compounds in strawberry vinegars[J]. Flavour and Fragrance Journal,2012,27(4):313-321.
[16]蔡培钿,白卫东,钱敏. 奶味香精分析技术研究进展[J]. 中国乳品工业,2009,37(8):51-54.
[17]De Jager L S,Perfetti G A,Diachenko G W. Comparison of headspace-SPME-GC-MS and LC-MS for the detection and quantification of coumarin,vanillin,and ethyl vanillin in vanilla extract products[J]. Food Chemistry,2008,107(4):1701-1709.
[18]广东出入境检验检疫局检验检疫技术中心. 一种应用顶空-固相微萃取技术测定奶粉中甲基香兰素和乙基香兰素的方法:中国,201410854703.0[P]. 2015-04-08.
[19]Pe′rez-silva A,Odoux E,Brat P,et al. GC-MS and GC-olfactometry analysis of aroma compounds in a representative organic aroma extract from cured vanilla(VanillaplanifoliaG.Jackson)beans[J]. Food Chemistry,2006,99(4):728-735.
[20]田怀香,王璋,许时婴. 顶空固相微萃取-气相色谱-质谱法分离鉴定金华火腿的挥发性风味物质[J]. 色谱,2006,24(2):177-180.
[21]陈明,阴永光,邰超,等. 顶空固相微萃取-气相色谱-质谱联用快速测定环境水样中的硝基苯、苯和苯胺[J]. 科学通报,2006,51(11):1359-1362.
[22]何迎春,王正虹,李林,等. 固相萃取/固相微萃取-气相色谱法测定饮用水中多溴联苯醚[J]. 食品科学,2012,33(8):236-240.
[23]成建国,刘开颖,白敏冬,等. 顶空固相微萃取-气相色谱-质谱联用测定饮用水中的2-甲基异莰醇和土臭素[J]. 色谱,2015,33(12):1287-1293.
[24]张璇,陈大舟,汤桦,等. 顶空固相微萃取/气相色谱-质谱法测定液态化妆品中8种增塑剂[J]. 分析测试学报,2012,31(3):317-321.
Determination of vanillin and ethyl vanillin in milky tea by HS-SPME-GC/MS
XU Xing1,PENG Fei-jin2,SHU Ping1,DI Jia-wei1,ZHAO Hao-jun1,WANG Kun1
(1.Dali Comprehensive Inspection Centre of Quality and Technical Supervision,Dali 671000,China;2.Centre Testing International Co.,Ltd.,Kunming 650217,China)
A method for headspace solid phase micro extraction(HS-SPME)and gas chromatography mass spectrometry(GC/MS)was developed for the determination of vanillin and ethyl vanillin in milky tea. 75 μm carboxen/polydimethylsiloxane(CAR/PDMS)fiber was selected for extraction in this study. The parameters affecting extraction efficiency such as extraction temperature,extraction time and salt concentration were investigated. 3′,4′-(methylenedioxy)acetophenone was used as an internal standard for quantifying vanillin and ethyl vanillin. The results showed that the linear relationships between ratio of peak area and concentration of vanillin(R2=0.9974)and ethyl vanillin(R2=0.9987)were good enough from 0.5 to 25.0 μg. The limits of detection for vanillin and ethyl vanillin were 0.5 mg/kg and 0.3 mg/kg in solid samples,and they were 0.05 mg/kg and 0.03 mg/kg in liquid samples,respectively. The average recoveries of vanillin were 88.99%~105.15%,and the relative standard deviations(RSDs)were 2.40%~9.26%. The average recoveries of ethyl vanillin were 91.57%~105.13%,and the RSDs were 2.35%~8.49%. This method is convenient and reliable,and it is suitable for the determination of vanillin and ethyl vanillin in milky tea.
vanillin;ethyl vanillin;headspace solid phase micro extraction and gas chromatography mass spectrometry(HS-SPME-GC/MS);milky tea
2016-02-19
徐幸(1983-),女,博士,工程师,研究方向:食品质量安全检测,E-mail:xuxing1983@163.com。
云南省卫生厅制修订食品安全地方标准项目(云卫[2014]DB003)。
TS207.3
A
1002-0306(2016)16-0079-06
10.13386/j.issn1002-0306.2016.16.007
