顶空固相微萃取-气相色谱法测定山楂果胶酯化度
2016-11-08王荣芳杨晓博陈剑桥李喜悦
王荣芳,杨晓博,陈剑桥,李喜悦,崔 同
(河北农业大学食品科技学院,河北保定 071000)
顶空固相微萃取-气相色谱法测定山楂果胶酯化度
王荣芳,杨晓博,陈剑桥,李喜悦,崔同*
(河北农业大学食品科技学院,河北保定 071000)
利用顶空固相微萃取与气相色谱联用(HS-SPME-GC)的方法测定山楂果胶的酯化度(包括甲酯化和乙酯化),对影响检测结果的萃取头种类、萃取温度、平衡时间、萃取时间、盐离子浓度、解吸温度、解吸时间进行了优化。结果表明,HS-SPME-GC测定山楂果胶酯化度较优条件为:5 mL山楂果胶溶液中加48.8%硫酸钠,在40 ℃下平衡20 min,用75 μm CAR-PDMS萃取头在40 ℃下萃取30 min,然后在280 ℃的GC进样口解析60 s。该方法线性良好r≥0.9983,检出限10~15 mg/L,加标回收率为95.6%~116.2%。该方法快速、简便、准确。
山楂果胶,酯化度,顶空固相微萃取,气相色谱
山楂(CrataequspinnatifidaBge)属于蔷薇科山楂属植物,是我国北方地区重要的栽培水果,其果实中有丰富的果胶,含量约为鲜重的4%[1]。果胶具有凝胶性、增稠性、乳化性、稳定性等功能特性,被广泛地用于食品、药品、化妆品领域中。它的这些理化性质直接取决于其化学结构,尤其是其α-1,4半乳糖醛酸结构单元的酯化度是影响果胶凝胶特性的主要因素[2-3]。因此,评价果胶的胶凝特性,必须准确测定果胶酯化度[4]。测定果胶酯化度的方法可以分为直接测定法和脱酯后测定法,直接测定法主要采用图谱分析技术,如NMR法[5]、FT-IR法[6-7],这些方法操作简便但需要精密仪器,而且有时会受共存杂质的干扰。脱酯后测定法是针对果胶皂化反应后释放出的羧基或者甲醇进行分析,包括碱液滴定法[8-9]、醇氧化法[10]、毛细管电泳法[11]、硼氢化法[12]。顶空固相微萃取(HS-SPME)是一种集采样,萃取,浓缩和进样于一体的无溶剂样品微萃取新技术[13],具有操作时间短、样品用量少、仪器设备简单,操作快速、便携,重现性好、精度高、检测限低等优点,是一种较理想的气相色谱(GC)的样品前处理技术。
本实验采取顶空固相微萃取与GC结合,探索建立一种可以同时测定山楂果胶甲酯化和乙酯化程度的方法,为山楂果胶改性及其功能评价提供一种方便、快捷的新方法。
1 材料与方法
1.1材料与仪器
山楂品种为大金星,购于河北省保定市果品批发市场;甲醇(色谱纯)Honeywell Burdick & Jackson公司;乙醇(分析纯)、NaCl(纯度99.5%)、Na2SO4(纯度99.5%)天津天力化学试剂有限公司;纯净水哇哈哈食品饮料有限公司。
6820型气相色谱仪美国Agilent 公司;SGH-300型高纯氢发生器、SGK-2LB型低噪音空气泵北京东方精华苑科技有限公司生产;固相微萃取装置Supelco公司生产,固相微萃取纤维头:50/30 μm DVB/CAR/PDMS型、75 μm CAR/PDMS型和100 μm PDMS型;RJ-TDL-40B型离心机无锡市瑞江分析仪器有限公司;KQ5200DE型超声波清洗器昆山市超声仪器有限公司生产;FD-1B-50型冷冻干燥机北京博医康实验仪器有限公司生产;HH-2型恒温水浴锅国华电器有限公司生产。
1.2实验方法
1.2.1山楂果胶的制备按照专利方法[14]从山楂果实中制备得到山楂膳食纤维。参考王娜等[15]的方法从山楂膳食纤维中提取山楂果胶:山楂膳食纤维中加入20倍体积蒸馏水,95 ℃热水搅拌提取,经离心(4000 r/min,3 min),收集上清液,重复4次上述过程,再将收集的上清液真空浓缩至原体积的1/3,加入2倍体积的95%乙醇沉淀果胶,离心(4000 r/min,3 min)得到果胶沉淀,加2倍体积的丙酮洗果胶沉淀,再加入2倍体积的蒸馏水溶解果胶沉淀,真空浓缩至原来的1/3,最后将浓缩的果胶溶液冷冻干燥,得到薄片状固体山楂果胶,置于干燥器中备用。
1.2.2萃取头的处理萃取头每次使用前均进行活化。将萃取头Hub端接入手柄后插入GC进样口进行活化,活化条件分别为:50/30 μm DVB/CAR/PDMS为270 ℃,1 h;75 μm CAR/PDMS为300 ℃,1 h;100 μm PDMS为250 ℃,0.5 h。同时监测系统压力,防止漏气。
1.2.3样品前处理准确称取0.200 g冷冻干燥的山楂果胶,加入20 mL纯净水,使之完全溶解,用1 mL 1 mol/L的NaOH溶液调pH至13,室温下皂化30 min,再用1 mL 1 mol/L HCl溶液调果胶溶液pH至7。
1.2.4顶空固相微萃取条件取皂化的果胶溶液注入含有Na2SO4的顶空瓶中,隔垫密封,在60 ℃下超声30 min使Na2SO4溶解,取出后涡旋混匀,在水浴中平衡一定时间,将SPME萃取头插入顶空瓶中萃取一定时间,立即将萃取头在GC进样口解析,进行GC分析。每份样品重复3次。
1.2.5单因素实验
1.2.5.1萃取头种类的选择在平衡时间为20 min,萃取温度为40 ℃,萃取时间为30 min,添加48.8% Na2SO4,解吸时间为60 s,解吸温度为280 ℃时,考察了50/30 μm DVB/CAR/PDMS、75 μm CAR/PDMS、100 μm PDMS 3种萃取头的萃取对萃取效果的影响。
1.2.5.2萃取温度对萃取效果的影响当果胶溶液中的甲醇和乙醇在气-液两相达到平衡时,它们在气相中浓度的高低受很多因素的影响,而萃取的温度是一个很重要的因素。本实验在使用75 μm CAR/PDMS萃取头,平衡时间为20 min,萃取时间为30 min,添加48.8% Na2SO4,解吸时间为60 s,解吸温度为280 ℃时,考察了不同萃取温度(30、40、50、60、70 ℃)对HS-SPME-GC萃取效果的影响。
1.2.5.3平衡时间对萃取效果的影响在一定的温度下,被分析组分在气-液两相达到平衡需要一定时间,本实验在使用75 μm CAR/PDMS萃取头,萃取温度为40 ℃,萃取时间为30 min,添加48.8% Na2SO4,解吸时间为60 s,解吸温度为280 ℃时,比较了不同平衡时间(10、20、30、40、50 min)对HS-SPME-GC萃取效果的影响。
1.2.5.4萃取时间对萃取效果的影响萃取时间即从萃取头进入顶空瓶到萃取达到平衡的时间。这个时间由被分析组分的分配系数、物质的扩散速率、萃取头的吸附能力等因素决定。本实验在使用75 μm CAR/PDMS萃取头,萃取温度为40 ℃,平衡时间为20 min,48.8% Na2SO4,解吸时间为60 s,解吸温度为280 ℃时,比较了不同萃取时间(5、10、20、30、40 min)对HS-SPME-GC萃取效果的影响。
1.2.5.5盐浓度对萃取效果的影响溶液中添加电解质,可增强溶液的离子强度,可以降低其在水中的溶解度,有利于促进目标成分挥发到气相中而增加分析的灵敏度。当使用75 μm CAR/PDMS萃取头,萃取温度为40 ℃,平衡时间为20 min,萃取时间为30 min,解吸时间为60 s,解吸温度为280 ℃时,比较了不同添加量的NaCl、Na2SO4对HS-SPME-GC固相萃取效果的影响。
1.2.5.6解吸温度对萃取效果的影响GC进样口的温度即为解吸温度,温度过低解吸不完全或造成二次进样;温度过高会对SPME萃取头涂层损害较大。而甲醇、乙醇都属于易挥发性化合物,温度不需要过高,因而,在使用75 μm CAR/PDMS萃取头,萃取温度为40 ℃,平衡时间为20 min,萃取时间为30 min,添加48.8% Na2SO4,解吸时间为60 s时,比较了不同解吸温度(240、250、260、270、280、290、300 ℃)对HS-SPME-GC固相萃取效果的影响。
1.2.5.7解吸时间对萃取效果的影响解吸时间与待分析组分的解吸完全程度直接相关。在使用75 μm CAR/PDMS萃取头,萃取温度为40 ℃,平衡时间为20 min,萃取时间为30 min,添加48.8% Na2SO4,解吸温度为280 ℃条件下,考察不同解吸时间(30、60、90、120 s)对解吸效果的影响
1.2.6色谱条件色谱柱:毛细管柱TG-WAXMS(30 m×0.25 mm×0.25 μm);检测器:氢火焰离子化检测器;载气:高纯氮,流速1 mL/min,分流比为1∶50。气化室温度:280 ℃;检测器:300 ℃;升温程序:35 ℃保持6 min,以20 ℃/min升至80 ℃;再以50 ℃/min升至230 ℃保持10 min。
1.2.7标准曲线制作精确称取400 mg甲醇和100 mg乙醇,加水定容至100 mL,配制成4000 mg/L甲醇和1000 mg/L乙醇标准储备溶液。贮备液密封保存,甲醇、乙醇标准溶液均由储备液稀释得到。
用甲醇标准储备液稀释得到浓度分别为2000、1000、400、200、100、20 mg/L的甲醇标准溶液,乙醇标准储备液稀释得到浓度分别为500、250、100、50、25、5 mg/L的乙醇标准溶液。按照1.2.4步骤顶空萃取,按照1.2.6色谱条件进行测定。分别以甲醇、乙醇标准液浓度为横坐标(X,mg/L),以甲醇、乙醇峰面积为纵坐标(Y)绘制标准曲线,求回归方程。
1.3数据处理
使用Excel进行数据处理并作图。
2 结果与分析
2.1顶空固相微萃取条件的优化
2.1.1萃取头种类的选择从50/30 μm DVB/CAR/PDMS、75 μm CAR/PDMS、100 μm PDMS 3种萃取头的萃取结果分析表明,这3种萃取头对甲醇、乙醇均有一定程度的萃取效果。其中,100 μm PDMS的萃取效果最差,得到甲醇、乙醇的峰面积均很小;50/30 μm DVB/CAR/PDMS萃取得到的杂峰较多,在甲醇出峰位置有杂峰干扰;而75 μm CAR/PDMS萃取效果最佳,且杂峰较少,因此,选择萃取头75 μm CAR/PDMS。
2.1.2萃取温度对萃取效果的影响结果如图1所示。从图1可以看出,当萃取温度为40 ℃时,甲醇和乙醇的萃取量均达到最大,再继续升高温度时它们的萃取效果没有明显的变化。因此,选择萃取温度为40 ℃。

图1 萃取温度对萃取效果的影响Fig.1 Effect of extraction temperature on the extraction rate
2.1.3平衡时间对萃取效果的影响从图2可以看出,当平衡时间少于20 min,萃取量增加,当平衡时间为20 min时,果胶溶液中甲醇和乙醇的萃取量达到最大。因此,选择平衡时间为20 min。

图2 平衡时间对萃取效果的影响Fig.2 Effect of balance time on the extraction rate
2.1.4萃取时间对萃取效果的影响从图3可以看出,当萃取时间小于30 min时,甲醇和乙醇的萃取量都在增加,但是乙醇增加量大于甲醇;当萃取时间为30 min时,两者的萃取量最大。因此,选择萃取时间为30 min。

图3 萃取时间对萃取效果的影响Fig.3 Effect of extraction time on the extraction rate
2.1.5盐离子浓度对萃取效果的影响从图4可以看出,虽然NaCl也有促进目标成分挥发的效果,但作用强度不及Na2SO4,当Na2SO4添加量达到饱和(48.8%)时,两者萃取量均达到最大。因此选择48.8% Na2SO4。

图4 盐浓度对萃取效果的影响Fig.4 Effect of salt concentration on the extraction rate
2.1.6解吸温度对萃取效果的影响结果如图5所示。从图5可以看出,当温度为280 ℃,甲醇、乙醇均完全解吸,因此,选择解吸温度为280 ℃。

图5 解吸温度对萃取效果的影响Fig.5 Effect of desorption temperature on the extraction rate
2.1.7解吸时间对萃取效果的影响从图6可以看出,当时间为60 s时,甲醇、乙醇峰面积达到最大值,延长解吸时间峰面积不再增加,因此,选择解吸时间为60 s。

图6 解吸时间对萃取效果的影响Fig.6 Effect of desorption time on the extraction rate
2.2方法评价
2.2.1方法的精密度按照优化的固相微萃取条件进行萃取后,按1.2.6的色谱条件重复进样分析(n=5),以评价检测仪器的精密度。数据统计结果见表1。

表1 甲醇、乙醇的精密度分析(n=5)
2.2.2方法的回归方程、线性范围、最低检出限按照1.2.7配制标准溶液标准曲线,按照1.2.6的色谱条件进行分析,以进样浓度为自变量(X,mg/L),峰面积为因变量(Y),分别求出甲醇、乙醇的线性回归方程、相关系数及线性范围。最低检出限以3倍信噪比(S/N)所对应的进样浓度求得,结果见表2。

表2 对照品的回归方程、相关系数、线性范围及最低检出限
2.2.3方法的加标回收实验采用加标回收实验以评价检测方法的准确度。分别称取已知质量的对照品分别按其在山楂果胶中常规含量水平加入山楂果胶样品中,按照1.2.3所述样品前处理,平行5份;按照优化的固相微萃取条件进行萃取后,按1.2.6色谱条件分别测定未加标和加标样品,计算组分的加标回收率,结果见表3。

表3 甲醇、乙醇的回收率
2.2.4实际样品分析按1.2.3所述方法重复进行山楂果胶样品前处理(n=3),按照优化的固相微萃取条件进行萃取,按1.2.6的色谱条件进行含量分析,对照品和样品色谱图如图7所示,酯化度分析结果见表4。
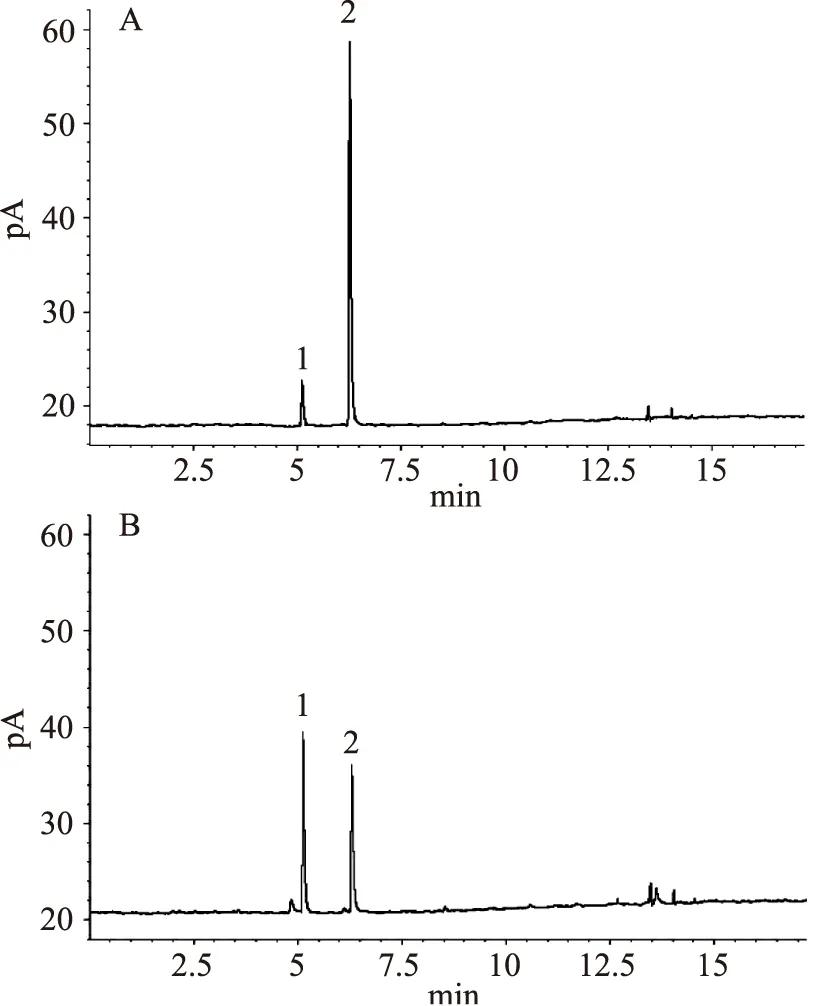
图7 混合对照品(A)和山楂果胶样品(B)的GC色谱图Fig.7 GC chromatograms of references(A)and hawthorn pectin sample(B)注:1:甲醇,2:乙醇。

类型酯化度(%)甲酯化56.13±1.35乙酯化1.76±1.41
从图7中可以看出,甲醇和乙醇达到很好的分离。而表4的结果表明,山楂果胶样品的总酯化度(包括甲酯化和乙酯化)达到57.89%,属于一种高甲氧基果胶,而其中的乙酯化度相对较低,仅有1.76%。
3 结论
通过对顶空固相微萃取条件进行优化,建立了一种HS-SPME-GC测定山楂果胶甲酯化和乙酯化的方法,较优条件为:75 μm CAR-PDMS萃取头,萃取温度40 ℃,平衡时间20 min,萃取时间30 min,加48.8%硫酸钠,进样解吸温度280 ℃,解吸时间60 s。方法操作简单,测定结果准确可靠,可为相关研究提供了新的检测方法。
[1]王喜萍,张文英. 山楂中果胶的测定及利用[J]. 中国林副特产,1999(4):13.
[2]Morris G A,Foster T J,Harding S E. The effect of the degree of esterification on the hydrodynamic properties of citrus pectin[J]. Food Hydrocolloids,2000,14:227-235.
[3]May C D. Industrial pectins:sources,production and applications[J]. Carbohydrate Polymers,1990,12(1):79-99.
[4]于铭章. 果胶对山楂加工的影响[J]. 河北林果研究,2009,24(3):309-310.
[5]Grasdalen H,Bakøy O E,Larsen B. Determination of the degree of esterification and the distribution of methylated and free carboxyl groups in pectins by1H-NMR spectroscopy[J]. Carbohydrate Research,1988,184:183-191.
[6]Chatjigakis A K,Pappas C,Proxenia C,et al. FT-IR spectroscopic determination of the degree of esterification of cell wall pectins from stored peaches and correlation to textural changes[J]. Carbohydrate Polymers,1998,37(4):395-408.
[7]Manrique G D,Lajolo F M. FT-IR spectroscopy as a tool for measuring degree of methyl esterification in pectins isolated from ripening papaya fruit[J]. Postharvest Biology and Technology,2002,25:99-107.
[8]应姗姗. 火龙果皮中果胶提取及改性研究[D]. 杭州:浙江大学,2014.
[9]Jiang C M,Liu S C,Wu M C. Determination of the degree of esterification of alkaline de-esterified pectins by capillary zone electrophoresis[J]. Food Chemistry,2005,91(3):551-555.
[10]Klavons J A,Bennett R D. Determination of methanol using alcohol oxidase and its application to methyl ester content of pectins[J]. Journal of Agricultural and Food Chemistry,1986,34(4):597-599.
[11]Zhong H J,Williams M A K,Goodall D M,et al. Capillary electrophoresis studies of pectins[J]. Carbohydrate Research,1998,308(1):1-8.
[12]Maness N O,Ryan J D,Mort A J. Determination of the degree of methyl esterification of pectins in small samples by selective reduction of esterified galacturonic acid to galactose[J]. Analytical Biochemistry,1990,185(2):346-352.
[13]Pawliszyn J Pawliszyn,B Pawliszyn M. Solid phase microextraction(SPME)[J]. The Chemical Educator,1997,2(4):1-7.
[14]崔同,茅原纮,刘文民. 山楂果实中活性成分的分离提取方法:中国,ZL 01103986.8[P]. 2001-02-19.
[15]王娜,张陈云,戚雨妲,等. 山楂果胶的提取及其食品化学特性[J]. 食品工业科技,2008,28(11):87-89.
Determination of the esterification degree of hawthorn pectin by headspace solid-phase microexrtaction and gas chromatography
WANG Rong-fang,YANG Xiao-bo,CHEN Jian-qiao,LI Xi-yue,CUI Tong*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
Headspace solid-phase microextraction and gas chromatography(HS-SPME-GC)were used for the qualitative determination of the esterification degree(methyl esterification and ethyl esterification)of haw pectin samples. HS-SPME experimental conditions,such as the type of fibers,extraction temperature,balance time,extraction time,salt concentrations,desorption temperature,desorption time were optimized. The best HS-SPME-GC performance was achieved under the following conditions:5 mL pectin solution in headspace glass vial with addition of 48.8% Na2SO4,20 min balance time and 30 min extraction time at 40 ℃ using 75 μm CAR-PDMS fiber and 60 s desorption time in the GC inlet at 280 ℃. The correlation coefficient r was greater than 0.9983,the detection limits of the method were 10~15 mg/L,the recovery rates were 95.6%~116.2%. The proposed method is simple,fast and accurate with high reproducibility.
hawthorn pectin;esterification degree;headspace solid-phase microextraction;gas chromatography
2016-01-15
王荣芳(1989-),女,在读硕士研究生,研究方向:农产品加工及贮藏工程,E-mail:15131220593@163.com。
崔同(1956-),男,教授,研究方向:天然产物活性成分分析,E-mail:cuitong98@aliyun.com。
河北省自然科学基金项目(C2015204187)。
TS207.3
A
1002-0306(2016)16-0056-05
10.13386/j.issn1002-0306.2016.16.002
