辣木叶中多酚提取的工艺研究
2016-11-08陶宁萍赵林敏梅梦瑶
沈 慧,陶宁萍,赵林敏,梅梦瑶
(上海海洋大学食品学院,上海 201306)
辣木叶中多酚提取的工艺研究
沈慧,陶宁萍*,赵林敏,梅梦瑶
(上海海洋大学食品学院,上海 201306)
本论文采用热浸提法,以食用酒精为溶剂,考察酒精度数、液料比、D-异抗坏血酸钠用量、提取温度和提取时间对辣木叶多酚提取率的影响,并在单因素实验的基础上,通过响应面实验分析,优化了辣木叶多酚的提取工艺。结果表明,辣木叶多酚的最优提取工艺条件:食用酒精度数为64%vol,液料比为20∶1(mL·g-1),D-异抗坏血酸钠添加量为0.15‰,提取温度为64 ℃,提取时间为115 min,在此条件下多酚的得率为3.39%。
辣木叶,多酚,酒精,提取
辣木(Moringaoleifera),分类学属为植物界(Plantage),种子植物门(Spermatophyta),双子叶植物纲(Dicotyledoneae),白花菜目(Brassicales),辣木科(Moringaceae),辣木属(MoringaAdans),乔木种(Arbor)。辣木原产于印度,由于辣木的叶、籽、根和花均能食用,主要用于增进营养与食疗保健,因而被誉为“神奇之树”[1]。我国于20世纪60年代引入,2012年11月我国卫生部发布公告批准辣木叶为新食品原料,这使得辣木叶在国内具有一定的发展前景[2]。
辣木叶富含各类维生素和矿物质成分,K含量很高,远高于Na的含量,适合高血压患者食用。除此以外,辣木叶还有许多医学效用,如消炎抑菌、降血糖、降血压、抗肿瘤、抗氧化等,其主要功效成分是多酚,并且辣木叶中多酚含量较高,具有很好的利用价值[3-4]。
目前,国内对于辣木叶的研究主要集中在蛋白质、多糖和黄酮的研究,对多酚提取的研究较少,并且已有的提取多采用工业乙醇、甲醇等有机试剂作为提取溶剂,提取后的提取液不可用于相关食品的生产[2]。本研究以辣木叶为原料,以食用酒精为载体,采用热浸提方法,在单因素实验的基础上,利用Box-Benhnken中心组合实验和响应面分析法对提取工艺进行优化,确定最佳工艺条件,以期为工业化提取辣木叶多酚提供适宜的工艺参数,得到的辣木叶酒精提取液可用于辣木酒的相关研究。
1 材料与方法
1.1材料与仪器
辣木叶粉云南辣木叶粉(水分含量10.91 g/100 g湿样),由上海中福集团有限公司提供;没食子酸、福林酚试剂、碳酸钠国药集团化学试剂有限公司;95%食用酒精等级为GB10343-2008中的优级,上海铨泽实业有限公司;D-异抗坏血酸钠食品添加剂,江西省德兴市百勤异VC钠有限公司;蒸馏水等。
HWS24型电热恒温水浴锅上海一恒科技有限公司;UV2300紫外分光光度计麦仪科学仪器(上海)有限公司;TG16-WS台式高速离心机湖南湘仪离心机仪器有限公司。
1.2实验方法
1.2.1标准曲线的绘制准确称量10 mg没食子酸,用蒸馏水定容至100 mL,配置成0.1 mg/mL的没食子酸水溶液。
具体操作根据文献[5-6]做适当的修改:精确吸取0.1 mg/mL的没食子酸标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL,分别置于20 mL的比色管中,加蒸馏水至1 mL,再加1.5 mL福林酚试剂,3 mL 75 g/L碳酸钠试剂,加水定容至10 mL后放置反应2 h。
用样品管在600~900 nm范围内扫描波长,得到扫描曲线,确定多酚的测定波长为752 nm。
以0管作空白,在752 nm处测定吸光值,以没食子酸标准品浓度为横坐标,吸光值为纵坐标,得到多酚标准曲线方程:y=99.357x-0.01538,相关系数R2=0.9992,其线性关系良好。
1.2.2辣木叶多酚的提取、测定及得率的计算准确称取一定量的辣木叶粉,以食用酒精于一定温度下进行浸提,提取后离心,得到绿色浸提液。
精确量取0.02 mL提取液于20 mL的比色管中,加蒸馏水至1 mL,再加1.5 mL福林酚试剂,3 mL 75 g/L碳酸钠试剂,加水定容至10 mL后放置反应2 h后,于752 nm处用紫外-可见分光光度计测定其吸光值。
辣木叶多酚的得率按以下公式计算:
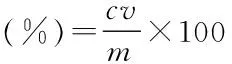
其中:c:提取液中多酚的含量,mg/mL;v:提取液体积,mL;m:称取的辣木叶粉量,mg。
1.2.3单因素实验采用1.2.2中方法提取辣木叶多酚,提取条件为:固定反应条件为1 g辣木叶粉,按液料比10∶1(mL·g-1),常温(20~26 ℃)浸提30 min,期间每隔10 min振摇1 min,考察不同酒精度(55%、60%、65%、70%、75%vol)对多酚得率的影响[7-8];固定反应条件为1 g辣木叶粉,加入65%vol的酒精溶液,常温(20~26 ℃)浸提30 min,期间每隔10 min振摇1 min,考察不同液料比(10∶1、15∶1、20∶1、25∶1、30∶1 mL·g-1)对多酚得率的影响[9];固定反应条件为1 g辣木叶粉,按液料比20∶1(mL·g-1)加入65% vol的酒精溶液,常温(20~26 ℃)浸提30 min,期间每隔10 min振摇1 min,根据GB 2760-2014食品安全国家标准食品添加剂使用标准[10],D-异抗坏血酸钠的最大添加量为0.15‰,进行添加量的筛选,考察不同添加量(0.03‰、0.06‰、0.09‰、0.12‰、0.15‰、0.18‰)对辣木叶多酚得率的影响,并进一步测定多酚稳定性;固定反应条件为1 g辣木叶粉,按液料比20∶1(mL·g-1)加入65%vol的酒精溶液,D-异抗坏血酸钠的添加量为0.15‰,浸提30 min,期间每隔10 min振摇1 min,考察提取温度(35、45、55、65、75 ℃)对多酚得率的影响[11];固定反应条件为1 g辣木叶粉,按液料比20∶1(mL·g-1)加入65%vol的酒精溶液,D-异抗坏血酸钠的添加量为0.15‰于65 ℃浸提,期间每隔10 min振摇1 min,考察提取时间(30、60、90、120、150 min)对辣木叶多酚得率的影响。
1.2.4Box-Benhnken中心组合实验设计在单因素实验的基础上,选取影响较大的四个因素,每个因素选取三个对多酚得率影响较大的水平,建立四因素三水平的Box-Benhnken中心组合实验,以多酚得率为响应值,各因素的三个水平采用-1、0、1进行编码,如表1。

表1 响应曲面设计实验因素水平和编码
1.3数据处理
利用Design-Expert 8.0.6Trial软件绘制曲线,用Excel 7.0进行数据分析,并用SPSS2.0软件进行显著性分析。
2 结果与讨论
2.1单因素对多酚得率的影响
2.1.1酒精度数对多酚得率的影响由图1可知,辣木叶多酚得率随着酒精度数的增大呈先增大再减小的趋势。这是由于多酚是多种化合物的混合物,包括各类苷类物质等,这些物质的极性和化学结构不同,在不同酒精度中的溶解度也不同。因此,确定提取辣木多酚的最佳酒精度数为65% vol。这与陈瑞娇等[8]对辣木叶总黄酮提取确定的70%的乙醇溶液相类似。

图1 酒精度数对辣木叶多酚得率的影响Fig.1 Influence of concentration of alcohol on yield of Moringa leaf polyphenols注:字母不同代表存在显著性差异(p<0.05),图2~图6同。
2.1.2液料比对多酚得率的影响图2显示多酚得率随液料比的增加先增大再减少。溶剂用量太少,导致多酚提取不完全,得率低;而用量过多会增加成本,对后续步骤带来不便,并且会由于辣木叶粉中一些其他物质如多糖溶出,影响了多酚的提取分离,导致多酚得率减少。在液料比为20∶1(mL·g-1)时多酚的得率最高,因此选择液料比20∶1(mL·g-1)。
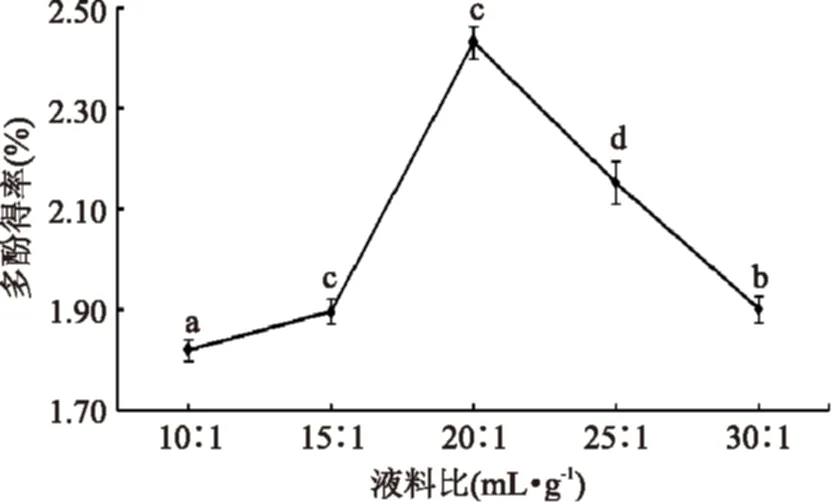
图2 液料比对辣木叶多酚得率的影响Fig.2 Influence of ratio of solution of alcoholto Moringa leaves on yield of Moringa leaf polyphenols
2.1.3D-异抗坏血酸钠用量对多酚得率的影响酚类物质由于含有两个或两个以上的酚羟基,因而极易被氧化。D-异抗坏血酸钠属于还原剂,能够将多酚氧化酶中的Cu2+还原成Cu+,还可将多酚氧化酶反应中生成的醌还原成酚,阻止醌的进一步氧化。因此,可以通过添加D-异抗坏血酸钠保护多酚。由图3可以看出,当抗氧剂添加量为0.15‰时,效果较好。
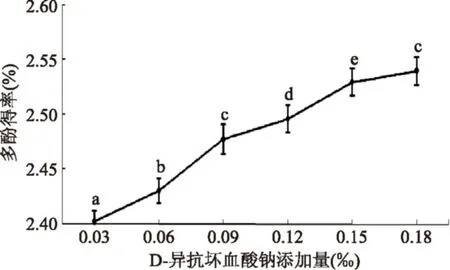
图3 D-异抗坏血酸钠添加量对辣木叶多酚得率的影响Fig.3 Influence of the amount of D-sodium erythorbate on yield of Moringa leaf polyphenols
进一步测定多酚的稳定性,结果如图4所示:
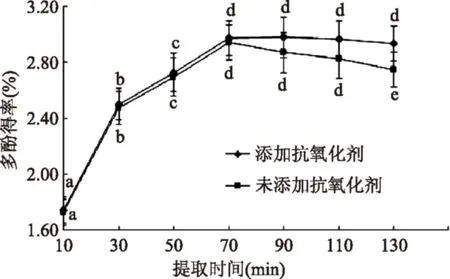
图4 多酚稳定性的研究Fig.4 The stability of Moringa leaf polyphenols
由图4可知,未加入抗氧化剂时随着时间延长多酚得率会出现显著性下降,而加入0.15‰的D-异抗坏血酸钠后多酚稳定性增强。
2.1.4提取温度对多酚得率的影响当提取温度小于65 ℃时,辣木多酚的得率随温度的升高而增加;当温度大于65 ℃时,辣木多酚的得率随温度的升高而降低。升温加强了辣木多酚的溶解扩散作用,加快了其溶出的速度,但温度过高一方面会对辣木多酚产生氧化破坏,另一方面酒精挥发导致酒精度数降低,降低了多酚的得率,因而在65 ℃以后得率逐渐减少。因此,确定最佳的提取温度为65 ℃。

图5 提取温度对辣木叶多酚得率的影响Fig.5 Influence of extraction temperature on yield of Moringa leaf polyphenols
2.1.5提取时间对多酚得率的影响提取时间对多酚得率有较大的影响。提取时间过短,导致多酚未能被完全溶解出来,提取不彻底。因此,延长提取时间可以大大提高多酚的得率。然而,提取时间过长,会造成辣木中的其它物质在热效应的作用下也被提取出来,影响提取液中多酚的含量,并且长时间受热会加速酚类物质与氧气反应不利于提取。
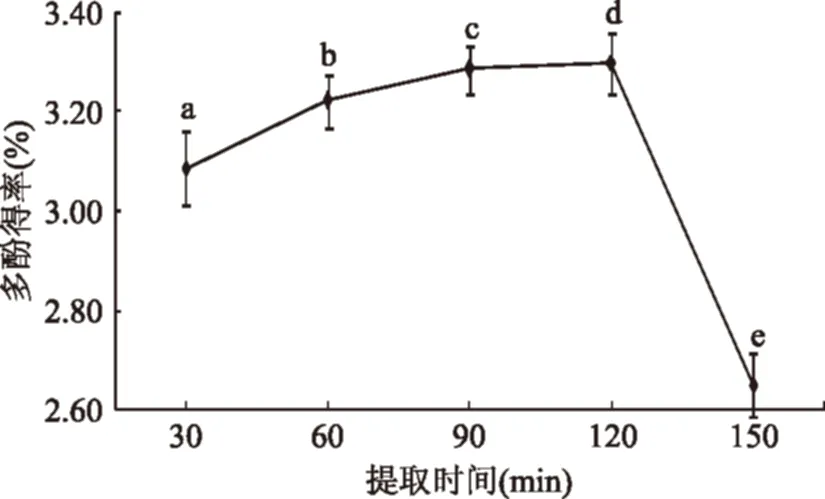
图6 提取时间对辣木叶多酚得率的影响Fig.6 Influence of extraction time on yield of Moringa leaf polyphenols
由图6可知,当提取时间小于120 min时,多酚得率随时间的延长提高;当提取时间超过120 min时,多酚得率减少。因此,辣木多酚的最佳提取时间为120 min。
2.2辣木叶多酚提取工艺优化
根据单因素各实验结果,采用Box-Benhnken进行实验因素设计,实验方案及结果如表2所示:
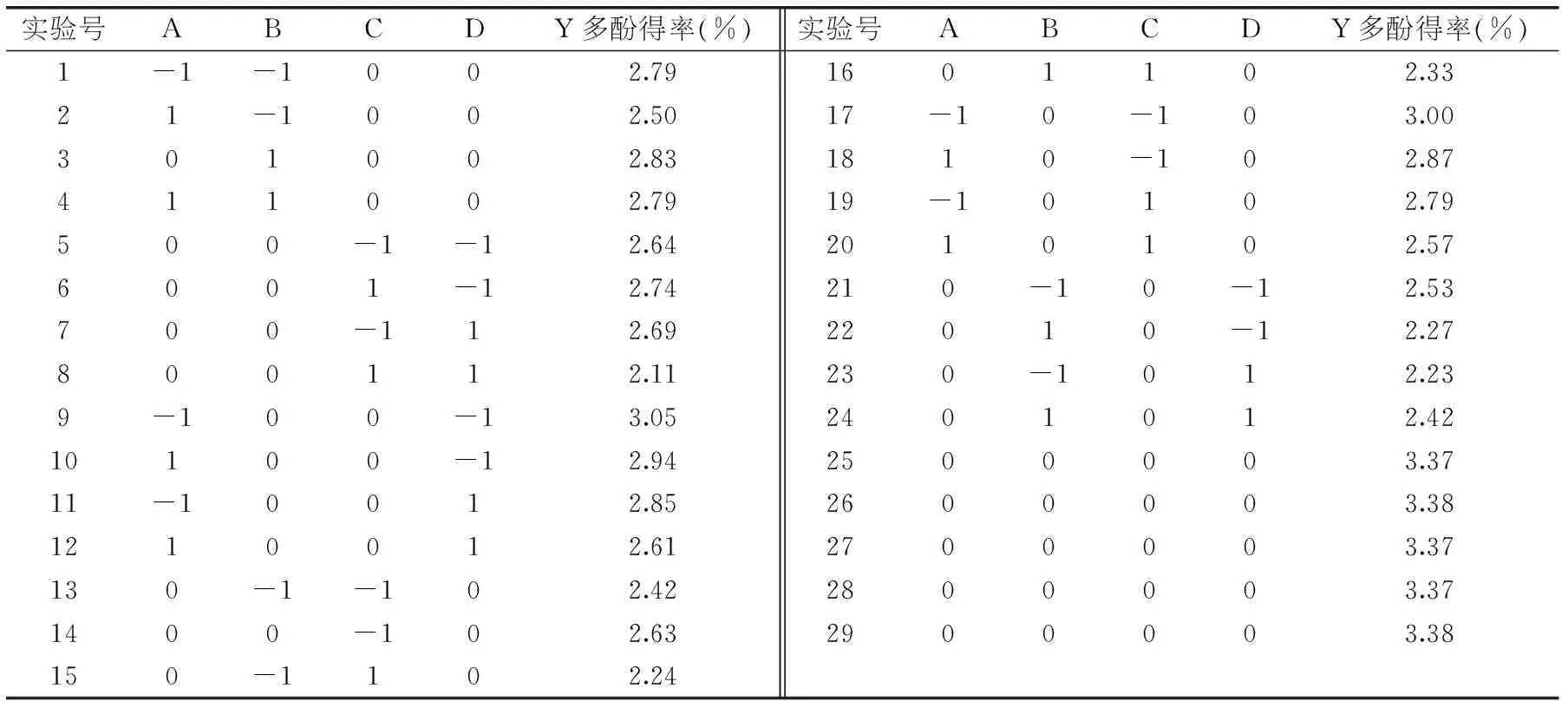
表2 Box-Behnken实验设计方案与结果
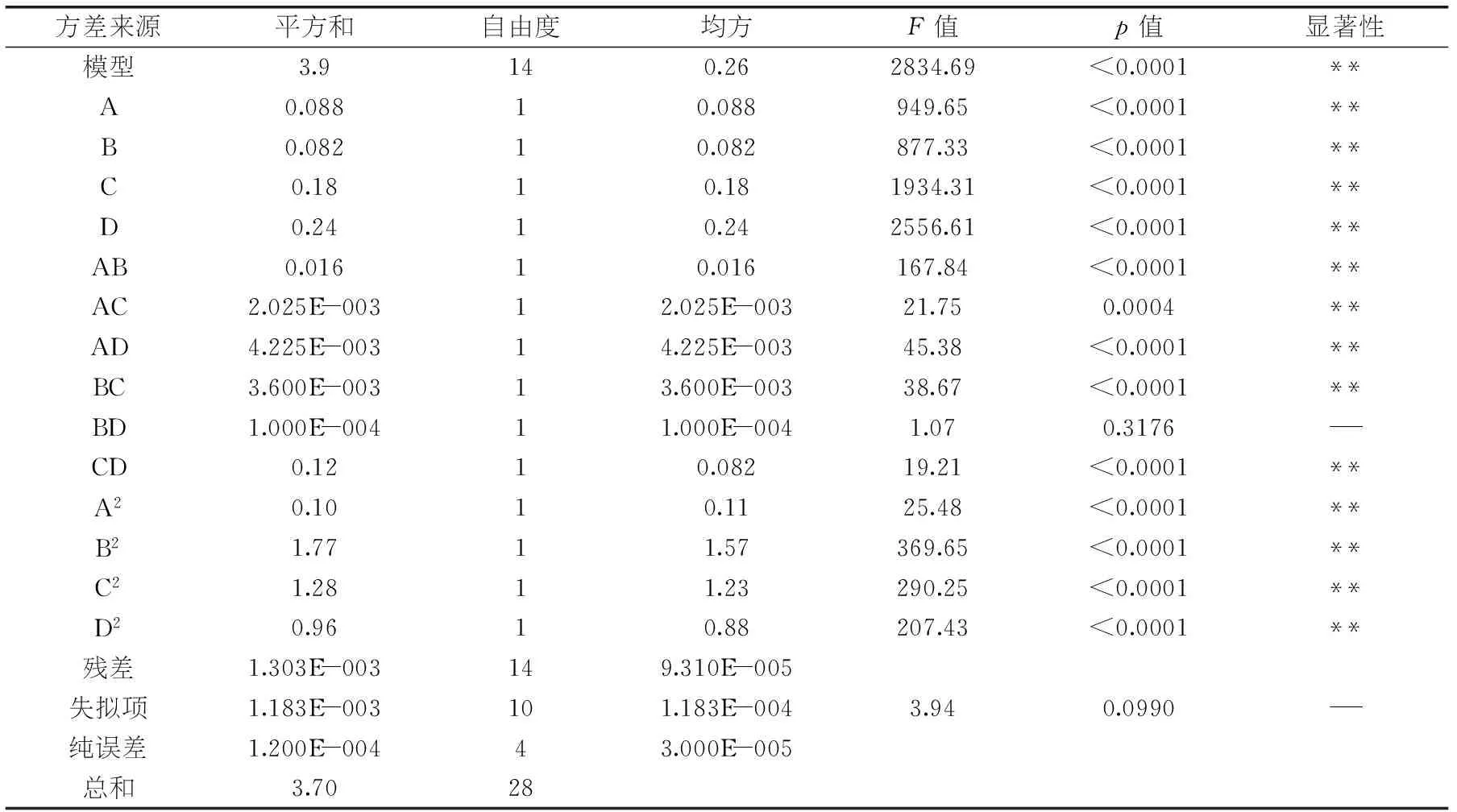
表3 响应面回归方程的方差分析
注:“-”表示不显著(p>0.05);“**”表示极显著(p<0.01)。
对表2中数据进行多元二次回归分析得到各个因素与响应值的回归方程:
Y=3.37-0.086A+0.083B-0.12C-0.14D+0.062AB-0.023AC-0.033AD-0.030BC+0.005BD-0.17CD-0.12A2-0.52B2-0.44C2-0.38D2
回归模型的R2=0.9996,为进一步验证回归模型的准确性,对实验数据和方程进行方差分析,其分析结果如表3所示,从表3可知模型对多酚得率值的影响显著(F=2834.69,p<0.0001<0.05)即实验所采用的二次模型是合理的,在统计学上是有意义的。而方程的失拟项小,差异性不显著(p=0.0990>0.05)表明回归模型与实验拟合程度好,有利于模型,因此可以利用该模型预测多酚得率代替实际实验点对实验进行结果分析。由表3可知,酒精度数、液料比、提取温度、提取时间四种因素均对响应值多酚得率的影响极显著(p<0.01),AB、AC、AD、BC、CD的p值均小于0.05,而BD的p值为0.3176大于0.05,说明酒精度数与液料比、酒精度数与温度、酒精度数与时间、液料比与温度、温度与时间之间对响应值交互作用极显著(p<0.01),而料液比和时间对响应值交互作用不显著(p>0.05)。
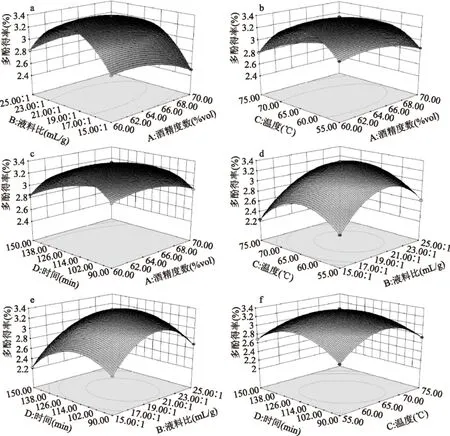
图7 提取条件对辣木叶多酚得率的响应面图Fig.7 Response surface of extraction conditions yield of Moringa leaf polyphenols evaluation
根据拟合函数的预测值可做出任意两个因素对响应值影响的三维响应面图,从模型的三维响应面图可以直观的反应因素对响应值的影响。图7a~f分别为酒精度数和液料比对多酚得率的影响、酒精度数和提取温度对多酚得率的影响、酒精度数和提取时间对多酚得率的影响、液料比和提取温度对多酚得率的影响以及提取温度和提取时间对多酚得率的影响,从图7a~f可知当其他因素浓度在0水平,其中一个因素浓度在一定水平时,多酚得率随着另外一个因素浓度的增加先上升后下降。图7e反应的是液料比和提取时间对多酚得率的影响。结合各响应面的等高线分析可以说明酒精度数和液料比之间交互作用显著,酒精度数和提取温度之间交互作用显著,酒精度数和提取时间之间交互作用显著,液料比和提取温度之间交互作用显著,提取温度和提取时间之间交互作用显著,而液料比和提取时间之间交互作用较弱,这与表3中的分析相一致。
通过对响应面分析和对回归方程求导,可得到酒精度数、液料比、提取温度、提取时间的最佳条件为:酒精度数63.63% vol、液料比20.20∶1(mL·g-1)、提取温度63.64 ℃、提取时间115.20 min,在此条件下模型的预测响应值(多酚得率)为:3.41%。鉴于实验操作可行性选择酒精度数64%vol,液料比20∶1(mL·g-1),提取温度64 ℃,提取时间115 min进行验证实验。
在最佳修正条件下进行3组平行验证性实验,所得辣木提取液的多酚得率为3.39%±0.04%。说明该模型能够较好地预测实际多酚的得率。
3 结论
通过研究发现,食用酒精浸提辣木叶多酚切实有效。酒精度数、料液比、提取温度、提取时间对辣木叶多酚的提取都有不同程度的影响。通过响应面优化并调整辣木叶多酚的最佳提取工艺条件为:酒精度数64% vol,液料比20∶1(mL·g-1),D-异抗坏血酸钠添加量0.15‰,提取温度64 ℃,提取时间115 min,在此条件下多酚的得率为3.39%;所制得的辣木提取液可进一步用于辣木酒的研发。
[1]Perumal Siddhuraju,Klaus Becker. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree(MoringaoleiferaLam.)leaves[J]. Journal of Agricultural and Food Chemistry,2003,51(8):2144-2155.
[2]郑学勤,刘福利,刘兴地,等.辣木[J]. 热带农业科学,2014,34(12):64-67.
[3]石碧,狄莹著.植物多酚[M]. 北京:科学出版社,2000.
[4]Carrie Waterman,Diana M Cheng,Patricio Rojas-Silva,et al. Stable,water extractable isothiocyanates fromMoringaoleiferaleaves attenuate inflammationinvitro[J]. Phytochemistry,2014,103:114-122.
[5]Sumaira Naeem,Muhammad Ali,Asif Mahmood. Optimization of extraction conditions for the extraction of phenolic compounds fromMoringaoleiferaleaves[J]. Pakistan Journal of Pharmaceutical Sciences,2012,25(3):535-541.
[6]Moyo B,Ovedemi S,Masika PJ,et al. Polyphenolic content and antioxidant properties ofMoringaoleiferaleaf extracts and enzymatic activity of liver from goats supplemented with Moringaoleifera leaves/sunflower seed cake[J]. Meat Science,2012,91:441-447.
[7]Vongsak B,Sithisarn P,Mangmool S,et al. Maximizing total phenolics,total flavonoids contents and antioxidant activity ofMoringaoleiferaleaf extract by the appropriate extraction method[J]. Industrial Crops and Products,2013,44:566-571.
[8]陈瑞娇,彭珊珊,王玉珍. 辣木叶总黄酮乙醇提取工艺的研究[J]. 食品研究与开发,2007,28(4):29-31.
[9]包辰. 茶树菇多酚提取及其功能学特性的研究[D]. 福州:福建农林大学,2013.
[10]GB 2760-2014,食品安全国家标准食品添加剂使用标准[S].
[11]王志巧,罗晓丽,贾江新,等. 草莓多酚的提取工艺研究[J]. 人参研究,2014(3):20-22.
Extraction technology of polyphenol fromMoringaoleiferaleaves
SHEN Hui,TAO Ning-ping*,ZHAO Lin-min,MEI Meng-yao
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
In order to study the extraction technology of polyphenol fromMoringaleave,alcohol was used as the solvent,effects of the extraction conditions,namely alcohol concentration,alcohol solution/Moringaleaves ratio,extraction temperature,extraction time and amount of D-sodium erythorbate on the extraction rate of polyphenol were investigated. And then the first 4 factors were chosen for optimization of the extraction conditions by means of response surface methodology combined with Box-Behnken experimental design based on the single factor experiments. The results showed that the optimal extraction conditions were as follows:the concentration of alcohol was 64%vol,alcohol solution/theMoringaleaves ratio was 20∶1(mL·g-1),the dosage of D-sodium erythorbate was 0.15‰,the extraction temperature was 64 ℃,the extraction time was 115 min. The yield of polyphenol was 3.39%.
Moringaoleiferaleaves;polyphenol;alcohol;ectraction
2016-02-23
沈慧(1992-),女,硕士研究生,研究方向:辣木多酚的研究,E-mail:514833410@qq.com。
陶宁萍(1968-),女,教授,研究方向:食品营养与品质评价,E-mail:nptao@shou.edu.cn。
国家科技支撑计划(2015BAD17B01)。
TS202.1
B
1002-0306(2016)18-0287-06
10.13386/j.issn1002-0306.2016.18.046
