水曲柳混交林与次生林土壤微生物量与酶活性特征1)
2016-11-07黄双双裴隆翠吴艳双孙海龙
黄双双 裴隆翠 吴艳双 孙海龙
(东北林业大学,哈尔滨,150040)
水曲柳混交林与次生林土壤微生物量与酶活性特征1)
黄双双 裴隆翠 吴艳双 孙海龙
(东北林业大学,哈尔滨,150040)
以天然次生林和人工营造的水曲柳-落叶松(水落)、水曲柳-云杉(水云)和水曲柳-红松(水红)混交林为研究对象,测定了4种林型的土壤微生物量和酶活性。结果表明:次生林和水云混交林土壤中微生物量碳、氮质量分数均高于水落和水红混交林,土壤微生物磷质量分数也表现为水红混交林最低,但是土层深(H)0≤H<10 cm土壤微生物量碳质量分数/总碳质量分数和土壤微生物量氮质量分数/总氮质量分数表现为水红混交林最高,水落混交林最低的趋势。土层0≤H<10 cm土壤过氧化氢酶、蔗糖酶、脲酶和磷酸酶活性均表现为水红混交林最低的趋势。各林型土壤微生物量质量分数与土壤酶活性之间均呈显著正相关关系,且与土壤全碳、全氮、全磷、铵态氮质量分数也呈显著正相关。总之,次生林、水云和水落混交林由于较低的林分密度和较高的阔叶树比例,土壤生物活性较高,而水红混交林则相反。
次生林;水曲柳混交林;土壤微生物;土壤酶活性
Soil microbial biomasses and soil enzyme activities were investigated in the secondary forest (SF) and the mixed plantations ofFraxinusmandshuricaandLarixgmelinii(FLP),FraxinusmandshuricaandPiceakoraiensis(FPKP),FraxinusmandshuricaandPinuskoraiensis(FPP). The soil microbial biomass carbon (MBC) and nitrogen (MBN) were higher in the SF and FPKP than those in the FLP and FKP. Soil microbial biomass phosphorus (MBP) in the FPP were significantly lower. But the ratio of soil MBC to total carbon and MBN to total nitrogen in 0-10 cm depth were highest in the FPP, while the lowest in the FLP. Soil catalase, sucrase, urease and phosphatase activities in 0-10 cm depth were also lower in the FPP. There were a significantly positive correlation between soil microbial biomasses and soil enzyme activities, which were positively correlated with the soil total carbon, total nitrogen, total phosphorus and ammonium nitrogen. Therefore, the lower stand density and higher ratio of broadleaf trees increase the soil biological activities in SF, FLP and FPKP, but they are opposite in FPP.
土壤微生物量是体积小于5×10-3μm3的细菌、真菌、藻类和原生动物等生物的总量[1-3],参与了土壤碳、氮、磷等营养元素的循环和转化,是土壤有机质的活性部分,也是土壤养分的储备库[4-6]。土壤酶是来自土壤微生物和植物根系的一种生物催化剂[7-8],参与了土壤中的各种生物和生物化学过程,常用其活性表征这些过程的强度[9-12]。两者对外界干扰的响应均十分敏感,常共同研究用于分析土壤生物活性情况,对于土壤肥力和质量的评价具有重要意义。维持和提高森林土壤质量是森林可持续经营的关键,但是营造人工针叶纯林常导致林地土壤质量下降[5,13-16],而针叶树与阔叶树的混交林能够缓解这种影响,如云杉(Piceaabies)与山毛榉(Fagussylvatica)混交[17]、落叶松(Larixgmelinii)与水曲柳(Fraxinusmandshurica)混交[18-19]、黑松(Pinusthunbergii)与刺槐(Robiniapseudoacacia)混交[20]等。研究发现,林分混交后土壤质量的这种转变与阔叶树混入后改变了土壤中的生物学过程密切相关[21-22],因此,增加对混交林中土壤微生物和酶活性的研究有助于深入理解林木混交对土壤肥力影响的机制,并为林分的可持续经营提供理论支持。
东北林区现有林地面积约4.53×107hm2,其中次生林采伐后营造的针叶人工林约占30%[23]。已有研究发现,营建水曲柳-针叶树混交林能够提高林木生长[24-25],改善林地土壤的质量[18,26],但是,现有研究对混交后林地土壤微生物和酶活性的关注较少,且主要集中于水曲柳和单一针叶树混交后与纯林之间的比较[27-28],而对树种组成不同的水曲柳混交林研究仍较匮乏。因此,本研究以水曲柳-落叶松(水落)、水曲柳-云杉(水云)和水曲柳-红松(水红)混交林,以及未采伐的次生林为研究对象,分析次生林与各水曲柳混交林间土壤微生物和酶活性的差异,探讨不同林型间土壤生物活性变化的原因,以及对土壤质量的影响,以期为我国东北地区的针叶人工林经营提供理论依据。
1 研究区概况
研究地点位于东北林业大学帽儿山实验林场,属于长白山系张广才岭西北坡,小岭余脉,该地区属温带大陆性季风气候,平均海拔约300 m。年平均气温2.8 ℃,1月份平均气温-23 ℃,7月份平均气温20.9 ℃。年平均降水量723 mm,主要集中在7、8月份,年平均蒸发量1 094 mm。无霜期120~140 d,≥10 ℃的积温2 526 ℃。原地带性顶级群落为红松阔叶林,后退化为以天然次生林为主的阔叶林。地带性土壤为暗棕壤。
2 研究方法
2.1 样地设置与样品采集
研究林分为立地条件相似的人工混交林和未采伐的次生林,坡度10°~15°,坡向为东北坡。人工混交林均为1987年营造的带状人工混交林,混交方式为3行水曲柳与3行针叶树混交,在每个林型内分别设置20 m×20 m的典型样地3块,共计12块样地。
2014年7月份对各样地进行了林木调查(表1),同时在每块样地用土钻采集0≤H<10 cm和10 cm≤H<20 cm土壤样品,每块样地内取12个点,低温保存带回实验室。土壤样品在实验室内挑去根系等杂质后过2 mm筛,一部分放于冰箱内4 ℃保存,用于土壤微生物生物量碳、氮、磷质量分数和土壤酶活性的测定,测定在2周内完成,另一部分风干后过0.149 mm筛,用于土壤基本理化性质测定。

表1 次生林与水曲柳混交林样地基本情况
2.2 研究方法

土壤微生物生物量碳、氮和磷质量分数测定均采用氯仿熏蒸浸提法[30],分别称取相当于25 g风干土质量的鲜土,放入50 mL烧杯中,置于真空干燥器中进行氯仿熏蒸,熏蒸后在25 ℃培养24 h,再将土壤样品分别用硫酸钾溶液和碳酸氢钠溶液浸提,浸提液用于土壤微生物量碳、氮和磷质量分数的测定,微生物量碳、氮质量分数用TOC(Multi N/C 2100,Jena)测定,微生物磷质量分数用流动注射分析仪(AA3)测定。
土壤全碳、全氮质量分数用元素分析仪(Elementar,Vario MACRO)测定;土壤硝态氮、铵态氮、全磷和有效磷质量分数用流动分析仪(AA3,SEAL)测定;土壤全钾和速效钾质量分数用火焰光度计测定;土壤pH值用水溶-pH值计法测定。
2.3 数据分析与处理
应用Excel2013进行数据处理,SPSS18.0进行差异性分析。
3 结果与分析
3.1 不同林型对土壤微生物量的影响
土层0≤H<10 cm土壤微生物量氮质量分数和土层10 cm≤H<20 cm土壤微生物量碳、氮质量分数由大到小均表现为次生林、水云混交林、水红混交林、水落混交林,但是仅土层10 cm≤H<20 cm土壤微生物量碳、氮质量分数具有显著差异(P<0.05)。而土层0≤H<10 cm土壤微生物量碳质量分数表现为水云混交林最高,水红混交林最低的格局(P>0.05)。土壤微生物量磷质量分数表现为水红混交林显著低于其他林型的趋势(P<0.05),土层0≤H<10 cm和10 cm≤H<20 cm微生物量磷质量分数最大值分别出现在次生林和水云混交林中。各林型土层0≤H<10 cm土壤微生物量碳、氮和磷质量分数高于土层10 cm≤H<20 cm的,其中水落混交林两土层之间差异最大(P<0.05),土层10 cm≤H<20 cm土壤微生物量碳、氮和磷质量分数分别为土层0≤H<10 cm的29%、26%和21%(表2)。
土层0≤H<10 cm土壤微生物量碳质量分数/总碳质量分数和微生物量氮质量分数/总氮质量分数均表现为水红最高,水落最低的趋势,而在土层10 cm≤H<20 cm由大到小均表现为次生林、水云混交林、水红混交林、水落混交林。各林型土壤微生物量磷质量分数/总磷质量分数的变化趋势与土壤微生物量磷质量分数相同,也表现为水红混交林最低。除了在次生林中土壤微生物量碳质量分数/总碳质量分数和微生物量氮质量分数/总氮质量分数均表现为10 cm≤H<20 cm土层高于0≤H<10 cm土层外,各林型土壤微生物量碳质量分数/总碳质量分数、微生物量氮质量分数/总氮质量分数和微生物量磷质量分数/总磷质量分数也表现为0≤H<10 cm土层的较高,但是仅土壤微生物量磷质量分数/总磷质量分数具有显著差异(P<0.05)(表2)。

表2 次生林与水曲柳混交林土壤微生物量碳、氮、磷质量分数及其与总碳、总氮、总磷质量分数的比值
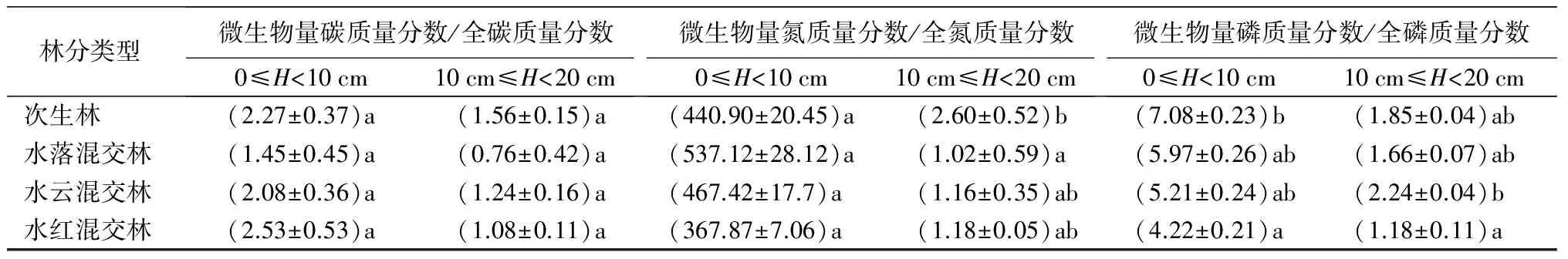
林分类型微生物量碳质量分数/全碳质量分数0≤H<10cm10cm≤H<20cm微生物量氮质量分数/全氮质量分数0≤H<10cm10cm≤H<20cm微生物量磷质量分数/全磷质量分数0≤H<10cm10cm≤H<20cm次生林(2.27±0.37)a(1.56±0.15)a(440.90±20.45)a(2.60±0.52)b(7.08±0.23)b(1.85±0.04)ab水落混交林(1.45±0.45)a(0.76±0.42)a(537.12±28.12)a(1.02±0.59)a(5.97±0.26)ab(1.66±0.07)ab水云混交林(2.08±0.36)a(1.24±0.16)a(467.42±17.7)a(1.16±0.35)ab(5.21±0.24)ab(2.24±0.04)b水红混交林(2.53±0.53)a(1.08±0.11)a(367.87±7.06)a(1.18±0.05)ab(4.22±0.21)a(1.18±0.11)a
注:表中数据为平均值±标准差;同列不同字母表示不同林型间具有显著性差异(P<0.05)。
3.2 不同林型对土壤酶活性的影响
在0≤H<10 cm和10 cm≤H<20 cm土层,过氧化氢酶活性最高值均出现在水云混交林中,比酶活性最低的水红和水落混交林均高约15%(P<0.05)。0≤H<10 cm土层的蔗糖酶和脲酶活性差异显著(P<0.05),由大到小均表现为次生林、水落混交林、水云混交林、水红混交林,而在10 cm≤H<20 cm土壤中,蔗糖酶和脲酶活性最高值分别出现在次生林和水云混交林,最低值也为水红混交林。0≤H<10 cm土层的酸性磷酸酶、中性磷酸酶、碱性磷酸酶活性由大到小均表现为水落混交林、水云混交林、次生林、水红混交林(P<0.05),10 cm≤H<20 cm土层的3种磷酸酶活性均为水红混交林最低,但最大值各不相同。3种磷酸酶活性除了红松在0≤H<10 cm土层表现为酸性磷酸酶活性最高外,其他各林型在两土层均表现为中性磷酸酶活性最高。各个林型中土层0≤H<10 cm土壤酶活性均高于土层10 cm≤H<20 cm土壤的(P<0.05),其中水落混交林上下层差异最大(表3)。

表3 次生林与水曲柳混交林土壤酶活性与理化性质

林分类型酸性磷酸酶活性/mg·kg-1·h-10≤H<10cm10cm≤H<20cm中性磷酸酶活性/mg·kg-1·h-10≤H<10cm10cm≤H<20cm碱性磷酸酶活性/mg·kg-1·h-10≤H<10cm10cm≤H<20cm次生林(445.21±18.45)ab(336.69±6.75)b (440.90±20.45)b(323.02±15.77)a(397.49±23.12)ab(257.91±10.11)b水落混交林(481.03±36.04)b(297.44±16.72)ab(537.12±28.12)c(381.77±32.89)a(466.46±47.07)b(212.32±23.80)ab水云混交林(445.46±22.65)ab(324.20±20.82)ab(467.42±17.70)b(371.19±21.01)a(416.88±21.27)ab(267.63±20.06)b水红混交林(375.82±24.70)a(251.03±29.25)a(367.87±7.06)a(316.09±5.28)a(298.47±42.37)a(158.98±20.38)a
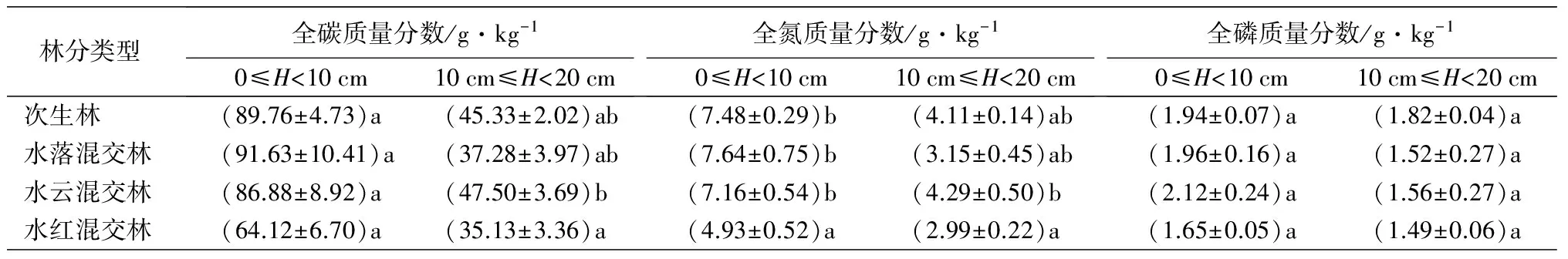
林分类型全碳质量分数/g·kg-10≤H<10cm10cm≤H<20cm全氮质量分数/g·kg-10≤H<10cm10cm≤H<20cm全磷质量分数/g·kg-10≤H<10cm10cm≤H<20cm次生林(89.76±4.73)a(45.33±2.02)ab(7.48±0.29)b(4.11±0.14)ab(1.94±0.07)a(1.82±0.04)a水落混交林(91.63±10.41)a(37.28±3.97)ab(7.64±0.75)b(3.15±0.45)ab(1.96±0.16)a(1.52±0.27)a水云混交林(86.88±8.92)a(47.50±3.69)b(7.16±0.54)b(4.29±0.50)b(2.12±0.24)a(1.56±0.27)a水红混交林(64.12±6.70)a(35.13±3.36)a(4.93±0.52)a(2.99±0.22)a(1.65±0.05)a(1.49±0.06)a
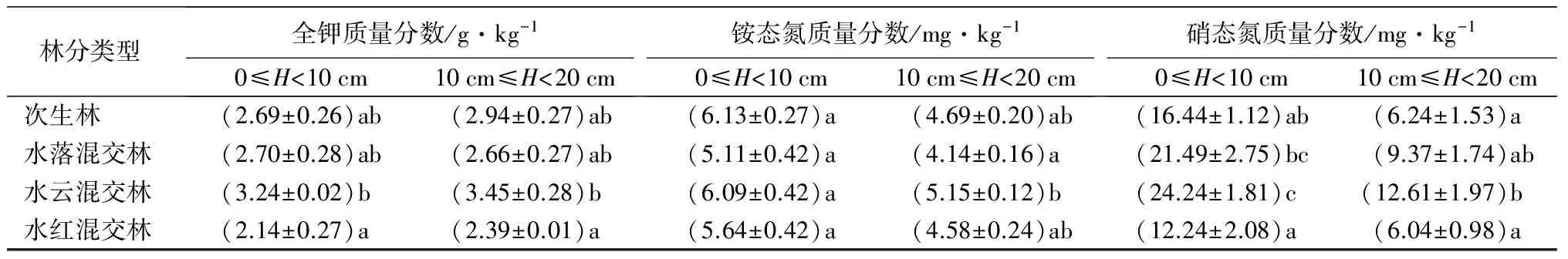
林分类型全钾质量分数/g·kg-10≤H<10cm10cm≤H<20cm铵态氮质量分数/mg·kg-10≤H<10cm10cm≤H<20cm硝态氮质量分数/mg·kg-10≤H<10cm10cm≤H<20cm次生林(2.69±0.26)ab(2.94±0.27)ab(6.13±0.27)a(4.69±0.20)ab(16.44±1.12)ab(6.24±1.53)a水落混交林(2.70±0.28)ab(2.66±0.27)ab(5.11±0.42)a(4.14±0.16)a(21.49±2.75)bc(9.37±1.74)ab水云混交林(3.24±0.02)b(3.45±0.28)b(6.09±0.42)a(5.15±0.12)b(24.24±1.81)c(12.61±1.97)b水红混交林(2.14±0.27)a(2.39±0.01)a(5.64±0.42)a(4.58±0.24)ab(12.24±2.08)a(6.04±0.98)a
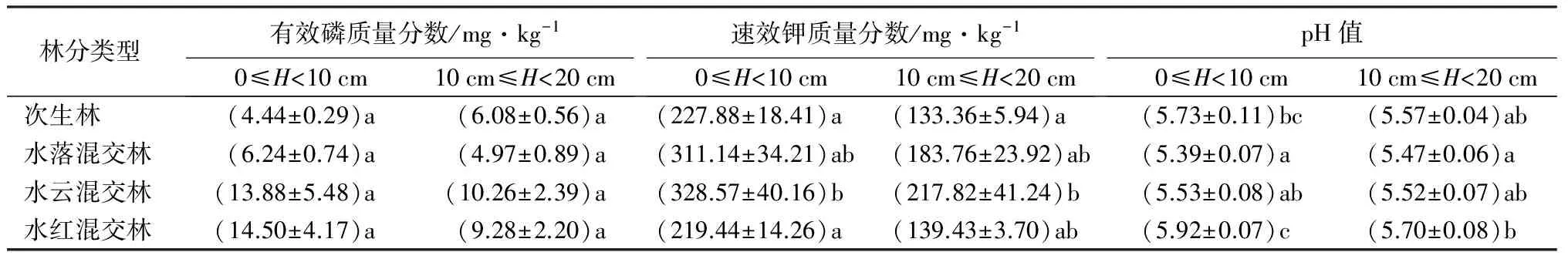
续(表3)
注:表中数据为平均值±标准差;同列不同字母表示不同林型间具有显著性差异(P<0.05)。
3.3 不同林型对土壤理化性质的影响
在0≤H<10 cm土层中,土壤全碳、全氮、全磷、全钾、硝态氮、速效钾质量分数在各林型均表现为水红混交林最低,而其他林型较高的趋势,但是仅全氮、硝态氮和速效钾质量分数在各林型间具有显著差异(P<0.05),而土壤有效磷质量分数和pH值则为水红混交林最高,土壤铵态氮为次生林最大,但差异不显著(P>0.05)。在10 cm≤H<20 cm土层中,除了土壤全磷质量分数和pH值最高值分别出现在次生林和水红混交林中,其他土壤理化性质指标均为水云混交林最高。各林型土层0≤H<10 cm土壤理化指标均高于土层10 cm≤H<20 cm的,其中土壤全碳、全氮、全磷、铵态氮、硝态氮和速效钾质量分数差异显著(P<0.05)(表3)。
3.4 土壤微生物量、土壤酶活性及土壤养分之间的相关关系
土壤微生物量碳、氮和磷质量分数之间均呈极显著正相关(P<0.01);与过氧化氢酶、蔗糖酶、脲酶和磷酸酶活性也呈正相关,但是土壤微生物量碳、氮质量分数与中性磷酸酶活性相关性不显著;除了土壤微生物量磷质量分数与有效磷质量分数呈负相关外,土壤微生物量与其他理化性质也均呈正相关,其中微生物量碳、氮和磷质量分数与全碳、全氮、全磷和铵态氮质量分数,微生物量氮质量分数与硝态氮质量分数,微生物磷质量分数与硝态氮和速效钾质量分数间相关性均达到显著水平(P<0.05)(表4)。
过氧化氢酶、脲酶、蔗糖酶和磷酸酶活性间也均呈极显著正相关(P<0.01),除了蔗糖酶活性与硝态氮、速效钾,脲酶活性与速效钾质量分数,中性磷酸酶活性与铵态氮质量分数间相关性不显著外,土壤酶活性与全碳、全氮、全磷、铵态氮、硝态氮和速效钾质量分数间均呈显著正相关;蔗糖酶、脲酶和中性磷酸酶活性与有效磷质量分数,过氧化氢酶、脲酶、磷酸酶活性与pH值间呈负相关关系,但是相关性均不显著(表4)。

表4 次生林与水曲柳混交林土壤微生物量、土壤酶活性与土壤理化性质相关性
注:*表示相关性显著(P<0.05);** 表示相关性极显著(P<0.01)。
4 结论与讨论
土壤微生物量能够反映微生物在土壤中的实际含量和作用潜力,是土壤肥力的重要体现[31]。研究表明,凋落物的数量和质量能够通过影响微生物的分解底物及其分解的难易程度,改变土壤微生物的生长和繁殖[2],一般认为阔叶树凋落物更易分解,能够为林地土壤微生物的生长提供更多的养分[32-33],本研究中水云混交林和次生林中阔叶树的比例均高于水落和水红混交林(表1),因此,水云混交林和次生林较高的土壤微生物量与两林型阔叶凋落物比例较大密切相关。陈莉莉等[34]研究发现,中等林分密度(1 500~1 650株·hm-2)下松栎混交林土壤微生物量碳、氮质量分数最高,本研究中次生林与水云混交林密度与其相似,而且低于水落和水云混交林,因此,两林型较低的林分密度能够改善林内的小气候情况[21],进而促进林下凋落物的分解,增加土壤微生物的生长和繁殖。同时研究还发现,次生林和水云混交林土壤物理状况一般较好[35],这也能为土壤微生物的生长提供适宜的环境,促进土壤微生物的生长。
研究表明,土壤微生物量不能全面反映微生物的活性、结构和功能,因而需进一步分析微生物量碳、氮、磷质量分数在土壤全碳、全氮、全磷质量分数中的比例[21,36]。本研究中微生物量碳质量分数/全碳质量分数、微生物量氮质量分数/全氮质量分数和微生物量磷质量分数/全磷质量分数分别为0.76~1.56、1.02~2.60、1.19~7.08,低于江元明等[21]和鹿士杨等[10]的研究结果,这主要与本研究中土壤总碳质量分数较高有关,与薛菁芳等[4]研究发现的沿纬度从北向南土壤微生物量碳质量分数/全碳质量分数和微生物量氮质量分数/全氮质量分数逐渐升高相似。土壤微生物量碳质量分数/全碳质量分数、微生物量氮质量分数/全氮质量分数和微生物量磷质量分数/全磷质量分数是土壤碳、氮和磷在微生物细胞中的固定比例,这些比例较高表明土壤的矿化能力较强,能够提高土壤养分有效性和土壤质量[37]。本研究中水红混交林土壤微生物量碳质量分数/全碳质量分数和微生物量氮质量分数/全氮质量分数在土层0≤H<10 cm均较高,但是土壤全碳、全氮质量分数均较低,表明水红混交林土壤肥力主要受土壤全量养分的限制。与水红混交林相反,水落混交林土壤具有较低的土壤微生物量碳质量分数/全碳质量分数和微生物量氮质量分数/全氮质量分数和较高的土壤总碳、总氮质量分数,表明该林分中土壤微生物对总碳和总氮的固定和转化较低,限制了养分的有效性。与水红混交林和水落混交林相比,次生林和水云混交林土壤全量养分和微生物对养分的固定转化较为均衡,土壤质量较高。
植物凋落物和根系分泌物是土壤酶的重要来源,因此,林分树种组成的变化能够影响土壤酶活性[11,38]。过氧化氢酶是合成土壤腐殖质和防止过氧化氢对生物毒害的重要酶,常用来反映土壤微生物活性的高低[39],一般也表现为阔叶林高于针叶林的趋势[20,40],因此,本研究中各林型土壤过氧化氢酶活性的变化与土壤微生物量碳、氮质量分数密切相关,而且阔叶树比例最低的水红混交林过氧化氢酶活性也最小。蔗糖酶和脲酶分别是土壤中碳和氮矿化的关键酶[40],常受土壤中底物供应的影响[41],因此,本研究中土壤总碳和总氮质量分数较高的水落混交林和次生林土壤酶活性也较高。除了受底物供应量的影响外,凋落物和根系组成改变后可以通过直接分泌或调整微生物类群影响蔗糖酶和脲酶的活性[42],如叶莹莹等[9]在喀斯特地区研究发现,次生林树木种类较多,土壤蔗糖酶和脲酶活性均较高,因此,本研究中次生林土壤蔗糖酶和脲酶活性较高也与该林分树种组成丰富有关。土壤磷酸酶活性是土壤中有机磷矿化的关键酶之一,常与土壤有效磷质量分数呈负相关关系[43],这是因为土壤中有效磷的缺乏可能会激发植物和微生物分泌更多的磷酸酶来获取磷素[44-45],所以本研究中水落混交林土壤磷酸酶活性最高也与该林型土壤有效磷较低有关,但是本研究中次生林土壤磷酸酶活性与此不符,这可能与该林型土壤微生物量磷质量分数较高有关,因为土壤微生物量磷的增加缓解了微生物对磷素的需求,进而减少了磷酸酶的分泌。
总体而言,次生林转变为水曲柳与针叶树的混交林后土壤微生物量和酶活性表现不同趋势,其中水云混交林土壤微生物量质量分数较高,水落混交林土壤酶活性较高,而水红混交林土壤生物活性均较低,在水红混交林经营中可以通过适当的间伐调整林分的阔叶树比例和林分密度,改善林地的生物活性,提高林地的土壤质量。因此,在水曲柳混交林经营过程中,应注意调节林分的密度和阔叶树种的比例,以利于土壤质量的保持。
[1] 曾全超,李鑫,董扬红,等.黄土高原不同乔木林土壤微生物量碳氮和溶解性碳氮的特征[J].生态学报,2015,35(11):3598-3605.
[2] 刘爽,王传宽.五种温带森林土壤微生物生物量碳氮的时空格局[J].生态学报,2010,30(12):3135-3143.
[3] JENKINSON D S, BROOKES P C, POWLSON D S. Measuring soil microbial biomass[J]. Soil Biology and Biochemistry,2004,36(1):5-7.
[4] 薛菁芳,高艳梅,汪景宽,等.土壤微生物量碳氮作为土壤肥力指标的探讨[J].土壤通报,2007,38(2):247-250.
[5] 杨凯,朱教君,张金鑫,等.不同林龄落叶松人工林土壤微生物生物量碳氮的季节变化[J].生态学报,2009,29(10):5500-5507.
[6] 张成霞,南志标.土壤微生物生物量的研究进展[J].草业科学,2010,27(6):50-57.
[7] BURNS R G, DEFOREST J L, MARXSEN J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry,2013,58(2):216-234.
[8] 曹慧,孙辉,杨浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,2003,9(1):105-109.
[9] 叶莹莹,刘淑娟,张伟,等.喀斯特峰丛洼地植被演替对土壤微生物生物量碳、氮及酶活性的影响[J].生态学报,2015,35(21):6974-6982.
[10] 鹿士杨,彭晚霞,宋同清,等.喀斯特峰丛洼地不同退耕还林还草模式的土壤微生物特性[J].生态学报,2012,32(8):2390-2399.
[12] SINSABAUGH R L, LAUBER C L, WEINTRAUB M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters,2008,11(11):1252-1264.
[13] 刘世荣,李春阳.落叶松人工林养分循环过程与潜在地力衰退趋势的研究[J].东北林业大学学报,1993,21(2):19-24.
[14] 田大伦,沈燕,康文星,等.连栽第1和第2代杉木人工林养分循环的比较[J].生态学报,2011,31(17):5025-5032.
[15] 何佩云,丁贵杰,谌红辉.连栽马尾松人工林土壤肥力比较研究[J].林业科学研究,2011,24(3):357-362.
[16] 胡亚林,汪思龙,颜绍馗,等.杉木人工林取代天然次生阔叶林对土壤生物活性的影响[J].应用生态学报,2005,16(8):1411-1416.
[17] BERGER T W, INSELSBACHER E, MUTSCH F, et al. Nutrient cycling and soil leaching in eighteen pure and mixed stands of beech (Fagussylvatica) and spruce (Piceaabies)[J]. Forest Ecology and Management,2009,258(11):2578-2592.
[18] 程国玲,唐立君,郎福生.水曲柳落叶松纯林与混交林根际土壤氮磷养分特点及变化[J].东北林业大学学报,2001,29(1):26-29.
[19] 吉艳芝,冯万忠,陈立新,等.落叶松混交林根际与非根际土壤养分、微生物和酶活性特征[J].生态环境,2008,17(1):339-343.
[20] 许景伟,王卫东,李成.不同类型黑松混交林土壤微生物、酶及其与土壤养分关系的研究[J].北京林业大学学报,2000,22(1):51-55.
[21] 江元明,庞学勇,包维楷.岷江上游油松与云杉人工林土壤微生物生物量及其影响因素[J].生态学报,2011,31(3):801-811.
[22] Borken F B. Methane and nitrous oxide fluxes of soils in pure and mixed stands of European beech and Norway spruce[J]. European Journal of Soil Science,2006,57(5):617-625.
[23] 李文华.东北天然林研究[M].北京:气象出版社,2011.
[24] 张彦东,王庆成,谷艳华.水曲柳落叶松人工幼龄混交林生长与种间竞争关系[J].东北林业大学学报,1999,27(2):6-9.
[25] 王乐祥,张同余,吕玉臣.红松、水曲柳混交林营造技术初报[J].吉林林业科技,2002,31(1):6-8.
[26] 陈永亮,李传荣.红松水曲柳纯林与混交林土壤水分性质分析[J].水土保持通报,2011,31(3):85-87.
[27] 邹莉,李国江,郑国强.水曲柳落叶松纯林与混交林土壤微生物主要生理类群[J].东北林业大学学报,2000,28(2):49-51.
[28] 谷思玉,隋跃宇.红松人工纯林、人工混交林和天然林几种土壤酶活性比较[J].农业系统科学与综合研究,2007,23(4):486-488.
[29] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[30] 吴金水.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[31] 邱权,李吉跃,王军辉,等.西宁南山4种灌木根际和非根际土壤微生物、酶活性和养分特征[J].生态学报,2014,34(24):7411-7420.
[32] 张彦东,王庆成,李清林.水曲柳落叶松纯林与混交林的枯叶分解动态[J].东北林业大学学报,1999,27(4):5-8.
[33] 杨万勤,邓仁菊,张健.森林凋落物分解及其对全球气候变化的响应[J].应用生态学报,2007,18(12):2889-2895.
[34] 陈莉莉,王得祥,于飞,等.松栎混交林土壤微生物数量与土壤酶活性及土壤养分关系的研究[J].土壤通报,2014,45(1):77-84.
[35] 夏祥友.水曲柳人工混交林土壤水分动态研究[D].哈尔滨:东北林业大学,2005.
[36] NAHIDAN S, NOURBAKHSH F, MOSADDEGHI M R. Variation of soil microbial biomass C and hydrolytic enzyme activities in a rangeland ecosystem: are slope aspect and position effective?[J]. Archives of Agronomy and Soil Science,2015,61(6):797-811.
[37] WEN L, LEI P, XIANG W, et al. Soil microbial biomass carbon and nitrogen in pure and mixed stands ofPinusmassonianaandCinnamomumcamphoradiffering in stand age[J]. Forest Ecology and Management,2014,328:150-158.
[38] WEAND M P, ARTHUR M A, LOVETT G M, et al. Effects of tree species and N additions on forest floor microbial communities and extracellular enzyme activities[J]. Soil Biology and Biochemistry,2010,42(12):2161-2173.
[39] 马朋,李昌晓,雷明,等.三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征[J].生态学报,2014,34(4):1010-1020.
[40] 张猛,张健.林地土壤微生物、酶活性研究进展[J].四川农业大学学报,2003,21(4):347-351.
[41] YIN R, DENG H, WANG H L, et al. Vegetation type affects soil enzyme activities and microbial functional diversity following re-vegetation of a severely eroded red soil in sub-tropical China[J]. Catena,2014,115(3):96-103.
[42] TIAN L, SHI W, TIAN L, et al. Short-term effects of plant litter on the dynamics, amount, and stoichiometry of soil enzyme activity in agroecosystems[J]. European Journal of Soil Biology,2014,65:23-29.
[43] 郑棉海,黄娟,陈浩,等.氮、磷添加对不同林型土壤磷酸酶活性的影响[J].生态学报,2015,35(20):6703-6710.
[44] CHEN H. Phosphatase activity and P fractions in soils of an 18-year-old Chinese fir (Cunninghamialanceolata) plantation[J]. Forest Ecology and Management,2003,178(3):301-310.
[45] NANNIPIERI P, GIAGNONI L, RENELLA G, et al. Soil enzymology: classical and molecular approaches[J]. Biology and Fertility of Soils,2012,48(7):743-762.
Soil Microbial Biomass and Enzyme Activities in theFraxinusmandshuricaMixed Plantations and Secondary Forest//
Huang Shuangshuang, Pei Rongcui, Wu Yanshuang, Sun Hailong
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(9):69-74.
Secondary forest;Fraxinusmandshurica; Soil microbial biomass; Soil enzyme activity
1)“十二五”国家科技支撑计划(2012BAD21B0202)、东北林业大学大学生创新项目(201410225066)。
黄双双,女,1993年2月生,东北林业大学林学院, 本科生 。E-mail:1750930417@qq.com。
孙海龙,东北林业大学林学院,讲师。E-mail:shlong12@126.com。
2016年3月16日。
S714.8
责任编辑:任 俐。
