Cbl-b基因沉默对小鼠原代淋巴细胞免疫活性影响的研究
2016-11-06胡彬倪娜娜吕雅琳陈浩刘毅孙建方
胡彬 倪娜娜 吕雅琳 陈浩 刘毅 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(第一作者现在武汉市第一医院皮肤科,430022)
·论著·
Cbl-b基因沉默对小鼠原代淋巴细胞免疫活性影响的研究
胡彬 倪娜娜 吕雅琳 陈浩 刘毅 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(第一作者现在武汉市第一医院皮肤科,430022)
目的 体外初步研究Cbl-b基因经特异性siRNA沉默后对小鼠淋巴细胞免疫活性的影响。方法摘取C57BL/6小鼠的脾脏,体外无菌分离小鼠脾脏淋巴细胞后进行培养。通过EntransterTM-R4000试剂将Cbl-b siRNA转染入小鼠原代淋巴细胞以沉默细胞内Cbl-b的表达。转染72 h后通过酶联免疫吸附实验(ELISA)检测淋巴细胞培养上清中干扰素γ(INF-γ)及肿瘤坏死因子α(TNF-α)的表达量。通过与B16F10黑素瘤细胞共培养,研究Cbl-b基因沉默后的淋巴细胞对B16F10黑素瘤细胞免疫杀伤活性的影响。结果 Cbl-b siRNA成功转染进小鼠原代淋巴细胞并能有效沉默细胞内Cbl-b的表达。与阴性对照转染组及空白组相比,转染Cbl-b siRNA的淋巴细胞IFN-γ、TNF-α分泌量增加(P<0.05)。共培养检测结果显示,Cbl-b siRNA转染组比转染阴性对照组能更高效地杀伤小鼠B16F10细胞。结论 Cbl-b基因沉默能够促进小鼠淋巴细胞INF-γ、TNF-α分泌能力,并能增强淋巴细胞对B16F10黑素瘤细胞的体外免疫杀伤作用。
黑色素瘤;基因沉默;小鼠;淋巴细胞;RNA,小分子干扰;免疫活性;Cbl-b
恶性黑素瘤肿瘤微环境中存在较多导致肿瘤免疫逃逸的负性调控因素,导致免疫治疗的临床有效率仍较低。研究发现,泛素连接酶Cbl-b(casitas B cell lymphoma-b)是调节T细胞活化的关键因子,在维持外周T细胞免疫耐受方面具有作用。Cbl-b在T细胞的活化过程中就起到了“闸”的作用,可能是恶性黑素瘤免疫治疗的理想靶位[1]。我们用Cbl-b基因特异性siRNA成功沉默小鼠原代淋巴细胞Cbl-b基因的表达,研究Cbl-b基因沉默对小鼠原代淋巴细胞增殖及免疫活性及杀伤活性的影响,为后续研究黑素瘤Cbl-b基因为靶向的免疫治疗建立基础。
材料与方法
一、材料
C57BL/6野生基因型小鼠,雌性,购自扬州大学比较医学中心(合格证号:201512801)。淋巴细胞分离液(天津灏洋生物制品科技有限责任公司,小鼠干扰素 γ(INF-γ)、肿瘤坏死因子 α(TNF-α)ELISA试剂盒(北京达科为生物技术有限公司),培养基为含10%胎牛血清的1640(美国Gibco公司)并添加100 U/ml青霉素和100 g/L链霉素(上海碧云天生物技术有限公司),TrizolReagent(美国Invitrogen公司),反转录试剂盒(美国Fermentas公司),PCR试剂盒(日本TaKaRa公司),Cbl-b单克隆抗体(sc-8006)(美国Santa Cruz公司),PVDF膜(美国Millipore公司),CCK-8试剂盒(日本同仁化学研究所)。PCR引物由深圳华大基因科技有限公司合成,其余为国产分析纯。CO2细胞培养箱(美国Thermo Scientific公司),PCR仪(美国ABI公司),凝胶成像及分析装置、聚丙烯酰胺凝胶电泳仪、聚丙烯酰胺凝胶垂直电泳槽、微型转膜仪(美国Bio-Rad公司),超纯水仪(美国Millipore公司),电热恒温水槽(上海精宏实验设备有限公司)。Cbl-b siRNA和阴性对照siRNA均由上海吉玛制药技术有限公司合成。
二、方法
1.细胞培养:从6周龄C57BL/6小鼠取出脾组织,D-Hanks液冲洗1次,含1%青霉素、链霉素的磷酸盐缓冲液(PBS)冲洗1次,磨碎后过滤。将过滤得到的液体以1∶1的比例与淋巴细胞分离液混合,1 118×g离心25 min后液体分为3层,取中间云雾状细胞层。D-Hanks液洗2遍,将细胞重悬于含1640培养基(含90%RPMI 1640培养基+10%胎牛血清+20 μg/L IL-2)中,整个过程无菌操作,于37℃、5%CO2饱和湿度培养箱中培养。B16F10黑素瘤细胞培养及共培养均用1640培养基。
2.原代淋巴细胞转染:淋巴细胞在6孔板中培养2~3 d,至细胞融合至80%~90%时,用PBS洗涤细胞2次。用Opti-MEM培养基稀释吹打细胞成单细胞悬液,以2×108/L密度接种24孔板,每孔500 μl,按照 EntransterTM-R4000 说明书转染。转染组每孔加1 μl EntransterTM-R4000和50 pmol Cbl-b siRNA,阴性对照组每孔加等量EntransterTM-R4000和阴性对照siRNA,同时把未经任何处理的细胞作为空白对照组。
3.RT-PCR和蛋白印迹法检测转染后Cbl-b的表达:细胞转染48 h后,收集各组细胞总RNA及总蛋白。其中RNA经RT-PCR扩增Cbl-b基因及内参照β肌动蛋白。RT-PCR所用Cbl-b正向引物:5′-GTCGCAGGACAGACGGAATC-3′,反向引物:5′-GAGCTGATCTGATGGACCTCA-3′。β 肌动蛋白正向引物:5′-ATGACCCAAGCCGAGAAGG-3′,反向引物:5′-CGGCCAAGTCTTAGAGTTGTTG-3′。PCR 条件:94 ℃ 5 min;94 ℃ 40 s,63 ℃ 40 s,72 ℃ 1 min,循环28次;最后1次延伸72℃10 min。提取的各组细胞蛋白经BCA法定量后进行蛋白印迹实验,实验用1抗为1∶200稀释的鼠抗Cbl-b,2抗为1∶2 000稀释的HRP标记的羊抗鼠IgG。以β肌动蛋白为内参照,加入ECL显色剂显色后曝光成像。各目的基因和目的蛋白的相对表达量以其与β肌动蛋白的灰度值比值表示。
4.ELISA法检测培养液中IFN-γ和TNF-α的分泌量:参照ELISA试剂盒说明要求,转染48 h后,取细胞培养上清液,把标准品、稀释液和待测样品分别加入酶标板中,每孔0.1 ml。37℃反应120 min后,加入0.1 ml生物素抗小鼠IFN-γ、TNF-α抗体工作液,37℃反应60 min。加入亲和素过氧化物酶复合物的工作液0.1 ml,37℃反应30 min。每孔依次加入TMB显色液,37℃避光反应30 min,加入0.1 ml终止液,酶联免疫监测仪450 nm测定吸光度(A值)。
5.CCK-8法检测小鼠淋巴细胞对B16F10黑素瘤细胞的杀伤活性:转染淋巴细胞24 h后,将转染组细胞、阴性对照组细胞分别与B16F10黑素瘤细胞按效靶比为 40∶1、20∶1、10∶1接种于 96孔板,每组3个复孔,体积各为100 μl。同时每个比例组均设相同数目单纯转染淋巴细胞、阴性对照组细胞及单纯肿瘤细胞作为效应细胞组和靶细胞组,每孔100 μl。培养48 h后,CCK-8试剂盒测定各组淋巴细胞对小鼠B16F10黑素瘤细胞的杀伤作用。肿瘤细胞杀伤率(%)=(单独效应细胞的A值+单独靶细胞的A值-效应细胞与靶细胞混合培养孔A值)/单独靶细胞的A值×100%。
6.统计学方法:采用SPSS13.0统计软件,所有试验重复3次,实验数据用±s表示。多组间比较采用方差分析,两两多重比较采用LSD法,小鼠淋巴细胞对B16F10黑素瘤细胞的杀伤作用比较采用两因素方差分析,P<0.05为差异有统计学意义。
结 果
一、RT-PCR检测转染后Cbl-b基因mRNA表达水平
Cbl-b特异性siRNA转染小鼠原代淋巴细胞48 h后,转染组细胞内Cbl-b的相对表达水平(0.370±0.016)明显低于阴性对照组(0.840±0.03)和空白对照组(0.850±0.015),差异有统计学意义(n=3,F=480.78,P < 0.01)。见图 1。
二、蛋白印迹法检测转染后Cbl-b基因蛋白表达水平
Cbl-b特异性siRNA转染小鼠原代淋巴细胞48 h后,Cbl-b蛋白相对表达水平(0.460±0.022)明显低于阴性对照组(0.740±0.006)和空白对照组(0.740±0.022),差异有统计学意义(n=3,F=240.57,P < 0.01)。见图 2。
三、ELISA法检测转染后淋巴细胞IFN-γ及TNF-α分泌改变
Cbl-b siRNA转染淋巴细胞48 h后,培养液中IFN-γ及TNF-α浓度在转染组、阴性对照组和空白对照组间差异均有统计学意义,且转染组IFN-γ及TNF-α浓度均显著高于阴性对照组和空白对照组,差异均有统计学意义(P<0.01),但阴性对照组与空白对照组间差异均无统计学意义(P>0.05)。见表1。
四、小鼠淋巴细胞与B16F10黑素瘤细胞共培养
C57BL/6小鼠淋巴细胞与B16F10黑素瘤细胞混合培养。肿瘤细胞未贴壁时呈圆形,有核;约2~3h后开始贴壁生长,呈长梭形,核仁明显;约12 h完全贴壁。淋巴细胞呈圆形,悬浮生长,有集群生长能力,能形成肉眼可见几十到几百个细胞成簇生长,淋巴细胞与肿瘤细胞之间有广泛的紧密膜接触。

图1 实时PCR检测Cbl-b siRNA转染淋巴细胞后Cbl-b mRNA的表达水平

图2 蛋白印迹实验检测转染后淋巴细胞内Cbl-b蛋白表达水平
五、CCK8法检测小鼠淋巴细胞对B16F10黑素瘤细胞的杀伤作用
实验结果显示,淋巴细胞与肿瘤细胞的不同效靶比对淋巴细胞的杀伤活性有显著影响(F=82.36,P<0.01),效靶比为40∶1时,淋巴细胞的杀伤最强,显著高于20∶1和 10∶1组(n=3,均P<0.01)。转染组淋巴细胞的杀伤活性显著高于阴性对照组(F=31.54,P<0.01)。见表 2。
讨 论
恶性黑素瘤是恶性程度最高的皮肤肿瘤,其对放疗和化疗均不敏感,且术后复发率高,临床上迫切需要新的治疗策略[2]。近年来研究发现,泛素连接酶Cbl-b是调节T细胞活化的关键分子,在避免免疫无能、维持外周T细胞耐受力方面具有作用[3]。研究表明,Cbl-b在调节T细胞转化生长因子β(TGF-β)信号转导通路中起着重要作用,可抑制TGF-β诱导的Foxp3+功能性Treg细胞的生成[4],还可控制T细胞活化的预支,其缺失能使T细胞对低亲和力配体产生反应,这在以分化抗原为靶点的肿瘤免疫治疗中相当重要,对抗肿瘤的负性调控有重要的意义。本实验旨在研究小鼠原代淋巴细胞经过Cbl-b基因特异性siRNA转染后,淋巴细胞抗肿瘤的细胞因子分泌情况,以及淋巴细胞与小鼠B16F10黑素瘤细胞混合培养后,对肿瘤细胞的杀伤活性的变化情况。
表1 ELISA法检测Cbl-b siRNA转染淋巴细胞48 h后干扰素γ及肿瘤坏死因子α分泌水平比较(±s,ng/L)
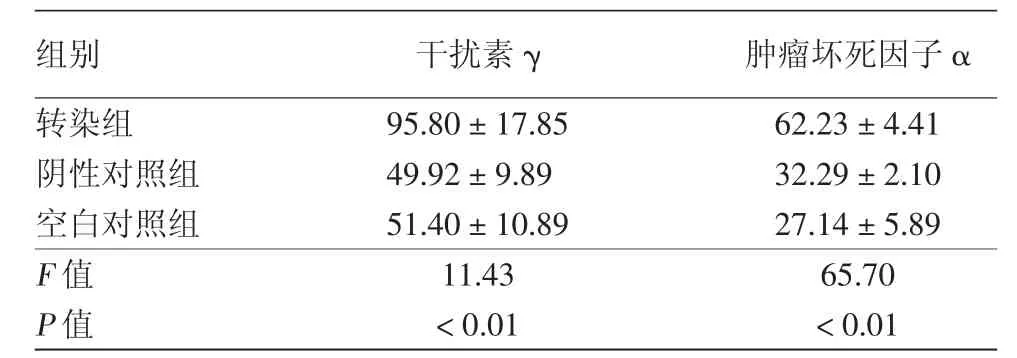
表1 ELISA法检测Cbl-b siRNA转染淋巴细胞48 h后干扰素γ及肿瘤坏死因子α分泌水平比较(±s,ng/L)
注:n=3
组别 干扰素γ 肿瘤坏死因子α转染组 95.80±17.85 62.23±4.41阴性对照组 49.92±9.89 32.29±2.10空白对照组 51.40±10.89 27.14±5.89 F值 11.43 65.70 P值 <0.01 <0.01
表2 淋巴细胞对B16F10黑素瘤细胞的杀伤率(%,±s)

表2 淋巴细胞对B16F10黑素瘤细胞的杀伤率(%,±s)
?
本研究利用合成并筛选出沉默效率最高的Cbl-b 基因特异性 siRNA[5],体外转染 Cbl-b siRNA至小鼠原代淋巴细胞,并观察其Cbl-b基因沉默后的效应。为了确保成功转染Cbl-b基因特异性siRNA,通过RT-PCR在基因水平检测基因的沉默情况,蛋白印迹实验在蛋白水平检测Cbl-b蛋白的表达下降情况,证实Cbl-b siRNA成功转入小鼠原代淋巴细胞并有效沉默Cbl-b的表达。
抗肿瘤免疫主要是以T细胞介导的细胞免疫为主,T细胞分为CD8+细胞毒性T细胞(CTL)和CD4+T辅助T细胞。CD4+T辅助细胞在接受抗原提呈细胞(APC)上的MHC-抗原复合物和共刺激分子双信号刺激后,发生活化及克隆性增殖,释放出多种细胞因子,其中以白细胞介素2(IL-2)、INF-γ、TNF-α等为主。这些细胞因子在活化、调节巨噬细胞、CD8+细胞毒性T细胞及B细胞的抗肿瘤效应中起重要作用。本试验通过ELISA法检测转染后淋巴细胞分泌抗肿瘤性细胞因子INF-γ、TNF-α的分泌情况,结果显示,转染组淋巴细胞相对于阴性对照组和空白对照组INF-γ、TNF-α分泌量明显增多,表明小鼠原代淋巴细胞经过Cbl-b基因特异性siRNA沉默后更易活化,能产生更多抗肿瘤细胞因子,因而对肿瘤细胞可能有更强的杀伤作用。另外,在淋巴细胞对B16F10黑素瘤细胞的杀伤实验中,我们将转染过Cbl-b基因特异性siRNA的淋巴细胞与小鼠B16F10黑素瘤细胞共培养,观察其对B16F10黑素瘤细胞的杀伤活性,结果显示,转染组肿瘤细胞杀伤率明显高于阴性对照组,表明Cbl-b基因沉默在体外可以增强淋巴细胞对于黑素瘤细胞的杀伤作用,当然,这种肿瘤抑制作用还需更为精确的方法,如3H-TdR掺入法等进一步验证。
[1]Wallner S,Gruber T,Baier G,et al.Releasing the brake:targeting Cbl-b to enhance lymphocyte effector functions[J].Clin Dev Immunol,2012,2012:692639.DOI:10.1155/2012/692639.
[2]Gray-Schopfer V,Wellbrock C,Marais R.Melanoma biology and new targeted therapy[J].Nature,2007,445(7130):851-857.DOI:10.1038/nature05661.
[3]Paolino M,Thien CB,Gruber T,et al.Essential role of E3 ubiquitin ligase activity in Cbl-b-regulated T cell functions[J].J Immunol,2011,186(4):2138-2147.DOI:10.4049/jimmunol.1003390.
[4]Venuprasad K.Cbl-b and itch:key regulators of peripheral T-cell tolerance[J].Cancer Res,2010,70(8):3009-3012.DOI:10.1158/0008-5472.CAN-09-4076.
[5]胡彬,倪娜娜,吕雅琳,等.Cbl-b基因shRNA干扰载体的构建及鉴定[J].中华皮肤科杂志,2015,48(3):204-207.DOI:10.3760/cma.j.issn.0412-4030.2015.03.018.Hu B,Ni NN,Lv YL,et al.Construction and identification of a short hairpin RNA expression vector targeting the Cbl-b gene[J].Chin J Dermatol,2015,48(3):204-207.DOI:10.3760/cma.j.issn.0412-4030.2015.03.018.
In vitroeffects of Cbl-b gene silencing on immunocompetence of primary murine lymphocytes
Hu Bin,Ni Nana,Lyu Yalin,Chen Hao,Liu Yi,Sun Jianfang
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(the current affiliation of the first author was Department of Dermatology,Wuhan No.1 Hospital,Wuhan 430222,China)
Objective To evaluatein vitroeffects of specific small interfering RNA (siRNA)-silencing of the casitas B-lineage lymphoma b (Cbl-b)gene on immunocompetence of primary murine lymphocytes.Methods Spleens were resected from C57BL/6 mice,and splenic lymphocytes were sterily isolated and culturedin vitro.These lymphocytes were divided into 3 groups:silence group transfected with a Cbl-b-specific siRNA using the EntransterTM-R 4000 reagent,negative control group transfected with a negative control siRNA using the EntransterTM-R4000 reagent,blank control group receiving no treatment.After additional culture for 72 hours,ELISA was performed to measure levels of interferon γ(IFN-γ) and tumor necrosis factor α (TNF-α) in culture supernatants of lymphocytes.In addition,the Cbl-b genesilenced lymphocytes were co-cultured with B16F10 melanoma cells to evaluate their immunocytotoxic effects on melanoma cells.ResultsSplenic lymphocytes were successfully isolated from C57BL/6 mice and culturedin vitro,and the Cbl-b-specific siRNA was also successfully transfected into the primary murine lymphocytes and effectively downregulated the expression of Cbl-b gene in them.Compared with the negative control group and blank control group,the silence group showed significantly increased supernatant levels of IFN-γ and TNF-α(allP<0.05).The immunocytotoxic effect of lymphocytes on melanoma cells was significantly stronger in the silence group than in the negative control group.Conclusion Cbl-b gene silencing can promote secretion of IFN-γ and TNF-α by murine lymphocytes,and enhance their immunocytotoxic effects on B16F10 melanoma cellsin vitro.
Melanoma;Gene silencing;Mice;Lymphocytes;RNA,small interfering;Immunocompetence;Cbl-b
s:Sun Jianfang,Email:Sunjf57@163.com;Liu Yi,Email:dr.liuyi@gmail.com
孙建方,Email:Sunjf57@163.com;刘毅,Email:dr.liuyi@gmail.com
10.3760/cma.j.issn.0412-4030.2016.03.004
国家自然科学基金(81171513);江苏省自然科学基金(BK2012506)
Fund programs:National Natural Science Foundation of China(81171513);Natural Science Foundation of Jiangsu Province of China(BK2012506)
2015-06-08)
(本文编辑:吴晓初)
