18F-FDG PET/CT发现胸腺鳞癌并多发肝转移两例报告
2016-11-04曹素娥焦举邹琼朱姝杨婷张勇
曹素娥 焦举 邹琼 朱姝 杨婷 张勇
·综合病例研究·
18F-FDG PET/CT发现胸腺鳞癌并多发肝转移两例报告
曹素娥焦举邹琼朱姝杨婷张勇
胸腺鳞癌在临床较为罕见,18F-脱氧葡萄糖(FDG)正电子发射型计算机体层摄像术/计算机X线体层扫描(PET/CT)应用于胸腺鳞癌亦较少报道。该文报告2例中老年男性患者,均因肝内多发转移灶行18F-FDG PET/CT检查,发现胸腺病灶,病理均证实为胸腺鳞癌。2例患者的胸腺病灶体积均较大,形态不规则,密度不均,见密集钙化灶,轻至中度强化,放射性分布不均匀,实性成分FDG摄取较高,2例患者预后均较差。该2例患者的诊治提示,胸腺鳞癌的18F-FDG PET/CT检查结果具有一定的特征性,可提供解剖及功能方面的信息。18F-FDG PET/CT在胸腺鳞癌的诊断、鉴别诊断和预测复发、转移及预后方面具有潜在价值。
胸腺肿瘤;诊断;18F-脱氧葡萄糖;
正电子发射型计算机体层摄像术/计算机X线体层扫描
Positron emission tomography computedtomograply
胸腺鳞癌是临床上罕见的纵隔恶性肿瘤,占所有恶性肿瘤不到1%[1]。WHO于2004年重新修订胸腺肿瘤分类,将胸腺肿瘤分为胸腺瘤(A、AB、B1、B2、B3型)和胸腺癌(C型),胸腺鳞癌是胸腺癌最常见的类型[2]。目前18F-脱氧葡萄糖正电子发射型计算机体层摄像术/计算机X线体层扫描(18F-FDG PET/CT)在胸腺鳞癌方面的报道少见。本文介绍2例因肝转移灶行PET/CT发现胸腺病变,病理证实为胸腺鳞癌的患者,并结合文献分析,以期提高PET/CT对其诊断价值。
病例资料
例1患者男,60岁。2015年9月20日因体检发现肝占位性病变就诊,自诉无其他异常症状,体格检查未见其他明显异常体征。实验室检查:糖链抗原19-9(CA19-9)>1 200 kU/L(正常参考值范围0~35 kU/L),糖链抗原125(CA125)233.6 kU/L (正常参考值范围0~35 kU/L),癌胚抗原 6.9 μg/L(正常参考值范围0~5.0 μg/L),甲胎蛋白3.50 μg/L(正常参考值范围0~8.1 μg/L),其余实验室检查未见明显异常。腹部CT示:肝内多发、大小不等的类圆形低密度影。超声引导下肝肿物穿刺活组织检查(活检),镜下示:肿物呈乳头状增生,乳头表面被覆多层细胞,细胞胞浆丰富,核不规则,有核仁,核分裂易见,间质血窦不丰富。免疫组织化学检查结果示:P63(+),细胞角蛋白5/6(CK5/6,+),雌激素受体(ER,-),孕激素受体(PR,部分+),人绒毛膜促性腺激素(hCG,-),人胎盘碱性磷酸酶(PLAP,-),CD30(-),肿瘤干细胞相关因子OCT-3/4(-),肝细胞抗原(hep,-),癌胚抗原启动子(PCEA,包膜+),CD34(-),CK7(-),甲状腺转录因子1(TTF1,-),CK20(-),尾型同源盒基因2(CDX2,-),细胞增殖抗原标记物Ki67(15%+)。病理诊断:低分化鳞癌,转移癌可能。之后行18F-FDG PET/CT检查,采用美国GE Discovery Elite 64排128层CT,结果示:前纵隔一肿块,形态不规则,边界尚清,大小约30 mm×50 mm,密度不均,内见多发囊性区及稍高密度条状分隔,实性成分见簇状密集钙化灶(图1),肿块放射性分布不均,实性成分见放射性浓聚,最大标准摄取值(SUVmax)约9.6,胸腺病灶SUV峰值(SUVpeak)与纵隔血池SUV均值(SUVmean)比率(T/M)约4.27,囊性及钙化区放射性分布稀疏或缺损(图2)。肝内病灶SUVmax约7.3(图3)。遂行胸腔镜下纵隔肿物切除术,术中见前纵隔一大小约30 mm×20 mm肿物,形状不规则,侵犯心包和纵隔胸膜。纵隔肿物的石蜡病理切片示:肿物肿瘤细胞异型性明显,有瘤巨细胞,核分裂象多见,并见坏死,排列成巢状,部分区域有囊性变。免疫组织化学检查结果示:CK(+),波形纤维蛋白(Vim,-),CK5/6(+),钙视网膜蛋白(CR,-),间皮表面微绒毛抗原(MC,灶性+),P63(+),Wilm’s肿瘤基因-1(WT-1,-),CEA(-),MOC31(-),S100(-),CD31(-),EMA(灶性+),D2-40(-),CD99(灶性+),Bcl-2(+),CD5(+),CD117(+),CD56(灶性+)。病理诊断:考虑胸腺低分化鳞癌并多发肝转移。术后行吉西他滨联合顺铂化学治疗,8个月后随访腹部CT,发现肝内病灶较前增多、增大(图4)。
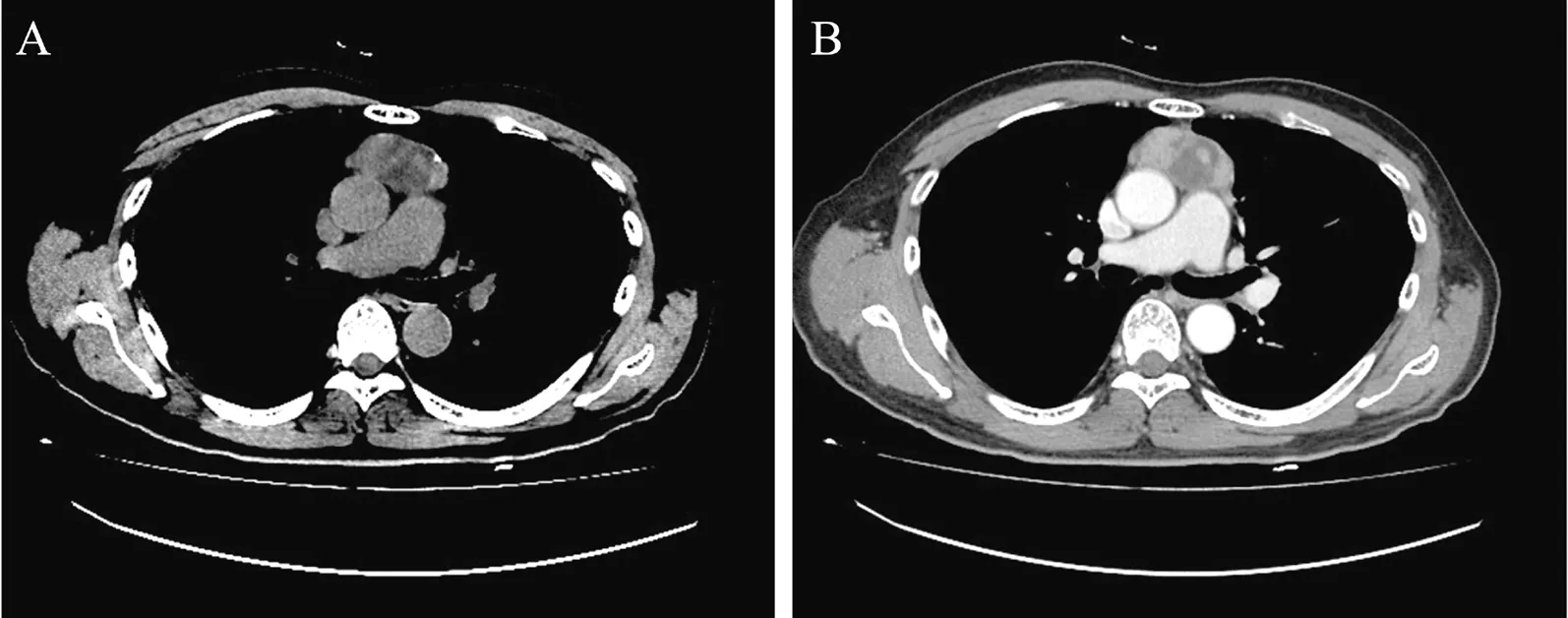
图1 例1胸腺鳞癌并多发肝转移患者的胸部CT检查结果
A:前纵隔一不规则肿块影,CT平扫密度不均,见囊状低密度影及稍高密度分隔影,另见钙化;B:增强扫描实性成分轻度强化
例2患者男,39岁。2016年3月2日因反复右上腹隐痛2个月就诊,自诉无其他异常症状,体格检查未见明显异常体征。实验室检查示:CA19-9 251 kU/L,CA125 1 458 kU/L,血清铁蛋白(FER)748.3 μg/L (正常参考值范围22~322 μg/L),癌胚抗原18.0 μg/L,AFP 2.20 μg/L(正常参考值范围0~8.1 μg/L),AST 121.0 U/L (正常参考值范围15~40 U/L) , ALT 130 U/L(正常参考值范围3~35 U/L),其余实验室指标未见明显异常。上腹部CT示:肝内多发大小不等、类圆形肿块影,不均匀强化,考虑转移瘤。遂行PET/CT,结果示:前纵隔一肿块,形态不规则,边界欠清,大小约59 mm×36 mm,密度不均,内见低密度囊性坏死区,实性成分内见密集钙化灶,轻度不均匀强化,放射性分布不均,实性成分放射性聚集,SUVmax约4.7,T/M约5.11,囊性及钙化区放射性分布稀疏或缺损;病灶与局部心包分界不清(图5);肝内多发大小不等低密度影,放射性浓聚,SUVmax约18.7(图6)。后行胸腔镜下纵隔肿物活检,镜下见肿物位于上纵隔主动脉弓前上方,质硬,与纵隔胸膜粘连紧密。纵隔肿物的石蜡病理切片示:在大量纤维结缔组织背景上见少量成巢的异形细胞,细胞胞浆丰富,核卵圆形或短梭形,可见核仁,核分裂可见,伴较多坏死。免疫组织化学检查结果示:CK(+),上皮膜抗原(EmA,+),Vim(-),TTF-1(-),CD56(-),突触素(Syn,-),嗜铬粒蛋白A(CgA,-),CD3(-),CD20(-),Oct3/4(-),PLAP(-),CD30(-),CD117(+),CD5(+),CK5/6(部分+),P63(+),Ki-67(约30%+)。病理诊断:胸腺鳞癌。临床综合诊断:胸腺鳞癌并多发肝转移。患者术后行培美曲塞二钠联合奈达铂化学治疗,1个半月后复查,结果示肝损伤加重,AST 269.0 U/L,ALT 151 U/L。

图2 例1胸腺鳞癌并多发肝转移患者的PET/CT检查结果(胸腺病灶)
前纵隔放射性分布不均,实性成分SUVmax约9.6,T/M约4.27
讨 论
胸腺鳞癌好发于中老年,男性略多于女性[3]。临床症状无特异性,主要表现为胸痛、咳嗽、乏力、体质量下降等,与胸腺瘤极为相似,部分患者可无任何症状[4]。本文2例患者分别为60、39岁男性,均因转移灶症状就诊,胸部未见异常症状及体征。
本文2例患者的病灶均位于前纵隔,大小分别约20 mm×30 mm、59 mm×36 mm,形态不规则,密度不均,内见囊状低密度区,与文献报道基本一致[4-6]。另外,2例患者的病灶内均见密集钙化灶。有研究认为恶性肿瘤常见簇状及点状密集钙化[7-8]。但也有研究认为,胸腺癌钙化少见[5]。张中等[9]认为,胸腺鳞癌的强化方式不均匀,且强化程度为轻至中度。本文2例病灶均呈不均匀轻度强化,与该观点一致。另外,例1患者的病灶内见稍高密度条状分隔,有关此类征象的报道较少。
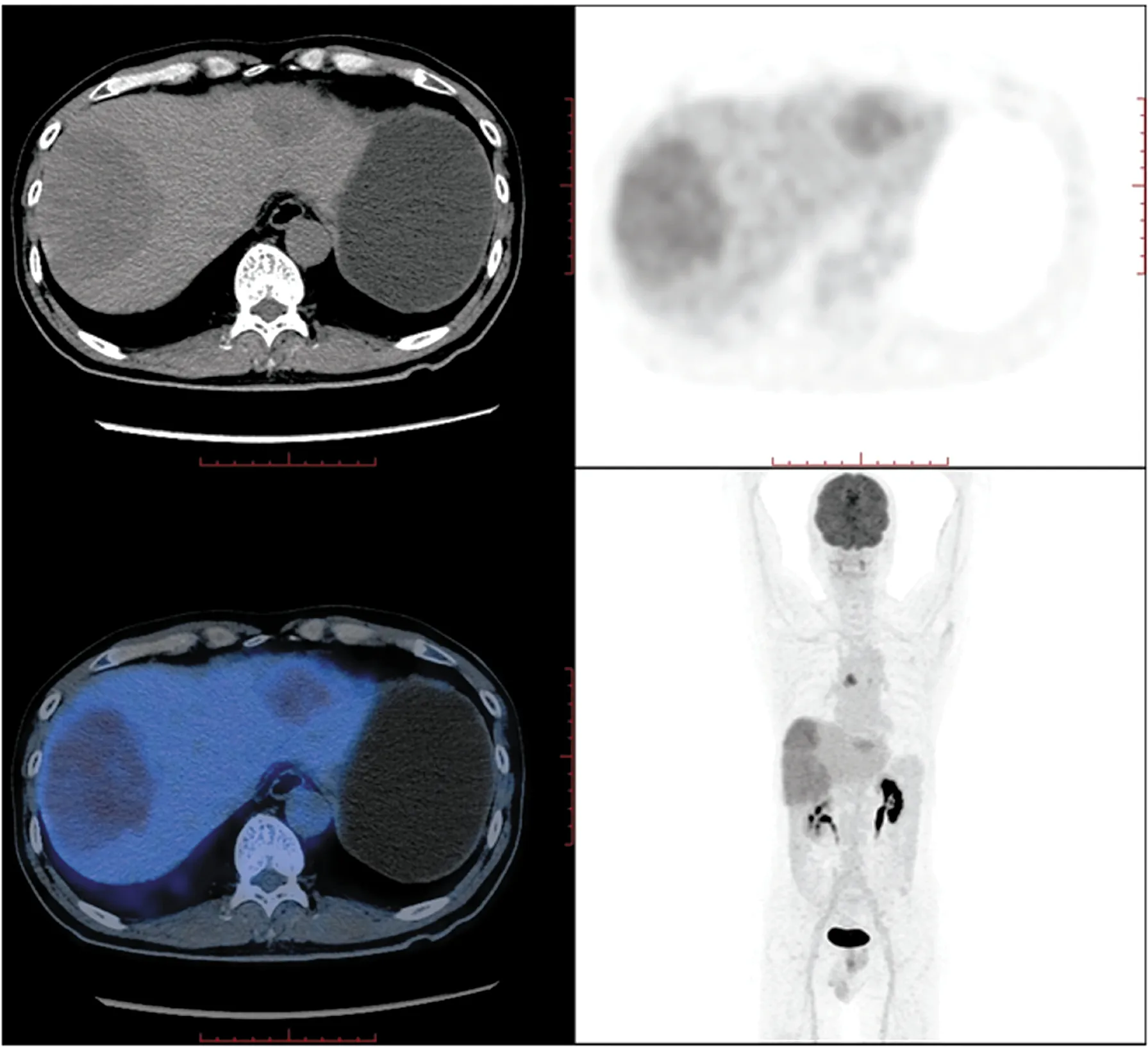
图3 例1胸腺鳞癌并多发肝转移患者的PET/CT检查结果(肝内病灶)
肝内见大小不等低密度灶,SUVmax约7.3

图4 例1胸腺鳞癌并多发肝转移患者术后8个月的腹部CT检查结果
A:CT平扫见肝内片状低密度影,囊变较前明显,范围较前增大;B:动脉期,病灶周边强化;C:病灶实性成分进一步强化;D:静脉期,病灶周边强化程度轻度减退
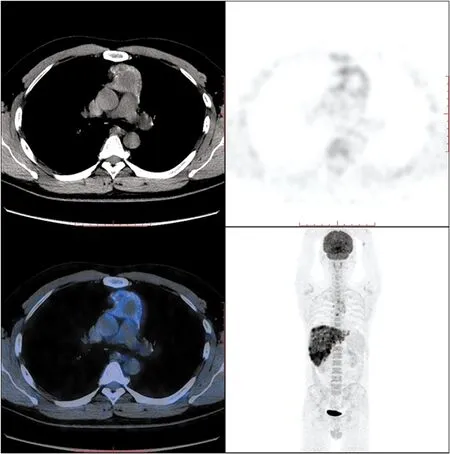
图5 例2胸腺鳞癌并多发肝转移患者的PET/CT检查结果(胸腺病灶)
前纵隔一肿物,形态不规则,CT平扫密度不均,病灶内多发小钙化灶,肿物放射性分布不均,实性成分SUVmax约4.7,T/M约5.11
18F-FDG PET/CT可一次性获得全身影像,在寻找肿瘤原发病灶方面具有独特的优势。本文2例患者均因病理或临床诊断肝转移,为寻找原发病灶而行PET/CT检查。PET/CT在肿瘤的诊断、分级及分期方面具有潜在价值。研究发现,18F-FDG PET/CT可用于纵隔肿瘤的鉴别诊断,病灶FDG摄取水平可预测其WHO分级及组织学类型[10-14]。Park等[13]研究发现,胸腺癌FDG摄取水平明显高于胸腺瘤,并通过受试者工作特征(ROC)曲线,选取SUVmax5.0作为截点,用于胸腺癌和胸腺瘤的鉴别诊断。但Benveniste等[11]报道了12例胸腺癌、37例胸腺瘤,发现当选取SUVmax5.0为截点时,59%胸腺瘤误诊为胸腺癌,当以SUVmax6.0为截点时,诊断胸腺癌的敏感度是100%,可仍有38%的胸腺瘤被误诊为胸腺癌。虽然在鉴别胸腺癌与胸腺瘤方面,SUVmax临界点的选取可能会导致一定的假阴性或假阳性,但病灶SUVmax值越高,胸腺癌诊断的敏感度越高。同时,有学者认为T/M比值可评估胸腺病灶,以T/M 2.75为截点,可用于鉴别A、AB、B1与B2、B3胸腺瘤及胸腺癌[14]。本文2例患者胸腺病灶的SUVmax分别为9.6、4.7,T/M分别为4.27、5.11。Lee等[1]研究发现,胸腺癌在FDG PET/CT上更易表现为放射性分布不均,这可能与肿瘤组织的细胞密度、增值分化能力、血管再生及坏死有关,本文2例患者的病灶实性成分放射性浓聚,坏死区及钙化区放射性分布稀疏及缺损。有报道,当胸腺肿瘤原发灶SUVmax≥4.27时,更易复发及远处转移[15]。同时,FDG摄取水平也是一个独立的预后因素,肿瘤细胞对FDG的摄取水平越高,患者的预后越差[16]。本文例1侵犯心包和纵隔胸膜,例2虽未经病理证实周围的侵犯,但胸腔镜下见肿物与纵隔胸膜粘连紧密,PET/CT上见病灶与心包分界不清,2例初诊时均已见肝转移,与文献报道基本相符。虽然病例1手术及辅助化学治疗后,患者未出现复发征象,但8个月后腹部CT提示肝转移灶较前增多、增大;例2化学治疗后1个半月复查,发现患者肝功能极差,2例患者的预后均不尽人意。
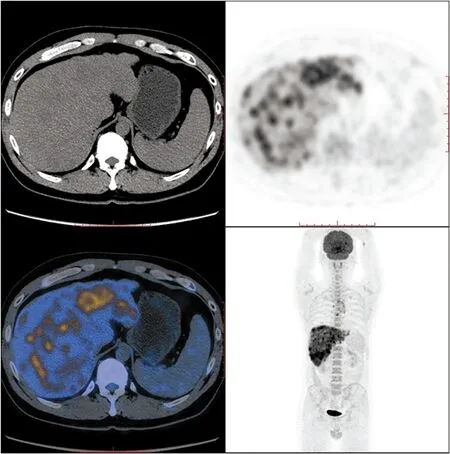
图6 例2胸腺鳞癌并多发肝转移患者的PET/CT检查结果(肝内病灶)
肝内多发低密度灶,放射性明显浓聚,SUVmax约18.7
综上所述,胸腺鳞癌罕见,18F-FDG PET/CT检查具有一定的特征性,可对疾病提供解剖及功能方面的信息,在其诊断、鉴别诊断和预测复发、转移及预后方面具有潜在价值。不过,18F-FDG PET/CT在胸腺鳞癌的价值,还需大样本研究进一步探究。
[1]Lee HS, Oh JS, Park YS, Jang SJ, Choi IS, Ryu JS. Differentiating the grades of thymic epithelial tumor malignancy using textural features of intratumoralheterogeneity via (18)F-FDG PET/CT. Ann Nucl Med,2016,30(4):309-319.
[2]孙传恕. 纵隔实性病变的影像学与病理学对照研究.大连医科大学, 2011.
[3]史敏科, 陈宝俊, 袁文杰. 11例胸腺鳞癌患者的临床分析. 中华肿瘤杂志, 2014, 36(5): 385-386.
[4]唐浩, 贾铭, 廖昕, 罗振东,黄婵桃,蔡裕兴. 胸腺少见原发性恶性肿瘤的CT表现. 临床放射学杂志, 2012, 31(9): 1261-1264.
[5]Hu YC, Wu L, Yan LF, Wang W, Wang SM, Chen BY, Li GF, Zhang B, Cui GB.Predicting subtypes of thymic epithelial tumors using CT: new perspective based on a comprehensiveanalysis of 216 patients.Sci Rep,2014,4:6984.
[6]Zhao Y, Zhao H, Hu D, Fan L, Shi J, Fang W.Surgical treatment and prognosis of thymic squamous cell carcinoma: a retrospective analysis of 105 cases.Ann Thorac Surg,2013,96(3):1019-1024.
[7]刘卫敏, 孔庆聪, 李健宁, 孟晓春,王晓红,单鸿. 触诊阳性乳腺病变的钼靶X线诊断. 新医学, 2014, 45(11): 742-745.
[8]张磊, 郑维. 钙化与甲状腺癌的关系. 医学理论与实践, 2012, 25(1): 38-39.
[9]张中, 阚晓婧, 龚智泉, 葛英辉,张继良. 胸腺鳞癌的临床及影像学表现. 医药论坛杂志, 2015, 36(11): 173-174.
[10]Lococo F, Cesario A, Okami J, Cardillo G, Cavuto S, Tokunaga T, Apolone G, Margaritora S, Granone P.Role of combined 18F-FDG-PET/CT for predicting the WHO malignancy grade of thymic epithelial tumors: amulticenter analysis.Lung Cancer,2013,82(2):245-251.
[11]Benveniste MF, Moran CA, Mawlawi O, Fox PS, Swisher SG, Munden RF, Marom EM.FDG PET-CT aids in the preoperative assessment of patients with newly diagnosed thymic epithelialmalignancies.J Thorac Oncol,2013,8(4):502-510.
[12]Igai H, Matsuura N, Tarumi S, Chang SS, Misaki N, Go T, Ishikawa S, Yokomise H.Usefulness of[18F]fluoro-2-deoxy-D-glucose positron emission tomography for predicting the WorldHealth Organization malignancy grade of thymic epithelial tumors.Eur J Cardiothorac Surg,2011,40(1):143-145.
[13]Park SY, Cho A, Bae MK, Lee CY, Kim DJ, Chung KY.Value of18F-FDG PET/CT for predicting the World Health Organization malignant grade of thymic epithelial tumors: focused in volume-dependent parameters. Clin Nucl Med, 2016,41(1):15-20.
[14]Terzi A, Bertolaccini L, Rizzardi G, Luzzi L, Bianchi A, Campione A, Comino A, Biggi A. Usefulness of 18-F FDG PET/CT in the pre-treatment evaluation of thymic epithelial neoplasms. Lung Cancer, 2011,74(2):239-243.
[15]Lococo F, Cesario A, Treglia G.Is it time to validate the prognostic role of 18-F-FDG PET/CT scan in thymic epithelial tumors?Ann Nucl Med,2014,28(6):593-594.
[16]Meirelles GS, Schöder H, Ravizzini GC, Gönen M, Fox JJ, Humm J, Morris MJ, Scher HI, Larson SM.Prognostic value of baseline[18F] fluorodeoxyglucose positron emission tomography and 99mTc-MDPbone scan in progressing metastatic prostate cancer.Clin Cancer Res,2010,16(24):6093-6099.
(本文编辑:林燕薇)
Application of18F-FDG PET/CT in diagnosis of thymic squamous cell carcinoma complicated with multiple hepatic metastases: report of two cases
CaoSue,JiaoJu,ZouQiong,ZhuShu,YangTing,ZhangYong.
DepartmentofNuclearMedicine,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
,ZhangYong,E-mail:zy5040@163.com
Thymic squamous cell carcinoma is rarely encountered in clinical practice. Application of18F-FDG PET/CT in the diagnosis of thymic squamous cell carcinoma has been seldom reported. In this paper, two middle-aged and elderly male patients received18F-FDG PET/CT due to multiple hepatic metastases. Thymus lesions were identified and pathologically diagnosed as thymic squamous cell carcinoma. In both patients, the thymus lesions were characterized as large size, irregular morphology, heterogeneous density, intensive calcification, mild to moderate enhancement and uneven radioactive distribution. The solid substances had high uptake level of FDG. Two cases presented with poor clinical prognosis. The diagnosis and treatment of these two patients prompted that thymic squamous cell carcinoma patients had specific18F-FDG PET/CT characteristics, which provided data for anatomical and functional analyses.18F-FDG PET/CT is of potential for the diagnosis, differential diagnosis, predicting the recurrence, metastasis and clinical prognosis of patients with thymic squamous cell carcinoma.
Thymus neoplasm; Diagnosis;18F-FDG;

10.3969/j.issn.0253-9802.2016.10.013
510630 广州,中山大学附属第三医院核医学科
,张勇,E-mail: zy5040@163.com
2016-04-20)
