双(氟磺酰)亚胺锂制备和应用研究进展
2016-11-03薛峰峰王建萍王鹏杰马广辉耿梦湍
薛峰峰 , 王建萍 , 王鹏杰 , 马广辉 , 耿梦湍
(多氟多化工股份有限公司 , 河南 焦作 454191)
双(氟磺酰)亚胺锂制备和应用研究进展
薛峰峰 , 王建萍 , 王鹏杰 , 马广辉 , 耿梦湍
(多氟多化工股份有限公司 , 河南 焦作454191)
双(氟磺酰)亚胺锂作为一种新型锂电池电解质,由于其优异的性能受到广泛关注。总结了双(氟磺酰)亚胺锂应用于新型锂电池中的性能,并对当前双(氟磺酰)亚胺锂合成工艺进行了归纳整理,对其今后的发展方向和前景进行了展望。
双(氟磺酰)亚胺锂 ; 合成 ; 应用
0 前言
锂离子电池因工作电压高、能量密度大、循环寿命长、可快速充放电的优良特性已广泛应用于移动电话、笔记本电脑、小型电动工具等领域,并且迅速向新能源电动汽车和大型储能电站拓展。
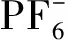
全氟烷基磺酰亚胺锂盐具有良好的热稳定性和化学稳定性被认为是有可能取代LiPF6的新一代锂离子电池电解质。目前研究较多的是双(三氟甲基磺酰)亚胺锂(LiN(CF3SO2)2,LiTFSI),LiTFSI电解液在3.7 V Li+/Li)的电位下开始对Al正极集流体表现出严重的腐蚀性,限定了其在锂离子电池体系中的应用。部分研究表明增长氟碳链有利于改善全氟烷基磺酰亚胺锂电解液/Al箔界面的电化学稳定性,例如Li[N(CF3SO2)(C4F9SO2)]对A1箔的腐蚀电位提高到4.5 V和4.6 V(vs. Li+/Li)。但是同时降低了相应电解液的电导率,而削弱了它们在锂离子电池电解液中的实际应用价值。此外含有F—S或者F—P键阴离子的电解质锂盐也有利于降低对集流体的腐蚀,双(氟磺酰)亚胺锂 LIFSI(分子式Li[N(SO2F)2]),相对分子质量187.07,CAS号171611-11-3)以其良好的化学和电化学稳定性、独特的电极材料相容性、低黏度、低熔点、高导电率等优异性能,近几年来引发了国内外电池领域学术界和产业界的高度关注。
1 双(氟磺酰)亚胺锂在锂电池中的应用
Abouimrane A等[1]对含LIFSI的EC∶DMC为1∶1电解液用于锂离子电池表现进行了研究。他们发现物质的量浓度0.85 mol/L的LIFSI溶于EC/DMC溶剂体系中表现出非常好的离子传导率(12 mS/cm,25 ℃)。基于LIFSI锂盐和EC/DMC溶剂电解液体系具有宽达5.6 V的电化学窗口,这种电解液不论用于LiFePO4还是LiCoO2正极组成的电池中都表现出良好的循环稳定性,同时也发现LIFSI基电解液在3.3 V即开始对Al发生腐蚀,甚至低于LITFSI对Al腐蚀3.7 V的电位。发生这种结果的原因是由于LIFSI残留痕量的Cl-氧化造成的。
Han等[2]同样对LIFSI用于锂离子电池的表现进行了研究对比,发现高纯LIFSI熔点为145 ℃,产品加热至200 ℃不发生分解,其热稳定性远超过LiPF6。各种不同锂盐配制的1 mol电解质EC/EMC(3∶7)电解液体系中,LIFSI表现出最好的离子电导率(LiFSI > LiPF6> Li[N(SO2CF3)2](LiTFSI) > LiClO4> LiBF4)。高纯LIFSI组成的液体电解液在高电压4.2 V条件下不会对Al产生腐蚀,但是如果在LIFSI含有少量LiCl(50×10-6),则明显发现电解液对Al产生腐蚀。同时发现LIFSI组成电解液低温-20 ℃下电导率要好于LiPF6基电解液。
Li等[3]对LIFSI溶于支链型碳酸酯溶剂中的电化学特性进行了研究,LIFSI因其具有高离域特性的阴离子,可以在低介电常数的溶剂如DMC中具有很高的溶解度(5 mol)。LIFSI基电解液在很宽的温度范围-50~50 ℃内表现出较LiPF6更高的离子传导性和高的Li离子转移数(0.5~0.6)。这是由于LIFSI低分子键合能以及FSI-中氧的未共用电子对的强相互作用造成的,在以LiFePO4为正极,石墨为负极组成的电池中,电池在0~4.3 V具有更高的容量保持率。
Eshetu等[4]对充分嵌锂后SFG6石墨/super-p炭黑混合物与含有LiPF6和LIFSI电解质锂盐组成的碳酸酯电解液接触后的热稳定性进行了研究。DSC分析发现LiPF6基电解液发生了电化学溶剂诱导产生的宽放热曲线(725 J/g),这种热效应起始于120 ℃,以沉积于SEI膜上盐与热解产生的PF5反应造成SEI膜坍塌开始的。嵌锂石墨与LIFSI基电解液接触则是在80 ℃产生一个小放热峰,随后在200 ℃产生剧烈放热(1 300 J/g)。LIFSI基电解液的剧烈放热是由于电解质中FSI-的还原。根据该现象,他们提出了使用VC/FEC/TDI/DIH作为电解液添加剂,在石墨表面层形成的聚合物基SEI膜具有高热稳定性和机械强度,从而降低了因LIFSI降解产生的热失控可能。
Yamada等[5]提出了一种应用于快速充电锂离子电池的乙腈基高浓度电解液。普通电解液的Li+浓度为1 mol/L左右,此时离子电导率最大,这种浓度需使用EC溶剂。如果使用EC以外的溶剂,电极会严重劣化。该小组使用4.2 mol/L的LIFSI和乙腈组成的电解液,即使以5 C以上的高速率进行充放电,容量衰减也非常小,而且还远远超过了商用EC系电解液。EC系电解液相对于锂金属和锂—石墨层间化合物(Li-GIC、锂共合后的石墨)能够稳定存在。这是因为EC溶剂主要用于还原分解,分解生成物作为具备Li+导电性和电子绝缘性的钝化膜(Solid Electrolyte Interphase,SEI)表现出良好的还原稳定性。低浓度AN电解液对于低电位负极极其不稳定,这主要是由于AN溶剂的还原稳定性非常低,而且无法形成良好的覆膜。而在高浓度电解液中,会优先进行锂盐的还原分解,而不是溶剂。还原分解物质的差异可通过高浓度溶液特有的Li+与阴离子间的相互作用所导致的最低空轨道(LUMO)变化来说明。通过提高浓度,锂盐的阴离子而非溶剂会作为覆膜形成剂工作,从而促进了电解液的还原稳定化。
由于具有高的可逆容量,硅成为下一代离子电池负极材料重要的研究方向。推动硅在电池中的重要问题就是控制电池循环过程中硅电极/电解液界面的化学反应。Philippe等[6]将LIFSI基电解液用于由纳米硅组成的锂离子电池体系中,他们通过使用LIFSI替代常规的LiPF6,通过对电池长程循环后硅表面结构进行分析发现,LIFSI的电解液既不与硅电极表面的SiO2发生氟化反应形成SiOxFy,也不会造成电极表面Li2O的溶解。相反,SiO2在长程循环过程中会与Li持续反应生成Li4SiO4沉积于电极表面。这种有益的反应使在黏接剂和活性材料表面形成良好的保护层。
这个保护层SEI膜由有机和无机物组成,因为电解液体系中含碳酸酯溶剂。LIFSI降解发生在第一次放电过程中(第一次还原),在第一次循环后LIFSI降解产生降解产物增长变得非常小,这些还原产物沉积在电极表面扮演了保护膜的作用,以阻止电解质盐LIFSI进一步降解,从而保证了电池电化学性能的发挥。
Kim等[7]将含LIFSI的有机电解液用于Li-S电池体系中,他们发现LIFSI基电解液在接近电池工作电压条件下发生电化学降解,从而在电池正负极上原位形成保护层。这种保护层能够有效地保护Li-S电池中多聚硫在高温60 ℃长循环过程中电解液中的溶解,量子化学研究表明保护膜的形成是由于电解液还原过程中FSI-阴离子自由基的降解造成的,降解过程还产生了LiF。LIFSI-DMC组成的电解液在电池中循环1 000周后,电池的容量衰减<0.013%,表明LIFSI原位降解形成的保护层阻止了电化学反应过程中副反应的产生。
2 双(氟磺酰)亚胺锂合成工艺
目前合成双氟磺酰亚胺锂一般都需要经过双(氯磺酰)亚胺合成、双(氯磺酰)亚胺氟化反应制备双(氟磺酰)亚胺、双(氟磺酰)亚胺碱金属盐制备三个主要阶段,研究机构对不同中间产物合成工艺优化进行了研究。
2.1双(氯磺酰)亚胺合成
1962年,Appel等[8]最早提出了几种合成双(氯磺酰)亚胺的合成方法。以尿素[(NH2)2CO]和氯磺酸(ClSO3H)为原料,反应具体方程式如下:
HN(SO2Cl)2+[NH4][HSO4]+HCl+CO2
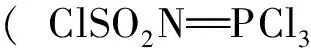
HN(SO2Cl)2+POCl3
Beran等[9]报道了一种以氨基磺酸(NH2SO3H)、二氯亚砜(SOCl2)和氯磺酸(ClSO3H)为原料,在120 ℃反应38 h后,在47~80 ℃、压力650 Pa条件下收集得到产物,反应方程式如下:
HN(SO2Cl)2+2SO2+3HCl
这种方法相较于前期方法操作简单,同时所得产品收率高,同时避免了高毒性PCl5的使用,反应条件相对温和可控,目前应用相对较多。
2.2双(氯磺酰)亚胺氟化反应制备双(氟磺酰)亚胺
双(氟磺酰)亚胺合成工艺优化改进主要集中在选用不同氟化试剂和氟化条件方面。
如Ruff[10]以双(氯磺酰)亚胺与三氟化砷AsF3回流反应,然后在温度78~80 ℃条件下减压蒸出产品,产品收率达到85%,Krumm等[11]使用SbF3在氮气保护条件下对HN(SO2Cl)2进行氟化,25 ℃条件下反应4 h,然后在温度25 ℃、压力1.333 Pa条件下减压蒸馏出HN(SO2F)2和SbCl3,后通过液氮对分离物进行冷却,低温下使液体的HN(SO2F)2和少量固体SbCl3分离,该工艺HN(SO2F)2的收率约70%。
使用AsF3氟化制备HFSI过程中,会有氟磺酸(沸点165 ℃)生成,其沸点与双(氟磺酰)亚胺沸点极为接近(170 ℃),造成分离提纯困难,此外AsF3毒性大,不利于大规模使用。而使用SbF3作为氟化剂,副产的SbCl3易升华,面临蒸馏难以分离的问题。
邹凯等[12]利用由氟化锑、氟化钾、氟化锌、氟化铝中的至少两种物质组成复配的氟化盐,使双氯磺酰亚胺盐在有机溶剂中进行有效氟化反应;反应结束后将上述反应液过滤,并浓缩;浓缩液结晶、过滤、干燥,即得到高纯度的双氟磺酰亚胺盐,进一步提升了氟化效率。
陈群等[13]采用氟化氢作为氟化试剂和反应溶剂与双氯磺酰亚胺、碱金属卤化物反应制得双氟磺酰亚胺碱金属盐,氟化氢相对易获得且原料成本较低,从而降低了生产成本;反应产物为双氟磺酰亚胺和氯化氢,不存在其他复杂的反应副产物,从而减少了物料消耗和废弃物生成,提高了原料的利用率、产品收率和纯度。同样以无水氟化氢作为氟化试剂,但是为了进一步提升氟化转化率,反应过程中使用催化剂SbCl5、TiCl4、SnCl4等,双氯与催化剂的物质的量比优选为1∶(0.05‰~ 1‰)。
2.3双(氟磺酰)亚胺碱金属盐制备
双(氟磺酰)亚胺的钾盐、铷盐、铯盐可以通过相似的方法制备得到,在温度-78 ℃的低温条件下,HN(SO2F)2与碱金属碳酸盐在水溶液反应体系下反应,反应后体系真空下除去水分后,乙醇重结晶得到产品[14]。
Beran等[9]在回流的条件下,HN(SO2C1)2与过量氟化钾在硝基甲烷或者二氯甲烷溶剂中反应,可以直接制备K[N(SO2F)2]。菊田学等[15]同样提出了以氟化钾、氟化锂、氟化钙等氟化物制备碱金属盐。如使用的水分含量200×10-6以下的KF,溶剂使用的水分含量300×10-6以下的乙腈和水分含量500×10-6以下的三乙胺原料,回流条件下体系在40 ℃条件下保持8 h,最终产品收率达到92%。
周志彬等[16]使用三氟化锑与双(氯磺酰)亚胺反应结束后,直接加入碳酸钾进行“原位一锅反应”得到高纯双(氟磺酰)亚胺钾,反应中生成的水与过量碳酸钾促进副产物SbCl3水解产生Sb2O3和KCl,避免了SbCl3易升华影响产品质量的问题。同时利用碱金属盐和高氯酸锂或者四氟硼酸锂在非质子溶剂中发生复分解反应,得到双(氟磺酰)亚胺锂。该方法缩短了工艺流程,提纯方法简单,产品杂质少,易于工业化生产。
张晓行等[17]以氯化亚砜、氨基磺酸、氯磺酸为原料制备双(氯磺酰)亚胺,然后以多余氯化亚砜为溶剂,加入高纯氯化锂反应得到双(氯磺酰)亚胺锂,移除氯化亚砜后,加入乙腈或乙酸丁酯作为溶剂,以及少量三乙胺,利用无水氟化锌进行氟化反应,过滤反应产物,对滤液进行结晶,得到双氟磺酰亚胺锂盐。沈鸣等[18]提出了以双(氯磺酰)亚胺锂为原料,在饱和碳酸烷基酯和或饱和氟代碳酸烷基酯溶剂中,在与碱金属氟化物相适应的冠醚类相转移催化剂的催化条件下,使双(氯磺酰)亚胺锂与碱金属氟化物反应,得到双(氟磺酰)亚胺锂。该工艺具有连续操作性强,产品易于分离,提纯、反应过程能耗低,无环境污染的优点。
3 结论
双(氟磺酰)亚胺锂因其良好的热稳定性、与电极良好的相容性、高电导率等优良特性,被认为是新型锂离子电池电解质而收到广泛研究与关注。但是目前双(氟磺酰)亚胺锂合成工艺仍存在流程较长、产品转化率低、副产物分离困难等缺点。如何进一步优化现有工艺,降低原料消耗,降低反应过程中产品与副产物分离难度,提升产品纯度,从而进一步降低生产成本,提升产品性能和成本竞争力,同时不断深入研究双(氟磺酰)亚胺锂在不同锂电池体系中的反应机理,从而推动产品在更广泛领域中的应用。
[1]Abouimrane A,Ding J,Davidson I J.Liquid electrolyte based on lithium bis-fluorosulfonyl imide salt:aluminum corrosion studies and lithium ion battery investigations[J].Journal of Power Sources,2009,189(1):693-696.
[2]Han H B,Zhou S S,Zhang D J,et al.Lithium bis(fluorosulfonyl)imide (LiFSI) as conducting salt for nonaqueous liquid electrolytes for lithium-ion batteries:physicochemical and electrochemical properties[J].Journal of Power Sources,2011,196(7):3623-3632.
[3]Li Lifei,Zhou Sisi,Han Hongbo,et al.Transport and electrochemical properties and spectral features of non-aqueous electrolytes containing LiFSI in linear carbonate solvents[J].Journal of The Electrochemical Society,2011,158(2):A74-A82.
[4]Eshetu G G,Grugeona S,Gachot G,et al.LiFSI vs LiPF6electrolytes in contact with lithiated graphite:comparing thermal stabilities and identification of specific SEI-reinforcing additives[J].Electrochimica Acta,2013,102(2):133-141.
[5]Yamada Y,Furukawa K,Sodeyama K,et al.Unusual stability of acetonitrile-based superconcentrated electrolytes for fast-charging lithium-ion batteries[J].J Am Chem Soc,2014,136(13):5039-5046.
[6]Philippe B,Dedryveère R,Gorgoi M,et al. Improved performances of nanosilicon electrodes using the salt LiFSI: a photoelectron spectroscopy study[J].J Am Chem Soc,2013,135(26):9829-9842.
[7]Kim Hyea,Wu Feixiang,Lee Jung Tae,et al.In situ formation of protective coatings on sulfur cathodes in lithium batteries with LiFSI-based organic electrolytes[J].Adv Energy Mater,2014(12):1-8.
[8]Appel R,Becke-Gonehring M,Eisenhauer G,et al.Imidobisschwefelsäurechlorid[J].Chem Ber,1962,95(3):625-626.
[9]Beran M,Prihoda J.A new method of the preparation of Imido-bis(sulfuric acid) dihalogenide,(F,Cl),and the potassium salt of imido-bis(sulfuric acid) difluoride[J].Z Anorg Allg Chem,2005,63(12):55-59.
[10]Ruff J K.Imidobis(sulfuryl fluoride),cesium Imidobis( sulfuryl fluoride), and fluoroimidobia(sulfuryl flzwride[J].Inorganic Syntheses,1968,11:138.
[11]Krumm B,Vij A,Kirchmeier R L,et al.Synthesis of poly- and the first perfluoroalkyl-N(SO2F)2derivatives:improved methods for the preparation of XN(SO2F)2(X)H,Cl) and single-crystal diffraction studies of HN(SO2Cl)2,HN(SO2F)2,and CF3CH2N(SO2F)2[J].Inorg Chem,1998,37(24):6295-6303.
[12]邹凯,赵世勇,闻立新,等.双氟磺酰亚胺盐的合成方法:中国,CN104671224[P].2015-06-03.
[13]陈群,石桥,郑仲天,等.双氟磺酰亚胺及其碱金属盐的制备方法:中国,CN103935970A[P].2014-07-23.
[14]Ruff J K.The imidodisulfuryl fluoride ion[J].Inorg Chem,1965,4(10):1446-1448.
[15]菊田学,北尾真大.双(氟磺酰基)亚胺阴离子化合物的制备方法和离子对化合物:中国,CN102046523[P].2011-05-04.
[16]周志彬,韩洪波,聂进,等.双(氟磺酰)亚胺和(全氟烷基磺酰基氟磺酰基)亚胺碱金属盐的制备方法:中国,CN101747242 A[P].2010-06-23.
[17]张晓行,刘红光,叶学海,等.一种双氟磺酰亚胺锂盐的制备方法:中国,CN103524387A[P]. 2014-01-22.
[18]沈鸣,沈锦良,张先林,等.双氟代磺酰亚胺锂的制备方法:中国,CN103663393A[P].2014-03-26.
Research Progress on Synthesis and Application of Lithium Bis(fluorosulfonyl)imide (LIFSI)
XUE Fengfeng , WANG Jianping , WANG Pengjie , MA Guanghui , GENG Mengtuan
(Do- Fluoride Chemicals Co. Ltd , Jiaozuo454191 , China)
Lithium bis(fluorosulfonyl)imide (LIFSI) is a new kind of electrolyte,which has been received widespread attention for its superior performance in lithium battery.Effect of LIFSI in different lithium battery systems and synthesis technology of LIFSI are summarized,and the future development direction and prospects are discussed.
lithium bis(fluorosulfonyl)imide (LIFSI); synthesis ; application
2016-06-18
薛峰峰(1984- ),男,工程师,从事氟化学工程技术研究工作,电话:15893078850。
TQ226.32
A
1003-3467(2016)09-0011-04
