大黄素对肺纤维化大鼠Th1/Th2型细胞因子平衡的影响
2016-11-03邓日强程江涛张宏华杨印楼
邓日强,程江涛,张宏华,杨印楼
(粤北人民医院呼吸内科,广东 韶关 512026)
大黄素对肺纤维化大鼠Th1/Th2型细胞因子平衡的影响
邓日强,程江涛,张宏华,杨印楼
(粤北人民医院呼吸内科,广东韶关512026)
目的:观察大黄素对博莱霉素所致大鼠肺纤维化的影响,并探讨其是否经调整Th1/Th2型细胞因子平衡起作用。方法:将50只雄性SD大鼠随机分为正常对照组、模型组、大黄素低剂量组、大黄素高剂量组和泼尼松组,每组10只,后4组经气管内注入博莱霉素A5建立大鼠肺纤维化模型,从第2 天开始,大黄素低、高剂量干预组大鼠分别予20、80 mg·kg-1大黄素灌胃,泼尼松组以5 mg·kg-1醋酸泼尼松灌胃,其余2组予生理盐水灌胃。建模后第28 天处死所有大鼠,取出肺组织行HE染色和Masson染色,用酶联免疫吸附法(ELISA)检测肺组织干扰素-γ(IFN-γ)、白介素-4(IL-4)含量,分离血清,ELISA测定血清IFN-γ、IL-4浓度。结果:大黄素低、高剂量组及泼尼松组肺泡炎症及肺纤维化程度明显轻于模型组(P<0.05 orP<0.01)。与正常对照组比较,模型组肺组织IFN-γ含量、血清IFN-γ浓度、IFN-γ/IL-4比值降低(P<0.01),肺组织IL-4含量、血清IL-4浓度升高(P<0.01);大黄素低、高剂量组及泼尼松组肺组织IFN-γ含量、血清IFN-γ浓度、IFN-γ/IL-4比值高于模型组(P<0.01),而肺组织IL-4含量、血清IL-4浓度低于模型组(P<0.01);大黄素高剂量组、泼尼松组上述指标改善程度优于大黄素低剂量组(P<0.01),但大黄素高剂量组与泼尼松组比较,差异无显著性(P>0.05)。结论:大黄素对博莱霉素所致的肺纤维化大鼠有保护作用,纠正Th1/Th2型细胞因子平衡失调可能是其抗肺纤维化的重要机制。
大黄素;肺纤维化;干扰素-γ;白介素-4
肺纤维化是由药物、化学制剂、有机或无机粉尘、放射线等因素引起的肺间质疾病的共同结局,以巨噬细胞、淋巴细胞等炎症细胞在肺间质浸润、纤维母细胞增生及纤维结缔组织沉积于肺间质为特征,对人类健康危害极大,近年发病率呈上升趋势,迄今尚无有效的治疗方法[1]。Th 细胞主要分为Th1、Th2细胞两大类型,其中Th1细胞产生干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-β、白介素(interleukin, IL)-2、IL-12、IL-18等细胞因子,Th2细胞产生IL-4、IL-5、IL-10、IL-13、单核细胞趋化蛋白-1等细胞因子。在生理状况下,Th1、Th2型细胞因子处于一种平衡状态,两者相互影响、相互作用,共同调控机体的免疫应答。近年来研究表明,当Th2型细胞因子占优势时,即发生Th1/Th2型细胞因子失衡,可促进肺纤维化的发生、发展[2-3]。大黄素是一种蒽醌类衍生物,主要来源于蓼科植物掌叶大黄根茎,化学名称为1,3,8-三羟基-6-甲基蒽醌,系中药大黄的主要有效单体,具有利尿、抗菌消炎、抗肿瘤、免疫抑制、保肝 、抗纤维化等多种药理活性[4]。已有研究证实,大黄素通过抗炎和抗氧化应激机制减轻博莱霉素所致的大鼠肺纤维化程度[5-6]。然而,大黄素的抗纤维化作用是否和调整Th1/Th2型细胞因子平衡有关仍不清楚。因此,本研究通过博莱霉素气管内注射建立SD大鼠肺纤维化模型,观察大黄素对肺组织病理改变、IFN-γ与IL-4含量及血清IFN-γ、IL-4浓度的影响,旨在进一步阐明大黄素抗肺纤维化的机制。
1 材料与方法
1.1动物、药品与试剂雄性SD大鼠50只,8~10周龄,体重为250~300 g,清洁级,由南华大学实验动物学部提供,实验动物使用许可证号:SYKK(湘)2010-0006,予常规颗粒饲料喂养,并自由饮水。博莱酶素A5(15 mg·支-1)购买于太和制药有限公司,产品批号:070501,经生理盐水稀释后配成浓度为7.5 g·L-1混悬液。大黄素由国家药物和生物制品检定研究所(NICPBP)提供,浓度>98%,溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)后制成3、12 g·L-1混悬液。醋酸泼尼松片购于天津太平洋制药有限公司,产品批号:080201,用生理盐水稀释成0.75 g·L-1混悬液。DMSO系美国 Sigma公司产品。酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒 (货号:BYE10184、BYE10293)购自上海邦奕生物科技有限公司。
1.2肺纤维化模型制备与处理50只SD大鼠随机分为正常对照组、模型组、大黄素低剂量组、大黄素高剂量组和泼尼松组,每组10只。按刘理静等[5]的方法建立肺纤维化模型,即后4组大鼠通过腹腔注射10%水合氯醛(3 mL·kg-1)麻醉后,沿颈正中位置切开,暴露气管,并向气管内一次性注入溶解了博莱霉素A5(5 mg·kg-1)的生理盐水0.2 mL,然后将大鼠直立并旋转,以使药液在肺内分布均匀。从次日开始,正常对照组、模型组予2 mL生理盐水灌胃,大黄素低、高剂量组分别予20、80 mg·kg-1大黄素灌胃,泼尼松组以5 mg·kg-1醋酸泼尼松灌胃,均为1次·d-1,共27 d。建模后第28 d,待大鼠麻醉后无菌开胸,以心脏采血法采集大鼠血液3 mL,血液标本静置2 h,3 000 r·min-1离心10 min(离心半径15 cm),提取上层血清,置入-20 ℃冰箱保存,用于IFN-γ、IL-4浓度检测,再颈动脉放血处死,截取右肺组织,迅速放入-70 ℃液氮中冻存,用于IFN-γ、IL-4含量检测,然后经主支气管向左肺内注入 0.1 mol·L-1中性缓和福尔马林,使胸膜展开后置于0.1 mol·L-1中性福尔马林中固定 24 h以上,石蜡包埋,切片,供 HE 染色及Masson 染色。
1.3肺组织病理学检查左肺石蜡切片进行常规HE染色和Masson染色,光镜下观察肺组织病理学改变。参照 Szapiel等[7]的方法用HE染色评定肺组织肺泡炎症程度:0分:无肺组织炎;1分:轻度肺组织炎,炎性细胞浸润仅限于局部或近胸膜部,面积小于全肺的 20%;2分:中度肺组织炎,受累面积占全肺的 20%~50%;3分:重度肺组织炎,受累面积大于 50%。Masson染色评定肺组织纤维化程度:0分:无肺纤维化;1分:轻度肺纤维化,受累面积少于全肺 20%;2分:中度肺纤维化,受累面积占 20%~50%;3分:重度肺纤维化,受累面积大于 50%,肺泡结构紊乱。
1.4ELISA检测肺组织IFN-γ、IL-4含量取部分右肺组织,用已经灭菌且已预冷的剪刀将肺组织块剪碎,以三去污裂解液将肺组织匀浆,4 ℃,10 000×g离心10 min,小心吸出上清液,用BCA法进行蛋白定量,然后通过双抗体夹心ELISA测定心肌组织匀浆液中IFN-γ、IL-4浓度含量,所有操作严格按照试剂盒说明书由专人进行统一检测。
1.5ELISA检测血清IFN-γ、IL-4浓度采用双抗体夹心ELISA检测各组大鼠血清IFN-γ和IL-4浓度,所有操作步骤严格按试剂盒说明书进行。
2 结 果
2.1大黄素对肺纤维化大鼠肺组织病理改变的影响实验中各组大鼠均无死亡。HE染色(图1)显示,正常对照组肺组织结构清晰,无炎性细胞浸润,模型组肺组织中可见较多的炎性细胞浸润,大黄素低、高剂量组及泼尼松组肺组织炎性细胞浸润明显减少;Masson染色发现(图2),正常对照组无纤维化发生,模型组肺泡间隔明显增厚,部分肺泡腔被纤维组织占据,肺泡壁被破坏,肺间质内有大量蓝色胶原沉积,出现明显的纤维化,大黄素低、高剂量组及泼尼松组肺间质内仅见少量的蓝色胶原沉积。表1显示,与模型组比较,大黄素低、高剂量组及泼尼松组肺泡炎与肺纤维化评分明显降低,差异均有显著性(P<0.05 orP<0.01),此外,大黄素高剂量组、泼尼松组上述指标低于大黄素低剂量组(P<0.05),然而,大黄素高剂量组与泼尼松组比较,差异无显著性(P>0.05)。
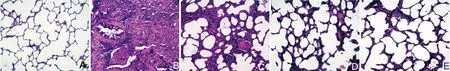
A:正常对照组;B:模型组;C:大黄素低剂量组;D:大黄素高剂量组;E泼尼松组。
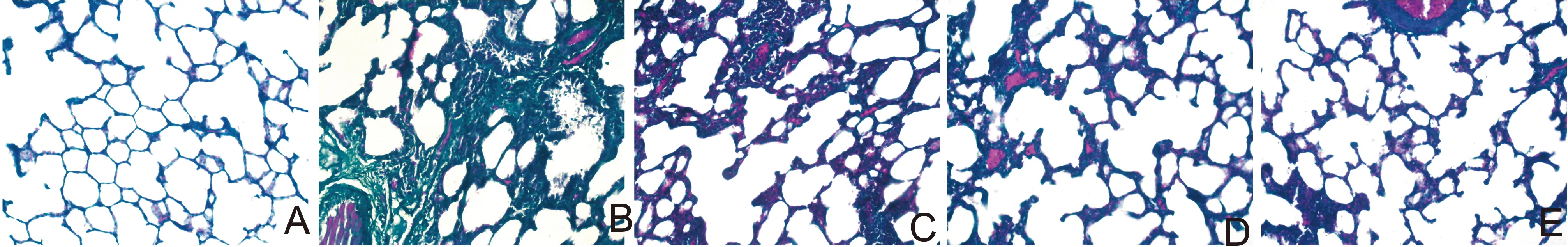
A:正常对照组;B:模型组;C:大黄素低剂量组;D:大黄素高剂量组;E泼尼松组
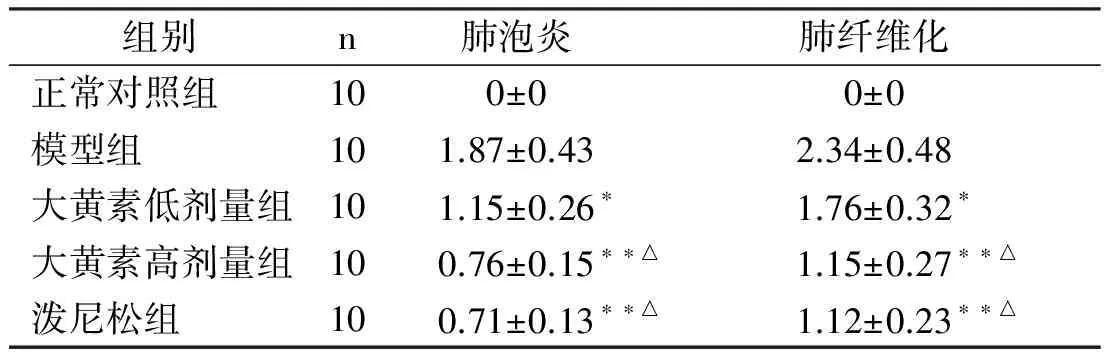
组别n肺泡炎肺纤维化正常对照组100±00±0模型组101.87±0.432.34±0.48大黄素低剂量组101.15±0.26∗1.76±0.32∗大黄素高剂量组100.76±0.15∗∗△1.15±0.27∗∗△泼尼松组100.71±0.13∗∗△1.12±0.23∗∗△
与模型组比较,*P<0.05,**P<0.01;
与大黄素低剂量干预组比较,△P<0.05。
2.2大黄素对肺纤维化大鼠肺组织IFN-γ、IL-4含量的影响IFN-γ、IL-4分别是Th1、Th2型细胞因子的代表,为了探讨大黄素对肺纤维化大鼠的保护作用是否和纠正Th1、Th2型细胞因子失衡有关,通过ELISA检测肺组织匀浆液中IFN-γ、IL-4含量,结果显示(表2),模型组较正常对照组IFN-γ含量降低(P<0.01),IL-4含量升高(P<0.01),IFN-γ/IL-4比值明显下降(P<0.01);经低、高剂量大黄素或泼尼松干预处理后,IFN-γ含量增加,IL-4含量减少(P<0.01),IFN-γ/IL-4比值升高,与模型组比较,差异均有显著性(P<0.01);大黄素高剂量组、泼尼松组IFN-γ含量、IFN-γ/IL-4比值高于大黄素低剂量组(P<0.01),IL-4含量则低于大黄素低剂量组(P<0.01);但大黄素高剂量组与泼尼松组上述指标无区别(P>0.05)。
2.3大黄素对肺纤维化大鼠血清IFN-γ、IL-4浓度的影响为了进一步证实大黄素是否能增加IFN-γ/IL-4比值,本研究运用ELISA检测各组大鼠血清IFN-γ、IL-4浓度。由表3可知,模型组血清IFN-γ浓度、IFN-γ/IL-4比值低于正常对照组(P<0.01),而血清IL-4浓度高于正常对照组(P<0.01);与模型组比较,大黄素低、高剂量组及泼尼松组血清IFN-γ浓度、IFN-γ/IL-4比值增加(P<0.01),血清IL-4浓度减少(P<0.01);大黄素高剂量组、泼尼松组血清IFN-γ浓度、IFN-γ/IL-4比值较大黄素低剂量组升高(P<0.01),血清IL-4浓度较大黄素低剂量组降低(P<0.01);然而,大黄素高剂量组与泼尼松组比较,差异无显著性(P>0.05)。

表2 各组大鼠肺组织IFN-γ、IL-4含量比较/pg·mg-1
*P<0.01 vs正常对照组;#P<0.01 vs模型组;△P<0.01 vs大黄素低剂量组。

表3 各组大鼠血清IFN-γ、IL-4浓度比较/pg·mL-1
*P<0.01 vs正常对照组;#P<0.01 vs模型组;△P<0.01 vs大黄素低剂量组。
3 讨 论
肺纤维化的治疗一直是临床难点,目前以糖皮质激素、免疫抑制剂(如环磷酰胺)、细胞毒类药物(如硫唑嘌呤)以及抗纤维化制剂(如N-乙酰半胱氨酸、秋水仙碱)等为主,但疗效都不佳,且长期使用激素和免疫抑制剂可出现感染、耐药等不良反应,因而限制了其临床应用。近年来,从中药及天然植物中提取的毒副作用低的有效单体成分已成为纤维化疾病治疗的新途径。大黄素作为从中药大黄的干燥根中提取的主要活性单体成分,已被证实有抗多种器官纤维化的作用[8]。本研究结果表明,正常对照组建模后第 28 天未发现肺泡炎症与纤维化,可以排除气管内灌注生理盐水的影响,此外,大黄素低、高剂量组肺泡炎与肺纤维化评分较模型组降低,并且剂量越大,效果越明显,但大黄素高剂量组肺泡炎与肺纤维化评分与泼尼松组无明显变化,与文献报道相符[5],进一步提示大黄素对博莱霉素所致的肺纤维化大鼠有良好的治疗效果,并且80 mg·kg-1大黄素与5 mg·kg-1醋酸泼尼松作用相当。
细胞因子的异常表达及其引起的细胞因子网络平衡失调与肺纤维化的进展密切相关。IFN-γ是最经典的Th1 型细胞因子, 它是一种强有力的抗肺纤维化因子,通过促进 Th1型细胞因子应答,抑制Th2型细胞因子反应,从而抑制肺成纤维细胞的增生和胶原的沉积[9]。ECM异常蓄积在肺纤维化进程中起关键作用。IL-4是标志性的Th 2型细胞因子,其高表达可以直接促进肺成纤维细胞增生及胶原分泌[10]。IFN-γ与IL-4之间存在相互拮抗作用,当IFN-γ/IL-4比值降低时,即可促进肺纤维化的发生、发展,而IFN-γ/IL-4比值升高则缓解肺纤维化[11-12]。本研究中,肺纤维化大鼠予低、高剂量大黄素灌胃治疗后,发现大黄素明显增加肺组织IFN-γ含量,降低肺组织IL-4含量,导致IFN-γ/IL-4比值升高,并且高剂量的效果优于低剂量,提示大黄素可能通过调整Th1/Th2型细胞因子平衡,重新恢复Th1型细胞因子的优势地位,从而产生抗肺纤维化作用。为了进一步证实大黄素的这种作用,本研究也检测了血清IFN-γ、IL-4浓度,发现各组大鼠血清IFN-γ、IL-4浓度的变化趋势与其肺组织匀浆液中的含量相似,进一步说明大黄素对肺纤维化大鼠的保护作用与其调整Th1/Th2型细胞因子平衡有关。
综上所述,本研究结果表明,大黄素对博莱霉素所致的肺纤维化大鼠有良好的保护作用,其机制可能与纠正Th1/Th2型细胞因子平衡失调(即恢复Th1型细胞因子的优势效应)有关,这些作用机制的揭示为指导临床用药提供了可靠的药理学依据,深入开展大黄素抗肺纤维化机制的研究将为这种难治性疾病的治疗带来新的思路和希望。
[1]Baddini-Martinez J, Baldi BG, Costa CH, et al. Update on diagnosis and treatment of idiopathic pulmonary fibrosis[J].J Bras Pneumol,2015,41(5):454-466.
[2]张晓猛, 刘超, 夏光云. Th1/Th2 型细胞因子在小鼠肺纤维化发病中的作用[J].蚌埠医学院学报, 2013,38(8):932-934.
[3]庄谊, 张德平. 肺纤维化与T h1/Th2失衡[J].国外医学呼吸系统分册, 2005,25(5):349-351.
[4]刘晗, 高云.大黄素药理作用的分子机制研究进展[J].中国药理学通报, 2015,31(2):1552-1555.
[5]刘理静, 钱红, 张平. 大黄素对肺纤维化大鼠的保护作用及部分机制研究[J].中国药理学通报, 2015,31(2):266-272.
[6]李玉花, 许先荣, 李国平, 等. 大黄素抗大鼠肺纤维化实验及对 IL-7的影响[J].浙江中医杂志, 2009,44(12):884-6.
[7]Szapiel S V, Elson N A, Fulmer J D, et al. Bleomycin-induce dinterstitial pulmonary disease in the nude, athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[8]高志强, 王彩花. 大黄素和器官纤维化[J].中国中西医结合杂志, 2005, 25(11):1030-1032.
[9]Fusiak T, Smaldone GC, Condos R. Pulmonary fibrosis treated with inhaled interferon-gamma (IFN-γ)[J].J Aerosol Med Pulm Drug Deliv, 2015, 28(5):406-410.
[10]Xiong S, Guo R, Yang Z, et al. Treg depletion attenuates irradiation-induced pulmonary fibrosis by reducing fibrocyte accumulation, inducing Th17 response, and shifting IFN-γ, IL-12/IL-4, IL-5 balance[J].Immunobiology, 2015, 220(11):1284-1291.
[11]张毅, 李金田, 刘永琦, 等. 黄芪多糖对肺纤维化大鼠血清中 Th1/Th2细胞因子平衡、NO水平的影响[J].中国老年学杂志,2009,29(10):1185-1187.
[12]宋康, 杨珺超, 陈君峰, 等. 补肺汤对肺纤维化大鼠血清IFN-γ、IL- 4表达水平影响的实验研究[J].中华中医药学刊,2010,28(3):456-458.
Effects of Emodin on the Balance of Th1/Th2 Cytokines in Pulmonary Fibrosis Rats
DENGRi-qiang,CHENGJiang-tao,ZHANGHong-hua,YANGYin-lou
(Dept.ofRespiratoryMedicine,YuebeiPeople'sHospital,ShaoguanGuangdong512026)
Objective: To observe the effects of emodin on bleomycin-induced pulmonary fibrosis in rats, and explore whether the effects are mediated by the balance of Th1/Th2 cytokines. Methods: Fifty male SD rats were randomly divided into normal control group, model group, emodin low-dose group, emodin high-dose group, and prednisone group. Each group included 10 animals. Rats in the latter 4 groups were intratracheally administered with bleomycin A5 to establish pulmonary fibrosis model. From the second day on, rats in emodin low- and high-dose groups were intragastrically treated with 20 and 80 mg·kg-1emodin, respectively. Rats in prednisone group were intragastrically administrated with 5 mg·kg-1prednisone acetate, while rats in normal control and model groups were treated with normal saline. All rats were sacrificed on day 28. The pulmonary tissues were removed and used for HE and Masson staining. The contents of interferon-γ (IFN-γ) and interleukin-4 (IL-4) in pulmonary tissues were detected by enzyme linked immunosorbent assay (ELISA). In addition, sera were collected to test IFN-γ and IL-4 concentrations using ELISA. Results: The pulmonary inflammation and fibrosis in emodin low- and high-dose as well as prednisone groups were significantly improved compared to model group (P<0.05 orP<0.01). In comparison with normal control group, pulmonary IFN-γ content, serum IFN-γ concentration and the ratio of IFN-γ to IL-4 were significantly decreased while pulmonary IL-4 content and serum IL-4 concentration were significantly increased in model group (P<0.01). Pulmonary IFN-γ content, serum IFN-γ concentration and the ratio of IFN-γ to IL-4 were higher in emodin low- and high-dose intervention as well as prednisone groups than model group (P<0.01),whereas pulmonary IL-4 content and serum IL-4 concentration were lower in emodin low- and high-dose as well as prednisone groups than model group(P<0.01). The above indicators were significantly improved in emodin high-dose and prednisone groups as compared to emodin low-dose group (P<0.01). However, there was no significant difference between emodin high-dose group and prednisone group (P>0.05). Conclusion: Emodin protects rats from pulmonary fibrosis induced by bleomycin. Rectification of Th1/Th2 cytokine balance may be a significant mechanism via which emodin is protective against pulmonary fibrosis.
Emodin; Pulmonary fibrosis; Interferon-γ;Interleukin-4
R285.5
A
1001-5779(2016)03-0350-05
10.3969/j.issn.1001-5779.2016.03.005
2016-01-11)(责任编辑:刘仰斌)
