经皮冠状动脉介入术后患者CYP2C19基因多态性与氯吡格雷抵抗的关系Δ
2016-11-02孙迪迪袁冬冬赵育洁牛思泉娄海奎王本军
孙迪迪,袁冬冬,赵育洁,王 军,牛思泉,娄海奎,王本军
(1.郑州市第七人民医院药学部,河南 郑州450016; 2.郑州市第七人民医院心内科,河南 郑州 450016)
经皮冠状动脉介入术后患者CYP2C19基因多态性与氯吡格雷抵抗的关系Δ
孙迪迪1*,袁冬冬1#,赵育洁2,王军1,牛思泉2,娄海奎1,王本军1
(1.郑州市第七人民医院药学部,河南 郑州450016; 2.郑州市第七人民医院心内科,河南 郑州450016)
目的:探讨经皮冠状动脉介入术(percutaneous coronary intervention,PCI)后患者CYP2C19基因多态性与氯吡格雷抵抗的关系。方法:选取2015年6月—2015年12月郑州市第七人民医院收治的拟行PCI术的冠心病患者73例作为研究对象。采用血栓弹力图仪测定二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板聚集抑制率,ADP诱导血小板聚集抑制率<30%定义为氯吡格雷抵抗。检测入选患者的CYP2C19基因型,根据检测结果分为快代谢型(*1/*1)、中间代谢型(*1/*2、*1/*3)和慢代谢型(*2/*3、*2/*2、*3/*3)。结果:所有患者中,CYP2C19基因快代谢型26例、中间代谢型35例、慢代谢型12例。3个代谢型组间ADP诱导血小板聚集抑制率比较的差异有统计学意义(P<0.05)。所有患者氯吡格雷抵抗发生率为31.51%(23/73),其中,快代谢型患者氯吡格雷抵抗的发生率明显低于中间代谢型和慢代谢型,差异有统计学意义(P<0.05)。结论:CYP2C19基因多态性与氯吡格雷抵抗相关,携带有中间代谢和慢代谢功能缺失等位基因的患者更容易发生氯吡格雷抵抗。
CYP2C19; 经皮冠状动脉介入术; 氯吡格雷抵抗; 基因多态性
随着人们生活节奏的加快和生活水平的提高,冠心病的发病率也逐年增高,严重威胁着人类的生命健康。经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是目前治疗冠心病的重要手段之一,冠心病患者PCI术后联合使用阿司匹林和氯吡格雷可抑制血小板聚集功能,有效降低支架内血栓及心血管事件的发生率[1]。但近年来的研究发现,部分患者口服常规剂量的氯吡格雷却依然无法避免急性血栓事件的发生,临床上将此现象称为氯吡格雷抵抗。氯吡格雷需在体内经过肝药酶CYP代谢转化成活性产物发挥抗血小板聚集的疗效,其中CYP2C19酶是肝药酶CYP中重要的一员,国内外众多研究结果表明,CYP2C19基因多态性与氯吡格雷的体内代谢息息相关[2-3]。本研究通过检测分析PCI术后患者血小板聚集抑制率和CYP2C19酶的基因型分布,探讨CYP2C19基因多态性与氯吡格雷抵抗的关系,为临床制订个体化的抗血小板治疗方案提供一定的理论依据,现报告如下。
1 资料与方法
1.1资料来源
选取2015年6月—2015年12月郑州市第七人民医院收治的择期行PCI术的冠心病患者73例作为研究对象。排除标准:(1)存在阿司匹林或氯吡格雷使用禁忌证的患者;(2)凝血功能异常者;(3)存在严重肝、肾功能损害者;(4)合并严重感染、肿瘤、血液疾病以及免疫疾病者;(5)血流动力学不稳定的严重心功能不全者;(6)术前2周服用华法林或其他抗凝药物者。男女患者的比例为1.5∶1,平均年龄(66.2±11.1)岁,平均体质量(67.2±5.4) kg。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2方法
所有入选患者均接受双联抗血小板治疗,在PCI术前6 h口服负荷剂量的阿司匹林(拜耳公司,批准文号:国药准字J20080078)300 mg和氯吡格雷(Sanofi Winthrop Industrie,批准文号:国药准字J20130083)300 mg。术后口服阿司匹林(拜耳公司,批准文号:国药准字J20080078)100 mg、氯吡格雷75 mg,1日1次,规律口服7 d后晨起空腹采静脉血检测血小板聚集抑制率和CYP2C19基因型。所有入选患者均未服用奥美拉唑等质子泵抑制剂。
1.3血小板聚集抑制率检测
本研究采用TEG 5000血栓弹力图仪(美国Haemonetics公司)测定血小板聚集功能,主要试剂包含高岭土试剂、冻干二磷酸腺苷(adenosine diphosphate,ADP)、冻干激活剂。所有患者于规律口服氯吡格雷第8日的清晨,空腹抽取静脉血5 ml置于含肝素的采血管中,2 h内使用TEG凝血分析仪进行检测,利用TEG软件测算出ADP诱导下血小板聚集抑制率。根据临床相关研究以及本实验采用的检测方法,我们将ADP诱导血小板聚集抑制率<30%定义为氯吡格雷抵抗[4]。
1.4CYP2C19基因检测方法
抽取患者2 ml静脉血液置于EDTA抗凝采血管中,充分混匀保存于-4 ℃,按DNA提取试剂盒(宁波海尔施基因科技有限公司)提取待检样本DNA,将抽提到的样本DNA通过Mx3000P型实时荧光定量PCR仪(美国Stratagene公司)进行扩增和杂交,得到待测样本的基因分型。本研究主要检测CYP2C19基因*2(G681A)和*3(G636A)两个位点,根据基因型检测结果,将CYP2C19基因*2、*3位点均无变异的野生型纯合子(*1/*1)归为快代谢型;CYP2C19基因*2、*3位点单突变杂合子(*1/*2、*1/*3)归为中间代谢型;CYP2C19基因*2、*3位点双突变杂合子和单突变纯合子(*2/*3、*2/*2、*3/*3)归为慢代谢型。
1.5统计学方法
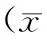
2 结果
2.1CYP2C19基因型分布
对入选的73例患者进行了CYP2C19基因型检测,其中快代谢型26例,占总例数的35.62%;中间代谢型35例,占总例数的47.95%;慢代谢型12例,占总例数的16.44%,见表1。

表1 CYP2C19基因型分布Tab 1 Distribution of types of CYP2C19 gene
2.2不同基因型之间血小板聚集抑制率比较
快代谢型、中间代谢型和慢代谢型患者的ADP诱导血小板聚集抑制率分别为(46.40±9.28)%、(36.91±11.21)%、(29.50±10.66)%,组间比较,差异有统计学意义(P<0.05)。中间代谢型患者的ADP诱导血小板聚集抑制率低于快代谢型,差异无统计学意义(P>0.05);慢代谢型患者的ADP诱导血小板聚集抑制率低于快代谢型,差异有统计学意义(P<0.05)。
2.3CYP2C19基因分型与氯吡格雷抵抗的关系
所有患者中,23例患者发生氯吡格雷抵抗,占总例数的31.51%。快代谢型、中间代谢型、慢代谢型患者的氯吡格雷抵抗发生率分别为11.54%、37.14%、58.33%,组间比较,差异有统计学意义(P<0.05),见表2。

表2 不同CYP2C19基因型的患者发生氯吡格雷抵抗的比较Tab 2 Comparison of clopidogrel resistance in different CYP2C19 gene patients
3 讨论
目前,氯吡格雷与阿司匹林双联抗血小板已成为冠心病患者PCI术后抑制血小板聚集的常规治疗方案,但仍有一部分患者会再次出现心血管不良事件,一系列的研究结果表明这与氯吡格雷抵抗密切相关。患者的遗传因素、用药依从性、饮食生活习惯、疾病以及药物的相互作用等多种因素均会影响氯吡格雷的临床疗效,其中遗传因素的差异性是导致氯吡格雷抵抗的一个重要因素。氯吡格雷为前体药物,本身并无生物活性,需在体内经过肝药酶CYP氧化生成具有抗血小板聚集活性的代谢产物,其中CYP2C19酶是肝脏中介导氯吡格雷生物转化的关键酶,而CYP2C19基因多态性决定着CYP2C19的酶活性,所以CYP2C19基因多态性显著影响着氯吡格雷的疗效。
目前研究初步识别的CYP2C19等位基因有36个,不同等位基因出现的频率与种族、人种等相关。其中CYP2C19*1/*1是野生型基因,其编码的酶具有正常的生物活性,而CYP2C19*2和CYP2C19*3是最常见的突变基因位点,其编码的酶生活活性明显降低。本研究检测分析了76例患者的CYP2C19基因型,结果显示,野生型CYP2C19*1/*1占35.62%,CYP2C19*1/*2和CYP2C19*1/*3分别占41.10%和6.85%,而CYP2C19慢代谢型基因(*2/*2、*2/*3、*3/*3)占16.44%,表明CYP2C19基因型突变发生率高,其中又以CYP2C19*1/*2为主,这与文献报道的我国CYP2C19基因型分布频率基本一致[5]。
随着血小板聚集率的增加,诱发心血管血栓事件的风险也逐渐上升。研究结果表明,至少携带1个CYP2C19*2或者CYP2C19*3等位基因的患者,血浆中的活性氯吡格雷代谢产物水平明显下降,不良心血管事件发生率明显上升[6]。本研究通过TEG血栓弹力图仪测定入选患者的ADP诱导血小板聚集抑制率,血栓弹力图仪可以综合全血中血浆成分(凝血因子、纤维蛋白)和细胞组分(血小板、红细胞、白细胞)及其浓度对凝血的贡献,对凝血的动态过程提供真实、准确的监测。检测结果显示,CYP2C19中间代谢型(*1/*2、*1/*3)与慢代谢型(*2/*3、*2/*2、*3/*3)患者的ADP诱导血小板聚集抑制率低于快代谢型(*1/*1)患者。根据ADP诱导血小板聚集抑制率的检测结果,本研究入选患者氯吡格雷抵抗的发生率为31.51%,与文献报道(4%~30%)基本一致[7],其中CYP2C19快代谢型患者氯吡格雷抵抗的发生率明显低于CYP2C19中间代谢型和慢代谢型患者,差异有统计学意义(P<0.05),表明携带有中间代谢和慢代谢功能缺失等位基因(*1/*2、*1/*3、*2/*3、*2/*2、*3/*3)的患者更容易发生氯吡格雷抵抗。
CYP2C19*2、*3突变基因与氯吡格雷抵抗密切相关,因此对PCI术后口服氯吡格雷的冠心病患者应进行CYP2C19基因型检测,针对不同基因型的患者采取个体化治疗方案[8-11]。对于检测出CYP2C19中间代谢或慢代谢的患者,可以增加氯吡格雷的给药剂量或者更换为不受CYP2C19基因多态性影响的抗血小板药物替格瑞洛,从而减少或避免临床不良终点事件的发生,改善患者的预后和生活质量[12-14]。值得注意的是,CYP2C19的基因多态性只能解释30%左右的氯吡咯雷抵抗,可能还存在未知的基因位点造成氯吡格雷抵抗[15]。本研究仅就CYP2C19基因突变与PCI术后口服氯吡格雷的患者ADP诱导血小板聚集抑制率的变化进行研究,未考虑其他影响因素,且纳入的样本量较小,因此,得出的结论仍需进一步全面深入的研究。
综上所述,CYP2C19基因多态性与氯吡格雷抵抗相关,携带有中间代谢和慢代谢功能缺失等位基因的患者更容易发生氯吡格雷抵抗。
[1]万海伟,杨士伟.双联抗血小板治疗的有效性与安全性评价研究进展[J].慢性病学杂志,2015,16(2):195-197.
[2]Hulot JS,Bura A,Villard E,et al.Cytochrome P450 2C19 loss-of-function polymorphism is a major determinant of clopidogrel respon-siveness in healthy subjects[J].Blood,2006,108(7):2244-2247.
[3]苟文,常静.氯吡格雷抵抗与CYP2C19基因多态性的相关性研究进展[J].心血管病学进展,2013,34(3):443-446.
[4]Sambu N,Radhakrishnan A,Dent H,et al.Personalised antiplatelet therapy in stent thrombosis:observations from the Clopidogrel Resistance in Stent Thrombosis(CREST)registry[J].Heart,2012,98(9):706-711.
[5]周健,吕虹,康熙雄.中国汉族人群不同性别、年龄、体重指数之间细胞色素氧化酶CYP2C19基因多态性的检测[J].中国临床药理学与治疗学,2007,12(2):208-213.
[6]唐晓芳,何晨,袁晋青,等.细胞色素P4502C19基因多态性对介入术后服用氯吡格雷冠心病患者临床预后的影响[J].中华心血管病杂志,2011,39(7):617-620.
[7]贺春晖,胡琴,邹建军,等.氯吡格雷抵抗的基因多态性探讨[J].中国临床药理学与治疗学,2010,15(11):1288-1293.
[8]杨莉萍,谢婧,刘瑶,等.CYP2C19*2、*3基因多态性与氯吡格雷临床疗效相关性的系统评价[J].中国循证医学杂志,2012,12(9):1063-1070.
[9]Zhang L,Chen Y,Jin Y,et al.Genetic determinants of high on-treatment platelet reactivity in clopidogrel treated Chinese patients[J].Thromb Res,2013,132(1):81-87.
[10]Xie X,Ma YT,Yang YN,et al.CYP2C19 phenotype,stent thrombosis,myocardial infarction,and mortality in patients with coronary stent placement in a Chinese population[J].PLoS One,2013,8(3):e59344.
[11]李韶南,刘震,罗义,等.细胞色素P450 2C19基因多态性与急性冠状动脉综合征患者氯吡格雷抵抗及预后关系[J].中华内科杂志,2013,52(11):961-965.
[12]郭健雄,石磊,袁进.利用CYP2C19基因分型指导氯吡格雷个体化用药[J].中国药学杂志,2015,50(12):1062-1065.
[13]Ari H,Ozkan H,Karacinar A,et al.The effect of high-dose clopidogrel treatment in patients with clopidogrel resistance (the EFFICIENT trial)[J].Int J Cardiol,2012,157(3):374-380.
[14]李婧.CYP2C19基因多态性指导下氯吡格雷个体化治疗的研究进展[J].心血管病学进展,2015,36(4):515-518.
[15]Yamamoto K,Hokimoto S,Chitose T,et al.Impact of CYP2C19 polymorphism on residual platelet reactivity in patients with coronary heart disease during antiplatelet therapy[J].J Cardiol,2011,57(2):194-201.
Relationship Between CYP2C19 Gene Polymorphisms and Clopidogrel Resistance in Patients After PCIΔ
SUN Didi1, YUAN Dongdong1, ZHAO Yujie2, WANG Jun1, NIU Siquan2, LOU Haikui1, WANG Benjun1
(1.Dept.of Pharmacy,the Seventh People’s Hospital of Zhengzhou,Henan Zhengzhou 450016,China; 2.Dept.of Cardiology,the Seventh People’s Hospital of Zhengzhou,Henan Zhengzhou 450016,China)
OBJECTIVE:To probe into the relationship between CYP2C19 gene polymorphisms and clopidogrel resistance in patients after PCI. METHODS: 73 patients undergoing PCI admitted into the Seventh People’s Hospital of Zhengzhou from Jun. 2015 to Dec. 2015 were enrolled. Thromboelastography was used to detect all the patients’ platelet aggregation inhibition rates induced by adenosine diphosphate(ADP). Clopidogrel resistance was defined as platelet aggregation inhibition rates<30%. CYP2C19 gene polymorphisms were analyzed and classified as fast metabolic genotypes (*1/*1), intermediate metabolic genotypes (*1/*2, *1/*2) and slow metabolic genotypes (*2*3, *2/*2,*3/*3). RESULTS: Of the 73 enrolled cases, 26 cases were fast metabolic genotype, 35 cases were intermediate metabolism genotype and 12 cases were slow metabolic genotype, with statistically significant difference(P<0.05). Clopidogrel resistance was present in 31.51%(23/73)patients. Fast metabolism genotype came up with a lower incidence of clopidogrel resistance than the other two genotypes,with statistically significant difference (P<0.05). CONCLUSIONS: CYP2C19 gene polymorphisms is associated with clopidogrel resistance, and patients with intermediate metabolism genotype and slow metabolic genotype are more likely to have clopidogrel resistance.
CYP2C19; Percutaneous coronary interention; Clopidogrel resistance; Gene polymorphism
常州四药临床药学科研基金(No.CZSYJJ13005)
主管药师。研究方向:临床药学。E-mail:44676878@qq.com
R972
A
1672-2124(2016)09-1175-03
10.14009/j.issn.1672-2124.2016.09.009
2016-05-19)
*副主任药师。研究方向:药事管理、临床药学。E-mail: 13592660518@139.com
