荧光原位杂交技术在尿路上皮癌辅助诊断中的应用价值
2016-11-01赵言廷郭晓慧朱德淳王金国
赵言廷,郭晓慧,白 晶,朱德淳,王金国
(吉林大学第一医院,吉林 长春130021)
荧光原位杂交技术在尿路上皮癌辅助诊断中的应用价值
赵言廷,郭晓慧,白晶,朱德淳*,王金国*
(吉林大学第一医院,吉林 长春130021)
尿路上皮癌是起源于尿路上皮的一种恶性肿瘤,包括肾盂尿路上皮癌、输尿管尿路上皮癌及膀胱尿路上皮癌,其中以膀胱尿路上皮癌的发病率最高,输尿管镜下或膀胱镜下取病理活检是目前确诊尿路上皮癌的金标准。然而,输尿管镜或膀胱镜为有创性检查,患者耐受性差,且易出现血尿、排尿疼痛等并发症。因此,寻找一种无创、有效的检查方法,对于可疑尿路上皮癌患者无论是早期筛查、辅助诊断、复发监测,还是减少有创性检查的次数,都具有重要意义。目前尿脱落细胞学为尿路上皮癌的常规无创检查方法,其特异度较高,但敏感度不尽如人意。随着人们对尿路上皮癌遗传学的不断深入研究,目前已经证实尿液中的脱落细胞3号、7号、17号及9号染色体p21位点异常与尿路上皮癌的发生密切相关[1]。现已有较多的文献报道,应用FISH技术检测尿路上皮癌的特异性与尿脱落细胞学相当,而敏感性明显高于尿脱落细胞学[2-5]。本项研究拟用FISH技术检测可疑尿路上皮癌患者尿液中脱落细胞3号、7号、17号及9号染色体p21位点的畸变情况,并与尿脱落细胞学进行比较,探讨FISH技术检测尿路上皮癌的临床应用价值。
1 资料和方法
1.1标本采集
收集自2014年10月到2016年1月就诊于吉林大学第一医院疑似尿路上皮癌患者的尿液,共111例,其中有6例无病理证据(拒绝镜检及手术),故未纳入本项研究,其余105例患者中,男78例,女27例,中位年龄65岁(30-85岁),均行FISH及尿脱落细胞学检查。留取患者的尿液标本取得了患者或其家属的知情同意,并签署了知情同意书,同时经过了本医院伦理委员会的批准。
1.2主要试剂与仪器
探针及前处理试剂均购置于美国Abbott公司生产的UroVysion膀胱癌检测试剂盒(内含膀胱癌检测探针、DAPI、PBS、NP-40、20×SSC、胃蛋白酶干粉及其缓冲液等)、 封片胶、微型离心机、涡旋混匀器、水浴锅(温度准确)、离心机(可容纳50 ml离心管,15 ml离心管)、 ThermoBrite杂交仪、 OLYMPUS-BX51荧光显微镜(100瓦水银灯,200小时以内)及相应的滤光片(DAPI Single Filter,Green/Red Dual Filter,Aqua Single Filter,Yellow Single Filter)等。
1.3FISH检测
将收集的尿液进行多次离心、加固定液、滴片、烤片、胃蛋白酶消化、加探针、变性、杂交等处理后,在荧光显微镜下分析结果。
1.4FISH结果判定
整个玻片中至少应有25个形态异常的细胞,否则需重新制片或重新留取尿液标本,具有单一染色体多体(3,7,17中的一种)的异常细胞核不被评估为阳性。在形态异常的细胞中≥4个细胞可观察到两种以上的染色体多体信号(3,7 或 17)或≥12个细胞中都无法观察到9p21位点信号(纯合缺失)则视为FISH阳性,否则评估结果为阴性。
1.5尿脱落细胞学检查
同时留取患者的尿液送我院检验科行细胞学检查,每个患者连查3天晨尿,至少有1次结果回报为找到癌细胞视为尿脱落细胞学阳性,找到可疑癌细胞及未找到癌细胞视为尿脱落细胞学阴性。
1.6统计学分析
FISH的敏感性和特异性与尿脱落细胞学的比较采用SPSS21.0软件进行分析,计数资料用χ2检验,P<0.05认为差异有统计学意义。
2 结果
实际研究的105例中经病理证实为尿路上皮癌者80例,包括肾盂尿路上皮癌9例,输尿管尿路上皮癌3例,膀胱尿路上皮癌68例,其中FISH检测
阳性者62例,阴性者18例,尿脱落细胞阳性者19例,阴性者61例。其余25例为非尿路上皮癌,包括前列腺增生7例,泌尿系结石8例,泌尿系感染5例,内翻性乳头状瘤2例,鳞癌1例,腺癌1例,移行上皮不典型增生1例,其中FISH检测阳性者3例,阴性者22例,尿脱落细胞阳性者0例,阴性者25例。FISH检测技术的敏感性为77.5%,特异性为88.0%。尿脱落细胞学检查的敏感性为23.8%,特异性为100.0%。FISH与尿脱落细胞学相比,两者的特异性相当,差异无统计学意义(P>0.05),但敏感性明显高于尿脱落细胞学,差异有统计学意义(P<0.05)。
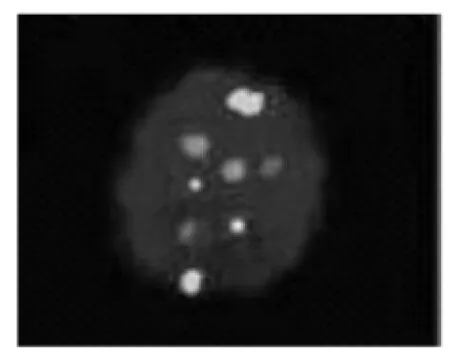
图1正常细胞
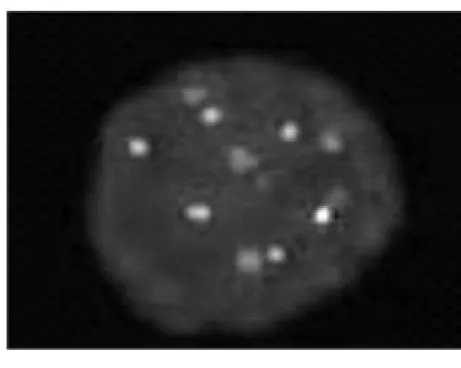
图2异常细胞
在80例尿路上皮癌患者中,病理分期为肌层浸润性尿路上皮癌48例,FISH阳性者42例,阳性率为87.5%,阴性者6例,尿脱落细胞学阳性者18例,阳性率为37.5%,阴性者30例;非肌层浸润性尿路上皮癌32例,FISH阳性者20例,阳性率为62.5%,阴性者12例,尿脱落细胞学阳性者1例,阳性率为3.1%,阴性者31例。病理分级为高级别尿路上皮癌42例,FISH阳性者37例,阳性率为88.1%,阴性者5例,尿脱落细胞学阳性者16例,阳性率为38.1%,阴性者26例;低级别尿路上皮癌38例,FISH阳性者25例,阳性率为65.8%,阴性者13例,尿脱落细胞学阳性者3例,阳性率为7.9%,阴性者35例。具体见表1。

表1 FISH和尿脱落细胞学在病理不同分期、分级中的检查结果及敏感性与特异性分析
3 讨论
泌尿系统从肾盏、肾盂、输尿管、膀胱及后尿道均被覆尿路上皮(又称移行上皮),起源于此部位的恶性肿瘤称尿路上皮癌,是泌尿外科常见的恶性肿瘤,其特点是发病率高且术后极易复发,其中起源于肾盂和输尿管的尿路上皮癌多属于高分期、低分化[6],恶性程度高,容易发生远处转移,失去手术指征。因此如何能对尿路上皮癌做出早期诊断及术后及时地监测复发显得尤为重要。FISH技术是一项分子细胞遗传学技术,它是在放射性原位杂交的基础上发展起来的一种非放射性原位杂交技术。其基本原理是用已知标记的单链核酸为探针,按照碱基互补配对的原则,与待检材料中未知的单链核酸进行特异性结合,形成可被荧光显微镜检测到的杂交双链核酸[7]。近年来,FISH技术已广泛用于血液肿瘤、宫颈癌、乳腺癌、膀胱癌和前列腺癌等疾病的诊断。2001年7月FISH检测技术被美国FDA批准可以用于尿路上皮癌的诊断。Fadl-Elmula等人研究发现,起源于上尿路与膀胱的尿路上皮癌在遗传学上基本是一致的[8],换言之,FISH适用于膀胱和上尿路尿路上皮癌的诊断。
恶性肿瘤组织常发生染色体或基因等遗传学的改变,其中尿路上皮癌易发生3号、7号和17号染色体数目的异常及9号染色体p21位点的缺失,其他如1、4、8、10、11、13、14、20及X、Y等染色体亦可能发生遗传学改变,但概率相对较小。众多研究资料证明CSP3、CSP7、CSP17及GLPp21探针组合诊断尿路上皮癌具有较高的敏感性和特异性[9-11]。本实验就用此方法进行尿路上皮癌诊断。
由本实验结果可知,FISH检测和尿脱落细胞学检查敏感性分别为77.5%、23.8%,差异有统计学意义(P<0.05),特异性分别为88.0%、100.0%,差异无统计学意义(P>0.05),且FISH检测技术在肌层浸润性、非肌层浸润性、低级别和高级别的尿路上皮癌的诊断中均明显高于尿脱落细胞学检查。FISH技术在诊断尿路上皮癌中与尿脱落细胞学相比,具有较高的敏感性和相似的特异性。
临床中常遇到肾癌侵犯肾盂或肾盂尿路上皮癌侵犯肾实质的患者,这两种肿瘤在影像学上难以区分,但两者的手术方式完全不同,故术前对这种患者做出正确诊断至关重要。从遗传学的角度来讲,FISH检测技术可以用于两者的区分,因为肾癌和肾盂尿路上皮癌的组织来源不同,发生的遗传学改变也不相同。本实验中未对肾癌患者行FISH检测,这一结论尚需大量的实验来验证。
综上所述,作为一种无创、快捷简便、敏感度和特异度均较高、受其他因素影响小、标本易获取等优点,且可以从基因水平并早于细胞形态学诊断尿路上皮癌,FISH检测技术在临床上的使用越来越广泛。但是由于检测费用昂贵及实验室技术人员要求较高,且只是定性诊断,不能对病变组织进行定位,只能起协助诊断作用。目前,该项检查不能大范围的推广。尽管如此,鉴于FISH检测技术的众多优点,相信将来会有比较好的应用前景。
[1] Sokolova IA,Halling KC,Jenkins RB,et al.The development of a multitarget,multicolor fluorescence in situ hybridization assay for the detection of urothelial carcinoma in urine[J].Mol Diagn,2000,2:116.
[2]Halling KC,Kipp BR.Bladder cancer detection using FISH(UroVysion assay)[J].Adv Anat Pathol,2008,15(5):279.
[3]LaudadioJ,Keane TE,Reeves HM,et al.Fluorescence in situ hybridization for detecting transitional cell carcinoma:implications for clinical practice[J].BUJ Int,2005,96(9):1280.
[4]Varella-Garcia M,Akduman B,Sunpaweravong P,et al.The UroVysion fluorescence in situ hybridization assay is an effective tool for monitoring recurrence of bladder cancer[J].Urol Oncol,2004,22(1):16.
[5]王鹏,靳风,叶锦,等.荧光原位杂交检测尿脱落细胞染色体异常诊断膀胱肿瘤的研究[J].第三军医大学学报,2009,31(10):948.
[6]Stewart GD,Bariol SV,Grigor KM,et al.A comparison of the pathology of transitional cell carcinoma of the bladder and upper urinary tract[J].BJU Int,2005,95:791.
[7]Pinkel D,Straume T,Gray JW.Cytogenetic analysis using quantitative,high-sensitivity,fluorescence hybridization [J].Proc Natl Acad Sci USA,1986,83(9):2934.
[8]Fadl-Elmula I,Gorunova L,Mandahl N,et al.Cytogenetic analysis of upper urinary tract transitional cell carcinomas[J].Cancer Genet Cytogenet,1999,115(2):123.
[9]Song MJ,Lee HM,Kim SH,et al.Clinical usefulness of fluorescence in situ hybridization for diagnosis and surveillance of bladder cancer [J].Cancer Genet Cytogenet,2010,198(2):144.
[10]Hailing KC,King W,Sokolova IA,et al.A comparison of BTA stat,hcmoglobin dipstick,telomerase and Vysis UroVysion assays for the detection of urothelial carcinoma in urine[J].Urol,2002,167(5):2001.
[11]Bergman J,Reznichek RC,Rajfer J,et al.Surveillance of patients with bladder carcinoma using fluorescent in-sim hybridization on bladderwashings[J].BJU Int,2008,101(1):26.
吴阶平医学基金会临床科研专项资助基金(3R215P203428)
1007-4287(2016)09-1522-03
2016-03-26)
