雌激素对人子宫内膜样癌JEC细胞中ERα、ERβ及p57kip2表达的影响*
2016-11-01刘蒙蒙孙小杰周正平
刘蒙蒙,孙小杰,周正平,肖 欣,袁 丹
(1.遵义医学院 病理学教研室,贵州 遵义 563099;2.遵义医学院 医学与生物学研究中心电镜室,贵州 遵义 563099)
临床医学研究
雌激素对人子宫内膜样癌JEC细胞中ERα、ERβ及p57kip2表达的影响*
刘蒙蒙1,孙小杰1,周正平2,肖欣2,袁丹1
(1.遵义医学院病理学教研室,贵州 遵义563099;2.遵义医学院 医学与生物学研究中心电镜室,贵州 遵义563099)
目的 研究雌激素干扰人子宫内膜样癌(endometrioid carcinoma ,EC)JEC细胞后雌激素受体(estrogen receptor,ER)亚型ERα、ERβ及p57kip2在细胞中的表达变化。方法 分别用含有3种不同浓度的雌二醇(β-Estradiol, E2)(10-6mol/L,10-8mol/L,10-10mol/L)的培养基进行JEC细胞的体外培养,用不含药物的培养基进行培养,作为对照,于培养24、48、72h后,用光镜及电镜观察E2干扰后JEC细胞的形态改变,用MTT法检测JEC细胞的增殖情况,用Western Blot (WB)法检测JEC细胞中ERα、ERβ、p57kip2蛋白的表达情况。结果 形态改变及增殖情况:E2浓度较低时可促进JEC细胞的生长(P<0.05),高浓度的E2则抑制JEC细胞的生长,但差异无统计学意义(P﹥0.05);与对照组比较,E2低浓度组JEC细胞微绒毛及胞质中分泌泡均有所减少,E2高浓度组JEC细胞微绒毛及胞质中分泌泡均有所增多。WB结果显示,实验各组及对照组ERα均不表达,ERβ则弱表达;随着E2作用浓度的增加、作用时间的延长,ERβ与p57kip2蛋白的表达均呈递增趋势(P<0.05)。结论 JEC细胞中ERα表达缺失。雌激素可上调ERβ、p57kip2在EC中的表达,具有时间依赖性和浓度依赖性;雌激素浓度较低时可以促进JEC细胞增殖,细胞的分化向较差的方向发展。
子宫内膜癌;雌激素;ERα;ERβ;p57kip2
子宫内膜癌(endometrial carcinoma)是最常见的女性生殖道恶性肿瘤之一,严重威胁着女性的身体健康,其病理组织学类型70%~80%为子宫内膜样癌(endometrioid carcinoma,EC)[1]。子宫内膜癌是一种激素依赖性肿瘤,其发病因素与内分泌调控紊乱、肥胖、月经来潮过早、绝经延迟、遗传等有关,其中缺乏孕激素对抗的高雌激素(estrogen,E)刺激与其发生发展密切相关[2]。雌激素与ER结合后可促进子宫内膜腺上皮细胞的增殖,引起子宫内膜腺体增生和内膜增厚,导致子宫内膜癌的发生、发展[3]。ER主要有ERα、ERβ两种亚型,在很多肿瘤组织中有表达。与正常子宫内膜相比,子宫内膜癌组织细胞中ER蛋白的表达下降[4]。
肿瘤的发生还与细胞周期调控紊乱有关[5]。细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors,CKI)分为INK4和Cip/Kip两大家族,p57kip2是Cip/Kip家族中的一员,在细胞周期的G1-S期、G2-M期可发挥负向调控作用,被认为是一种肿瘤抑制基因[5]。本研究拟通过对E2干扰下人EC细胞(JEC细胞株)的培养,用倒置显微镜、透射电镜、MTT、WB等实验仪器与方法,观察与检测E2干扰下JEC细胞的生长情况及ERα、ERβ、p57kip2蛋白的表达情况,以进一步探讨雌激素、细胞周期调控紊乱与子宫内膜癌的关系。
1 材料与方法
1.1细胞株人子宫内膜样癌中分化JEC细胞株由遵义医学院微生物教研室提供。
1.2试剂雌二醇购自北京华迈科公司,MTT相关试剂购自南京凯基公司, p57kip2、ERα、ERβ鼠抗人单克隆抗体均购自美国Santa Cruz公司,鼠抗人β-actin单克隆抗体及WB有关试剂均购自上海碧云天生物研究所。
1.3仪器倒置显微镜DM4000B(德国Leica公司),透射电子显微镜H-7650(日本日立公司),WB相关仪器(BIO-RAD公司)。
1.4方法
1.4.1细胞培养及药物分组用含有10%胎牛血清的RPMI-1640培养基,在37 ℃、5%CO2、饱和湿度条件下体外培养JEC细胞。取对数生长期的细胞,分别用含有3种不同浓度E2(10-6mol/L,10-8mol/L,10-10mol/L)的培养基进行JEC细胞的体外培养,另取一组不加E2的细胞作为对照组,分别培养24、48、72、96 h后进行后续实验,所有实验均重复3次。
1.4.2MTT法观察细胞生长情况96孔板培养细胞后,PBS冲洗各孔,每孔加20 μL MTT,4 h后再用PBS冲洗后各加100 μL 二甲基亚砜(DMSO),用酶标仪检测490 nm 波长处JEC细胞的吸光光度值(OD值)。
1.4.3倒置显微镜观察细胞生长情况将对数生长期的JEC细胞制成浓度为1×106/mL的单细胞悬液,接种于6孔板,其中3孔分别加入含不同浓度(10-6mol/L,10-8mol/L,10-10mol/L)E2的培养基进行培养,另取一孔细胞不加E2,作为对照组,每组细胞设3个复孔(3个6孔板同时进行实验),在倒置显微镜下观察细胞生长情况。
1.4.4透射电镜观察细胞形态变化将实验组及对照组JEC细胞制成单细胞悬液,离心后加入2.5%戊二醛固定液前固定、1%饿酸后固定、梯度脱水、浸透、包埋、聚合、超薄切片、电子染色,在H-7650透射电镜下观察细胞的超微结构变化。
1.4.5WB法检测细胞中ERα、ERβ、p57kip2蛋白的表达情况将4组JEC细胞分别提取细胞总蛋白,按照SDS-PAGE凝胶配制说明书配制分离胶和浓缩胶,将细胞蛋白与上样缓冲液按4∶1的比例混匀后沸水煮5 min,加样至浓缩胶的加样孔,电泳。取出凝胶,切下目的蛋白所在区域的凝胶后转膜,封闭。取出膜分别放入对应的一抗(β-actin、p57kip2、ERα、ERβ鼠抗人单克隆抗体)稀释液中,4 ℃过夜。用TBST洗膜3次后放入山羊抗鼠荧光单克隆抗体稀释液中,置摇床上室温孵育2 h,TBST洗膜3次,Odyssey系统扫描成像,测出目的蛋白与内参蛋白的灰度值后作比即为目的蛋白的相对含量。

2 结果
2.1MTT法观察E2干扰后JEC细胞的生长情况与对照组相比,中、低浓度(10-8mol/L,10-10mol/L )E2对JEC细胞有促增殖作用(P<0.05),且有时间依赖性,高浓度(10-6mol/L) E2则可抑制JEC细胞的生长,但差异无统计学意义(P>0.05,见图 1)。

图1 E2各浓度组作用JEC细胞24、48、72、96 h的生长曲线
2.2倒置显微镜下观察E2干扰后JEC细胞的生长情况与对照组相比,E2中、低浓度组细胞密度增大,E2高浓度组细胞密度减小,各组细胞形态变化不明显(见图2)。

A:对照组;B:低浓度组;C:中浓度组; D:高浓度组。 图2 E2各浓度组作用JEC细胞72h后JEC细胞生长情况(×100)
2.3透射电镜下观察E2干扰后JEC细胞的形态结构变化与对照组比较,E2低浓度组JEC细胞表面微绒毛及胞质中分泌泡均减少,高浓度组JEC细胞表面微绒毛及胞质中分泌泡均有所增多(见图3)。

A:对照组;B:低浓度组;C:中浓度组;D:高浓度组。 图3 E2各浓度组作用JEC细胞72 h后JEC细胞形态变化(bar=5.0 μm)
2.4WB检测E2干扰后JEC细胞中ERα、ERβ、p57kip2蛋白的表达情况
2.4.1WB检测E2干扰后JEC细胞中ERα蛋白的表达情况对照组及E2干扰下的JEC细胞均无ERα蛋白的表达(见表1、图4~6)。
2.4.2WB检测E2干扰后JEC细胞中ERβ蛋白的表达情况相同药物浓度比较:随着E2干扰时间的延长,ERβ蛋白的表达量增加,其中24 h与72 h比较,中、高浓度组差异有统计学意义(P<0.05);相同作用时间比较:随着药物浓度的增高,ERβ蛋白的表达量增加,其中低、高浓度组在48 h与72 h比较时差异有统计学意义(P<0.05);与对照组比较,中、高浓度组在48 、72 h差异均有统计学意义(P<0.05)(见表1、图4~6)。
2.4.3WB检测E2干扰后JEC细胞中p57kip2蛋白的表达情况相同药物浓度比较:中、高浓度组p57kip2蛋白随E2干扰时间的延长表达增加,其中高浓度组在24 h与72 h比较差异有统计学意义(P<0.05),中浓度组在72 h与24、48 h比较差异有统计学意义(P<0.05)。相同作用时间比较:24 h时,高浓度组p57kip2蛋白表达量最高,中浓度组表达量最低,3组与对照组比较差异均有统计学意义(P<0.05),48 h与72 h时,p57kip2蛋白表达量随药物浓度的增高而增高,48 h高浓度组与对照组、低浓度组比较差异有统计学意义(P<0.05),72 h低浓度组与高、中浓度组及对照组比较差异有统计学意义(P<0.05)(见表1、图4~6)。
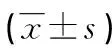

培养时间(h)组别ERβp57kip2ERα24对照组0.039±0.0061.42±0.072-低浓度组0.043±0.0081.13±0.100■-中浓度组0.047±0.006●1.13±0.064■-高浓度组0.052±0.011▲1.17±0.194&■-48对照组0.039±0.0151.12±0.102-低浓度组0.044±0.007◆0.95±0.082#-中浓度组0.064±0.012※1.13±0.109-高浓度组0.072±0.025※1.40±0.176★-72对照组0.032±0.0031.56±0.106-低浓度组0.045±0.010▼1.23±0.059▽-中浓度组0.071±0.012△1.52±0.100◇-高浓度组0.072±0.009△1.61±0.120-
※与48 h对照组比较,△与72 h对照组比较,◆与48 h中、高浓度组比较,▼与72 h中、高浓度组比较,●与72 h中浓度组比较,▲与48、72 h高浓度组比较,■与24 h对照组比较,★与48 h对照组、低浓度组比较,▽与72 h中、高浓度组及对照组比较,#与24、72 h低浓度组比较,◇与24、48 h中浓度组,&与72 h高浓度组比较,P<0.05。

A:对照组;B:低浓度组;C:中浓度组; D:高浓度组。 图4 WB检测E2各浓度组作用JEC细胞24h后ERα、ERβ、 p57kip2蛋白的表达情况

A:对照组;B:低浓度组;C:中浓度组; D:高浓度组。 图5 WB检测E2各浓度组作用JEC细胞48 h后ERα、ERβ、 p57kip2蛋白的表达情况
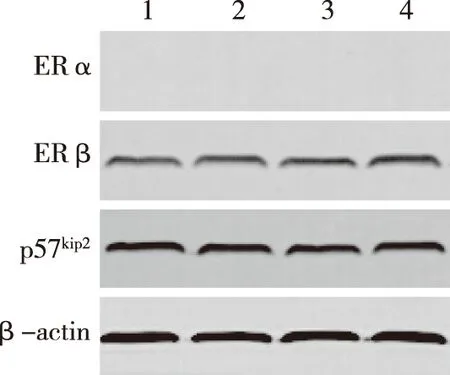
A:对照组 ;B:低浓度组;C:中浓度组;D:高浓度组。 图6 WB检测E2各浓度组作用JEC细胞72h后ERα、ERβ、 p57kip2蛋白的表达情况
2.5E2干扰后JEC细胞中ERβ、p57kip2蛋白表达的相关性分析P=0.054>0.05,r=0.324,按α=0.05检验水准,尚不能认为ERβ、p57kip2蛋白表达之间有相关关系。
3 讨论
近年来,在我国大中城市,子宫内膜癌的发病率逐年升高,其中最常见的为雌激素依赖型子宫内膜癌[6]。雌激素主要通过与ER结合形成激素-受体复合物二聚体调节靶基因的转录[7];此外,雌激素还可以通过不依赖于ER的非经典调控模式促进子宫内膜细胞增殖、抑制细胞凋亡[8-9]。本实验结果显示,用含不同浓度E2的培养基培养子宫内膜癌JEC细胞,与对照组相比,中、低浓度E2均促进细胞增殖,高浓度E2则抑制细胞增殖;电镜观察结果显示,与对照组JEC细胞相比,E2低浓度组JEC细胞微绒毛及胞质中分泌泡减少,E2高浓度组JEC细胞微绒毛及胞质中分泌泡增多。提示低浓度雌激素可以促进JEC细胞增殖,细胞分化向较差的方向发展;高浓度雌激素则抑制JEC细胞增殖,细胞分化向较好的方向发展。
ER主要有ERα和ERβ两种核受体。经典的雌激素受体为ERα,ERβ为新发现的雌激素受体。ERα和ERβ在不同组织中表达不一致,且介导的转录激活特性也可表现出相反的效应,E2由ERα介导表现为激活转录,从而诱导肿瘤细胞增殖;而ERβ介导则可抑制转录,并可抑制ERα的表达,提示在肿瘤发生过程中ERβ可能起到抑癌基因的作用,但也有研究发现ERβ可促进乳腺癌的转移[10]。有研究表明[4],与正常子宫内膜组织相比,子宫内膜癌组织中ERα和ERβ两种受体的表达均有减少,因此推测两种受体均与子宫内膜癌的发生发展有关。也有研究发现,ERα受体的低表达或表达缺失与子宫内膜癌细胞的恶性转变呈正相关[11]。ERβ在子宫内膜癌中的研究较少,但有研究发现[12],ERβ在晚期和有淋巴结转移的子宫内膜癌患者中表达有所增加。且研究表明[13],子宫内膜癌的恶性转变与ERα/ERβ mRNA的比值降低有关。以上研究说明ERα和ERβ在子宫内膜癌中的表达异常与在其他肿瘤组织中的表达并不完全一致,推测可能与雌激素的不同调控有关,提示子宫内膜癌的发生及预后需要同时分析ERα和ERβ两种受体。本实验所选用人EC中分化细胞株JEC细胞为吴中明[14]所建,已通过酶联亲和组化法(S-P法)被证实为ER阴性细胞株,但并未进行ER亚型的检测。本实验结果显示,对照组及E2作用组JEC细胞均无ERα表达,ERβ表达较弱;E2作用于JEC细胞后,与对照组比较,各组细胞ERβ表达量随E2干扰时间的延长、药物浓度的增高而提高。提示JEC细胞为 ERα表达缺失、ERβ弱表达的细胞株;雌激素可促进EC细胞中ERβ的表达,且有时间和浓度依赖性。
p57kip2基因位于染色体11p15.5上[15],属于CIP/KIP家族的重要成员,在G1-S期、G2-M期阻滞细胞周期的进行[16]。研究显示[17-18],p57kip2在肝癌组织细胞中表达降低,且其表达量的降低与肿瘤体积增大、TNM分期增高、浸润转移存在正相关。Guo[19]研究发现,p57kip2表达的增高可以抑制卵巢癌细胞的增殖和转移。此外,p57kip2在绝大多数乳腺癌中表达也降低,且与其预后不良有关,提示p57kip2可能是乳腺癌的一个肿瘤抑制基因[20-22]。本课题组前期研究发现,p57kip2蛋白在子宫内膜分泌期中表达最高,在子宫内膜癌中表达较低,在增生性病变中表达最低,推测p57kip2蛋白在子宫内膜不同病变组织中的表达与在其他组织中的表达不同,可能与雌、孕激素调控有关。本实验结果显示,E2干扰JEC细胞后,随着时间的延长和药物浓度的提高,p57kip2蛋白的表达呈递增趋势,提示雌激素可上调p57kip2在EC中的表达,且有时间和浓度依赖性。
本实验WB结果显示,E2作用JEC细胞24h后,细胞中p57kip2蛋白的表达较对照组降低,可能由于存在转录后修饰途径,如磷酸化和泛素化,使p57kip2蛋白表达降低,也可能是存在microRNAs通过诱导靶mRNA降解和抑制靶mRNA翻译,以降低p57kip2蛋白的表达;随着E2干扰时间的延长、药物浓度的增高,JEC细胞中ERβ、p57kip2蛋白的表达均逐渐升高,推测在雌激素作用下,ERβ蛋白在EC中的表达增高,可能诱导p57kip2蛋白表达增高,使细胞无法从G1期转变到S期,从而抑制细胞进一步恶性增殖。
[1] Kreizman-Shefer H,Pricop J,Goldman S,et al.Distribution of estrogen and progesterone receptors isoforms in endometrial cancer[J].Diagnostic Pathology,2014,9(1):164-166.
[2] Kim H I,Kim T H,Lim J M,et al.Steroid hormone intervenes in the endometrial tumorigenesis of pten ablation[J].J Cancer Prev,2013,18(4):313-321.
[3] 李继俊.妇产科内分泌治疗学[M].北京:人民军医出版社,2014:65-79.
[4] Jarzabek K,Koda M,Walentowicz-Sadlecka M,et al.Altered expression of Ers,aromatase,and COX2 connected to estrogen action in type 1 endometrial cancer biology [J].Tumour Biol,2013,34(6):4007-4016.
[5] Guo H,Tian T,Nan K,et al.p57:A multifunctional protein in cancer (Review)[J].International Journal of Oncology,2010,36(6):1321-1329.
[6] Tangjitgamol S,Anderson B O,See H T,et al.Management of endometrial cancer in Asia:consensus statement from the Asian Oncology Summit 2009[J].Lancet Oncol,2009,10(11):1119-1127.
[7] Renoir J M,Marsaud V,Lazennec G.Estrogen receptor signaling as a target for novel breast cancer therapeutics[J].Biochem Pharmacol,2013,85(4):449-465.
[8] Winuthayanona W,Hewitta S C.Uterine epithelial estrogen receptor α is dispensable for proliferation but essential for complete biological and biochemical responses[J].PNAS,2010,107(9):19272-19277.
[9] Zhu Y,Shen J,Gao L,et al.Estrogen promotes fat mass and obesity-associated protein nuclear localization and enhances endometrialcancer cell proliferation via the mTOR signaling pathway[J].Oncology reports,2016,35(4):2391-2397.
[10] 谢辛慈,吴佳,潘芬芬,等.雌激素受体与肿瘤发生的研究进展[J].药物生物技术,2015,22(2):156-159.
[11] Wik E,Raeder M B,Krakstad C,et al.Lack of estrogen receptor-alpha is associated with epithelial-mesenchymal transition and PI3K alterations in endometrial carcinoma [J].Clin Cancer Res,2013,19(5):1094-1105.
[12] Jongen V,Briet J,de Jong R,et al.Expression of estrogen receptor-alpha and -beta and progesterone receptor-A and -B in a large cohort of patients with endometrioid endometrial cancer [J].Gynecol Oncol,2009,112(3):537-542.
[13] Mylonas I.Prognostic significance and clinical importance of estrogen receptor alpha and beta in human endometrioid adenocarcinomas [J].Oncol Rep,2010,24(2):385-393.
[14] 吴中明,张逸群,刘祖林,等.子宫内膜腺癌细胞系的建立及其生物学特性[J].中国肿瘤临床,1999,26(10):779-781.
[15] Borriello A,Caldarelli I,Bencivenga D,et al.p57kip2and cancer:time for a critical appraisal[J].Mol Cancer Res,2011,9(10):1269-1284.
[16] Pateras I S,Apostolopoulou K,Niforou K,et al.p57kip2:“Kip”ing the Cell under Control [J].Mol Cancer Res,2009,7(12):1902-1919.
[17] Hu T,Guo H,Wang W,et al.Loss of p57 expression and RhoA overexpression are associated with poor survival of patients with hepatocellular carcinoma[J].Oncol Rep,2013,30(4):1707-1714.
[18] Guo H,Lyu Y,Tian T,et al.Downregulation of p57 accelerates the growth and invasion of hepatocellular carcinoma[J].Carcinogenesis,2011,32(12):1897-1904.
[19] Guo J,Cai J,Yu L,et al.EZH2 regulates expression of p57 and contributes to progression of ovarian cancer in vitro and in vivo[J].Cancer Sci,2011,102(3):530-539.
[20] Larson P S,Schlechter B L,King C L,et al.CDKN1C/p57kip2 is a candidate tumor suppressor gene in human breast cancer[J].BMC Cancer,2008,8(1):68.
[21] Xu X Y,Wang W Q,Zhang L,et al.Clinical implications of p57kip2expression in breast cancer[J].Asian Pac J Cancer Prev,2012,13(10):5033-5036.
[22] Yang C,Nan H,Ma J,et al.High Skp2/Low p57kip2Expression is associated with poor prognosis in human Breast Carcinoma[J].Breast Cancer:Basic and Clinical Research,2015,9(Suppl 1):13-21.
[收稿2016-06-08;修回2016-07-06]
(编辑:王福军)
Effects of estrogen on the expressions of ERα, ERβ and P57kip2in JEC cells of human endometrial carcinoma
LiuMengmeng1,SunXiaojie1,ZhouZhengping2,XiaoXin2,YuanDan1
(1.Department of Pathology, Zunyi Medical University, Zunyi Guizhou 563099, China;2.Electron Microscope Laboratory of Medicine and Biology Research Center, Zunyi Guizhou 563099, China)
Objective To investigate the effects of estrogen on the expressions of estrogen receptor subtype (ERα, ERβ) and p57kip2in human endometrioid carcinoma cells named JEC.Methods The JEC cells cultured in vitro were treated with different concentrations (10-6mol/L,10-8mol/L,10-10mol/L) of β-Estradiol (E2); Another group of JEC cells was cultured without E2, as control group.After 24, 48, 72 h, the morphological changes of JEC cells were observed by light microscopy and electron microscopy.The growth of cells was detected by MTT assay.And, the expression of ERα、ERβ、and p57kip2protein was analyzed by Western Blot (WB) assay.Results The middle and low concentration of E2could promote the growth of JEC cells (P<0.05), Conversely, high concentration of E2could inhibit the growth of JEC cells, even the difference was not statistically significant (P>0.05); Compared with the control group, the microvilli and cytoplasmic secretory vesicles of JEC cells in low concentration group were decreased, While in high concentration group, microvilli and cytoplasmic secretory vesicles of JEC cells were increased.Furthermore, ERβ, but not ERα, was expressed weakly in experimental group or control group.With the increase of the concentration of E2and the extension of the time, the expression of ERβ and p57kip2protein showed an increasing trend (P<0.05).Conclusion The expression of ERα in JEC cells may be missing.With the increase of the concentration of estrogen and the extension of time, the expression of ERβ and p57kip2in EC are all up-regulated.The middle and low concentration of estrogen could promote the proliferation of JEC cells.
endometrial carcinoma; estrogen; ERα; ERβ; p57kip2
贵州省社发攻关项目(NO:黔科合SY字[2013]3011)。
周正平,女,教授,硕士生导师,研究方向:妇科肿瘤, E-mail:zhouzp66@163.com。
R737.33
A
1000-2715(2016)04-0397-06
