影响鸡胸肉中肌肽/鹅肌肽提取率因素的研究
2016-10-31朱俊颖赵黎明蒋丽华邱勇隽夏泉鸣
朱俊颖,赵黎明,蒋丽华,邱勇隽,夏泉鸣
(华东理工大学生物反应器国家重点实验室,发酵工业分离提取技术研发中心,上海 200237)
影响鸡胸肉中肌肽/鹅肌肽提取率因素的研究
朱俊颖,赵黎明*,蒋丽华,邱勇隽,夏泉鸣
(华东理工大学生物反应器国家重点实验室,发酵工业分离提取技术研发中心,上海 200237)
为了探寻低值原料中提取制备肌肽和鹅肌肽的工艺,并进一步优化提取工艺条件,本研究采用OPA柱前衍生法检测了鸡胸肉等7种市售原料中两种二肽的含量,并对提取方式、料液比和膜处理方式进行了优化研究。结果表明:7种天然原料中,鸡胸肌肉中含有肌肽和鹅肌肽含量最高,总量为21.58 μmol/g;相对于切丁、绞碎、搅拌、超声、蒸煮及酶解等提取方法,绞碎后搅拌的方法能够最大化的提取两种二肽,且提取物中其他蛋白质及多肽较少;采用1000 u超滤膜和500 u纳滤膜两步法进行分离,进一步除去大分子蛋白和多肽,经氨基酸分析,提取液中肌肽和鹅肌肽含量约60%(w/w)。本研究为低值肉制品的高值利用和开发提供了基础的工艺技术。
肌肽,鹅肌肽,分离提取,鸡胸肉
组氨酸二肽(Histidine-containing dipeptides,HCDPs)[1]是一类天然水溶性二肽,包括肌肽(Carnosine,β-alanyl-L-histidine,Car)、鹅肌肽(Anserine,β-alanyl-L-1-methylhistidine,Ans)、鲸肌肽(Balenine,β-alanyl-L-3-methylhistidine)及N-乙酰-肌肽等。组氨酸二肽具有许多生理特性,如:具有缓冲生理pH功能[2],螯合金属离子功能[3],具有抗氧化[4]、抗衰老的能力[5];以及神经调节的能力等。近年来,有研究发现肌肽和鹅肌肽在治疗高尿酸血症以及痛风[6-7]、阿尔兹海默症[8]上有一定作用,并且在体外及体内治疗中有明显作用。因此,组氨酸二肽中,对于肌肽和鹅肌肽的研究最为广泛,分子式如图1所示。

图1 肌肽和鹅肌肽结构图Fig.1 The structure of carnosine and anserine
目前市售的组氨酸二肽保健品中两种二肽主要从鲣鱼、鲔鱼等深海鱼中提取,这些原料深海鱼捕捞难、价格贵,这些因素限制了两种二肽的规模生产和广泛应用。组氨酸二肽具有良好的水溶性,在水溶液中呈碱性,不溶于醇,并具有高热稳定性,如肌肽可承受120 ℃高温20 min[9],因此提取方式通常为肌肉中直接提取,如可采用加工废弃的肉骨上的肉提取[10],或从肉类预煮液中提取[11],也有从淘汰的蛋鸡肉中提取[12]。所以通过从低值肉类或肉类下脚料中提取肌肽和鹅肌肽,是降低组氨酸二肽生产成本重要选项,也是未来对组氨酸二肽研究的一个重要方向。
本文研究了从7种市售天然原料(猪、牛、鸡、鸭、带鱼、秋刀鱼及黄花鱼)提取肌肽和鹅肌肽的关键技术,为两种二肽的提取寻找低值原料,并进一步优化提取工艺,降低成本,为低值肉制品原料及下脚料的利用和开发提供了依据。
1 材料与方法
1.1材料与仪器
猪肉、牛肉、鸡胸肉、鸭肉、带鱼、秋刀鱼、黄花鱼上海超市;肌肽标准品、β-巯基乙醇北京百灵威科技有限公司公司;鹅肌肽标准品上海予利化学科技有限公司;乙腈、甲醇、硼砂、邻苯二甲酸(OPA)、甲醇国药化学试剂有限公司;无水乙酸钠、乙酸、三氯乙酸、盐酸、氢氧化钠上海凌风化学试剂有限公司;动物蛋白酶广西南宁庞博生物制品有限公司。其中,肌肽和鹅肌肽标准品为生物纯,乙腈、甲醇为色谱纯,其他化学试剂均为分析纯,蛋白酶为食品级。
Agilent 1200 LC高效液相色谱仪美国安捷伦科技公司;ODS-C18液相色谱柱日本岛津有限公司;Waters 600高效液相色谱仪沃特世科技有限公司;TSK-Gel G2000柱日本TOSOH有限公司;DS-1高速组织捣碎机上海标本模型厂;L-8900全自动氨基酸分析仪日本Hitachi公司;KDN-2C凯氏定氮仪上海纤检仪器有限公司;RNM-1812G卷式膜设备杭州瑞纳膜工程有限公司。
1.2实验方法
1.2.1肌肽和鹅肌肽的提取新鲜原料购于市场后保存于-20 ℃冰箱中,测定前取出置于4 ℃冰箱内解冻12 h。猪肉、牛肉等去肥去筋,带鱼、秋刀鱼、黄花鱼去皮去骨取鱼肉。分别称取20 g原料,加入50 mL去离子水于高速组织捣碎机中,破碎匀浆2 min。采用高速冷冻离心机4 ℃下12000×g离心15 min,将残渣加20 mL水搅拌均匀,相同提取方法再提取2次,将3次提取得到的上清液混合,并定容至100 mL,得粗提液。取粗提液5 mL,加入5 mL 10%(v/v)三氯乙酸混匀,于4 ℃下静置2 h。采用4 ℃下12000×g离心15 min,取上清液并经0.45 μm微孔滤膜过滤。采用OPA衍生法测定(详见1.2.4),并计算肌肽和鹅肌肽含量,如下。
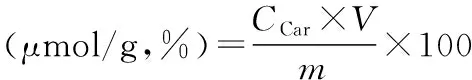
式(1)
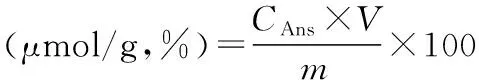
式(2)
式中,CCar和CAns分别为提取液中肌肽和鹅肌肽的浓度(mmol/L);V为提取液体积,即100 mL;m为原料质量,即20 g。
1.2.2提取方式对鸡胸肉中肌肽和鹅肌肽提取的影响冷冻鸡胸肉于4 ℃下解冻12 h,A组切成约1 cm3立方体,B组采用高速组织捣碎机绞碎成泥。将A、B两组各分为4等份,每份20 g备用。A、B两组每份分别置于4 ℃下搅拌(150 r/min),4 ℃下超声提取,100 ℃沸水中隔水蒸煮。30 min后取出,于4 ℃下12000×g离心15 min取上清液,将残渣加20 mL水搅拌均匀,相同提取方法提取2次,将3次提取得到的上清液混合,并定容至100 mL。另取A、B组各20 g,加水90 mL于50 ℃水浴锅中预热,加入动物蛋白酶(2000 U/g),50±1 ℃下搅拌(150 r/min)1.5 h。分别于4 ℃下12000×g离心15 min,取上清液并定容至100 mL。采用OPA衍生法测定肌肽和鹅肌肽含量(详见1.2.4)。
1.2.3料液比对鸡肉中提取肌肽和鹅肌肽的影响冷冻鸡胸肉于4 ℃下解冻12 h,切成小块后用高速组织捣碎机搅拌成泥。准确取10.0、20.0、30.0、40.0、50.0 g肉泥,分别加50 mL水置于4 ℃下搅拌30 min(150 r/min),并于4 ℃下12000×g离心15 min取上清液,将残渣加20 mL水搅拌均匀,相同提取方法再提取2次,将3次提取得到的上清液混合,并定容至100 mL。采用OPA衍生法测定肌肽和鹅肌肽含量(详见1.2.4)。
1.2.4肌肽和鹅肌肽的测定肌肽和鹅肌肽的定量检测方法采用OPA柱前衍生高效液相(OPA-HPLC)法进行测定[13]。色谱柱采用岛津ODS-C18色谱柱(4.6 mm×25 mm,5 μm),色谱设备选用Agilent 1200高效液相色谱设备,流动相A为12.5 mmol/L乙酸-乙酸钠缓冲液,流动相B为甲醇-乙腈溶液(7∶3,v/v)。梯度洗脱条件为:0 min,A相为60%;15 min,A相为40%;20~22 min,A相为0;后运行5 min。样品进样量为10 μL,样品流速为1.0 mL/min,柱温为28 ℃,检测器选用紫外检测器,于228 nm下测定。OPA衍生试剂的配制方法采用20 mg领苯二甲酸,加入1 mL甲醇溶解后,加入4 mL硼酸缓冲液(pH9.5)和100 mLβ-巯基乙醇混匀,避光,现配现用。
1.2.5提取液中蛋白溶出率的测定采用双缩脲法测定蛋白质含量,采用浓度为0~10 g/L牛血清白蛋白(BSA)做标准曲线。
1.2.6提取液中蛋白质分子量分布利用高效凝胶排阻色谱进行分子量[14],采用Waters600 HPLC系统和TSK-Gel G2000柱(7.8 mm× 300 mm)。用含有0.1%三氟乙酸的45%乙腈稀释样品,进样量10 μL,洗脱液为45%乙腈(含有0.1%三氟乙酸),柱温30 ℃,0.5 mL/min的流速洗脱30 min,220 nm处检测。分子量由标准分子量曲线计算得到。
1.2.7膜处理对肌肽和鹅肌肽提取的影响鸡胸肉粗提液3 L(固形物含量为1.6%),采用1812型膜设备,进行MWCO 1000 u超滤膜分离实验(QY-UF-10-T-1812),跨膜压差控制在2.25 bar下进行超滤处理,截留液加1 L水进行透析,并重复2次,收集透过液进行合并,将透过液在进行MWCO 500 u纳滤膜分离实验(QY-NF-5-A-1812),跨膜压差控制在3.0 bar下进行纳滤处理,截留液加1 L水进行透析。检测超滤和纳滤透过液肌肽和鹅肌肽含量,计算透过率。

式(3)
式中,C透过液分别为透过液中肌肽/鹅肌肽的浓度(mmol/L);V为料液体积(L)。
1.2.8数据统计分析所有实验数据均经过3次平行实验获得,并计算平均值和标准偏差。采用平均值和标准偏差作图,采用OriginPro 8.0作图软件对作图。实验数据采用Statistix 8.0(Analytical Software,Tallahassee,FL,USA)进行统计分析,采用t检验法计算数据间的显著性差异,其中显著水平p为0.05,当p<0.05为显著性差异。
2 结果与讨论
2.1不同物种中的肌肽和鹅肌肽含量
尽管前人研究中报道了常见肉类(猪肉、牛肉、鸡肉、鸭肉)以及几种低价值鱼类中的肌肽和鹅肌肽,但是他们的数据差异性比较大,为了本实验的稳定性,课题组在同种实验条件下对它们的含量进行测定。本研究测试了上述样品中肌肽和鹅肌肽含量(图2)。我们发现畜类中猪肉和牛肉中肌肽含量(10.86、9.51 μmol/g)明显高于鹅肌肽(0.91、0.48 μmol/g);对于家禽而言,两种二肽含量高于畜类,且鹅肌肽含量(11.01 μmol/g,鸡肉;7.35 μmol/g,鸭肉)略高于肌肽含量(10.57 μmol/g,鸡肉;6.68 μmol/g,鸭肉)。而对于水产来说,不同种类鱼的肌肽和鹅肌肽含量差异较大,如带鱼中不含有鹅肌肽,肌肽含量仅为1.55 μmol/g;黄花鱼中肌肽和鹅肌肽含量与带鱼较为类似;而秋刀鱼中肌肽和鹅肌肽含量相对丰富,且肌肽含量高于鹅肌肽含量。综上,禽类中肌肽和鹅肌肽含量丰富,而畜类动物中肌肽含量高于鹅肌肽,而对于水产类而言,肌肽和鹅肌肽含量较低,秋刀鱼除外。

图2 不同动物中的肌肽和鹅肌肽含量Fig.2 The concentration of Car and Ans in different animals注:标注不同字母表示差异显著(p<0.05),图3~图5同。
2.2提取方式对肌肽和鹅肌肽含量的影响

图3 不同提取方式下鸡胸肉中肌肽和鹅肌肽含量Fig.3 The contents of Car and Ans via different extraction methods注:A为切丁处理,B为绞碎处理。
从上述数据可以看出,禽类肉中肌肽和鹅肌肽含量相对丰富(特别是鸡胸肉含量最高,数据未显示),所以在接下来的实验中,采用禽类样品作为研究对象。采用鸡胸肉作为原料在料液比为2∶10(w/v)条件下,采用不同提取方法提取肌肽和鹅肌肽。由图3A和图3B比较发现,绞碎成肉泥后再经后续处理的肌肽和鹅肌肽的提取率明显高于切丁处理,说明相比较切丁处理方式,经高速组织捣碎机绞碎后,肌肽和鹅肌肽更容易溶到水中。由图3B可见,经绞碎后,分别采用搅拌、超声和蒸煮这3中提取方式,对于肌肽和鹅肌肽的提取并没有显著差异(p>0.05),说明组氨酸二肽为水溶性二肽,经绞碎后,已经能够很好地溶在水中[15],而经过酶解处理,总含量却有所下降,表明采用动物蛋白酶进行酶解,酶解位点可能作用于组氨酸和丙氨酸间的肽键上,促使肌肽和鹅肌肽水解,使检测出的二肽含量降低。
由图4可以看出,无论是切丁还是绞碎的处理方式,采用蒸煮或者酶解方法提取都会使蛋白溶出率明显增加,而肌肽和鹅肌肽总量却并未增加(图3)。这可能是由于蒸煮和酶解这种加工条件比较剧烈,而导致动物细胞的完整性遭到破坏,而使细胞内肌浆蛋白流出,使蛋白含量升高。但是所需的肌肽和鹅肌肽的绝对含量没有增加,说明肌浆蛋白中不含有这两种二肽,但是肌浆蛋白的溶出反而会影响肌肽和鹅肌肽的提取。因此,采用高速组织破碎机绞碎成肉泥后采用搅拌的提取方法,避免动物细胞的破坏,既能得到高含量的肌肽和鹅肌肽,同时能控制其他蛋白质和多肽的溶出。
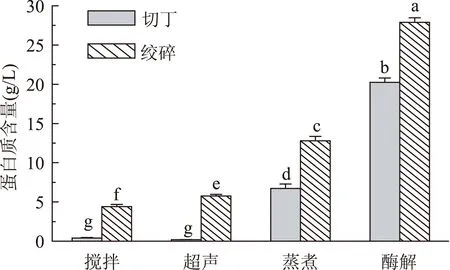
图4 不同提取方式下溶液中蛋白质的含量Fig.4 The protein contents via different extraction methods
2.3料液比对肌肽和鹅肌肽提取的影响
为研究料液比对从鸡胸肉中提取肌肽和鹅肌肽的影响,在料液比为1∶10、2∶10、3∶10、4∶10、5∶10(w/v)条件下,从鸡胸肉泥中提取的肌肽和鹅肌肽,并采用HPLC进行检测,绘图5。由图可见,随着料液比的增加,肌肽和鹅肌肽含量也增加。而在料液比为1∶10(w/v)和料液比为2∶10(w/v)下无明显差异(p>0.05),至于料液比对以上二肽引起含量下降的原因是,二肽中丙氨酸二肽残基为疏水氨基酸所致。为了平衡物料处理量和提取液中肌肽和鹅肌肽的含量,因此采用料液比为2∶10(w/v)进行提取。
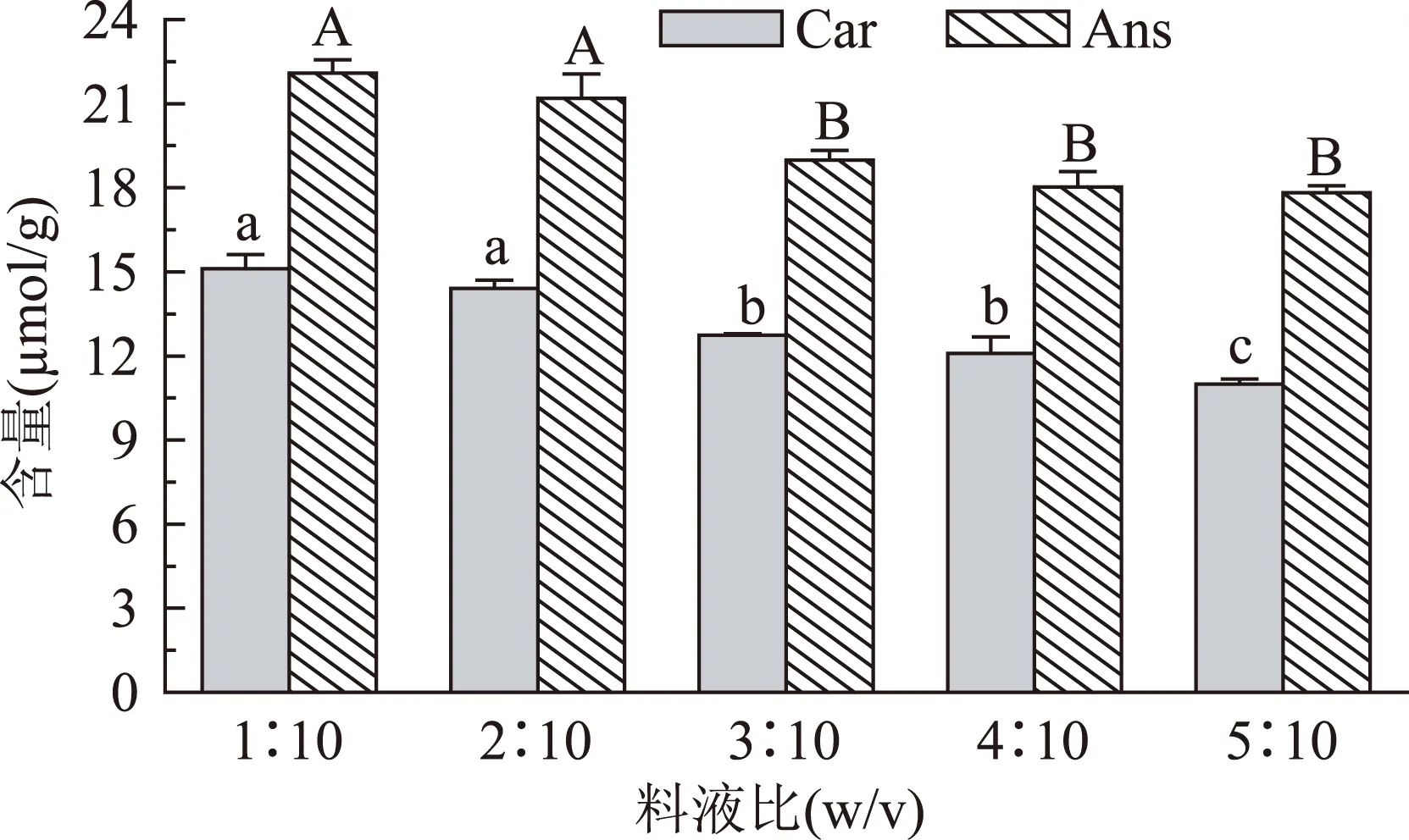
图5 料液比对肌肽和鹅肌肽提取的影响Fig. 5 The effect of the ratio of material to solvent to extract Car and Ans
2.4膜处理对肌肽和鹅肌肽透过率的影响
膜处理在食品加工中具有工业化的潜力,因此采用膜处理对肌肽和鹅肌肽提取液进行处理。采用绞碎-搅拌的方法提取得到3 L粗提液,经离心后的分子量分布如图6所示。分子量大于1300 u的蛋白质多肽占16%,分子量范围在700~1300 u之间的多肽占8%,而分子量小于500 u的小分子肽及氨基酸超过70%。故采用MWCO为1000 u和500 u两级膜过滤,减少膜堵塞的产生。

图6 鸡胸肉粗提液分子量分布Fig. 6 The molecular weight distribution of the extraction from chicken breast
由于膜设备存在1 L料液残留,为了减少截留液中肌肽和鹅肌肽的含量,增加其透过率,因此在超滤过程中加水2次,每次1 L,多次过滤。表1为超滤前后物料肌肽及鹅肌肽的含量及得率。超滤前3.23 L的粗提液中含有肌肽3.63 mmol,鹅肌肽5.03 mmol。经过超滤处理的透过液中肌肽和鹅肌肽含量分别为3.14、4.46 mmol,透过率分别达到87%和89%。同时料液中的固形物含量由原来的1.6%减少至1.2%(折算成相同体积)透过液为澄清透明液体,微黄。

表1 过膜处理下肌肽和鹅肌肽的透过率
取纳滤处理后的提取液,测定溶液中的氨基酸组成如表2所示。经过膜处理后以肌肽和鹅肌肽为代表的组氨酸二肽含量约为60%(w/w)。提取液中含有人体必需的18种氨基酸,而其中丙氨酸含量为8.21%,谷氨酸含量为5.54%,其余氨基酸含量均小于5%,表明采用绞碎-搅拌法提取,再经过膜处理,能获得较高含量的肌肽和鹅肌肽。

表2 经纳滤处理后提取液中游离氨基酸含量
3结论
测定不同物种中组氨酸二肽含量发现,以牛、猪为代表的畜类中肌肽含量高于鹅肌肽;而以鸡鸭为代表的禽类汇总鹅肌肽含量高于肌肽,且总含量高于家畜;3种水产中肌肽和鹅肌肽含量随物种不同而差异明显。采用切丁、绞碎、搅拌、超声、蒸煮及酶解方法提取肌肽和鹅肌肽,绞碎后搅拌方法能够最大化的提取二肽且引入其他蛋白质及多肽较少,2∶10(w/v)为最佳料液比。采用1000 u超滤膜和500 u纳滤膜两步法进行分离,肌肽和鹅肌肽的透过率较高,经氨基酸分析,组氨酸二肽含量约60%(w/w)。
综上,鸡胸肉中既含有较高的肌肽含量同时又具有低廉的经济价值,是获得组氨酸二肽的理想原料。采用绞碎-搅拌方法提取二肽,能够最大程度的提取二肽,同时减少其他多肽和氨基酸引入。粗提液经两步膜分离后,二肽含量约60%。
[1]Boldyrev A A,Severin S E. The histidine-containing dipeptides,carnosine and anserine:distribution,properties and biological significance[J]. Advances in Enzyme Regulation,1990,30(90):175-188.
[2]Smith E C B. The buffering of muscle in rigor;protein,phosphate and carnosine[J]. The Journal of Physiology,1938,92(3):336-343.
[3]Yanase K,Funaguchi N,Iihara H, et al. Prevention of radiation esophagitis by polaprezinc(zinc L-carnosine)in patients with non-small cell lung cancer who received chemoradiotherapy
[J]. International Journal of Clinical and Experimental Medicine,2015,8(9):16215-16222.
[4]Manhiani P S,Northcutt J K,Han I,et al. Antioxidant activity of carnosine extracted from various poultry tissues[J]. Poultry Science,2013,92(2):444-453.
[5]Song B C,Namseok J,Aldini G,et al. Biological functions of histidine-dipeptides and metabolic syndrome[J]. Nutrition Research & Practice,2014,8(1):3-10.
[6]Yeum K J,Orioli M,Regazzoni L. Profiling histidine dipeptides in plasma and urine after ingesting beef,chicken or chicken broth in humans[J]. Amino Acids,2010,38(3):847-858.
[7]Grover R P,Rakhra K S. Pes anserine bursitis-an extra-articular manifestation of gout.[J]. Bulletin of the Nyu Hospital for Joint Diseases,2010,68(1):46-50.
[8]Herculano B,Tamura M,Ohba A,et al.β-alanyl-L-histidine rescues cognitive deficits caused by feeding a high fat diet in a transgenic mouse model of Alzheimer’s disease.[J]. Journal of Alzheimers Disease Jad,2013,33(4):983-997.
[9]Sale C,Artioli G G,Gualano B,et al. Carnosine:from exercise performance to health[J]. Amino Acids,2013,44(6):1477-1491.
[10]Mora L,Sentandreu M A,Toldrá F. Hydrophilic chromatographic determination of carnosine,anserine,balenine,creatine,and creatinine[J]. Journal of Agricultural and Food Chemistry,2007,55(12):4664-4669.
[11]邢子鑫,何一航,朱秋劲. 牛肉预煮液中肌肽含量的检测[J]. 食品科学,2008,29(9):515-517.
[12]Nabetani H,Hagiwara S, Yanai N,et al. Purification and concentration of antioxidative dipeptides obtained from chicken extract and their Application as Functional Food[J]. Journal of Food and Drug Analysis,2012,20(1):179-183.
[13]Mark D,Roger CH. High-performance liquid chromatographic determination of imidazole dipeptides,histidine,1-methylhistidine and 3-methylhistidine in equine and camel muscle and individual muscle fibres[J]. Journal of Chromatography B,1997,688(1):47-55.
[14]朱丽娟,熊幼翎,唐学燕,等. 玉米醇溶蛋白抗氧化肽耐消化性研究[J]. 食品工业科技,2008(12):61-64.
[15]Mano T,Senju T. Distribution of carnosine in several species of fish and shellfish[J]. Journal of the Japanese Society of Food and Nutrition,1969,22(3):164-167.
Factors affecting the extraction of carnosine/anserine from chicken breast
ZHU Jun-ying,ZHAO Li-ming*,JIANG Li-hua,QIU Yong-jun,XIA Quan-ming
(State Key Laboratory of Bioreactor Engineering,R&D Center of Separation and Extraction Technology in Fermentation Industry,East China University of Science and Technology,Shanghai 200237,China)
To explore the extraction process of carnosine and anserine from natural materials which has low-value and optimize the extraction conditions,high-pressure liquid chromatography with OPA as reagent were used in this study. Carnosine and anserine concentration of seven kinds of materials in the market,extracting approach,the ratio of material to solvent and the membrane treatment were investigated. The results showed the chicken breast had a high concentration of histidine-containing dipeptides(21.58 μmol/g),including the seven kinds of materials in market. The chopping,homogenates,stirring,ultrasonic,boiling and enzymatic hydrolysis method were employed to extract carnosine and anserine. Homogenate/stirring method was the best way to extract carnosine and anserine,and with lower other peptides or proteins. After sequential treatment of ultrafiltration(1000 u)and nanofiltration(500 u),the content of carnosine and anserine was 60%(w/w)in extraction samples which assayed by the amino acid analysis. Our research provides the basic technique for utilizing the low-valued materials.
carnosine;anserine;separation;chicken breast
2016-06-03
朱俊颖(1991-),女,硕士研究生,研究方向:食品加工技术,E-mail:juju2_2@163.com。
赵黎明(1977-),男,博士,教授,研究方向:食品加工技术,E-mail:zhaoliming@ecust.edu.cn。
国家高技术研究发展计划“863”课题(2014AA021005)。
TS251.1
B
1002-0306(2016)17-0215-05
10.13386/j.issn1002-0306.2016.17.034
