芽孢杆菌对番茄抗枯萎病防御性酶活性的诱导效应
2016-10-29王改兰
张 亮,王改兰
(湖南农业大学资源环境学院,湖南 长沙 410128)
尖孢镰刀菌所致的番茄枯萎病是一种严重威胁番茄产量和品质的土传性病害[1]。目前应用根围促生细菌等有益微生物来控制作物病害的发生已经成为生物防治领域的热点[2-3]。以过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)等为代表的相关植物防御性酶在植物抵抗病虫害的生理生化过程中起着非常重要的作用。PPO能够催化植物体内酚类物质形成醌从而抑制病原菌生长,并能抑制病原菌果胶分解酶和纤维素分解酶的活性[4]。SOD能够清除植物体内活性氧和H2O2[5]。苯丙氨酸解氨酶(PAL)参与抗病有关的次生代谢与其催化反应[6]。植物经诱导所分泌的几丁质酶和葡聚糖酶能够降解病原菌细胞,从而抵御病原菌的侵染[7]。通过研究植物相关防御性酶活性的变化来了解植物获得系统性抗性和诱导系统抗性已成为研究微生物-植物互作机理的重要共识途径[8]。大量研究结果表明,芽孢杆菌和假单胞菌等生防菌株可以诱导寄主植物通过改变细胞组织结构、提高病程蛋白、产生防御性酶等作用机制来获得寄主植株自身的系统性抗性,从而起到抵御病原菌侵染的作用[9-11]。多粘芽孢杆菌SR10和解淀粉芽孢杆菌SR22筛选分离于健康大豆植株,具有对尖孢镰刀菌等病原菌良好的室内抑菌能力和番茄枯萎病防病效果[12]。本研究采用菌株SR10、SR22诱导番茄抗枯萎病菌的盆栽试验,测定了POD、PPO等7类重要防御性酶的早期活性变化,揭示了2株芽孢菌对番茄寄主系统性防御机制的诱导激活性能,明确并完善了其生防机制。
1 材料和方法
1.1 试验材料
1.1.1 供试菌种
多粘芽孢杆菌SR10和解淀粉芽孢杆菌SR22由笔者分离于田间土壤种植的大豆根内。病原菌为尖孢镰刀菌番茄专化型(Fusarium oxysporum f.sp. radicis lycopersic,Forl)。
1.1.2 供试培养基
细菌培养采取NBY培养基(营养肉汤粉8 g,酵母提取物2 g、磷酸氢二钾2 g、磷酸二氢钾0.5 g、葡萄糖2.5 g、1 mol/L七水硫酸镁1 mL、去离子水1 L)。真菌培养采用PDA配方培养基(SIGMA公司)。
1.2 试验方法
采用温室盆栽法。番茄品种为Bonny Best。土壤为碱性砂土(3.6%有机质,pH 8.0),采自15~20 cm土层小麦耕作层。选取长势相同的4叶1心番茄幼苗作为供试植株。感病土壤配制采用拌种法[13],即将病原菌接种于PDB液体培养基于24 ℃、180 r/min振荡培养120 h后,经双层灭菌纱布过滤,用无菌水稀释至1×106CFU/mL,与供试土壤按1∶10体积质量比混合制备而成。生防菌接种采用超细灭菌泥炭裹根法[14],即诱导前1 d,将经24 ℃、180 r/min振荡培养48 h的生防菌离心,经生理盐水重新悬浮(1×109CFU/mL),与辐照灭菌泥炭按1∶10体积质量比制备成生防泥炭(1×108CFU/mL)。诱导时,取3 g生防泥炭均匀包裹于番茄幼苗根部,并移栽至感病土壤中。
1.2.1 试验设计
试验共设计6个处理,分别为:阴性对照,接种清水(CK);阳性对照,接种番茄枯萎病菌(Forl);单独接种生防菌SR10(SR10);接种生防菌SR10与病原菌(SR10+Forl);单独接种生防菌SR22(SR22);接种生防菌SR22与病原菌(SR22+Forl)。每个处理设置3次重复,每个重复8盆,每盆(直径10 cm)添加500 g感病土壤并移栽1株番茄。按上述方法接种芽孢杆菌诱导剂并移栽后,分别于第0、24、48、72、96、120、144 h时,随机对每个处理选取3盆,采集倒数第2片番茄叶子并立即置于液氮中,于-80 ℃低温保存供防御性酶测定。日常管理25 d后收获并调查统计各处理的病情指数。
病情指数采用3级分类统计[15],0级为无症状;1级为根尖部位轻度褐色;2级为维管组织中度褐变,但没超过土壤基线;3级为土壤基线以上维管组织重度褐变或植株枯萎死亡。其计算公式为:病情指数=∑(病情等级×发病株数÷(总植株数×最高病情等级)×100。防治效果=(对照病情指数-处理病情指数)÷对照病情指数×100%。
1.2.2 粗酶液的提取
称取2 g番茄叶片,加入2 mL的0.05 mol/L磷酸缓冲液(pH为6.8)以及少许石英砂,冰浴研磨后于4 ℃、15 000 r/min离心20 min,取上层清液即为粗酶液,保存于4 ℃并于24 h内使用[16]。粗酶液蛋白含量使用ND-1000核酸蛋白浓度检测仪(美国NanoDrop公司)测定。
1.2.3 多酚氧化酶(PPO)活性测定
4.4 mL的反应体系中含有3 mL的50 µmol/L磷酸缓冲液(pH 7.8)、1 mL的0.1 mol/L邻苯二酚以及400 µL粗酶液。加入粗酶液启动反应,室温条件下测定10 min内在490 nm下吸光值读数的变化。以每分钟吸光值增加0.01作为一个酶活性单位U,酶的比活以U/mg蛋白表示[17]。
1.2.4 过氧化物酶(POD)活性测定
3.195 mL反应体系中含有3 mL的0.05 mol/L磷酸缓冲液(7.8)、15 µL愈创木酚、30 µL的15% H2O2以及150 µL粗酶液。加入粗酶液启动反应,室温条件下测定30 s内在470 nm下吸光值的变化。以每分钟增加0.01作为1个单位的酶活性单位U,酶的比活以U/µg蛋白表示[18]。
1.2.5 超氧化物歧化酶(SOD)活性测定
4.3 mL的反应体系中含有3 mL的0.05 mol/L磷酸缓冲液(pH 7.8)、300 µL 26 mmol/L蛋氨酸、300 µL 0.75 µmol/L NBT、300 µL 22 µmol/L维生素B2以及 400 µL粗酶液。25 ℃、4 000 lx 光照强度下反应15 min后置于黑暗条件下5 min结束反应,并在560 nm下测定其吸光值。以抑制NBT还原50%的酶量作为一个单位的酶活性单位U,酶的比活以U/mg蛋白表示[19]。
1.2.6 苯丙氨酸解氨酶(PAL)活性测定
5 mL的反应体系中含有3.9 mL的0.01 mol/L磷酸缓冲液(pH 8.8)、1 mL的0.6 mmol/L苯丙氨酸以及100 µL粗酶液,以未添加苯丙氨酸的反应液作为对照。加入粗酶液启动反应,室温条件下测定30 min内在290 nm下吸光值的差值。以每小时增加0.01作为1个单位的酶活性单位U,酶的比活以U/µg蛋白表示[20]。
1.2.7 β-1,3葡萄糖酶活性测定
将62.5 µL的4%海带多糖与62.5 µL粗酶液混匀并置于37 ℃条件下静置30 min,然后加入1 mL的DNS试剂终止反应并迅速放入沸水浴中加热显色5 min,流水冷水至室温后于500 nm下测定吸光度值,以沸水浴10 min失活的酶液为标准对照,以吸光度差值(样品液A值减去标准对照A值)从葡萄糖标准曲线求出产生的葡萄糖量。相同反应下以加入0~20 mg/mL葡萄糖替代粗酶液来配制标准曲线。以37 ℃条件下每克新鲜组织每分钟催化昆布多糖所产生1 µg葡萄糖的酶量作为一个酶活单位U,酶的比活以U/mg蛋白表示[21]。
1.2.8 几丁质酶活性测定
将混有1 mL的0.05 mol/L磷酸缓冲液(pH 5.0)、200 µL的4%胶状几丁质溶液以及200 µL粗酶液于37 ℃下静置30 min,然后放入沸水浴中2 min并终止反应,随后于12 000 r/min 离心1 min。吸取1 mL上清液并加入2 mL铁氰化钾溶液并置于沸水浴中15 min,流水冷却至室温后于420 nm下测定吸光值。相同反应下以加入不同浓度的乙酰氨基葡萄糖取代粗酶液来配制标准曲线。以37 ℃条件下水解几丁质每小时降低1 µmol/L糖的酶量作为一个酶活单位U,酶的比活以U/mg蛋白表示[22]。
1.3 数据处理与分析
试验均设3次重复。数据经Excel 2010统计分析,并采用SAS 9.1进行方差分析,显著性水平采用Duncan’s新复极差法分析。
2 结果与分析
2.1 接种菌株SR10和SR22后番茄对枯萎病的抗病效果
盆栽试验结果表明(表1),接种芽孢杆菌25 d后,与单接病原菌处理相比,Forl+SR10和Forl+SR22对番茄枯萎病具有显著的防治效果,并对植株生长具有一定的促进作用,其防治效果分别为41.11%和51.11%,株高分别增加了114%和115%,鲜质量分别提高了453%和447%,干质量分别提高了178%和189%。
2.2 菌株SR10和SR22诱导番茄防御性酶活性变化分析
2.2.1 菌株SR10和SR22诱导番茄PPO酶活性变化
图1表明,与对照相比,接种病原菌或芽孢杆菌后,PPO酶活性持续性升高,单接种病原菌的处理在96 h达到最高,此时的PPO酶活性比对照增加了28%;单接芽孢杆菌处理的PPO酶活性则至120 h达到最高,此时其PPO酶活性比对照增加了39%~44%。与单接病原菌处理相比,同时接种芽孢杆菌和病原菌的处理(Forl+SR10和Forl+SR22)在120 h时出现PPO酶活峰值,此时其PPO酶活性比单接病原菌处理分别增加了9%和13%。
2.2.2 菌株SR10和SR22诱导番茄POD酶活性变化
从图2可以看出,与对照相比,接种病原菌或芽孢杆菌24 h后,POD酶活性持续性升高;单接芽孢杆菌处理均在96 h达到酶活峰值,此时其POD酶活性比对照增加了31%和47%;单接病原菌处理的POD酶活性则在120 h达到峰值,此时其酶活性比对照增加了39%。与单独接种病原菌相比,接种芽孢杆菌与病原菌的处理的酶活变化差异不明显,但表现不同,其中Forl+SR10处理在120 h峰值时的POD酶活性比单接病原菌处理升高了4%;而Forl+SR20处理的POD酶活峰值则出现在144 h,且此峰值POD酶活性比单接病原菌处理降低了2%。
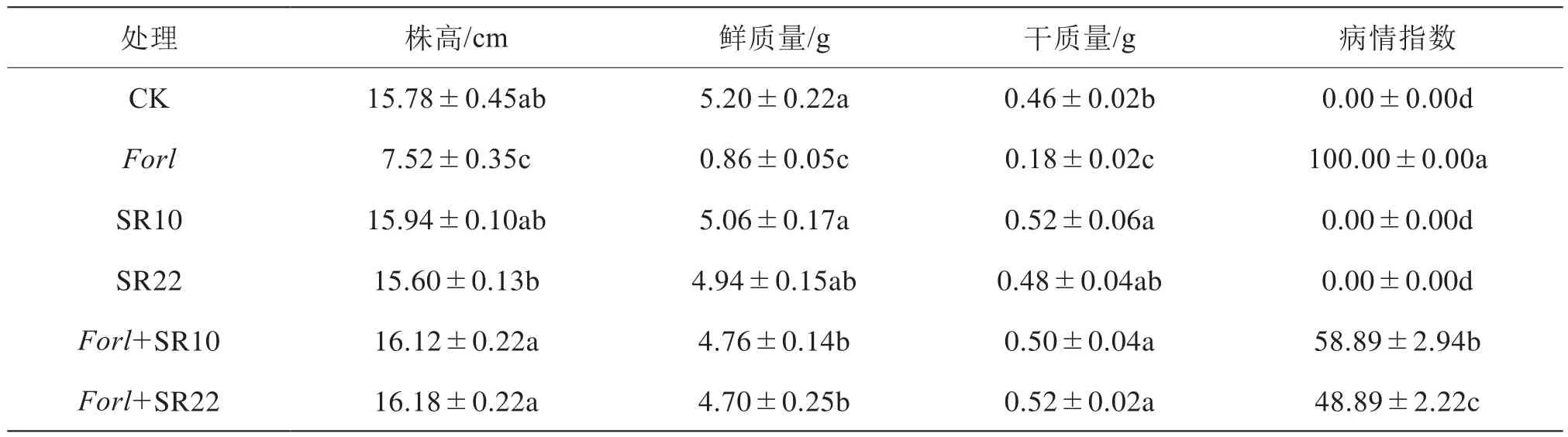
表1 芽孢杆菌SR10、SR22对温室番茄生长及枯萎病病情指数的影响

图1 芽孢杆菌SR10、SR22诱导番茄PPO酶活性变化
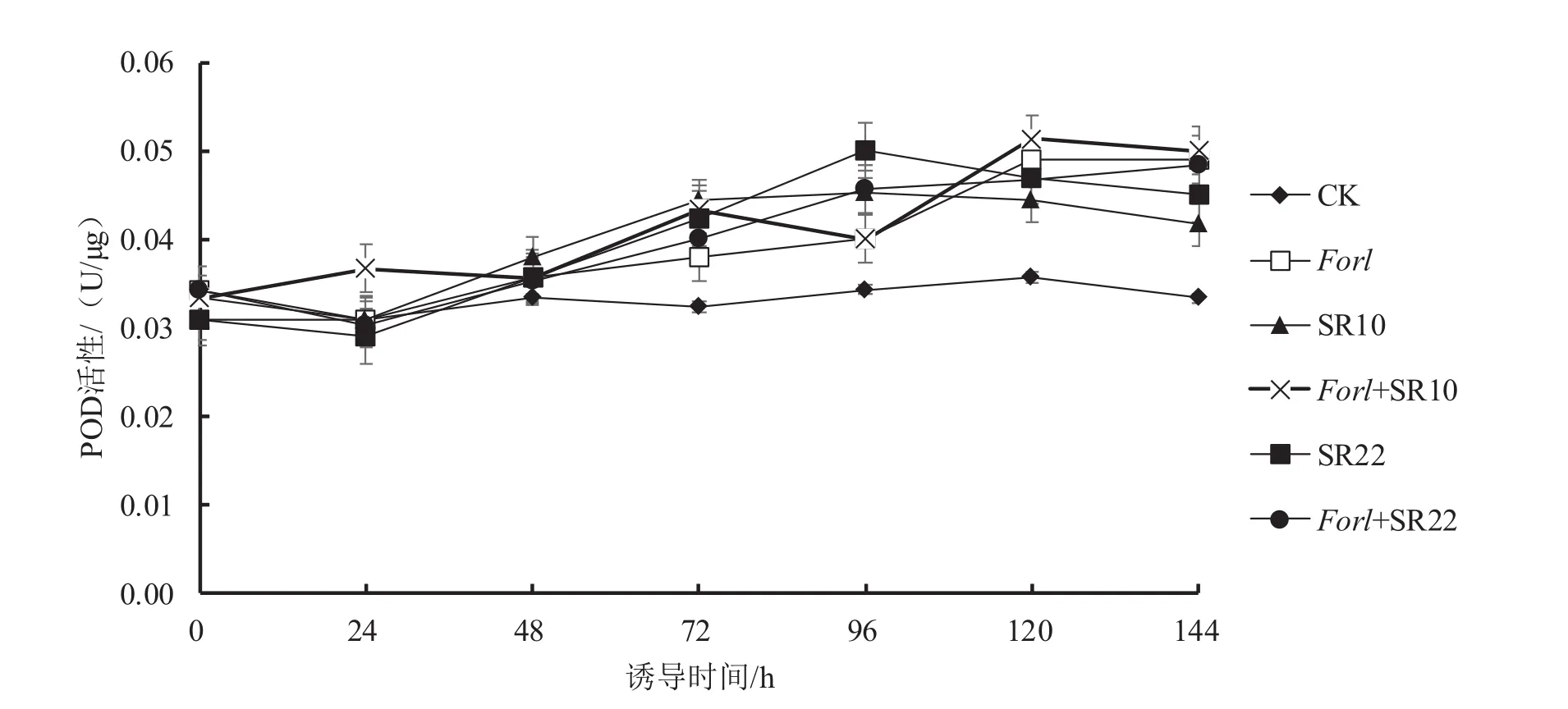
图2 芽孢杆菌SR10、SR22诱导番茄POD酶活性变化
2.2.3 菌株SR10和SR22诱导番茄SOD酶活性变化
从图3可以看出,与对照相比,接种病原菌或芽孢杆菌后,SOD酶活性均持续升高;单接病原菌处理的SOD酶活性在96 h时达到最高,此时其SOD酶活性比对照增加了53%;单接芽孢杆菌处理的SOD酶活性分别在96 h(SR10)和72 h(SR22)时达到最高,其峰值时的酶活性比对照分别增加了82%和100%。与单接病原菌相比,接种芽孢杆菌和病原菌的处理的SOD酶活变化差异明显,其峰值SOD酶活性分别比单接病原菌处理增加了38%(Forl+SR10,96 h)和27%(Forl+SR20,72 h)。
2.2.4 菌株SR10和SR22诱导番茄PAL酶活性变化
从图4可以看出,与对照相比,盆栽24 h后,接种病原菌或芽孢杆菌处理的PAL酶持续升高,并分别于96、120 h达到最高,其峰值时的PAL酶活性比对照增加了11%~41%;单接病原菌处理在96 h达到最高,此时其PAL活性比对照增加了11%;单接芽孢杆菌处理(SR22和SR10)在120 h达到最高,此时其PAL活性分别比对照增加了27%和29%。与单接病原菌相比,接种芽孢杆菌和病原菌的处理(Forl+SR10和Forl+SR22)均表现出PAL酶活性显著提高,其峰值PAL酶活性分别比单接病原菌处理增加了23%(96 h)和27%(120 h)。
2.2.5 菌株SR10和SR22诱导番茄β-1,3葡聚糖酶活性变化
从图5可以看出,与对照相比,接种病原菌和芽孢杆菌处理的葡聚糖酶活性总体持续增加,并在120 h内达到最高;单接病原菌处理的葡聚糖酶活性在120 h时达到最高,比对照增加了14%;单接芽孢杆菌处理的葡聚糖酶峰值则分别在96 h(SR22)、120 h(SR10)达到最高,其葡聚糖酶活性分别比对照增加74%和31%。与单接病原菌相比,接种芽孢杆菌和病原菌处理的葡聚糖酶活性得到明显提高,Forl+SR10和Forl+SR20最高葡聚糖酶活性分别比单接病原菌处理增加15%和26%,且Forl+SR22处理显著高于Forl+SR10菌株处理。
2.2.6 菌株SR10和SR22诱导番茄几丁质酶活性变化
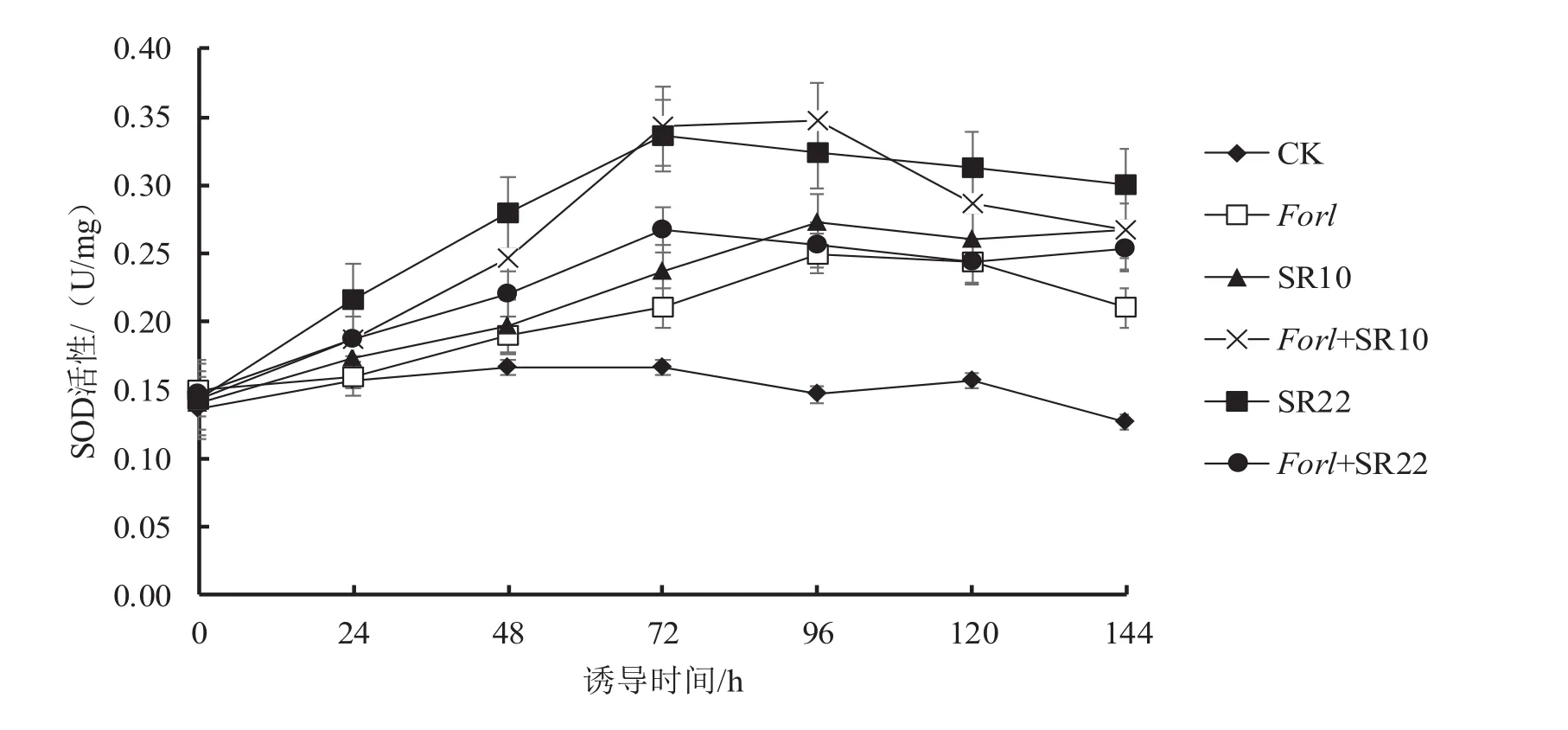
图3 芽孢杆菌SR10、SR22诱导番茄SOD酶活性变化
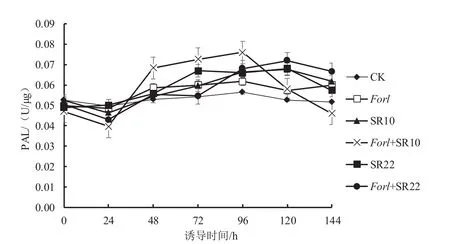
图4 芽孢杆菌SR10、SR22诱导番茄PAL酶活性变化
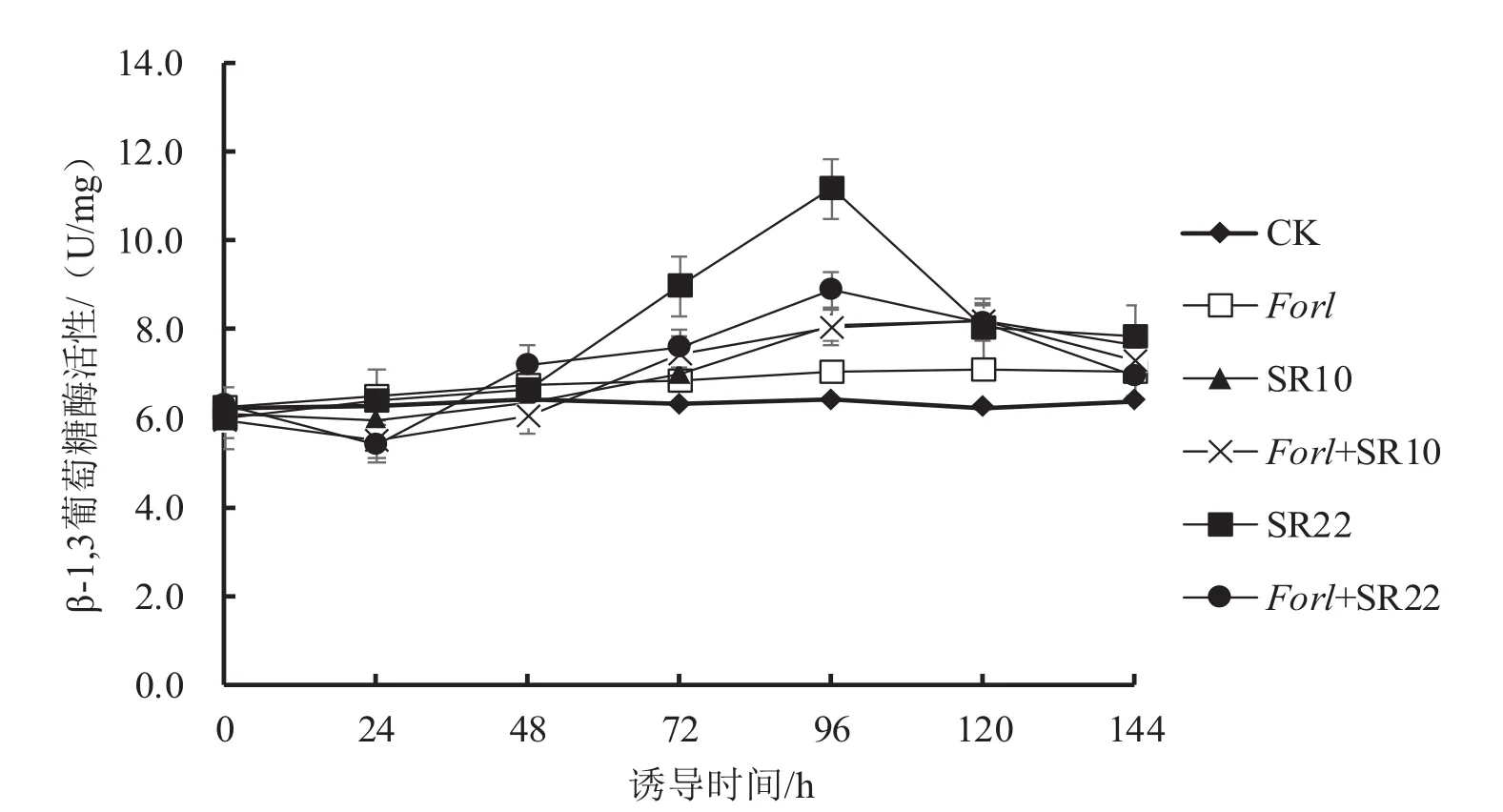
图5 芽孢杆菌SR10、SR22诱导番茄β-1,3葡萄糖酶活性变化
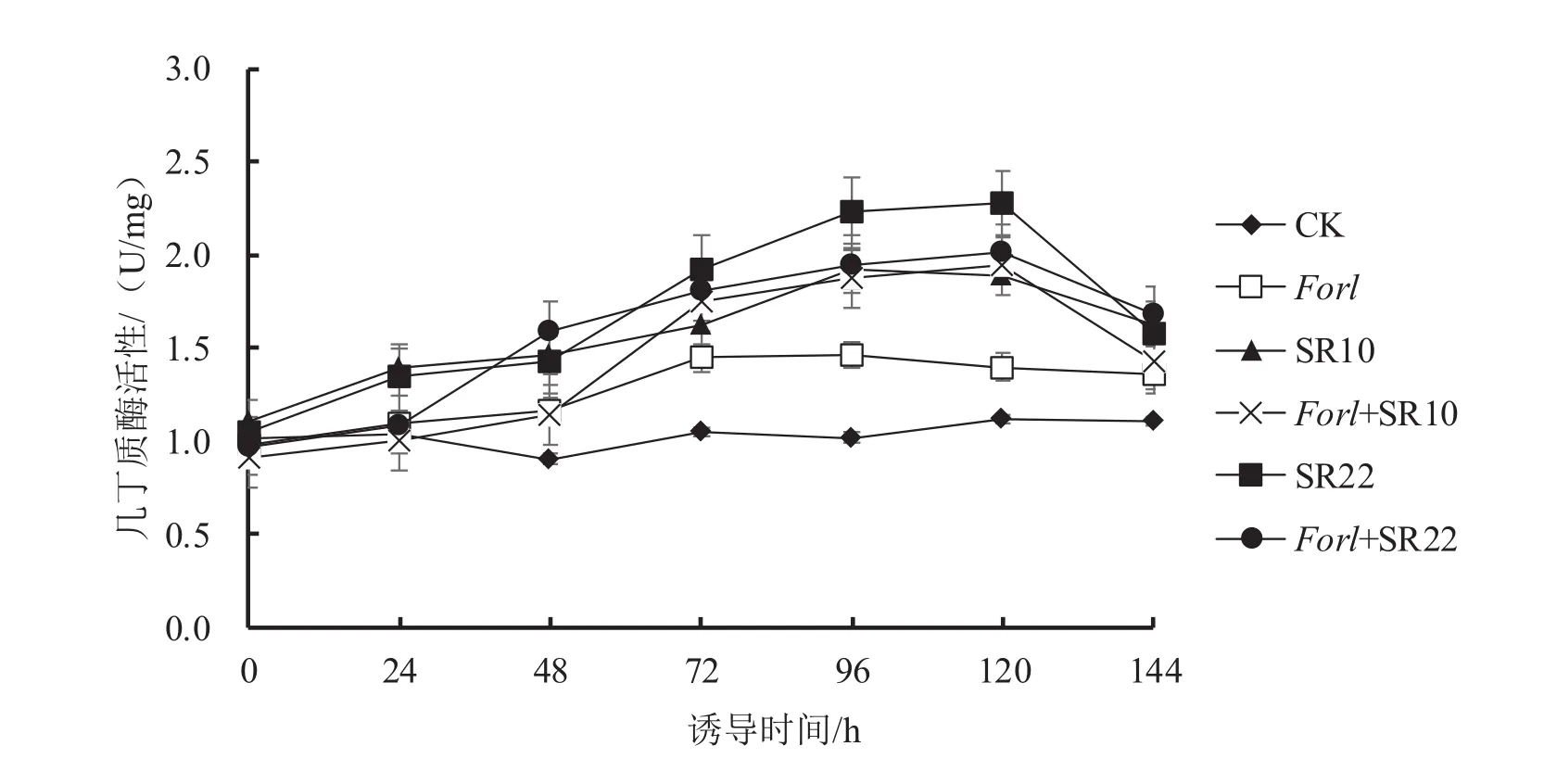
图6 芽孢杆菌SR10、SR22诱导番茄几丁质酶活性变化
从图6可以看出,与对照相比,接种病原菌或芽孢杆菌后,各处理的几丁质酶活性均持续增加,并在120 h内达到最高,其中单接病原菌处理的几丁质酶活性在96 h达到最高,比对照增加了43%;单接芽孢杆菌处理的几丁质酶活性分别在96 h(SR10)和120 h(SR22)内达到最高,比对照分别增加了88%和103%。与单接病原菌相比,接种芽孢杆菌和病原菌的处理(Forl+SR10和Forl+SR22)的几丁质酶活性在短时间内得到显著提高,并在120 h时表现出最高酶活性,分别比单接病原菌处理增加了39%和44%。
3 讨论与结论
由病原菌所诱导的系统获得性抗性(SAR)和由非致病菌所介导的诱导系统抗性(ISR)是植物抵御病菌侵染的重要机制[23-24]。通过诱导植物防御性酶、PR蛋白以及植保素的积累等生理生化变化来抵御病原菌的侵害是根围促生菌和有益内生菌等生防微生物非常重要的作用机制之一[25-26]。例如,Sun等[27]研究发现接种芽孢杆菌KY-21能够诱导香蕉体内POD、PPO酶活性快速增加,从而对尖孢镰刀菌引起的枯萎病起到抑制效果。Liu等[28]报导接种芽孢杆菌SY1能够诱导茄子体内SOD活性显著提高103.2%。Chen等[29]发现接种芽孢杆菌B579能够诱导黄瓜PLA酶活性显著增强并抑制枯萎病的发生。Hyakumachi等[30]研究发现,苏云金芽孢杆菌(Bacillus thuringiensis)能够诱导番茄植株几丁质酶和葡聚糖酶基因表达并降低青枯病的发生。虽然目前关于芽孢杆菌诱导番茄系统性抗性的研究较多,但通过芽孢杆菌诱导番茄产生系统性抗性来防治Forl型番茄枯萎病的报道并不多见。
本研究采用根部包裹接种法对多粘芽孢杆菌SR10和解淀粉芽孢杆菌SR22诱导番茄系统性抗性(ISR)以及病原菌Forl诱导番茄系统获得性抗性(SAR)的相关防御性酶活性变化进行了研究,试验结果表明,受病原菌对番茄SAR诱导效应的影响,单独接种Forl能够在短时间内增加番茄PPO、POD等防御性酶活性,即系统获得性抗性(SAR)得到了提高;而单独接种多粘芽孢杆菌或解淀粉芽孢杆菌亦表现出短时间内迅速提高番茄PPO、POD、SOD、PAL、葡萄糖酶以及几丁质酶等相关防御性酶活性的能力,即诱导番茄产生系统性抗性(ISR),这些研究结果验证了前人有关植物诱导抗性的研究结果。本研究供试的多粘芽孢杆菌SR10与解淀粉芽孢杆菌SR22对番茄不同防御性酶活性变化的诱导效果以及峰值时间的影响存在差异,这可能与作为产生诱导因子的生防菌株自身代谢特性有关[21]。试验第25天时的枯萎病防治效果统计结果显示,同时接种病原菌和多粘芽孢杆菌SR10与解淀粉芽孢杆菌SR22的番茄植株枯萎病防治效果分别达到41.11%和51.11%,这很可能与病原菌胁迫条件下芽孢杆菌的诱导抗性有关,即受SAR与ISR的共同作用影响,番茄相关防御性酶活性得到显著增强,从而提高了番茄抵御枯萎病病原菌侵染的能力。
研究揭示了多粘芽孢杆菌SR10和解淀粉芽孢杆菌SR22通过诱导并提高番茄系统性抗性来抑制Forl型番茄枯萎病病原菌侵染的生理学特性,进一步论证和完善了2株芽孢杆菌抑制Forl型尖孢镰刀菌侵染、防治番茄枯萎病的作用机制,为后续生防工作提供了必要的理论基础。
