正交设计优选皂矾洗剂的水提工艺
2016-10-29任桂林明俊男杨文信杨春艳蒲清荣
陈 珂,黄 锐,任桂林,赵 剑,明俊男,杨文信,杨春艳,蒲清荣
(1.四川省泸州市食品药品检验所,四川泸州646000;2.西南医科大学附属中医医院,四川泸州646000)
正交设计优选皂矾洗剂的水提工艺
陈珂1,黄锐2,任桂林2,赵剑2,明俊男2,杨文信2,杨春艳2,蒲清荣2
(1.四川省泸州市食品药品检验所,四川泸州646000;2.西南医科大学附属中医医院,四川泸州646000)
目的优选皂矾洗剂的提取工艺。方法以苦参碱为指标,对加水量、浸泡时间、提取时间、提取次数4个影响因素进行考察,采用正交试验法优选皂矾洗剂的提取工艺。结果皂矾洗剂的最佳水提工艺是,按处方比例称取药材,加入10倍量水,浸泡1.5 h,提取3次,每次1 h。结论优选的水提工艺简单可行,稳定可靠,具可操作性和重复性。
皂矾洗剂;水提工艺;正交设计;苦参碱
皂矾洗剂来源于西南医科大学附属中医医院皮肤科杨文信教授的多年临床经验总结,由苦参Radix Sophorae Flavescentis、皂角Gleditsia Sinensis、白矾Alum等7味中药组成,可杀菌止痒、清热燥湿,可用于脂溢性皮炎,或其他可能引起油脂分泌异常的疾病,如银屑病、湿疹、头癣等的辅助治疗,且具有一定的抑菌功能[1]。苦参中含苦参碱,具有抗菌作用[2-3]。因此本试验中选用苦参碱作为指标成分,采用正交试验法对皂矾洗剂的提取工艺进行了筛选。
1 仪器与试药
1.1仪器
LC-20AT型高效液相色谱仪(日本岛津);AUW120D型电子天平(日本岛津);JP型全数字超声波发生器(武汉嘉鹏电子有限公司);DB211型电热鼓风干燥箱(成都电烘箱厂);BO-200T型多功能粉碎机(永康铂欧五金厂); HH型数显电热恒温水浴箱(江苏国胜实验仪器厂)。
1.2试药
苦参碱对照品(批号为110805-200508),购自中国食品药品检定研究院;甲醇,乙腈(色谱纯),水为哇哈哈纯净水,其余试剂均为分析纯;处方中药材均购自泸州百草堂中药饮片有限公司,经西南医科大学附属中医医院赵剑主任中药师鉴定,均符合2015版《中国药典(一部)》相关项下规定。
2 方法与结果
2.1正交试验设计及因素水平
取苦参、皂角、白矾等7味中药,采用加水煎煮法提取有效成分,以加水量(因素A)、浸泡时间(因素B)、提取时间(因素C)、提取次数(因素D)为因素,采用正交试验法安排试验,以干浸膏收率、提取物中有效成分苦参碱相对含量作为评价指标,优选皂矾洗剂的最佳水提取工艺。因素水平见表1。按处方比例称取适量药材9份,每份275 g,按表1中9种工艺条件组合加水提取,提取液浓缩成稠浸膏,备用。

表1 L9(34)正交试验因素水平表
2.2干浸膏收率测定
取2.1项下得到的稠浸膏,置已烘干至恒重的蒸发皿中,水浴蒸干,于80℃烘至恒重,计算干浸膏收率[(干浸膏重/总药材重)×100%]。
2.3苦参碱含量测定
2.3.1色谱条件及系统适用性试验
色谱柱:Inertsil ODS-SP C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.05 mol/L磷酸二氢钾溶液(15∶85,用三乙胺调节pH为6.5),二元高压梯度;流速:1 mL/min;柱温:40℃;检测波长:205 nm;进样量: 10 μL。理论板数按苦参碱峰计算应不低于4 000[4-6]。在此条件下的色谱图见图1。
2.3.2溶液制备
精密称取减压干燥至恒重的苦参碱对照品适量,置20 mL容量瓶中,用适量蒸馏水溶解后,再用流动相稀释得苦参碱质量浓度为0.575 g/L的对照品贮备液。

图1 高效液相色谱图
精密吸取对照品贮备液4.0 mL至10 mL容量瓶中,以流动相定容至刻度,摇匀,经0.45 μm微孔滤膜滤过,即得对照品溶液。
分别取2.2项下干浸膏,研细,精密称取0.2 g,置100 mL锥形瓶中,超声提取2次,每次加氯仿20 mL,1 mL氨水,每次30 min,滤过,合并提取液,蒸干,用流动相溶解并定容至10 mL,摇匀,经0.45 μm微孔滤膜滤过,即得供试品溶液。
按处方比例,称取苦参以外的中药材适量,模拟水提工艺制成不含苦参的阴性对照样品,按供试品制备方法制备不含苦参药材的阴性对照品溶液。
2.3.3方法学考察
线性关系考察:取2.3.2项下对照品贮备液0.4,0.8,1.0,2.0,4.0 mL分别置10 mL棕色容量瓶中,流动相定容至刻度,摇匀,取10 μL注入液相色谱仪,按拟定色谱条件进行试验,记录峰面积。以苦参碱峰面积积分值(Y)为纵坐标、进样质量浓度(X,g/L)为横坐标绘制标准曲线,得苦参碱的回归方程为Y=8 421X-273.613,R2=0.999 6(n=5)。结果表明苦参碱进样质量浓度在0.023~0.23 mg/mL与峰面积积分值呈良好的线性关系。
精密度试验:取2.3.2项下同一对照品溶液10 μL,按拟订色谱条件测定,连续进样6次。结果苦参碱峰面积的RSD为0.52%(n=6),表明仪器精密度良好。
稳定性试验:取同一供试品溶液,分别于0,1,2,4,6,8,12 h时进样10 μL注入液相色谱仪,测定苦参碱峰面积。结果的RSD为1.21%(n=7),表明供试品溶液在12 h内基本稳定。
重复性试验:取同一样品制备的供试品溶液6份,按2.3.1项下色谱条件测定苦参碱面积,结果的RSD为1.51%(n=6),表明方法的重复性良好。
加样回收试验:取2.1项下已知含量的正交试验5号的供试品溶液,加入2.3.2项下苦参碱对照品溶液1 mL,按拟订色谱条件进行测定,计算加样回收率。结果见表2。
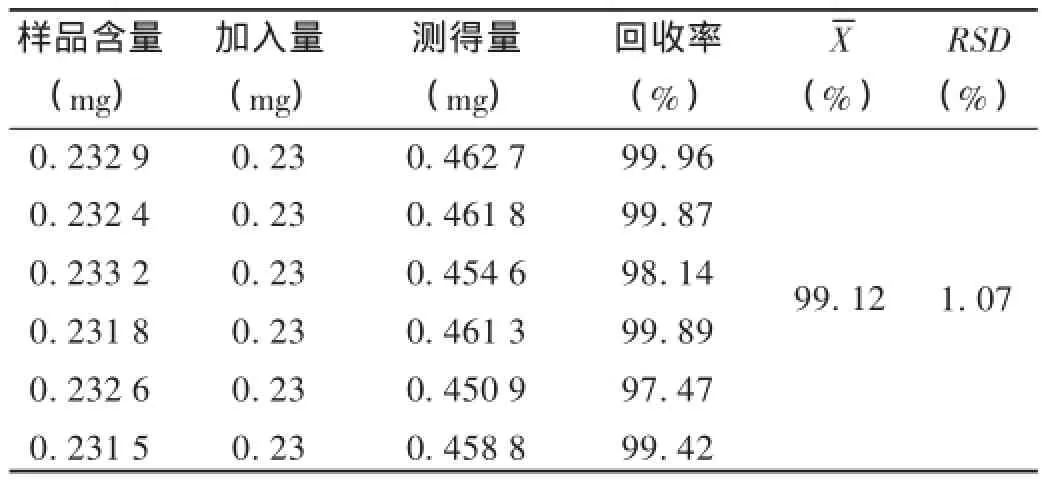
表2 苦参碱加样回收试验结果(n=6)
2.4正交试验结果及方差分析
取2.1项下9份稠浸膏,按2.3.2项下方法制备供试品溶液,按拟订色谱条件进行测定,结果见表3,方差分析结果见表4。由方差分析结果可知,因素C提取时间对于指标具有显著影响。经直观分析,因素影响大小的顺序为提取时间>提取次数>加水量>浸泡时间。综合考虑,得优化处方条件为A3B3C2D3,即皂矾洗剂原药材加入10倍量水,浸泡1.5 h,提取1 h,共提取3次。
2.5工艺验证
精密称取3份处方中所含的药材,照上述确定的最佳工艺条件制成皂矾洗剂,烘成干浸膏,再按2.3.2项下方法制备供试品溶液,按拟定色谱条件进行测定。结果3批样品浸膏收率平均值为14.85%,RSD为0.48%;所含苦参碱的平均含量为11.84 mg/g,RSD为1.35%。结果表明,该优选工艺稳定可行。
3 讨论
预试验曾考察药材粗细度、吸水率、加水量、浸泡时间、煎煮时间、提取次数对苦参碱相对含量的影响[7-9],最终选取对提取效果相对影响较大的4个因素(加水量、浸泡时间、提取时间、提取次数)作为本试验的考察因素。结果表明,L9(34)正交试验所优选的水提工艺稳定可行。

表3 L9(34)正交试验结果

表4 方差分析结果表
皂矾洗剂以苦参为君药,水提工艺以苦参碱作为质量控制指标。苦参碱含量测定方法参考了2015年版《中国药典(一部)》苦参药材的液相色谱条件[10]及0.05mol/L磷酸二氢铵水溶液(H3PO4调节pH为2.5)-甲醇-乙腈-高氯酸钠(900 mL∶20 mL∶80 mL∶6 g)[11-12],结果分离效果不好且峰形不对称,后改用以乙腈-0.05 mol/L磷酸二氢钾溶液(用三乙胺调节pH为6.5)流动相并分别以不同比例测定,确定以乙腈-0.05 mol/L磷酸二氢钾溶液(15∶85,用三乙胺调节pH为6.5)为流动相时能较好地将苦参碱分离。参考文献[13-15],考察了C18色谱柱和氨基色谱柱下苦参碱的色谱峰形、分离度,发现采用适宜的流动相比例均可达到苦参碱分离度的要求;C18色谱柱下无法检测出氧化苦参碱,有待于进一步验证。C18色谱柱较氨基色谱柱耐用,氨基色谱柱维护保养较复杂,故本试验采用C18色谱柱,这有别于药典中采用氨基柱来测定苦参碱相对含量,可作为高效液相色谱法测定苦参碱的一种方法参考。
本试验中以苦参碱相对含量为指标,通过正交试验法优选水提工艺,简单可行,稳定可靠,具可操作性和重复性,可为大规模生产提供理论依据。
综上所述,苦参中苦参碱可作为提取工艺的筛选指标,有利于提高该洗剂的质量标准。所建立的HPLC法快速、准确、灵敏度高,可作为皂矾洗剂生产过程中的质量控制方法。
[1]杨文信,胡祥宇,赵福兰,等.一种中药组合物及其制备方法和用途:CN201510230911.8[P].2015-05-07.
[2]斯琴塔娜,金亮.苦参的研究进展[J].北方药学,2015,12(8): 85-87.
[3]王航,孟春,石贤爱,等.抗菌中草药的筛选及其有效成分的分离提取和初步鉴定[J].中国药业,2006,15(20):15-16.
[4]高云,郑祝华.HPLC法测定复方参花搽剂中苦参碱的含量[J].药学研究,2014,33(9):519-521.
[5]杨帆,陆娟,刘春明,等.快速溶剂萃取提取山豆根中苦参碱和氧化苦参碱最佳条件研究[J].中国药学杂志,2012,47(7):495-499.
[6]张超,韩丽,张芳.星点设计—效应面法优化苦参方的醇提工艺[J].现代中药研究与实践,2015,29(1):52-54.
[7]师忠,陈霞,盛国荣.祛疣洗剂提取工艺优选的试验研究[J].中国药业,2008,17(23):38-39.
[8]王琴.苦参清热洗液[J].海峡药学,2014,26(10):14-15.
[9]付起凤,曹琦,吕邵娃.正交法优化苦参中苦参生物碱的超声提取工艺[J].中医药信息,2015,32(1):11-13.
[10]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:202.
[11]尚柏,孙英华,张媛.RP-HPLC法测定苦参碱中苦参碱、氧化槐果碱和氧化苦参碱[J].中草药,2005,36(12):1813.
[12]刘彦民,刘战宏,刘敬欣.康妇灵胶囊中苦参碱含量测定的研究[J].陕西中医学院学报,2008,31(4):87-88.
[13]谭安军.高效液相色谱法测定止痒消炎水中苦参碱含量[J].中国药业,2015,24(13):26-28.
[14]周世玉,周晓英,唐婧坤.高效液相色谱法测定苦参片中苦参碱含量[J].药物鉴定,2011,20(7):27-28.
[15]邸敏.正交设计优选苦参微波提取工艺[J].中国药业,2013,22(17):38-39.
Optimization of Water-Extraction Technology of Melanterite Lotion by Orthogonal Design
Chen Ke1,Huang Rui2,Ren Guilin2,Zhao Jian2,Ming Junnan2,Yang Wenxin2,Yang Chunyan2,Pu Qingrong2
(1.Luzhou Institute For Drug Control,Luzhou,Sichuan,China 646000;2.The Affiliated TCM Hospital of Southwest Medical University,Luzhou,Sichuan,China646000)
ObjectiveTo optimize the preparation technology of melanterite lotion.MethodsThe contents of matrine was taken as the indexes,the factors of the amount of water,time of soaking and extraction,and extraction times were investigated.Orthogonal design was used to optimize the prepartion technology for extrating melanterite lotion.ResultsThe optimal preparation technology was as follows:adding 10 folds of water,soaking for 1.5 h,extracting 3 times,1 h/time.ConclusionThe optimized preparation technology for melanterite lotion is reasonable,feasible,stable,reliable and has good reproducibility.
melanterite lotion;water-extraction technology;orthogonal design;matrine
TQ461;R286.0
A
1006-4931(2016)13-0037-03
陈珂(1970-),女,大学本科,副主任药师,研究方向为药物分析,(电话)0830-3162253(电子信箱)365369747@qq.com;蒲清荣,大学本科,主任药师,研究方向为中药制剂,本文通讯作者,(电话)0830-3162253(电子信箱)365369747@qq.com。
2016-02-10;
2016-03-20)
