不同骨密度人群外周血单核细胞的基因表达谱分析
2016-10-27赵和平蒋文艳王冀邯于燕
赵和平,蒋文艳,王冀邯,于燕
(西安交通大学医学院附属红会医院检验科,陕西 西安 710054)
不同骨密度人群外周血单核细胞的基因表达谱分析
赵和平,蒋文艳,王冀邯*,于燕*
(西安交通大学医学院附属红会医院检验科,陕西 西安710054)
目的探讨不同骨密度人群外周血单核细胞基因表达谱的变化。方法运用R语言对公共数据平台NCBI下的基因芯片数据集GSE7158进行差异基因表达分析、DAVID(the database for annotation,visualization and integrated discovery)注释工具对差异基因进行功能注释、Medcalc统计软件进行受试者工作特征(receiver operator characteristic,ROC)曲线分析。结果与高骨密度组相比,低骨密度组外周血单核细胞中61个基因表达改变(倍数大于1.5,P<0.05),且多数基因呈上调模式。表达差异基因分别参与了71个生物学过程(biological process,BP)条目、4个细胞组分(cellular component,CC)条目、6个分子功能(molecular function,MF)条目以及1个KEGG通路。基因CXCL10、IFI44L、IGKV4-1作为生物标志物鉴别两组样本具有较好的特异性、敏感度及准确性,且CXCL10&IGKV4-1基因联合检测能够增加鉴别诊断的准确性。结论运用高通量组学与相关数据库结合有助于全面的解析病理状态下生物样本中的组学改变,为后续骨质疏松症研究提供系统的分子学机制基础。
骨质疏松;骨密度;基因表达谱;功能注释;受试者工作特征
骨质疏松症是一种威胁人类健康的全球性疾病,以骨质量下降伴随低创伤性骨折风险增加为主要特征[1]。破骨细胞数量增多及骨吸收活性增强促进了骨质疏松症的发病与进展。单核细胞为破骨细胞的前体,能够在合适微环境下分化成为破骨细胞,且分泌肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等多种破骨细胞因子,直接影响了骨质代谢,因此也常被视为骨质疏松症研究的靶细胞[2-3]。本研究以公共数据库NCBI中的数据信息为基础,分析了不同骨密度人群单核细胞基因的表达模式变化及差异表达基因所参与的生物学功能,并且分析了差异表达显著基因在不同骨密度人群中鉴别诊断的应用价值,为探讨骨质疏松症相关的细胞学机制奠定了基础。
1 资料与方法
1.1数据来源下载公共数据库NCBI-GEO DataSets-GSE7158数据集,该数据集为26 例外周血单核细胞基因表达谱芯片。在此研究中,研究者招募了878 例健康中国女性(年龄分布在20~45 岁,平均年龄27.3 岁),检测个体的峰值骨量(peak bone mass,PBM)。依据峰值骨量的Z-分数对人群进行分布,在前100位峰值骨量的人群中选取14 例作为高骨密度个体,在后100位峰值骨量人群中选取12 例作为低密度个体。提取所筛选26 例个体的单核细胞总核糖核酸(ribonucleic acid,RNA)进行后续芯片实验,所用芯片为昂飞公司产品,芯片类型:Affymetrix Human Genome U133 Plus 2.0 Array。
1.2筛选差异表达基因经公众数据平台下载芯片实验的原始数据,运用R语言进行数据分析[4]。具体步骤包括:采用affy包的鲁棒多芯片平均法(robust multichip average,RMA)方法对芯片原始数据进行背景校正和标准化处理;运用R/Bioconductor中的limma包选取差异表达基因[5],判定差异倍数(fold change,FC)大于1.5,P<0.05为差异有统计学意义;运用R/Bioconductor中的pheatmap包对差异表达基因进行双聚类分析。
1.3基因的功能注释对选取的差异表达基因进行功能注释,所用注释工具为DAVID(the database for annotation,visualization and integrated discovery)[6]。具体步骤为:在网站首页“upload”标签下提交差异基因列表,接着选取输入基因列表的ID类型,最后确定所提交列表的类型并选取物种进入分析。对基因本体论(gene ontology,GO)和通路Pathways模块进行功能注释,选取GO以及KEGG中P<0.05条目为功能显著性条目。
1.4受试者工作特征(receiver operator characteristic,ROC)曲线分析运用MedCalc 15.2.2统计分析工具进行ROC曲线分析,以基因在各样本中的表达值为数据信息,评估其在不同骨密度组中鉴别诊断的应用效果。采用多元逻辑回归分析多基因联合检测对两组样本的鉴别效果。分别获取特异性、敏感度及曲线下面积(area under curve,AUC)等指标进行统计分析。
2 结 果
2.1芯片数据质量检测研究首先对公共数据平台NCBI-GEO DataSets中的GSE7158数据集进行初步质量检测,结果:数据集中一张芯片(高骨密度1)的原始信号强度图,提示灰度较均匀(见图1a);数据集所有样本总RNA的降解曲线图,曲线斜率较小,提示样本总RNA降解较少(见图1b);原始数据经RMA方法标准化后信号强度分布图,可见经标准化后所有的曲线重合度高(见图1c);RMA标准化处理后的箱线图,可见各样本的中值十分接近(见图1d)。以上质量控制分析结果提示所选芯片数据可用,能够进行下一步的基因差异表达分析。
2.2差异表达基因分析运用R/Bioconductor中的Limma包对低骨密度组和高骨密度组的探针数据进行差异分析,将差异倍数大于1.5,P<0.05的基因定义为差异基因。结果显示,与高骨密度组相比,低骨密度组中存在着61个差异基因,其中52个基因在低密度组中呈高表达,9个基因呈低表达。差异表达基因进行的双聚类分析结果(见图2)。
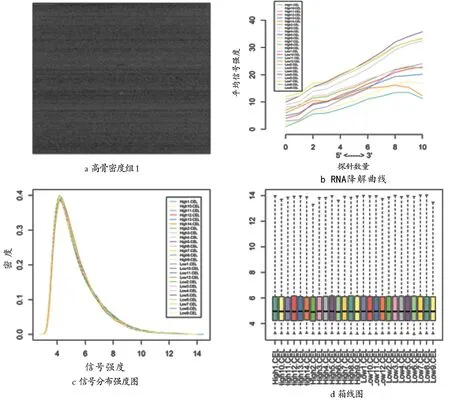
图1 芯片数据的质量检测结果
2.3差异表达基因的功能注释运用DAVID对差异基因进行功能注释,结果显示:差异基因共参与了71个生物学过程(biological process,BP)条目、4个细胞组分(cellular component,CC)条目、6个分子功能(molecular function,MF)条目以及1个KEGG通路,其中有显著性(P<0.05)的分别为58个BP条目、3个CC条目、4个MF条目以及0个KEGG通路。表1总结了前五位显著性强的BP条目、有显著性的CC条目、有显著性的MF条目以及1个KEGG通路(见表1)。
2.4ROC曲线分析为了判断基因表达水平对两组不同骨密度群体的鉴别效果,我们筛选出倍数改变显著的基因对其进行了ROC分析。差异基因结果显示,共有5个基因在两组中的差异倍数FC>2,分别为IFI44L、CXCL10、STAT1、IGKV4-1、SOCS3。ROC分析结果表明,基因IFI44L、CXCL10、IGKV4-1作为生物标志物鉴别两组样本的ROC曲线下面积在0.7以上,具有较好的鉴别准确性;进一步运用二元回归得到基因联合检测的回归方程,表达式为:Y=1/[1+e13.1024-3.00976(CXCL10)+1.0674(IGKV4-1)],运用CXCL10+IGKV4-1联合检测能够增强鉴别诊断的准确性,曲线下面积达0.9以上,结果见图3及表2所示。
3 讨 论
随着人口老龄化日趋发展,骨质疏松己成为日益严重的全球性问题。骨密度作为骨质疏松的风险因子,是研究骨质疏松疾病机制的主要替代表型。单核细胞是与骨代谢密切相关的细胞,分析不同骨密度群体单核细胞基因表达谱的改变,有助于系统的探索单核细胞对骨代谢的影响机制。对疾病相关基因进行高通量数据分析也是当下医学研究的大趋势[7]。本研究收录了公共数据平台NCBI中高骨密度与低骨密度人群外周血单核细胞的基因芯片数据集(GSE7158),对两组基因表达进行了差异分析及功能注释,并进一步检测了差异表达显著基因在两组群体鉴别诊断中的应用价值。分析显示,与高骨密度组相比,低骨密度组外周血单核细胞基因表达谱发生改变,且大多数基因表达活跃(52/61)。差异基因所参与的生物学过程主要涉及对细胞凋亡及细胞死亡的调控;主要参与了胞外区细胞组分的组成;分子功能包含了抗原结合、酶的调节/抑制活动。差异基因参与了趋化因子信号通路。

注:横坐标为样本名称,Low为低骨密度,High为高骨密度;纵坐标为差异基因名称

类型 条 目 名 称P 值 基 因BPimmuneresponse1.95E-08IL1RN,RSAD2,SERPING1,IFI44L,IGHM,CXCL10,IGHD,FCGR1B,IGKV4-1,RNF19B,XCL1,THBS1,IFI6,IGLV3-21,GBP1anti-apoptosis5.05E-05SERPINB9,SOCS3,BCL2A1,NRG1,THBS1,IFI6,SOD2negativeregulationofapoptosis1.32E-04SERPINB9,CDKN1A,SOCS3,BCL2A1,NRG1,THBS1,IFI6,SOD2negativeregulationofprogrammedcelldeath1.44E-04SERPINB9,CDKN1A,SOCS3,BCL2A1,NRG1,THBS1,IFI6,SOD2negativeregulationofcelldeath1.46E-04SERPINB9,CDKN1A,SOCS3,BCL2A1,NRG1,THBS1,IFI6,SOD2CCextracellularspace0.00LGALS3BP,ADM,IL1RN,SERPING1,XCL1,NRG1,THBS1,CX-CL10extracellularregion0.00IL1RN,SERPING1,IGHM,CXCL10,SIGLEC1,LGALS3BP,ADM,IGLV2-23,IGHD,IGKV4-1,NRG1,XCL1,THBS1,IGLV3-21extracellularregionpart0.02LGALS3BP,ADM,IL1RN,SERPING1,XCL1,NRG1,THBS1,CX-CL10MFantigenbinding6.22E-04IGHD,IGKV4-1,IGHM,IGLV3-21proteinkinaseregulatoractivity0.00CDKN1A,SOCS3,NRG1,CXCL10kinaseregulatoractivity0.00CDKN1A,SOCS3,NRG1,CXCL10enzymeinhibitoractivity0.05SERPINB9,CDKN1A,SOCS3,SERPING1KEGGChemokinesignalingpathway0.09XCL1,STAT1,CXCL10

图3 不同基因的ROC曲线
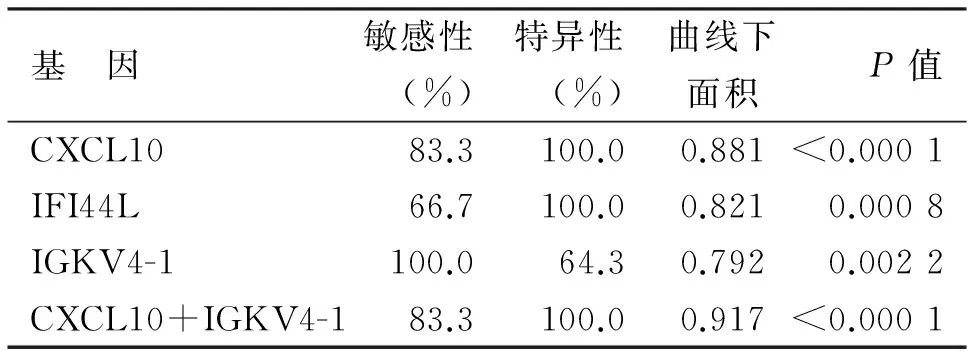
基 因敏感性(%)特异性(%)曲线下面积P值CXCL1083.3100.00.881<0.0001IFI44L66.7100.00.8210.0008IGKV4-1100.064.30.7920.0022CXCL10+IGKV4-183.3100.00.917<0.0001
ROC分析提示基因CXCL10、IFI44L、IGKV4-1的表达水平有助于鉴别低骨密度组与高骨密度组人群,且CXCL10+IGKV4-1联合检测能够提高鉴别诊断的准确性,ROC曲线下面积在0.9以上。CXCL10是一种趋化因子,属于CXC类非ELR亚族。CXCL10主要介导Th型炎症反应,能够趋化单核细胞,参与多种疾病的免疫调控。国外研究显示,CXCL10具有促进破骨细胞分化和溶骨性骨转移作用,内源性CXCL10是形成溶骨性骨转移的关键因子[8-9]。本研究也显示低骨密度人群外周血单核细胞中CXCL10呈高表达。与此类似,IFI44L在低骨密度人群中表达升高。干扰素诱导蛋白44(interferon-inducible-protein 44,IFI44)是IFN-α的诱导基因之一,其主要参与了自身免疫性疾病、IFNα/介导的抗病毒过程、某些炎症反应等过程[10]。与CXCL10及IFI44L相反,IGKV4-1在低骨密度人群中呈低表达。目前,IFI44L、IGKV4-1与骨质代谢之间的相关性尚无文献报道,有待进一步研究。
综上所述,该研究在全基因层面分析不同骨密度人群外周血单核细胞的基因改变,进一步发现运用基因表达值作为检测指标能够较好的将两组人群鉴别开来,且基因联合检测可提高鉴别的准确性,为骨质疏松症的研究提供理论依据。
[1]孟迅吾.原发性骨质疏松症的危险因素和风险评估[J].诊断学理论与实践,2012,11(1):1-4.
[2]许娟,陈丽.破骨细胞相关受体研究进展[J].中国骨质疏松杂志,2014,20(4):457-460.
[3]陈晓虎,孙瑜隆,骞爱荣,等.破骨细胞的形成和活化研究进展[J].中国细胞生物学学报,2014,36(2):1-9.
[4]Du L,Qian X,Dai C,etal.Screening the molecular targets of ovarian cancer based on bioinformatics analysis[J].Tumori,2015,101(4):384-389.
[5]Chen L,Zhuo D,Chen J,etal.Screening feature genes of lung carcinoma with DNA microarray analysis[J].Int J Clin Exp Med,2015,8(8):12161-12171.
[6]Jiang CM,Wang XH,Shu J,etal.Analysis of differentially expressed genes based on microarray data of glioma[J].Int J Clin Exp Med,2015,8(10):17321-17332.
[7]许建婷,金浩范,王冀邯,等.基于分子互作网络的MMPs相关基因在胃癌组织中的表达研究[J].中国实验诊断学,2015,19(1):56-59.
[8]Lee JH,Kim HN,Kim KO,etal.CXCL10 promotes osteolytic bone metastasis by enhancing cancer outgrowth and osteoclastogenesis[J].Cancer Res,2012,72(13):3175-3186.
[9]Kwak HB,Ha H,Kim HN,etal.Reciprocal cross-talk between RANKL and interferon-gamma-inducible protein 10 is responsible for bone-erosive experimental arthritis[J].Arthritis Rheum,2008,58(5):1332-1342.
[10]李彬彬,郑燕,郏雁飞,等.IFI44的研究现状[J].山东科学,2008(3):32-37.
Gene Expression Analysis of PBMC in Different BMD Groups
Zhao Heping,Jiang Wenyan,Wang Jihan,etal
(Clinical Laboratory of Honghui Hospital,Xi′an Jiaotong University College of Medicine,Xi′an710054,China)
ObjectiveTo explore gene expression profile of peripheral blood mononuclear cells(PBMC) in different bone mineral density(BMD) groups.MethodsWe performed R language to analyze the gene expression profile based onGSE7158 dataset from NCBI;DAVID online tools was utilized for gene functional annotation;Medcalc statistical software was used for ROC evaluation.Results61 genes were dysregulated and most of them were up-regulated in low BMD compared with high BMD group.The differentiate expressed genes involved in 71 GO-BP,4 GO-CC,6 GO-MF terms and 1 KEGG Pathway.CXCL10,IFI44L,IGKV4-1 were good markers for differential diagnoses between the two groups,and combination examination of CXCL10 &IGKV4-1 was better for ROC evaluation.ConclusionHigh-throughput dataset and bioinformatics tools is help for genomic analysis under different pathological conditions,which will provide more comprehensive molecular mechanisms for further osteoporosis study.
osteoporosis;bone mineral density;expression profile;functional annotation;receiver operator characteristic
1008-5572(2016)09-0810-04
西安市红会医院科研基金资助课题;*本文通讯作者:王冀邯,于燕
R580
A
2016-04-26
赵和平(1967- ),男,副主任技师,西安交通大学医学院附属红会医院检验科,710054。
