无籽刺梨多倍体诱导试验初报
2016-10-26辛亚龙唐军荣尹丽莎韩国伟辛培尧
李 斌 林 源 辛亚龙 唐军荣 尹丽莎 韩国伟 辛培尧
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;3. 大理农林职业技术学院,云南 大理 671003)
无籽刺梨多倍体诱导试验初报
李斌1,2林源3辛亚龙1唐军荣1,2尹丽莎1,2韩国伟1,2辛培尧1,2
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;3. 大理农林职业技术学院,云南 大理 671003)
采用育种技术对无籽刺梨进行多倍体诱导,以期获得无籽刺梨多倍体植株。以秋水仙素作为诱导剂,二倍体组培苗为材料,比较不同的预培养时间、处理时间及秋水仙素浓度对无籽刺梨染色体加倍的诱导效果。结果表明:无籽刺梨茎段在分化培养基上预培养1 d后,继而用含300 mg/L秋水仙素溶液浸泡处理12 h,再进行分化培养的诱导效果最佳,其诱导变异率达25.6%;无籽刺梨多倍性植株同质化培养的最佳次数为6次。对变异植株根尖细胞进行染色体计数后发现,部分变异植株的根尖细胞染色体为2n=4x=28,为四倍体。部分植株同时存在2n=2x=14和2n=4x=28两种倍性细胞,为嵌合体。
无籽刺梨;多倍体诱导;浸泡处理;染色体数;组织培养
无籽刺梨 (Rosasterilis) 是蔷薇科 (Rosaceae) 蔷薇属 (Rosa) 的多年生攀援小灌木,为中国特有种,是刺梨 (R.roxbunghii) 的近缘种[1]。其野生资源主要分布在贵州安顺市北部和贵阳市南部,近年来多地大量进行引种种植[2]。无籽刺梨具有较高的药用保健、观光、生态保护和经济价值。与普通刺梨相比,无籽刺梨无籽或有1~2粒籽,单宁含量较少,糖含量更高,肉厚且果味香甜,无明显涩味,鲜果售卖更有优势。其无籽的特性,可以减少加工成本[3]。但是,无籽刺梨果实营养成分VC、VE和SOD含量比刺梨少[4-5],果径比刺梨小,可食用部分也较少[6],在一定程度上极大影响了这一特色植物的生产利用价值。因此,利用现代生物技术选育果实大,营养成分含量高的无籽刺梨,成为其产业开发,提高无籽刺梨经济价值的当务之急。而在诸多的植物育种手段中,倍性育种所选育的多倍体品种能显著增加果实体积及营养成分含量[7]。因此,对无籽刺梨进行多倍体育种,选育较高倍性的无籽刺梨,无疑是解决上述问题的有效方法之一。无籽刺梨品种改良,仅见韦景枫等[8]对其进行了单株选优方面的研究,而在倍性育种方面未见报道。本研究以无籽刺梨幼嫩茎段为材料,利用先浸泡处理,再离体培养的方法[9],进行无籽刺梨多倍体的诱导,并对变异材料的倍性进行鉴定和分析。研究结果可为无籽刺梨多倍体育种提供参考依据。
1 材料与方法
1.1试验材料
试验材料选用西南林业大学生物多样性保育重点实验室所建立的无籽刺梨无菌苗。
1.2试验方法
1.2.1材料的诱导处理
将无菌苗茎段去除叶片和顶端后,截成长1 cm左右,每段至少保留1个叶腋,转入培养基MS+0.5 mg/L 6-BA中预培养,预培养时间分别为0、1、2、3 d,预培养结束后进行光照培养。光培养期间,先将预培养后的茎段分别浸泡于含不同浓度 (200、300、400、500 mg/L) 秋水仙素的无菌水中,并置于摇床上以120 r/min,25~30 ℃避光震荡,处理时间分别为12、24、48、72 h。对照组的茎段置于无菌水中避光震荡培养处理12、24、48、72 h,方法同上。处理后,将茎段放在超净工作台上,用无菌过滤纸吸尽表面残留液体,再转入MS + 0.5 mg/L 6-BA + 0.15 mg/L NAA (未附加秋水仙素) 的培养基中继续培养。试验不考虑交互作用,采用L16(43) 正交设计进行试验,试验处理共计16组,每组接种10瓶,每瓶接种茎段5枚,重复3次。
1.2.2变异芽的同质化处理
经诱导后,具有多倍性的材料大多为 “嵌合体”, 因此需要对这一类材料进行 “同质化”,以期得到倍性一致、性状稳定的多倍体材料。采用陈杰等[10]提出的方法,挑取生长状况良好、变异明显的材料 (表现为叶片变大变厚,茎段变粗变短) 进行分化培养,剪成0.5~1 cm茎段,平铺于培养基MS + 0.5 mg/L 6-BA + 0.15 mg/L NAA中培养。经过40 d左右的培养,待重新分化出的丛生芽,长势比较一致且能够很好的观察丛生芽性状时,定义为完成1个同质化周期的培养,记为第1次同质化处理,然后继续挑选性状良好、多倍性状突出的丛生芽,重复上述培养过程8次,观察培养不同次数后的分化芽数、死亡芽数及多倍化芽数比率。
1.2.3变异材料的倍性鉴定
当同质化处理的芽长至2~3 cm时,与对照组比较,将变异明显的无籽刺梨芽苗转入1/2MS + 0.1 mg/L 6-BA+0.2 mg/L IBA + 0.3 g/L活性炭的培养基中生根。并采用林源等[11]提出的方法,对变异的无籽刺梨组培苗及二倍体材料根尖染色体数目进行计数,以确定其倍性。
2 结果与分析
2.1不同处理对无籽刺梨多倍体诱导的影响
不同处理条件下无籽刺梨诱导率的方差分析结果表明,各处理诱导率之间存在显著差异,见表1。
由表1可知,未进行预培养的处理中诱导率最低,处理1、4诱导率为0。在相同的预处理时间和相同浓度处理下,随着秋水仙素处理时间的增加,诱导率有下降趋势;在预处理和秋水仙素处理的时间相同时,随着秋水仙素处理浓度的增加,诱导率有上升趋势,但当浓度达到500 mg/L时,诱导率明显降低,最佳的秋水仙素诱导处理浓度为300~400 mg/L。多重比较结果表明,处理6、11、14无籽刺梨多倍体芽的平均诱导率较高,且三者之间无显著差异。其中,处理6、14与处理11相比,秋水仙素用量较少,而处理6中,秋水仙素处理时间较短。因此认为,预培养1 d后,用300 mg/L秋水仙素处理12 h,为诱导无籽刺梨多倍体产生的较佳处理方案,其诱导率为25.6%。
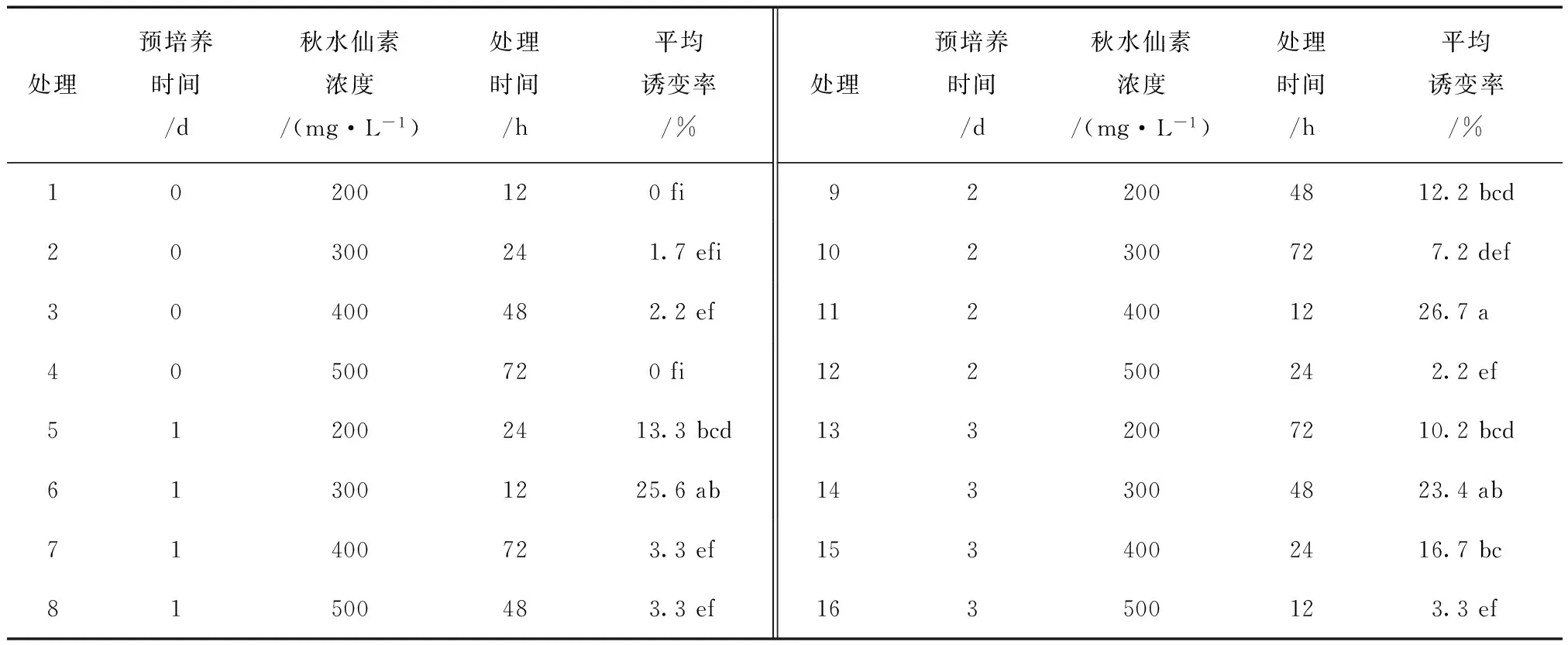
表1 不同处理对无籽刺梨多倍体诱导的影响
注:同列中不同小写字母表示在0.05水平上差异显著。
2.2多倍体丛生芽同质化培养
在嵌合体同质化培养过程中,随着分化培养次数的增加,分化芽数、死亡芽数、多倍体芽数比率等均出现了不同的变化情况,见图1。
由图1可以看出,随着同质化培养次数的增加,多倍化材料比率呈现逐渐上升的趋势,从第1次分化到第5次分化,多倍化材料比率从26%上升到30%,上升趋势平缓。第5次分化以后,多倍化材料比率上升速度明显高于前5次,当分化到第8次时,多倍化材料比率达到了46%;其后随着分化次数的增加,分化芽数出现下降趋势;随着诱导分化次数增加,死亡率从0上升到了15%,在重复分化6次以后死亡比率上升速度明显。因此,无籽刺梨多倍化植株同质化培养的最佳次数为6次。

图1不同同质化次数对多倍体诱导效果的影响
Fig.1Influence on polyploid induction effect in different homogenization frequency
2.3鉴定结果
经多次同质化处理后,对无籽刺梨生根组培苗的根尖细胞染色体数目进行观察。结果表明,无籽刺梨二倍体染色体数目是2n=2x=14 (图2a)。变异植株中,部分材料根尖细胞染色体数目均为28条,可判定为四倍体 (图2b);而部分材料中,既有14条染色体细胞,又有28条染色体细胞,可断定为嵌合体。试验中未发现有三倍体细胞的产生。
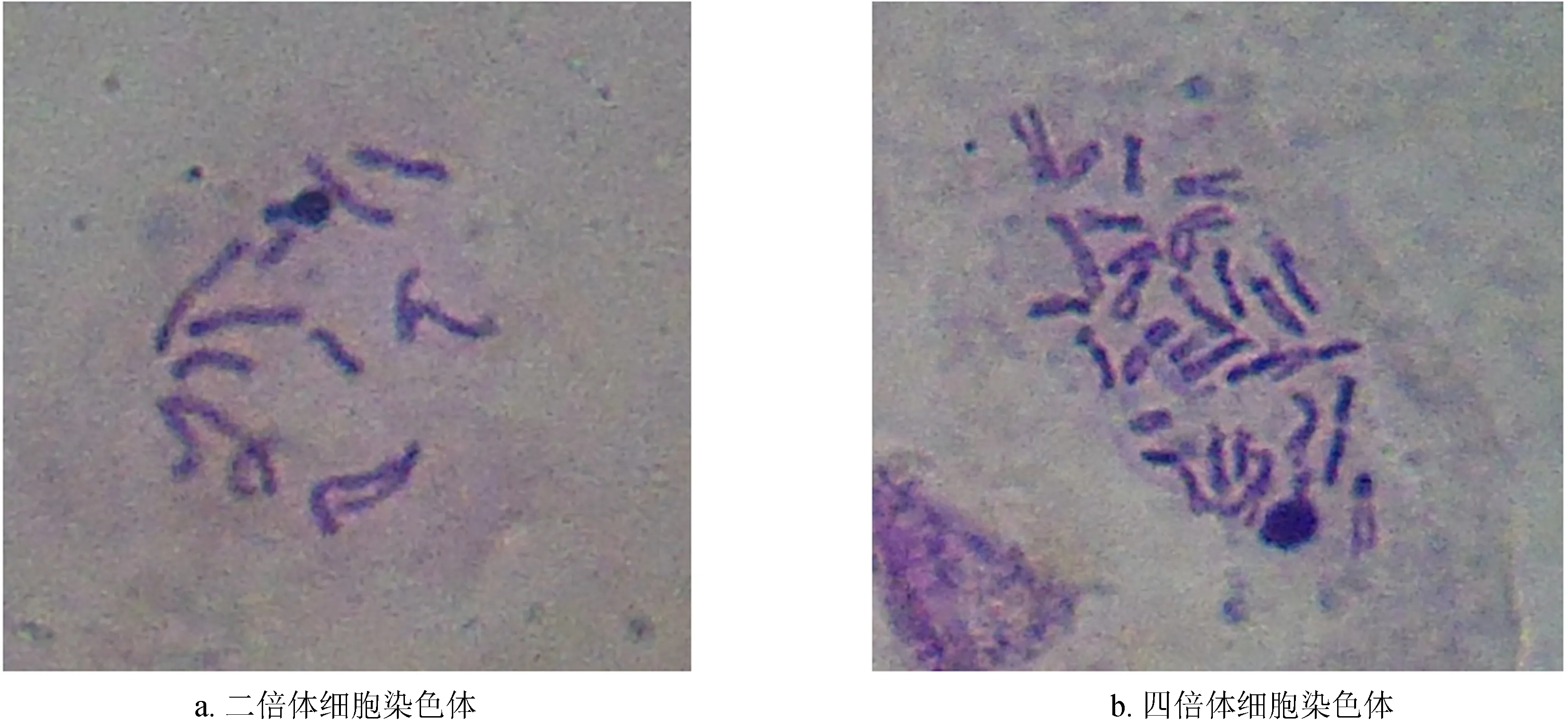
图2 二倍体与四倍体染色体数目差异
3 结论与讨论
试验结果表明:无籽刺梨茎段在分化培养基上预养1 d后,用含300 mg/L秋水仙素处理12 h的诱导效果最佳,其诱导变异率达25.6%;无籽刺梨多倍性植株同质化培养的最佳次数为6次。对变异植株根尖细胞进行染色体计数后发现,根尖细胞染色体为2n=4x=28,为四倍体。部分植株中同时存在2n=2x=14和2n=4x=28两种倍性细胞,为嵌合体。
秋水仙素是多倍体诱导中常用的诱变剂,其浓度、诱导时间和诱导方法是影响多倍体诱导效率的主要因素。由于外植体来源不同,其对秋水仙素的耐受性和敏感性不同[12],因此,须选择不同的秋水仙素浓度、处理时间和处理方法。一般来说,选用的浓度越高,处理时间应较短;浓度越低,处理时间应该相应延长。常用离体条件下诱导植物多倍体的方法有浸渍法和混培法,解谜[13]采用混培法在0.002%秋水仙碱中长时间处理,诱导山葡萄 (Vitisamurensis) 多倍体效果最佳,而用浸泡法在0.2%秋水仙素溶液中浸泡处理6 h诱变率最高。李晓燕[14]认为当处理浓度和时间合适,浸泡法比混培法的诱导效果好。本试验在预试验中也得出浸泡法的诱导效果明显优于混培法,故采用浸泡法对无籽刺梨进行多倍体诱导。但也有学者认为,混培法诱导多倍体产生要优于浸泡法[9,15-16]。因此,选择哪一种诱变方法应建立在多次试验的基础上,结合植物本身的生物特性来决定。
在不同处理组合下,处理6、11与处理14的诱导效果无显著差异,但处理6和14中秋水仙素的用量均小于处理11,而处理6所需时间小于处理11。一般认为,较高浓度秋水仙素处理较长时间,并不利于被诱导材料后期化学毒害的解除与生长恢复。因此,在诱导结果无明显差异的情况下,选择处理6,即先预培养1 d,再在300 mg/L的秋水仙素溶液中处理12 h,作为诱导无籽刺多倍体产生的较佳处理方案。
嵌合体问题是关乎于能否获得性状稳定的多倍体的关键,也是多倍体诱导的难题。在诱变苗形成初期 (15~30 d),变异形态明显,随着幼苗成长,部分变异植株的外部形态与正常二倍体逐渐相似,最终恢复为二倍体植株。由于变异的多倍体细胞,在生长初期,其生活力较弱,比正常二倍体细胞分裂速度慢,倍性嵌合的植株随着生长发育,变异的嵌合体组织会逐渐发生层间取代,最终表现出性状恢复,而使得多倍体诱导失败[7]。试验发现,采用培养基中添加秋水仙素的诱导方法,材料基部形成的愈伤组织致密,呈淡黄色,且部分失去再分化能力,分化能力明显减弱。可见,秋水仙素对愈伤组织的再分化能力有明显抑制或毒害作用。然而,将经过秋水仙素处理的单株苗转至未附加秋水仙素的培养基中培养一段时间后,大部分表现出生长状态和增殖能力明显优于对照的现象,表现为多倍化材料相对于二倍体材料具有生长方面的优势。
随着研究的深入, 试验中出现了一些有待彻底解决的问题。1) 需要找到一种更适宜的诱导剂, 因为秋水仙素属于生化制品, 价格昂贵且对生物体有毒, 与组织培养结合时, 不仅使离体组织受害、抑制不定芽的分化, 而且再生植株生长缓慢, 甚至可能使外植体在继代培养基中褐化死亡;2) 嵌合体现象还不能完全克服, 真正同一倍性的多倍体出现的有效频率不高。鉴于以上存在的问题, 在后期的研究中需找到一种安全高效的诱导剂, 既能保证较高的成活率又能保证较高的诱变率。有学者发现,二硝基苯胺类除草剂与秋水仙碱诱导多倍体的机理一致,并且与植物微管蛋白有着更高的亲和力,在相当浓度下比秋水仙碱诱导效果更佳,且其毒性较小。因此,可作为秋水仙碱的代替品[18]。另外,要进一步研究嵌合体分离的时机和分离技术,提高多倍体同质化效率,得到更多的染色体数目一致的多倍体种质。
[1]韦景枫, 程友忠. 无籽刺梨生物学特性观察[J]. 中国林副特产, 2012(6): 27-29.
[2]任启飞, 陈睿, 周艳. 贵州蔷薇属植物资源及开发利用研究[J]. 种子, 2012, 31(11): 66-69.
[3]林源, 唐军荣, 田斌, 等. 无籽刺梨的研究现状及发展建议[J]. 江苏农业科学, 2014, 42(4): 122-124.
[4]吴洪娥, 金平, 周艳, 等. 刺梨与无籽刺梨的果实特性及其主要营养成分差异[J]. 贵州农业科学, 2014, 42(8): 221-223.
[5]史肖白, 顾姻, 庄一义, 等. 刺梨超氧化物歧化酶含量分析[J]. 中国野生植物资源, 1998, 17(4): 49-50.
[6]季祥彪. 贵州4种刺梨的比较形态解剖学研究[J]. 山地农业生物学报, 1998, 17(1): 28-33.
[7]曹家树, 申书兴. 园艺植物育种学[M]. 北京: 中国农业大学出版社, 2001: 84.
[8]韦景枫, 程友忠, 钟漫, 等. 安顺金刺梨丰产栽培技术初探[J]. 贵州林业科技, 2012, 40(1): 30-32.
[9]谭冠德, 庄南生, 黄华孙. 组织培养与秋水仙碱诱导相结合培育植物多倍体的应用 (综述) [J]. 亚热带植物科学, 2005, 34(1): 77-80.
[10]陈杰, 周军, 孙正海, 等. 组织培养结合秋水仙素诱导滇杨多倍体的研究[J]. 云南农业大学学报, 2013, 28(2): 251-256.
[11]林源, 唐军荣, 张颖, 等. 无籽刺梨染色体制片技术及染色体数目研究[J]. 中国南方果树, 2015, 44(1): 77-78, 82.
[12]王长泉, 张文胜, 李雅志, 等. 苹果叶片离体培养中秋水仙素加倍效应的研究[J]. 果树科学, 1999, 16(2): 104-109.
[13]解谜. 山葡萄多倍体育种技术研究[D]. 长春:吉林农业大学, 2008: 1-44.
[14]李晓燕. 越橘离体培养诱导多倍体研究[D]. 长春: 吉林农业大学, 2006: 1-47.
[15]陈杰. 滇杨多倍体种质的诱导与鉴定[D]. 昆明: 西南林业大学, 2009: 1-65.
[16]刘岩. 滇杨组织培养及其多倍体诱导[D]. 昆明: 西南林业大学, 2010: 1-76.
[17]姜二花. 利用氨磺灵 (Oryzalin) 进行萝卜四倍体种质创新研究[D]. 南京: 南京农业大学, 2010: 2-3.
(责任编辑韩明跃)
Preliminary Report on PolyPloidy Induction ofRosasterilis
Li Bin1,2, Lin Yuan3, Xin Yalong1, Tang Junrong1,2, Yin Lisha1,2, Han Guowei1,2, Xin Peiyao1,2
(1. Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province, Southwest Forestry University, Kunming Yunnan 650224,China; 2. Key Laboratory of Biodiversity Conservation in Southwest Region of State Forestry Administration, Kunming Yunnan 650224,China; 3. Dali Vocational and Technical College of Agriculture and Forestry, Dali Yunnan 671003,China)
The polyploidy breeding technology was used to induceRosasterilispolyploidy, for the obtaining ofR.sterilispolyploidy plants. The colchicine was used as induction dose, diploid cuvette seedling ofR.sterilisas material, to compare induction effect on chromosome doubling in different preculture time, different colchicine concentration and different treatment time. The results showed that after preculture in differentiation medium for 1 d, and soaking in 300 mg/L colchicine solution for 12 h, then differentiation culture in differentiation medium, the induction effect was better, and the mutation rate was 25.6%. The best culture frequency of homogenization was 6. After observing the chromosome number in root-tip of mutation plants, it was found that chromosome number in some tetraploid plants cells was 2n=4x=28,while cells with both 2n=2x=14 and 2n=4x=28 in some chimera plants.
Rosasterilis, polyploid induction, soaking treatment, choromosome number, tissue culture
10. 11929/j. issn. 2095-1914. 2016. 05. 005
2016-04-15
云南省林学一级学科博士点建设项目;西南林业大学云南省高校林木遗传改良与繁育重点实验室开放基金项目;云南省省院省校教育合作咨询共建重点学科项目 (211015) 资助。
辛培尧 (1975—),男,博士,副教授。研究方向:林木遗传育种与繁育。Email: xpytgyx@163.com。
S718.46
A
2095-1914(2016)05-0027-05
第1作者:李斌 (1988—),男,硕士生。研究方向:林木遗传育种与繁育。Email: 445118715@qq.com。
