黏着连接分子A在非小细胞肺癌组织中的表达及其临床意义
2016-10-26邱雪杉
张 珉 黄 波 邱雪杉
(沈阳医学院基础医学院病理教研室,辽宁 沈阳 110034)
黏着连接分子A在非小细胞肺癌组织中的表达及其临床意义
张珉 黄波1邱雪杉2
(沈阳医学院基础医学院病理教研室,辽宁沈阳110034)
目的探讨黏着连接分子(JAM)-A在非小细胞肺癌(NSCLC)组织中的表达及临床病理意义。方法采用免疫组织化学 Elivision 法检测JAM-A蛋白在82例NSCLC及10例癌旁正常肺组织中的表达。 结果JAM-A主要定位于细胞膜,82例NSCLC组织中,30例(37%)为高表达,在10例癌旁正常肺组织中均为低表达。JAM-A膜高表达同肺癌pTNM分期(P=0.012),局部淋巴结转移(P=0.007),患者不良预后相关(P=0.02)。 结论JAM-A的高表达与NSCLC的进展密切相关,检测JAM-A可为监测NSCLC预后及治疗提供理论依据。
黏着连接分子A;非小细胞肺癌;肿瘤标志物
黏着连接分子(JAM)-A,主要表达于上皮或内皮细胞的细胞间连接处以及循环血液的多种细胞表面〔1~5〕,参与维持细胞屏障完整性,调控上皮细胞及内皮细胞运动,白细胞游走,血小板活化,介导病毒感染等多种生物学活动〔6,7〕。目前已发现JAM-A在乳腺癌等多种肿瘤中存在表达,但是,关于JAM-A在肿瘤发展过程中发挥何种生物学作用尚存在争议,基于不同实验条件的研究分别发现JAM-A可以促进〔8~11〕或抑制肿瘤发展〔12~14〕。在非小细胞肺癌(NSCLC)组织中,JAM-A的表达及临床意义尚无报道,本文探讨JAM-A在NSCLC发生、发展过程中的作用及其对NSCLC患者预后判定的临床意义。
1 材料与方法
1.1材料来源及处理选取2002年1月至2006年12月经病理确诊的NSCLC标本82例,其中49例具有完整随访资料。随访截止时间为2011年12月。生存时间计算为手术日期到随访截止日期,或因复发转移及其他原因死亡的日期。10例对照标本取自同期距离癌灶边缘>5 cm以上并经HE染色证实的正常肺组织。所有患者术前均未接受放、化疗。82例肺癌标本中,男38例,女44例;年龄40~78岁,中位年龄59岁;肺癌标本根据世界卫生组织2004年的分类标准分为鳞癌36例,腺癌46例;其中高分化11例,中分化27例,低分化44例,淋巴结转移31例。临床病理分期根据国际抗癌联盟(UICC)1997年修订的肺癌 pTNM 分期标准,Ⅰ期45例,Ⅱ期30例,Ⅲ期7例。
1.2主要试剂及方法所有切除标本均用10%中性甲醛溶液固定,石蜡包埋,制成4 μm切片,经脱蜡,脱苯,水化后,采用免疫组织化学法(Elivision法)检测JAM-A蛋白表达情况。JAM-A单克隆抗体购自美国Abcam公司,Elivision法试剂盒及二氨基联苯胺(DAB)显色试剂盒购自福州迈新生物技术开发公司,首先用3%的过氧化氢阻断内源性过氧化物酶的活性,高温高压修复抗原,然后使用JAM-A一抗(1∶100)4℃湿盒内孵育过夜,次日按照Elivision试剂盒说明书进行染色,DAB显色,苏木素复染。PBS代替一抗。判定标准:JAM-A定位于细胞膜,每张切片在高倍镜下随机选取10个视野(×400),随机计数100个细胞,细胞膜染色强度计分标准:0分(阴性染色),1分(淡黄色染色),2分(黄棕色染色),3分(棕褐色染色);肿瘤细胞染色范围计分:0分(阴性染色),1分(阳性细胞数1%~10%),2分(阳性细胞数11%~50%),3分(阳性细胞数51%~80%),4分(阳性细胞数81%~100%)。两项计分相乘为最终得分(0~12分),得分≤4分为低表达,得分>4分为高表达。
1.3统计学方法采用SPSS13.0统计软件进行χ2检验及 Fisher 确切概率法,生存数据分析采用Kaplan-Maier 法,采用Log-rank 法判断差异性。
2 结 果
2.1免疫组织化学染色结果表1及图1可见,JAM-A主要定位于细胞膜,82例NSCLC组织中,30例(37%)为高表达,在10例癌旁正常肺组织中低表达。JAM-A膜高表达同肺癌pTNM分期(P=0.012),局部淋巴结转移(P=0.007)相关,与患者性别(P=0.96)、年龄(P=0.818)、肿瘤组织类型(P=0.818)、肿瘤体积(P=0.105)、肿瘤分化水平(P=0.174)等均无明显相关性。
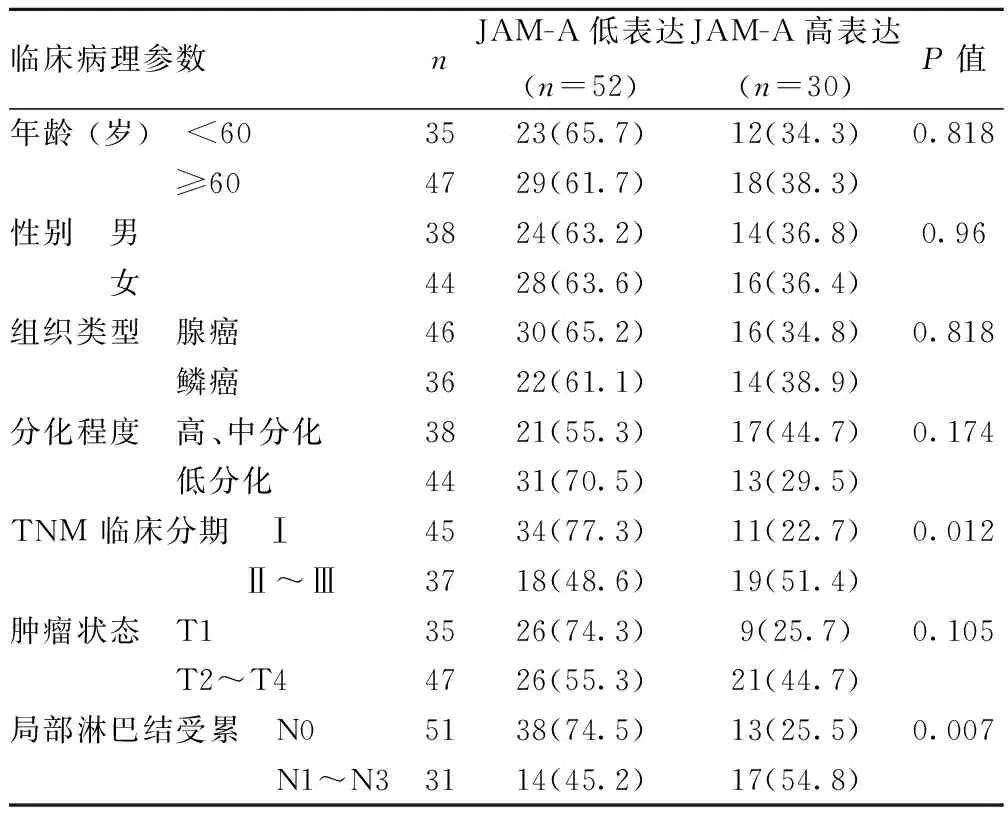
表1 JAM-A蛋白表达与NSCLC临床病理参数关系〔n(%)〕
2.2JAM-A膜表达水平与NSCLC患者预后生存率之间的关系对49例有完整的术后随访记录的患者进行Kaplan-Meier生存时间分析显示:肺癌组织细胞膜JAM-A高表达患者生存时间低于低表达患者〔(50 ± 8.92)个月vs(61± 4.31)个月,Log-rankP=0.02〕。见图2。

图1 JAM-A免疫组织化学染色Elivision法结果(×400)

图2 NSCLC术后生存时间
3 讨 论
JAM-A蛋白结构由细胞外段,细胞内段及跨膜段三部分组成,相邻蛋白分子间可借细胞外段免疫球蛋白样环袢结构介导JAM-A二聚体形成并发挥调控作用〔15,16〕;同时,其蛋白细胞内段含有PDZ结构域,可与ZO-1,AF-6,PAR-3 等各种细胞内支架蛋白结合并进一步介导信号转导通路活化过程。JAM-A生物学功能较为复杂,可参与维持细胞屏障完整性,调控上皮细胞及内皮细胞运动,白细胞游走,血小板活化,介导病毒感染,调控肿瘤进展等多种生物学活动〔17~19〕。
然而,关于JAM-A在肿瘤发生、发展过程中的具体作用仍然是一个富于争议的话题。Naik 等〔12〕最早对12例乳腺癌和配对的非瘤组织标本以及50例乳腺癌及相应淋巴结转移病灶标本进行研究,发现JAM-A的表达与乳腺癌侵袭、转移呈负相关。相反,McSherry等〔8,10〕先后对多个含有数百例乳腺癌病例的组织芯片及基因芯片信息进行研究,发现JAM-A高表达同乳腺癌进展及患者不良预后相关。Murakami 等〔9〕通过对包含444例侵袭性乳腺癌病例的组织芯片进行研究分析也得出了与 McSherry 等〔8〕相似的结论。由于后两组研究采用的样本量较大,全面研究分析了JAM-A表达同各种临床病理因素及患者生存时间的关系,所得出的结论较为客观可信,即JAM-A高表达同侵袭性乳腺癌的进展及患者不良预后相关。与McSherry等〔8〕及Murakami等〔9〕的研究结论类似,我们的研究发现NSCLC组织中JAM-A高表达同肿瘤 pTNM 分期,局部淋巴结转移及患者不良预后相关,提示JAM-A高表达与NSCLC的进展密切相关。Lathia等〔11〕对恶性胶质细胞瘤的研究也有类似的发现:JAM-A在肿瘤组织中的表达水平高于正常脑组织,JAM-A高表达同恶性胶质瘤患者生存时间负相关,并参与肿瘤干细胞的干性维持。在癌细胞中JAM-A高表达的机制仍需进一步研究,Gotte 等〔20〕报道了Micro RNA miRNA-145以JAM-A为靶基因并干扰其转录,导致JAM-A蛋白表达减少,而在在乳腺癌组织中miRNA-145低表达,这也许可以解释侵袭性乳腺癌组织中JAM-A高表达的成因,在NSCLC及恶性胶质瘤组织中miR-145是否也发挥了同样功效尚需进一步研究。然而,在肿瘤的进展过程中就此简单将JAM-A定义为致癌因子是不全面的,Koshiba 等〔13〕对子宫内膜癌的相关研究发现JAM-A表达同肿瘤进展负相关,JAM-A低表达同患者不良预后相关。Fong 等〔14〕对于前列腺癌的研究发现JAM-A低表达同肿瘤侵袭及患者不良预后相关。上述这些看似矛盾的研究结果提示JAM-A的功能较为复杂,其所发挥的具体生物学作用可能具有组织特异性,不同组织内由于各种信号蛋白表达及活化水平不同,可经JAM-A介导活化不同的信号通路,发挥不同的生物学作用,这些都需进一步研究,以明确JAM-A调控各种肿瘤生物学行为的作用机制。
1Liu Y,Nusrat A,Schnell FJ,etal. Human junction adhesion molecule regulates tight junction resealing in epithelia〔J〕.J Cell Sci,2000;113(Pt 13):2363-74.
2Liang TW,DeMarco RA,Mrsny RJ,etal. Characterization of huJAM:evidence for involvement in cell-cell contact and tight junction regulation〔J〕.Am J Physiol Cell Physiol,2000;279(6):C1733-43.
3Gupta SK,Pillarisetti K,Ohlstein EH.Platelet agonist F11 receptor is a member of the immunoglobulin superfamily and identical with junctional adhesion molecule (JAM):regulation of expression in human endothelial cells and macrophages〔J〕.IUBMB Life,2000;50(1):51-6.
4Bradfield PF,Nourshargh S,Aurrand-Lions M,etal. JAM family and related proteins in leukocyte migration (Vestweber series)〔J〕.Arterioscler Thromb Vasc Biol,2007;27(10):2104-12.
5Sobocka MB,Sobocki T,Banerjee P,etal. Cloning of the human platelet F11 receptor:a cell adhesion molecule member of the immunoglobulin superfamily involved in platelet aggregation〔J〕.Blood,2000;95(8):2600-9.
6Naik MU,Mousa SA,Parkos CA,etal. Signaling through JAM-1 and alphavbeta3 is required for the angiogenic action of bFGF:dissociation of the JAM-1 and alphavbeta3 complex〔J〕.Blood,2003;102(6):2108-14.
7Barton ES,Forrest JC,Connolly JL,etal. Junction adhesion molecule is a receptor for reovirus〔J〕.Cell,2001;104(3):441-51.
8McSherry EA,McGee SF,Jirstrom K,etal. JAM-A expression positively correlates with poor prognosis in breast cancer patients〔J〕.Int J Cancer,2009;125(6):1343-51.
9Murakami M,Giampietro C,Giannotta M,etal. Abrogation of junctional adhesion molecule-A expression induces cell apoptosis and reduces breast cancer progression〔J〕.PLoS One,2011;6(6):e21242.
10Brennan K,McSherry EA,Hudson L,etal. Junctional adhesion molecule-A is co-expressed with HER2 in breast tumors and acts as a novel regulator of HER2 protein degradation and signaling〔J〕.Oncogene,2013;32(22):2799-804.
11Lathia JD,Li M,Sinyuk M,etal. High-throughput flow cytometry screening reveals a roleforjunctional adhesion molecule a as a cancer stem cell maintenance factor〔J〕.Cell Rep,2014;6(1):117-29.
12Naik MU,Naik TU,Suckow AT,etal. Attenuation of junctional adhesion molecule-A is a contributing factor for breast cancer cell invasion〔J〕.Cancer Res,2008;68(7):2194-203.
13Koshiba H,Hosokawa K,Kubo A,etal. Junctional adhesion molecule A corrected expression in human endometrial carcinoma〔J〕.Int J Gynecol Cancer,2009;19(2):208-13.
14Fong D,Spizzo G,Mitterer M,etal. Low expression of junctional adhesion molecule A is associated with metastasis and poor survival in pancreatic cancer〔J〕.Ann Surg Oncol,2012;19(13):4330-6.
15Mandell KJ,McCall IC,Parkos CA.Involvement of the junctional adhesion molecule-1 (JAM1) homodimer interface in regulation of epithelial barrier function〔J〕.J Biol Chem,2004;279(16):16254-62.
16Severson EA,Jiang L,Ivanov AI,etal. Cis-dimerization mediates function of junctional adhesion molecule A〔J〕.Mol Biol Cell,2008;19(5):1862-72.
17Bazzoni G,Martinez-Estrada OM,Orsenigo F,etal. Interaction of junctional adhesion molecule with the tight junction components ZO-1,cingulin,and occludin〔J〕.J Biol Chem,2000;275(27):20520-6.
18Ebnet K,Schulz CU,Meyer ZBMK,etal. Junctional adhesion molecule interacts with the PDZ domain-containing proteins AF-6 and ZO-1〔J〕.J Biol Chem,2000;275(36):27979-88.
19Ebnet K,Suzuki A,Horikoshi Y,etal. The cell polarity protein ASIP/PAR-3 directly associates with junctional adhesion molecule (JAM)〔J〕.EMBO J,2001;20(14):3738-48.
20Gotte M,Mohr C,Koo CY,etal. miR-145-dependent targeting of junctional adhesion molecule A and modulation of fascin expression are associated with reduced breast cancer cell motility and invasiveness〔J〕.Oncogene,2010;29(50):6569-80.
〔2015-02-17修回〕
(编辑苑云杰/曹梦园)
张珉(1976-),男,博士,讲师,主要从事肿瘤侵袭转移机制研究。
R734.2
A
1005-9202(2016)15-3737-03;doi:10.3969/j.issn.1005-9202.2016.15.059
1辽宁省肿瘤医院病理科
2中国医科大学附属第一医院病理科中国医科大学基础医学院病理教研室
