热应激和低营养摄入对猪肠道完整性和功能的影响
2016-10-26PearceSCManiVWeberTERhoadsRPPatienceJFBaumgardLHGablerNK
PearceSC,ManiV,WeberTE,RhoadsRP,PatienceJF,BaumgardLH,GablerNK
(1.爱荷华州立大学动物科技学院,美国埃姆斯50011;2.弗吉尼亚理工大学动物和家禽科学系,美国布莱克斯堡24061)
热应激和低营养摄入对猪肠道完整性和功能的影响
PearceSC1,ManiV1,WeberTE1,RhoadsRP2,PatienceJF1,BaumgardLH1,GablerNK1
(1.爱荷华州立大学动物科技学院,美国埃姆斯50011;2.弗吉尼亚理工大学动物和家禽科学系,美国布莱克斯堡24061)
热应激会损害肠道完整性,并诱发肠渗漏。因此,本试验研究了直接或间接热应激(通过减少采食量)对生长猪肠道通透性的影响。选用体重(43±4)kg的杂交后备母猪(n=48),分别安置在以下控制环境中:热中性(TN)环境(20℃,湿度35%~50%,自由采食)、热应激(HS)环境(35℃,湿度20%~35%,自由采食)、热中性环境配对饲喂(PFTN,以消除不同采食量的交互影响)。第1、3、7天使猪只安乐死,采集的空肠样品被安装到尤式灌流室,测定跨膜电阻抗值(TER)和异硫氰基荧光标记的脂多糖(LPS)渗透性(APP,表示为表观渗透系数)。此外,评估肠道完整性以及应激基因和蛋白标志物。结果表明,不考虑热应激天数,HS组与TN组猪相比,血浆内毒素水平增加45%(P<0.05),空肠TER降低30%(P<0.05),LPS渗透率增加2倍(P<0.01)。此外,与PFTN组相比,HS组第7天的猪LPS渗透性有增加的趋势(P=0.06)。整个试验阶段HS组溶菌酶和碱性磷酸酶活性下降,分别下降46%和59%(P<0.05);然而,3 d和7 d空肠免疫细胞标记物——髓过氧化物酶活性增加(P<0.05)。由此可见,热应激和减少采食量都会降低肠道完整性,并增加内毒素渗透性。推测这可能会导致炎症加重,在炎热的夏季可能是导致猪生长性能降低的原因。
内毒素;热应激;肠道完整性;猪
中国猪营养国际论坛是由美国动物科学学会、上海亘泰实业集团和上海优久生物科技有限公司联合主办,以“凝聚全球科研力量,驱动猪业创新思维”为宗旨,力邀全球一流的机构、专家和学者,倾力打造一个动物营养领域具有国际性、前沿性和权威性的论坛。该论坛每两年举办一届,聚焦行业发展中的热点、难点,通过专家学者和企业领导者之间进行开放建设性的学术探讨、理论研究和实践经验交流,整合全球动物营养领域最新的技术和研究成果,推动行业发展,创造和提升产业价值。
www.asaschina.org
热应激会对动物产生不良影响。生长猪处在热应激环境中,呼吸速率和体温明显增加,增重缓慢,采食量明显降低(Pearce等,2013)。然而,与热中性(TN)配对饲喂猪(PFTN)相比,热应激猪增加更多的体重有明显不同的吸收后生物能变量,如胰岛素(Pearce等,2013、2012)。研究表明吸收后代谢的独特变化与高热负荷的直接作用和热量摄入的减少以及肠道完整性功能改变有关。
热应激时哺乳动物将重新分配血流量,血液更多分配至周围血管,以最大限度发挥辐射散热,而胃肠道中血管收缩(Lambert,2008)。因此,流入肠道上皮的血流量和营养物质减少,使肠道屏障完整性受损(Yan等,2006)。紧密连接蛋白对肠道正常屏障功能有重要作用,其合成改变与某些应激相关(包括热应激),会增加肠道通透性。这种增强的渗透性使某种血液内毒素标记物升高,启动免疫应答,并激活肠道和肝脏解毒机制(Hall等,2001)。
本试验旨在研究直接或间接热应激(通过减少采食量)是否可以增加生长猪肠道通透性和肠道应激标记物。假设热负荷增加会引起肠上皮生理改变,导致屏障完整性受损,肠道功能和代谢变化,那么会进一步增加热应激相关疾病的严重性,并使全身代谢发生变化。
1 材料与方法
1.1试验动物和设计本研究中试验动物、试验设计和非肠道结果在先前的研究中已详细描述(Pearce等,2013)。简单的说,根据体重选择杂交后备母猪(n=48,体重43 kg±4 kg;PIC C22/C29× 337,Carthage Veterinary Service,Carthage,IL)两栋猪舍的一栋在热中性环境(20℃±1℃,35%~50%湿度),分别饲喂在单独的栏中(有单独的给料器和饮水器)每栋猪舍24栏。动物有5 d的预试期。然后猪只被分为3个处理:热中性环境(TN,自由采食)、热应激环境[HS,(35±1)℃,相对湿度20%~35%,自由采食]、配对饲喂在热中性环境(PFTN,以对比热应激猪营养摄入)。为了评估热处理的时间响应,选择热中性猪(n=18)和热应激猪(n= 24)分别在第1(n=12)、3(n=12)、7天(n=18)安乐死。进行配对饲喂以量化不同饲料和营养摄入的交互影响(Pearce等,2013;Rhoads等,2009)。仅在限饲后第7天安乐死6头PFTN猪。所有猪只饲喂配合饲料,并持续监控应激现象,如温度过高(>41℃)、体重减少和食欲完全丧失。
安乐死前,通过静脉穿刺收集颈静脉血,并于4℃、1300 r/min离心10 min以获得血清和EDTA-血浆,-20℃保存,用于后期分析。屠宰时,刮取收集离胃3 m远的空肠近端和空肠黏膜,-80℃液氮冻存用于后期分析。另外,收集20 cm整个空肠段鲜样立即放入Krebs-Henseleit缓冲液中(包含25 mmol/L NaHCO3,120 mmol/L NaCl,1 mmol/L MgSO4,6.3 mmol/L KCl,2 mmol/L CaCl,0.32 mmol/L NaH2PO4,pH 7.4),置冰块上,并不断通风送往实验室,安装到尤氏灌流室(Mani等,2013;Gabler等,2009、2007)。新鲜空肠段也立即被固定在10%福尔马林溶液用于组织学分析。选择空肠组织是因为其对营养吸收和高血液流量时有重要作用,并对血液内毒素和低氧环境敏感(Maier等,2009)。
1.2肠道结构及功能完整性测定
1.2.1肠道组织形态观察固定在福尔马林中的空肠样品被送到爱荷华州立大学兽医诊断实验室,做肠道组织切片和苏木伊红染色。使用显微镜(DMI3000B倒置显微镜,班诺克本,徕卡显微系统有限公司)附带相机(12-bit QICAM Fast 1394,QImaging,Surrey,BC,Canada)观察,每个切片分3个部分,选取10处绒毛和10处隐窝。测量每个图片的绒毛高度和隐窝深度。最终,计算30个绒毛和隐窝的平均值作为每头猪的一个数值。使用Q-capture Pro 6.0软件(QImaging,Surey,BC)获得每个绒毛和隐窝照片,并用Image-Pro Plus 7.0软件测量(Media Cybernetics,Bethesda,MD)。
1.2.2肠道完整性和脂多糖渗透性体外试验收集近端新鲜空肠样品安装到尤式灌流室,检测肠道完整性和内毒素及标记的脂多糖(LPS)。选取每头猪的一个代表性组织样本,固定并垂直放置在连接有双通道电流的尤氏室,其电压电极浸没在3%的琼脂中,以3 mol的氯化钾作为电导率。各段浆膜和黏膜层被浸泡在4 mL Krebs-Henseleit缓冲液中,给组织样品提供稳定的O2-CO2混合物。各段用0 mV电压固定,处理30 min,测定其跨膜电阻抗(TER),通过前10 min组织稳定化的平均电流来计算(Gabler等,2007)。
使用异硫氰酸荧光素(FITC)标记的LPS(来自大肠杆菌055:B5)测定空肠段内毒素渗透性(Mani等,2013;Tomita等,2004)。组织稳定在修正的尤氏室30min后,将20μg/mL的FITC-LPS加到黏膜侧,每20 min一次,持续120 min从黏膜和浆膜室获得培养基样品在荧光分光光度计495 nm处读数。计算FITC-LPS穿过空肠的表观渗透系数(APP)(Mani等,2013;Tomita等,2004)。
1.3循环内毒素测定使用市售试剂盒测定血液内毒素水平。用重组C因子(rFC)内毒素法,将猪血浆样品稀释1000倍测定内毒素含量(Pyro-Gene Recombinant Factor C Endotoxin Detection System,Lonza,Walkersville,MD),3个平行样分析。使用96微孔板,37℃培养0 h和1 h时测定荧光值。使用Synergy 4酶标仪(Bio-Tek,Winooski,VT),激发和发射波长分别为380 nm和440 nm,荧光读数。由于内毒素的高敏感性,使用此方法组间和组内差异小于20%。相对荧光单位表示为任意单位(AU/mL)。
1.4空肠、血浆炎症和应激标记物测定使用市售试剂盒测定空肠的溶菌酶活性。用EnzChek荧光试剂盒测定溶壁微球菌细胞壁溶菌酶活性(Invitrogen Molecular Probes,Carlsbad,CA)。稀释样品,用Synersy 4酶标仪(Bio-Tek,Winooski,VT),激发和发射波长分别为485 nm和530 nm,测定荧光值。建立标准曲线,校正样品稀释倍数,计算溶菌酶活性。此方法检测限为0~500 U/mL,组间和组内差异分别为1.1%和2.9%。
使用市售试剂盒(QuantiChrom,Bioassay Systems,Hayward,CA)测定组织碱性磷酸酶活性,检测限为0~800 IU/L。从空肠中提取蛋白,并检测蛋白含量。然后取50 μL样品加入到150 μL含有镁、乙酸盐、磷酸对硝基苯酯和检测缓冲液的混合工作液中。样品置于96微孔板,使用Synergy 4酶标仪(Bio-Tek,Winooski,VT),分别在0 min和4 min于405 nm处读数。
使用Suzuki等(1983)描述的方法测定空肠髓过氧化物酶(MPO)活性。组织样品加入0.5%十六烷基三甲基溴化铵(CTAB)磷酸钾缓冲液(PPB,pH 6.0),匀浆,冰融,涡旋3次。然后,于4℃、10000r/min离心15 min。上清液转移到新管中,沉淀部分再加入500 μL 0.5%的PPB+HTAB混合液,悬浮物冰融,匀浆2 min,取500 μL转移至另一新管。样品于4℃、10000 r/min离心15 min,收集上清液。最终上清液与邻联茴香胺盐酸盐和0.005%过氧化氢混合。1单位MPO活性以分解1 μmol过氧化氢的值来表示。反应10 min读取在460 nm处吸光度,以每毫克组织1 mL样品计算。
空肠黏膜组织使用T-PER哺乳动物蛋白提取试剂(Pierce,Rockford,IL)提取,补充有蛋白酶(罗氏,印第安纳波利斯,IN)抑制剂和12 mmol/L丁基化羟基甲苯,裂解液在4℃、10000 r/min离心5 min。空肠裂解液蛋白含量用二喹啉酸测定法测定。等量的空肠组织蛋白(100 μg)用于分析白细胞介素8(IL-8),使用猪特异性ELISA法(DuoSet猪IL-8,目录号DY535,R&D系统,明尼阿波利斯,明尼苏达),按说明书测定。结果以每单位蛋白为基础。检测限为0~8000 pg/mL,组内和组间差异分别为10.8和12.9%。
根据先前发表的评估炎症对组织4-NHE加合物的影响(Yin等,2009),采用狭缝杂交分析法检测空肠4-羟基壬烯醛(4-HNE)加合物。蛋白质裂解物(15 μg)使用狭缝印迹装置印迹到硝酸纤维素膜上,两个平行样分析。Ponceau S印迹可视化蛋白质转移染色,膜在4℃下与4-HNE羊抗兔抗体(AB5605,Millipore,Temecula,CA)反应,稀释度为1∶5000,孵育过夜。羊抗兔IgG抗体偶联辣根过氧化物酶(HRP,皮尔斯),使用化学发光检测试剂盒连同柯达影像专业4000 mm成像系统和软件(纽约州罗切斯特市)可视化和量化反应物。
刮取黏膜测定谷胱甘肽浓度,黏膜样品在含有1 mmol/L EDTA的冰冻MES缓冲液中匀浆,于4℃、10000 r/min下离心15 min。上清液中加入等体积10%的偏磷酸以去除蛋白,4℃、2000 r/min离心2 min。脱蛋白质裂解物中总谷胱甘肽浓度使用比色谷胱甘肽试剂盒测定(开曼化工,安阿伯,密歇根州),结果以每单位蛋白为基础。
使用市售ELISA试剂盒(ALPCO Diagnostics,Salem,NH)分析样品中的血浆结合珠蛋白,将样品加入到吸附有抗猪结合珠蛋白的孔中。清洗后,HRP-偶联的抗结合珠蛋白抗体添加到板中。再次清洗后,加入显色底物3,3',5,5'-四甲基联苯胺(TMB),在450 nm处测定吸光度,从而测定HRP。测试样品中结合珠蛋白数量通过标准曲线和校正样品稀释倍数得到。结合珠蛋白检测限为25~400 ng/mL,组内变异系数为4.9%。
1.5空肠Na+/K+ATP酶活性测定回肠黏膜在含有50 mmol/L蔗糖、1 mmol/L EDTA二钠、20 mmol/L三羟甲基氨基甲烷的蔗糖缓冲液(pH 7.4)中匀浆,于4℃、1000 r/min离心10 min得到蛋白提取物。蛋白提取物被分成5等份:两份用水处理,两份用乌本苷处理,一份用于BCA蛋白分析。蛋白提取物用MQ水或20 mmol/L乌本苷,及Na+/K+ATP酶反应缓冲液(pH 7.0;2000 mmol/L NaCl,100 mmol/L KCl,50 mmol/L MgCl2和250 mmol/L HEPES)预孵15 min,然后,添加新鲜的105 mmol/L ATP孵育45 min以启动反应。反应45 min后,用50%冰冷的三氯乙酸终止反应。样品在4℃、1500 r/min离心10 min得到上清液中最终产物(Fuller等,2003)。最后,用钼钒酸盐方法(Ueda和Wada,1970)分析样品中无机磷(Pi),3个重复,使用Synergy 4酶标仪(Bio-Tek,Winooski,VT)在400 nm处读数。在无乌本苷(特定Na+/K+ATP抑制剂)存在的情况下,特定Na+/K+ATP酶活性取决于ATP中无机磷含量。非特异性磷酸通过测定无蛋白悬浮液中释放出的无机磷计算,结果以每单位蛋白为基础。
1.6RNA分离和定量PCR使用市售试剂盒分离组织中总RNA(RNeasy纤维组织小型试剂盒,Qiagen公司,瓦伦西亚,加利福尼亚)。使用分光光度计(ND-100,NanoDrop Technologies,Rockland,DE)在260 nm处测定吸光度,对总RNA定量分析,通过测定260nm和280 nm的吸光度之比评估RNA纯度。所有样品OD260/280大于1.8,RNA制备的完整性评估,经过2%琼脂凝胶电泳后,以SYBR Safe DNA凝胶染色(Life Technologies,Carlsbad,CA),观察18S和28S核糖体条带决定。使用市售cDNA试剂盒(Quantitect reverse transcription kit,Qiagen,Valencia,CA)完成总RNA(1 μg)反转录反应和消除基因组DNA。使用NanoDrop对cDNA定量,并用于实时定量PCR反应。在含总体积为25 μL的2×quantitect的SYBR Green PCR主混合物(iQ SYBR green supermix,Bio-Rad,Hercules,CA)、正向和反向引物(0.3 mmol/L)及200 ng cDNA中完成扩增。目的基因和看家基因引物序列如表1所示。循环条件包括变性温度95℃,15 min,然后以下循环50次:95℃,30 s;55℃,30s;72℃,30 s。72℃进行光学检测分析。PCR反应结束时,进行溶解曲线分析验证引物特异性。每个分析同时伴随非模板控制,所有检测3个平行。每个样品的mRNA丰度值根据2-ΔΔCT方法标准化为RPL32(Livak和Schmittgen,2001)。

表1 试验用引物
1.7数据分析使用SAS 9.2软件(SAS Inst. Inc.,Cary,NC)混合线性模式过程进行双模型统计学分析。每只猪均作为一个试验样品单位,用以评估随时间的推移,热应激对猪生理的影响。正如预期结果,不同时间(0、3、7 d)TN组猪没有显著差异。因此,第一次统计模型将这些猪作为无热应激,时间作为固定因素,比较TN组第0天和HS组第1、3、7天的差异。为了更好的理解随时间的变化我们所测的参数类型,将这些数据进一步作线性分析和二次方对比。设计二次统计模型,将第7天数据作为固定效应,分析TN、PFTN和HS组差异(Pearce等,2013)。所有数据均以最小二乘“平均值±标准差”表示,以P<0.05表示差异显著,P<0.1表示有差异趋势。
2 结果与分析
2.1热应激第0、1、3、7天对肠道完整性和功能标记物的影响由图1可知,热应激第7天,空肠TER线性降低(P=0.02)。相反地,7 d内空肠LPS渗透性呈二次方增加(P=0.023)。第3天,FITCLPS APP增加118%(P<0.05),但第7天仅增加52%(P>0.05)。由图2可见,与TN组第0天猪相比,HS组所有观察日(1、3、7天)血浆内毒素均显著升高(P<0.05)。另外,7 d内血浆内毒素水平呈线性和二次方增加趋势(P<0.10)。由表2可见,空肠形态也明显受长期热应激影响。与第0天TN组猪相比,热应激组第1、3、7天,绒毛高度和绒毛/隐窝均下降(线性和二次方,P<0.05)至23%。与第0天TN组猪相比,前3天HS组隐窝深度增加,而在第7天显著降低(P<0.05)。

图1 热应激对猪体外空肠脂多糖渗透性和跨膜电阻抗的影响

图2 热应激对猪血液内毒素水平的影响

表2 持续热应激对空肠绒毛形态的影响
由表3可见,热应激前24 h,空肠Na+/K+ATP酶活性和氧化应激标记物(4-HNE)水平均显著增加(P<0.05)。然而,抗氧化剂谷胱甘肽呈降低趋势(P=0.062),下降到26%,到第7天呈线性降低(P=0.016)。随着时间的推移,未见空肠细胞因子和趋化因子IL-8有显著差异(P>0.05)。第3、7天,空肠中性粒细胞浸润标记物(MPO活性)明显增加(P<0.01)。随着时间推移,溶菌酶和碱性磷酸酶活性显著降低(P<0.05)。
由表4可知,第7天mRNA紧密连接蛋白Occludin、Claudin 3和ZO-1丰度比第0、1、3天高2~6倍。尽管无统计学差异,但热应激第1天和第3天这些紧密连接蛋白基因表达量较低。与0 d和7 d相比,第1天和第3天空肠HSP27分别增加254%和367%(P=0.041)。然而,HIF-1α表达量在热应激第3天达到最高值,到第7天呈二次方下降趋势(P<0.10)。主要紧密连接蛋白调节激酶-肌球蛋白轻链激酶(MLCK)的基因表达与HSP27相似(P=0.011)。
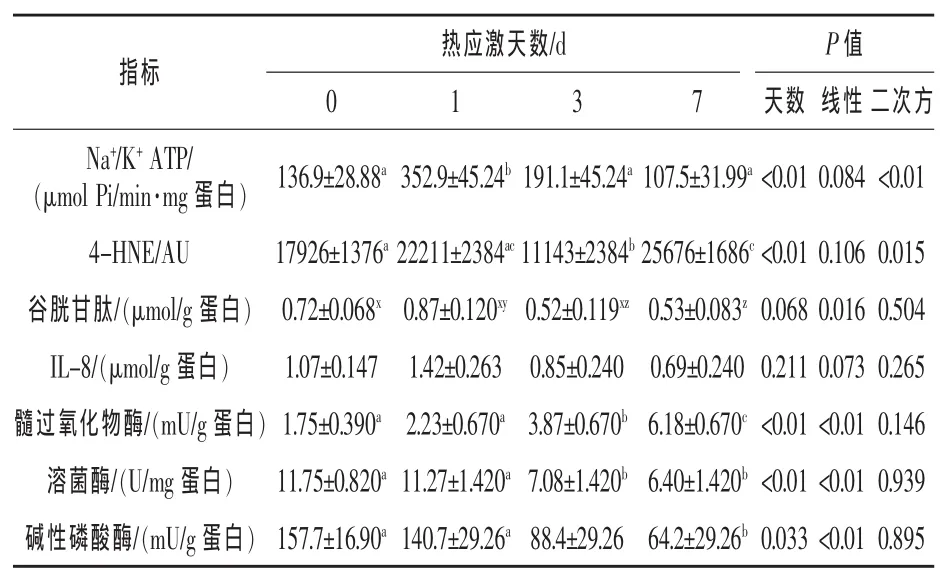
表3 热应激对肠道应激、炎症和功能标记物的影响

表4 热应激诱导猪空肠应激和mRNA丰度变化
2.2持续热应激和减少采食量对肠道完整性和功能的影响由表5可见,TN、HS和PFTN组间TER无显著差异(P>0.10)。然而,热应激使体外空肠LPS渗透性增加(240%,P=0.045)。与TN组相比,PTFN组猪LPS渗透性也增加(170%),但差异不显著。7 d后不同处理组血浆内毒素水平无明显差异。但与TN组猪相比,HS组第7天结合珠蛋白升高(171%,P<0.05),而PFTN组猪与TN组无差异(P>0.10)。

表5 热应激7 d和限制采食量对猪肠道完整性和血液应激标记物的影响
与TN组相比,HS组第7天绒毛高度(图3A)及绒毛高度/隐窝深度(图3C)显著降低(P<0.05);另外,HS组和PFTN组隐窝深度分别降低5%~18%(图3B,P<0.05);PFTN环境不会改变猪绒毛高度和绒毛高度/隐窝深度(图3A、3C)。然而,与TN组和HS组相比,PFTN组猪隐窝深度较浅(P<0.05,图3B)。

图3 热中性环境(TN,20℃)自由采食、热应激环境(HS,35℃)自由采食及热中性环境(PFTN)配对饲喂对空肠形态的影响
到第7天,与TN组和PFTN组相比,HS组脂质过氧化物标记物4-HNE水平升高(P<0.05,图4A)。与预期一样,热应激导致4-HNE增加50%(P<0.05)。与TN组猪相比,HS组和PFTN组猪肠道谷胱甘肽均降低,分别降低36%和61%(图4B,P<0.05)。肠道IL-8水平(图4C)不受配对饲喂影响,但热应激导致其减少36%(P<0.05)。热应激导致肠道MPO活性增加(图4D),是衡量中性粒细胞浸润和炎症的指标。然而,HS组肠道溶菌酶活性比PFTN组猪低(P<0.05),但与TN组相比无差异(图4E)。碱性磷酸酶活性(图4F)不受配对饲喂的影响,但热应激导致其降低65%(P<0.05)。试验处理7 d后,与对照组相比,PFTN组空肠Na+/K+ATP酶活性降低(P<0.05),并有与HS组同减弱的趋势(分别为每毫克蛋白每小时143.77 μmol和108 μmol无机磷)(P<0.10)。
由图5可知,与TN组猪相比,HS组空肠紧密连接蛋白occludin mRNA丰度增加1~2倍(P<0.10),ZO-1(P<0.05)和claudin 3丰度差异显著。然而,HS组和PFTN组claudin 3 mRNA丰度未见明显差异(P<0.05)。不同处理组7 d的热休克蛋白27和HIF-1α mRNA丰度没有差异(图5D和5E)。与TN组猪相比,HS组和PFTN组猪第7天MLCK mRNA丰度降低(P<0.05,图5F),然而,HS组和PFTN组无显著差异。

图4 热中性环境(TN,20℃)自由采食、热应激环境(HS,35℃)自由采食及热中性环境(PFTN)配对饲喂对7 d时空肠炎症和功能标记物的影响
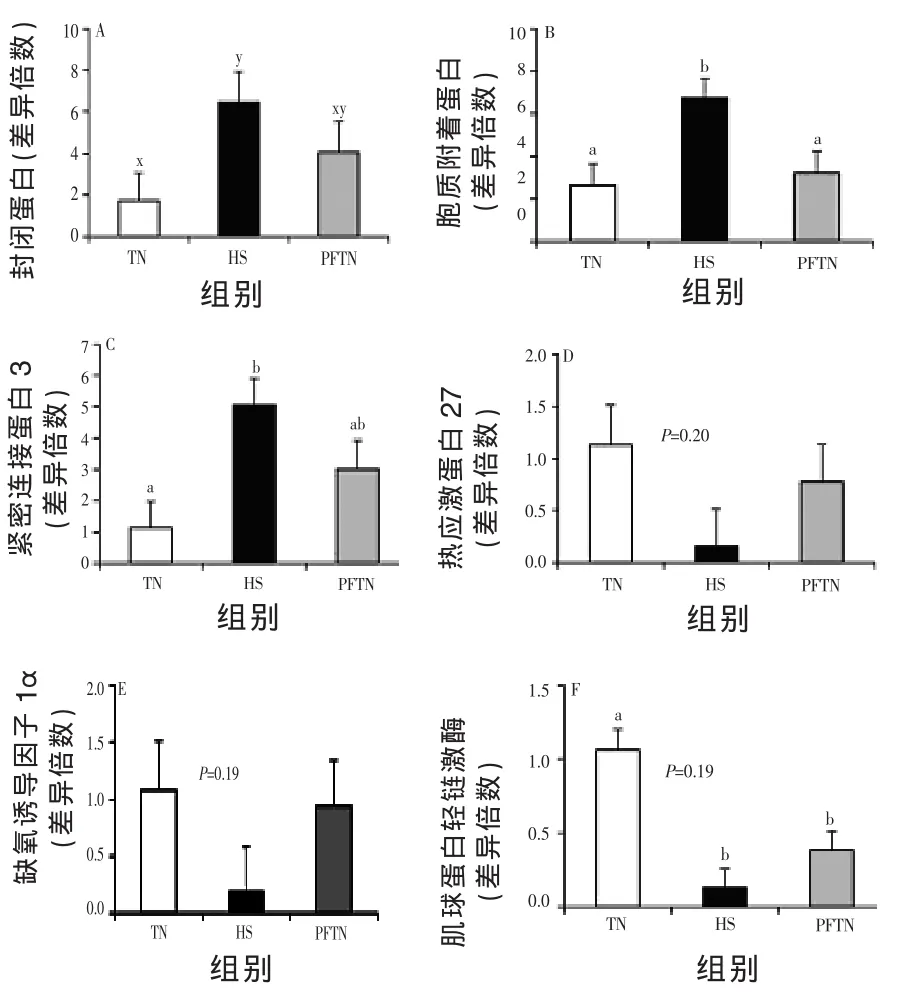
图5 热中性环境(TN,20℃)自由采食、热应激环境(HS,35℃)自由采食及热中性环境(PFTN)配对饲喂对7 d时肠道完整性和炎症标记物mRNA丰度的影响
3 讨论
本研究旨在确定热应激直接或间接(通过采食量减少介导)增加生长猪肠道渗透性。随着环境热负荷增加,内脏血液重新分配到皮肤(通过调控外周血管扩张和胃肠道血管收缩)(Hall等,1999)。最终,肠道上皮细胞变得缺氧、酸性、ATP耗尽、经历氧化或亚硝化应激,最终可导致细胞凋亡(Yan等,2006)。这些结果会损伤肠上皮细胞,使其渗透性增加,最终导致内毒素血症、炎症及器官损伤(Lambert,2004)。本研究表明,热应激引起HIF-1α mRNA丰度、4-HNE快速增加,且谷胱甘肽减少,验证了这一结论。肉鸡4-HNE增加证明其与饲料利用率降低和代谢改变有关(Bottje和Carstens,2008)。另外,HS组肠道Na+/K+ATP酶活性明显增加,而配对饲喂无此现象。离子泵大量耗能,且离子主动运输跨质膜要消耗ATP水解释放的能量。因此,能量消耗中额外的20%用于骨骼肌、肝脏和肠道运输Na+/K+,10%用于运输Ca+(Milligan和McBride,1985)。热应激下这些离子泵正向调节以维持肠道渗透压平衡。如果离子平衡和渗透压没有被严格控制,可能会导致酶功能、蛋白质结构、细胞膜完整性和保水性紊乱(Street等,2010;Craig,2004)。
本试验发现小肠绒毛形态发生变化;然而,热应激对绒毛形态的影响是可变的。40℃热应激降低猪空肠和十二指肠绒毛高度和隐窝深度(Yu等,2010)。同样地,热应激导致十二指肠和空肠绒毛高度变短,隐窝深度变浅(Liu等,2009)。肠绒毛高度变短和隐窝变浅表明肠道上皮细胞受损。肠上皮细胞受损(例如上皮脱落和坏死)引起肠道渗透性增加(Lambert等,2002)。上皮细胞损伤发生在其他脏器损伤之前是由于血流量减少首先影响肠道。肠道上皮细胞损伤也可能影响营养物质的消化和吸收(Liu等,2009)。但研究表明,仅限制饲喂(类似于HS和PFTN猪)就可以引起肠道功能、运输和形态的改变,也可能会增加细菌败血症形成的风险(Ferraris和Carey,2000)。因此,热应激期观察到的影响可能被大幅度降低采食量而混淆并加剧。
研究表明热应激可以调控肠道完整性(Dokladny等,2008;Lambert,2004)。肠道上皮由黏附分子、间隙和紧密连接蛋白组成,并形成保护屏障,有助于营养物质吸收和转运,防止潜在的有害分子易位。上皮细胞还包含一个肌动蛋白骨架,它是上皮屏障的主要组成部分。通过MLCK活化调节,肌动蛋白细胞骨架收缩有助于维持细胞活力,导致紧密连接打开,并增加肠道通透性(Lambert,2009;Yang等,2007)。本研究数据表明热应激对MLCK和紧密连接基因表达丰度的影响是周期性的,因为在急性热应激下其迅速上调,而在第3天急剧下降。体外试验表明,热应激引起ZO-1蛋白重新分配,例如扩散到胞浆(Ikari等,2005)。同样地,ZO-1蛋白表达降低,表明紧密连接被破坏(Dokladny等,2006)。本试验与已有研究报道一致,热应激可以正向调节occludin基因的表达(Dokladny等,2008),这是一种可以维持屏障功能的重要紧密连接蛋白,其表达增加可能与肠道上皮复原的保护性反应相关。肠应激时,急性期反应在改善肠上皮细胞伤口愈合和恢复上有重要作用。
由于紧密连接蛋白和MLCK的改变与肠道渗透性变化和抗应激相关,本试验中以空肠TER作为肠道上皮过紧或渗透的指标。已有报道指出热应激引起猪回肠和结肠FITC-葡聚糖(4kDa)大分子渗透性增加(Pearce等,2012)。与体外试验(Dokladny等,2006)和体内小鼠试验(Prosser等,2004)研究报道一致的是随着热应激时间推移,肠道TER减少。LPS APP和血液内毒素增加这一数据也验证了热应激猪TER呈线性降低。APP增加是对FITC-LPS肠道通透性定量测定,是渗漏的另一个评估指标。虽然我们怀疑细胞旁路转运,但LPS可通过主动、被动、跨细胞或受体介导的过程进入肠上皮细胞(Mani等,2013)。
由于PFTN组和HS组变化相似,因此热应激对肠道完整性的影响似乎是由采食量降低直接介导的。因此,由热应激引起许多生物效应(Leon,2007;Lambert,2004;Hall等,2001)可能是由环境引起的过高热造成的间接影响(采食量降低介导)。高水平血液内毒素有可能导致炎症形成,并降低生长潜力。本研究中,热应激动物血清内毒素和急性蛋白、结合珠蛋白有升高趋势。血清内毒素数据与热应激下小鼠(Lim等,2007;Hall等,2001)、鸡(Cronje,2007)研究数据一致。这表明肠道渗透性增加,内毒素解毒、中和和清除功能降低。热应激导致肠道碱性磷酸酶和溶菌酶活性降低。这归结于热应激期间炎症和LPS反应的增加。受损黏膜碱性磷酸酶和溶菌酶活性可能会使细菌和病原菌黏膜通道增加,降低对LPS诱发炎症的保护作用(Mani等,2013;Lackeyram和Yang,2010)。虽然试验未发现肠道细胞因子增加,但MPO活性显著增加。这两个标记物都是常用于评估肠道炎症和中性粒细胞浸润的指标(Suzuki等,1983)。
已有报道指出,与TN和PFTN猪相比,整个热应激猪直肠温度(1.5℃)和呼吸速率(2倍)有明显的和持续的增加。另外,与TN组猪相比,热应激猪从第1天开始采食量较少,整个试验期内持续减少超过46%。通过设计,PFTN猪采食量与HS组猪相同。整个试验期TN组猪日增重为1.14 kg/d,而HS组猪在第1天在初始体重基础上损失2.7 kg,但是与初始重相比,3、7 d累积增重分别为0.03 kg和1.65 kg。PTFN组猪试验期内损失2.47 kg体重。这些表征变化可能与肠道完整性降低和内毒素渗透性增加相关。
总之,长期热应激可导致肠道完整性破坏,功能和代谢紊乱。这可能部分归结于营养摄入减少,如PFTN组猪,由于采食量减少,引起食糜流速和蠕动发生潜在变化。总之,本试验结果有助于解释热应激是如何直接或间接(通过减少采食量)影响肠道生理、吸收代谢和动物生长性能参数的(Pearce等,2013)。
[1]Bottje W G,Carstens G E.Association of mitochondrial function and feed efficiency in poultry and livestock species[J].Journal of Animal Science,2008,87(14):48~63.
[2]Craig S A.Betaine in human nutrition[J].American Journal of Clinical Nutrition,2004,80(3):539~549.
[3]Cronje P B.Gut health,osmoregulation and resilience to heat stress in poultry[A].Proceedings of the 19th Australian Poultry Science Symposium,Sydney,New South Wales,Australia,12-14 February 2007ed[C].2007.9~13.
[4]Dokladny K,Moseley P L,Ma T Y.Physiologically relevant increase in temperature causes an increase in intestinal epithelial tight junction permeability[J].American Journal of Physiology Gastrointestinal&Liver Physiology,2006,290(2):204~212.
[5]Dokladny K,Ye D,Kennedy J C,et al.Cellular and molecular mechanisms of heat stress-induced up-regulation of occludin protein expression:regulatory role of heat shock factor-1[J].American Journal of Pathology,2008,172(3):659~670.
[6]Ferraris R P,Carey H V.Intestinal transport during fasting and malnutrition[J].Annual Review of Nutrition,2000,20(1):195~219
[7]Fuller W,Parmar V,Eaton P,et al.Cardiac ischemia causes inhibition of the Na/K ATPase by a labile cytosolic compound whose production is linked to oxidant stress[J].Cardiovascular Research,2003,57(4):1044~1051.
[8]Gabler N K,J Scott R,Spencer J D,et al.Feeding long-chain n-3 polyunsaturated fatty acids during gestation increases intestinal glucose absorption potentially via the acute activation of AMPK[J].Journal of Nutritional Biochemistry,2009,20(1):17~25.
[9]Gabler N K,Spencer J D,Webel D M,et al.In utero and postnatal exposure to long chain(n-3)PUFA enhances intestinal glucose absorption and energy stores in weanling pigs[J].Journal of Nutrition,2007,137(11):2351~2358.
[10]Hall D M,Baumgardner K R,Oberley T D,et al.Splanchnic tissues undergo hypoxic stress during whole body hyperthermia[J].American Journal of Physiology,1999,276:1195~1203.
[11]Hall D M,Buettner G R,Oberley L W,et al.Mechanisms of circulatory and intestinal barrier dysfunction during whole body hyperthermia[J].American Journal of Physiology Heart&Circulatory Physiology,2001,280(2):509~521.
[12]Ikari A,Nakano M,Suketa Y,et al.Reorganization of ZO-1 by sodiumdependent glucose transporter activation after heat stress in LLC-PK1 cells[J]. Journal of Cellular Physiology,2005,203:471~478.
[13]Lackeyram D,Yang C.Early weaning reduces small intestinal alkaline phosphatase expression in pigs[J].Journal of Nutrition,2010,140(3):461~468.
[14]Lambert G P.Role of Gastrointestinal Permeability in Exertional Heatstroke[J].Exercise&Sport Sciences Reviews,2004,32(4):185~190.
[15]Lambert G.Intestinal barrier dysfunction,endotoxemia,and gastrointestinal symptoms:the'canary in the coal mine'during exercise-heat stress[J]. Medicine&Sport Science,2008,53(53):61~73.
[16]Lambert G P.Stress-induced gastrointestinal barrier dysfunction and its inflammatory effects[J].Journal of Animal Science,2009,87(14):101~108.
[17]Lambert G P,Gisolfi C V,Berg D J,et al.Selected Contribution:Hyperthermia-induced intestinal permeability and the role of oxidative and nitrosative stress[J].Journal of Applied Physiology,2002,92(4):1750~1761.
[18]Leon L R.Heat stroke and cytokines[J].Progress in Brain Research,2007,162:481~524.
[19]Lim C L,Wilson G,Brown L,et al.Pre-existing inflammatory state compromises heat tolerance in rats exposed to heat stress[J].American Journal of Physiology Regulatory Integrative&Comparative Physiology,2007,292(1):186~194.
[20]Liu F,Yin J,Du M,et al.Heat-stress-induced damage to porcine small intestinal epithelium associated with downregulation of epithelial growth factor signaling[J].Journal of Animal Science,2009,87(6):1941~1949.
[21]Livak K J,Schmittgen T D.Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-△△CT Method[J].Methods,2001,25(4):402~408.
[22]Maier S,Pajk W,H,Hausdorfer H,et al.Epoprostenol improves mucosal tissue oxygen tension in an acute endotoxemic pig model[J].Shock,2009,31(1):104~110.
[23]Mani V,Harris A J,Keating A F,et al.Intestinal integrity,endotoxin transport and detoxification in pigs divergently selected for residual feed intake[J].Journal of Animal Science,2013,91(5):2141~2150.
[24]Milligan L P,Mcbride B W.Energy costs of ion pumping by animal tissues[J].Journal of Nutrition,1985,115(10):1374~1382.
[25]S C,Gabler N K,Ross J W,et al.The effects of heat stress and plane of nutrition on metabolism in growing pigs[J].Journal of Animal Science,2013,91(5):2108~2118.
[26]Pearce S C,Mani V,Boddicker R L,et al.Heat stress reduces barrier function and alters intestinal metabolism in growing pigs[J].Journal of Animal Science,2012,4(13):257~259.
[27]Prosser C,Stelwagen K,Cummins R,et al.Reduction in heat-induced gastrointestinal hyperpermeability in rats by bovine colostrum and goat milk powders[J].Journal of Applied Physiology,2004,96(2):650~654
[28]Rhoads M L,Rhoads R P,Vanbaale M J,et al.Effects of heat stress and plane of nutrition on lactating Holstein cows:I.Production,metabolism,and aspects of circulating somatotropin[J].Journal of Dairy Science,2009,92(5):1986~1997.
[29]Street T O,Krukenberg K A,Rosgen J,et al.Osmolyte-induced conformational changes in the Hsp90 molecular chaperone[J].Protein Science,2010,19(1):57~65.
[30]Suzuki K,Ota H,Sasagawa S,et al.Assay method for myeloperoxidase in human polymorphonuclear leukocytes[J].Analytical Biochemistry,1983,132(2):345~352.
[31]Tomita M,Ohkubo R,Hayashi M.Lipopolysaccharide transport system across colonic epithelial cells in normal and infective rat[J].Drug Metabolism& Pharmacokinetics,2004,19(1):33~40.
[32]Ueda I,Wada T.Determination of inorganic phosphate by the molybdovanadate method in the presence of ATP and some interfering organic bases[J].Analytical Biochemistry,1970,37(1):169~174.
[33]Yan Y E,Zhao Y Q,Hui W,et al.Pathophysiological factors underlying heatstroke[J].Medical Hypotheses,2006,67(3):609~617.
[34]Yang P C,He S H,Zheng P Y.Investigation into the signal transduction pathway via which heat stress impairs intestinal epithelial barrier function[J]. Journal of Gastroenterology&Hepatology,2007,22(11):1823~1831.
[35]Yin C,Pettigrew A,Loftus J P,et al.Tissue concentrations of 4-HNE in the black walnut extract model of laminitis:indication of oxidant stress in affected laminae[J].Veterinary Immunology&Immunopathology,2009,129(3–4):211~215.
S815
A
1004-3314(2016)03-0036-08
10.15906/j.cnki.cn11-2975/s.20160309
