血浆活化蛋白C水平在老年糖尿病肾病动脉粥样硬化形成中的机制
2016-10-26张林霞
张林霞 孙 茜 孙 波
(唐山工人医院,河北 唐山 063000)
血浆活化蛋白C水平在老年糖尿病肾病动脉粥样硬化形成中的机制
张林霞孙茜孙波
(唐山工人医院,河北唐山063000)
目的探讨血浆活化蛋白C(APC)在老年糖尿病肾病(DN)动脉粥样硬化(AS)形成。方法2型糖尿DN病未接受透析治疗的老年患者60例和本院体检中心52例健康志愿者。ELISA法检测可溶性血栓调节蛋白(sTM)、可溶性血管细胞黏附分子(sVCAM)-1、可溶性血管内皮细胞蛋白C受体(sEPCR)、APC水平,超声检测颈动脉内-中膜厚度(IMT)。根据尿蛋白严重程度将60例患者分为微量蛋白尿组26例(30 mg/d<尿蛋白量≤300 mg/d)和蛋白尿组34例(尿蛋白量>300 mg/d);根据患者IMT水平分为IMT<0.1 cm组12例、0.1 cm≤IMT≤0.12 cm组14例、IMT>0.12 cm组34例;分析与血管内皮损伤指标的关系。结果糖尿病肾病患者IMT水平与24 h尿白蛋白、sTM、sVCAM-1、sEPCR呈明显正相关(P<0.05);APC水平与24 h尿白蛋白、sTM、sVCAM-1、IMT呈明显负相关(P<0.05);对照组、微量蛋白尿组、蛋白尿组之间sTM、sVCAM-1、sEPCR、APC、IMT均有统计学差异(P<0.05);不同颈动脉IMT组之间APC水平有统计学差异(P<0.05)。结论老年DN患者血浆APC水平与病情严重程度和IMT呈负相关,APC水平降低可能导致炎性介质水平升高和内皮细胞损伤而参与DN患者AS的发生发展。
血浆活化蛋白C;糖尿病肾病;动脉粥样硬化
蛋白C是一类由肝脏合成的维生素K依赖性蛋白酶,经凝血酶活化后成为激活的蛋白C(APC)。APC作为一种体内重要保护因子,具有抗凝、抗炎、抗氧化应激等作用。炎性反应为诱发血管内皮损伤的主要机制,相关研究显示,APC能够通过改善败血症患者体内炎症状态,防止肾损伤,外源性APC还能够缓解糖尿病肾病(DN)进展〔1〕。而DN患者体内APC水平降低加重体内炎性反应和内皮细胞损伤能否促进动脉粥样硬化(AS)形成至今尚未明确。同时考虑到DN多发于老年人群〔2〕,而AS也是诱发老年人全身性疾病的重要原因。因此,本次研究拟分析DN患者血浆APC、炎性介质水平、内皮细胞损伤情况,并探讨与其AS的相关性。
1 资料与方法
1.1一般资料选取2014年1~12月本院收治的2型糖尿病DN未接受透析治疗的患者60例。筛选标准:年龄≥60岁,患者及其家属自愿参与本次研究并签署知情同意书;糖尿病病程≥6年,糖尿病视网膜病变;尿白蛋白量>30 mg/d;无严重应激状态。入选本研究前2个月内未使用免疫抑制剂、激素,以及其他可引发肾损伤的药物。男36例,女24例;年龄60~78岁,平均(67.29±8.87)岁。选取同期本院体检中心52例健康老年志愿者为对照组,男32例,女20例;年龄56~74岁,平均(65.07±6.32)岁;入选者血压、血常规、尿常规、尿微量蛋白、肝肾功能均正常。
1.2方法
1.2.1颈动脉内-中膜厚度(IMT)检测采用美国GEVivid7Pr0彩色多普勒超声诊断仪检测IMT,由本院同一名超声科医师单盲检测,IMT值取两侧最大值,≥1 mm为IMT增厚,分叉处>1.2 mm为斑块。
1.2.2实验室指标检测清晨抽取两组研究对象空腹肘静脉血,放于枸橼酸钠抗凝管中,5 000 r/min离心30 min,取上清置于-80℃超低温冰箱中保存待测。采用ELISA法检测可溶性血栓调节蛋白(sTM)、可溶性血管细胞黏附分子(sVCAM)-1、可溶性血管内皮细胞蛋白C受体(sEPCR)、APC,试剂盒购于上海心语生物科技有限公司。采用贝克曼库尔特ACCESS2化学发光免疫分析仪检测全段甲状旁腺激素(iPTH);迈瑞Bc2600全自动血球分析仪检测血常规;迈瑞BS-400全自动生化分析仪检测血生化。
1.3统计学分析采用SPSS13.0软件进行t检验,多组间进行单因素F检验;进行两变量直线相关分析。
2 结 果
2.1IMT、APC与各指标相关性分析DN患者IMT水平与24 h尿白蛋白、sTM、sVCAM-1、sEPCR呈明显正相关(P<0.05);APC水平与24 h尿白蛋白、sTM、sVCAM-1、IMT呈明显负相关(P<0.05),见表1。
2.2不同程度蛋白尿患者血管内皮损伤指标比较根据患者尿蛋白严重程度分为微量蛋白尿组26例(30 mg/d<尿蛋白量≤300 mg/d)和蛋白尿组34例(尿蛋白量>300 mg/d),方差分析显示,对照组、微量蛋白尿组、蛋白尿组之间sTM、sVCAM-1、sEPCR、APC、IMT均有统计学差异(P<0.05),见表2。
2.3不同IMT病变患者血管内皮损伤指标比较根据患者IMT水平分为IMT<0.1 cm组12例、0.1 cm≤IMT≤0.12 cm组14例、IMT>0.12 cm组34例。方差分析显示,三组间APC水平差异有统计学意义(P<0.05),见表3。
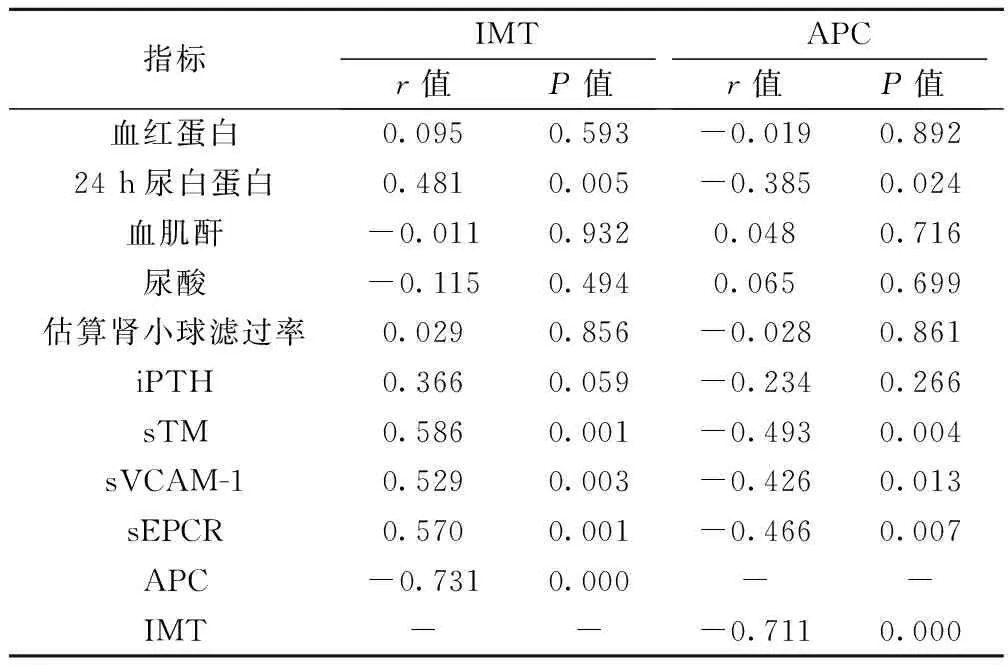
表1 DN患者IMT、APC与各指标相关性分析
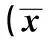
表2 不同程度蛋白尿患者血管内皮损伤指标比较±s)
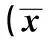
表3 不同IMT病变患者血管内皮损伤指标比较±s)
3 讨 论
机体处于长时间高血糖状态可增强体内氧化应激、炎性介质、PKC等信号途径,损伤内皮细胞,这是DN患者AS发生、发展的主要原因。相关研究显示,外源性APC可有效抑制DN小鼠肾功能的恶化,因此推测,APC水平下降能够加快肾功能和进展速度〔3〕。
本次研究中DN患者APC水平明显降低,说明该类患者AS与APC对内皮细胞保护能力降低有关。随着蛋白尿程度、IMT的增加APC水平明显降低,说明随着患者肾脏病情的恶化,APC水平降低,导致对细胞的保护作用明显减弱,加重了AS进程。血管内皮细胞表面均存在sTM受体、sEPCR表达,当内皮细胞受到损伤时,sTM受体、sEPCR从细胞膜表面脱落,使细胞表面sTM受体、sEPCR密度降低。脱落到血浆中的sEPCR虽然仍能够与APC结合,但会抑制APC活性。本研究结果提示患者血管内皮细胞受到了明显损伤,进一步引发APC水平下降,加速AS进程。但也有研究显示,糖尿病患者APC受体表达水平与正常人无明显差异〔4,5〕,而本次研究的DN患者病程较长,同时存在肾损害,病情较重,血管内皮细胞受损较严重,可能导致与相关研究结论不同。
血管壁表面微炎性状态也是AS形成的重要机制〔6〕。sVCAM-1多表达于内皮和平滑肌细胞,诱导炎性因子黏附,参与AS形成〔7〕。糖尿病患者血管壁表面sVCAM-1水平明显提升,但在AS早期sVCAM-1表达更明显,且与肾功能密切相关,可作为DN早期血管损害的标志物。本研究提示DN患者体内APC水平随病情进展而降低,导致抗炎作用减弱,体内炎性反应增强,促进AS的形成。
1陈娅,丁涵露,王莉,等.Ad-FLT-1/PC对糖尿病肾病动脉粥样硬化大鼠炎症因子表达的影响〔J〕.中华医学杂志,2015;95(24):1961-5.
2周颖,冯烈.老年糖尿病肾病肾内动脉阻力指数异常与颈动脉粥样硬化的相关性〔J〕.中国老年学杂志,2015;35(15):4227-8.
3钱书虹,钱庆文.对氧磷酶2 C311S与对氧磷酶1 Q192R基因多态性与糖尿病肾病的关系〔J〕.中华肾脏病杂志,2010;26(2):132-3.
4刘坤,高志敏.脂联素与2型糖尿病及其血管并发症关系的研究进展〔J〕.医学综述,2012;18(1):126-9.
5Keller SA,Moore CC,Evans SL,etal.Activated protein C alters inflammation and protects renal function in sepsis〔J〕.J Surg Res,2011;168(5):e103-6.
6刘鹏,王德宝,张凤梅,等.替米沙坦对早期糖尿病肾病患者血浆同型半胱氨酸及颈动脉内膜中层厚度的影响〔J〕.中国全科医学,2012,15(21):2431-3.
7杨生,张鲁宁.糖尿病肾病与脂联素、血管细胞黏附分子-1的相关性〔J〕.中国老年学杂志,2010;30(21):3155-6.
〔2015-12-30修回〕
(编辑李相军)
河南省医学科技攻关计划项目(No.201304053)
张林霞(1970-),女,硕士,副主任医师,主要从事老年肾脏、心脏等疾病研究。
R587
A
1005-9202(2016)17-4186-03;doi:10.3969/j.issn.1005-9202.2016.17.023
