斑马鱼模型在药物研发早期肾脏毒性中的应用研究
2016-10-26梁锦锋朱勇张洪瑶劳乔聪马敏康李春启
梁锦锋,朱勇,张洪瑶,劳乔聪,马敏康,李春启
(1.浙江省药品化妆品审评中心,杭州 310012;2.杭州环特生物科技股份有限公司,杭州 310012)
斑马鱼模型在药物研发早期肾脏毒性中的应用研究
梁锦锋1*,朱勇1,张洪瑶1,劳乔聪2,马敏康1,李春启2
(1.浙江省药品化妆品审评中心,杭州310012;2.杭州环特生物科技股份有限公司,杭州310012)
目的 利用斑马鱼模型评价注射用盐酸万古霉素和厄贝沙坦片的肾毒性。方法构建AB系斑马鱼肾脏模型,药物处理受精后2 d(2 dpf)的斑马鱼至5 dpf,统计各实验组斑马鱼肾性水肿发生率,判断药物是否具有肾毒性。结果万古霉素在注射剂量为16.4 ng/尾(1/10 MNLD)时,斑马鱼发育正常,未见明显的毒性;在注射剂量为54.7 ng/尾(1/3 MNLD)、164 ng/尾(MNLD)和273 ng/尾(LD10)时,斑马鱼肾性水肿发生率分别为3.3%、10%和10%,死亡率分别为0%、0%和16.7%,表明万古霉素在注射剂量54.7 ng/尾(1/3 MNLD)至273 ng/尾(LD10)的范围内,有明显的肾毒性。厄贝沙坦在浓度为8.3 μg/mL(1/10 MNLC)至91 μg/mL(LC10)范围内,斑马鱼肾脏均发育正常,未见肾毒性。结论斑马鱼肾毒性模型的建立,可用于药物肾毒性的早期评价,并且精确评价了万古霉素和厄贝沙坦的肾脏毒性。
斑马鱼;肾毒性;新药研发;万古霉素;厄贝沙坦
在药物临床前和临床研究过程中,超过70%的新药由于其本身的毒性和安全性等问题被淘汰。因此,建立快速、经济、有效的药物早期安全性评价技术已成为国内外新药研发领域的研究热点,在新药研发过程中具有非常重要的意义。在新药研发早期阶段,体外细胞、分子生物学手段具有快速、高效、经济等特点,但是由于其过程在吸收、分布、代谢、排泄等方面与人体有较大的差异,在很大程度上不能替代体内试验。而常规的动物体内实验采用的动物模型如猴、犬、大小鼠等由于存在动物福利、实验成本等问题,严重制约了其在早期筛选中的应用。
由于养殖方便、繁殖周期短、胚胎体外受精、产卵量大、胚体透明,斑马鱼已成为生命科学研究中的新宠。在国际上,斑马鱼在生物学中逐渐使用于生命体的各种系统,如神经系统、免疫系统、心血管系统、生殖系统等的发育[1-3]、功能和疾病的研究,已建立了神经退行性疾病、心血管疾病[4,5]、糖尿病[6]、肿瘤[7]、免疫系统疾病,造血系统疾病,先天缺陷等方面疾病的模型,并已广泛应用于药物的毒性研究[8-12]。
在肾毒性研究中,实验人员使用斑马鱼建立了各种肾脏毒性模型[13-15],包括肾毒性引起的局部水肿(心包水肿、眼水肿和脑水肿等) 或全身水肿模型,肾小球滤过障碍模型,肌酐检测模型,以及基于基因构建的转基因斑马鱼模型等。肾脏毒性的斑马鱼模型已经广泛使用于肾脏的发育机制及药物肾脏毒性的机制及药效学研究中。药物诱导斑马鱼发生肾脏毒性时往往会引起肾脏的形态学的改变,因此本研究基于此建立了快速、高效的肾脏毒性早期检测方法,为新药的临床前研究提供早期的安全性信息。
1 材料和方法
1.1实验动物
野生型AB品系斑马鱼,以自然成对交配的方式进行交配。受精后2 d(2 dpf)挑选合适的胚胎进行给药试验。在28℃条件下用养鱼用水孵育胚胎(每1L反渗透水中加入200 mg速溶海盐,电导率为 480~510 μS/cm;pH 为 6.9~7.2;硬度为 53.7~71.6 nmol/L CaCO3)。实验完成后,用三卡因甲磺酸对各个发育阶段的斑马鱼进行过度暴露处理,从而将斑马鱼麻醉处死后进行相应检测。
1.2主要试剂与仪器
注射用盐酸万古霉素,由Eli Lilly Japan K.K生产,批号C218774;厄贝沙坦片,由赛诺菲(杭州)制药有限公司生产,批号4A245;阳性对照药物马兜铃酸购自于阿拉丁,批号A111318;解剖显微镜(SZX7,OLYMPUS,Japan);与显微镜相连的相机(TK-C1481EC, JVC, Japan);显微注射仪(IM-300,Narishige),拉针仪(PC-10, Narishige, Japan);精密电子天平(CP214,奥豪斯)。
1.3实验方法
1.3.1药物的LD10(LC10)和最大非致死剂量(MNLD)(最大非致死浓度(MNLC))测定
注射用盐酸万古霉素采用血液循环注射给药,厄贝沙坦片采用溶解给药,每个实验组均处理30尾斑马鱼,注射用盐酸万古霉素的5个检测剂量分别为:1000 ng/尾、500 ng/尾、250 ng/尾、125 ng/尾和62.5 ng/尾,厄贝沙坦片的浓度为0.1 μg/mL、1 μg/mL、10 μg/mL、100 μg/mL和1000 μg/mL;药物处理结束后,统计各实验组的斑马鱼死亡数量,使用统计学软件Origin 8.0绘制最佳的剂量效应曲线,并计算LD10和MNLD或LC10和MNLC。
1.3.2浓度或剂量设置
注射用盐酸万古霉素选取4个剂量或浓度进行检测(注射给药分别为LD10、MNLD、1/3 MNLD和1/10 MNLD,厄贝沙坦溶解给药分别为LC10、MNLC、1/3 MNLC和1/10 MNLC),浓度或剂量设置如表1所示。

表1 肾毒性评价实验药物浓度或剂量组别
1.3.3药物对斑马鱼肾脏的影响
依据预试验得到的药物致死曲线,每种药物选取4个剂量或浓度进行检测(通常为LD10、MNLD、1/3 MNLD和1/10 MNLD或LC10、MNLC、1/3 MNLC和1/10 MNLC);阳性对照组给以4 μM马兜铃酸,每个实验组均处理30尾斑马鱼,药物处理72 h后,每组随机取10条斑马鱼观察有无肾性水肿形成。对异常形态进行拍照,并统计肾性水肿发生率。
2 结果
2.1药物的LD10(LC10)和最大非致死剂量(MNLD)(最大非致死浓度(MNLC))
根据各实验组斑马鱼的死亡数(见表2),使用Origin 8.0软件绘制万古霉素剂量致死曲线(图1),得到万古霉素的MNLD为164 ng/尾,LD10为273 ng/尾。
根据各实验组斑马鱼的死亡数(见表3),使用Origin 8.0软件绘制厄贝沙坦浓度致死曲线(图2),得到厄贝沙坦的MNLC为83 μg/mL,LC10为91 μg/mL。

表2 万古霉素处理的斑马鱼死亡率统计(n=30)
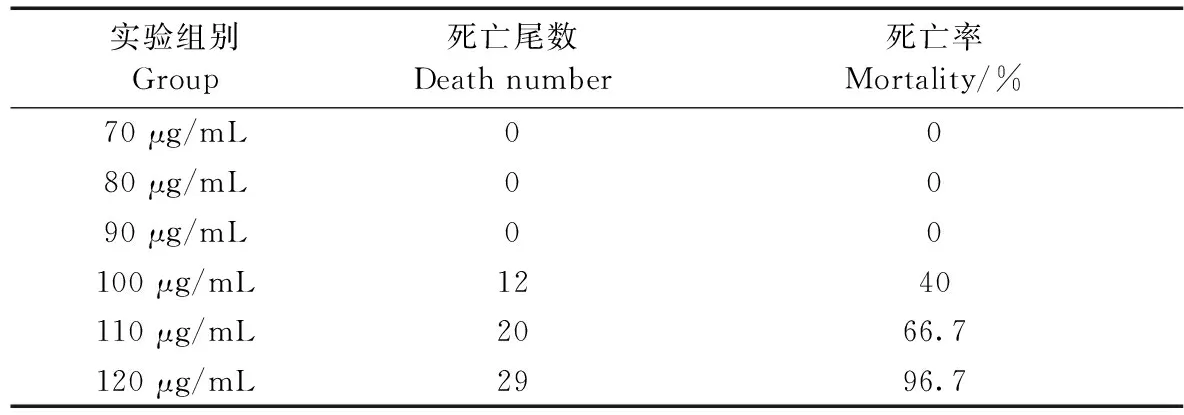
表3 厄贝沙坦处理的斑马鱼死亡率统计(n=30)
2.2不同药物对斑马鱼肾性水肿的影响
2.2.1万古霉素对斑马鱼肾性水肿的影响
万古霉素在注射剂量为16.4 ng/尾(1/10 MNLD)时,斑马鱼发育正常,未见明显的毒性;在注射剂量为54.7 ng/尾(1/3 MNLD)、164 ng/尾(MNLD)和273 ng/尾(LD10)时,斑马鱼肾性水肿发生率分别为3.3%、10%和10%,死亡率分别为0%、0%和16.7%,说明万古霉素在注射剂量为54.7 ng/尾(1/3 MNLD)至273 ng/尾(LD10)的范围内,有明显的肾毒性(表4,图3-4)。
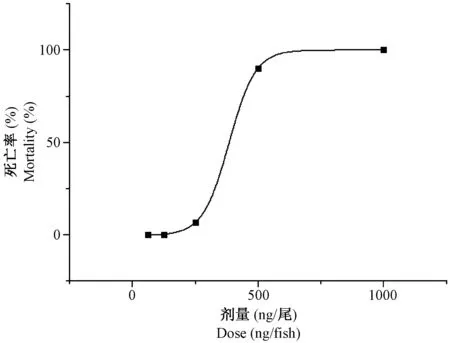
图1 万古霉素浓度致死曲线Fig.1 Vancomycin-induced dose-dependent zebrafish mortality
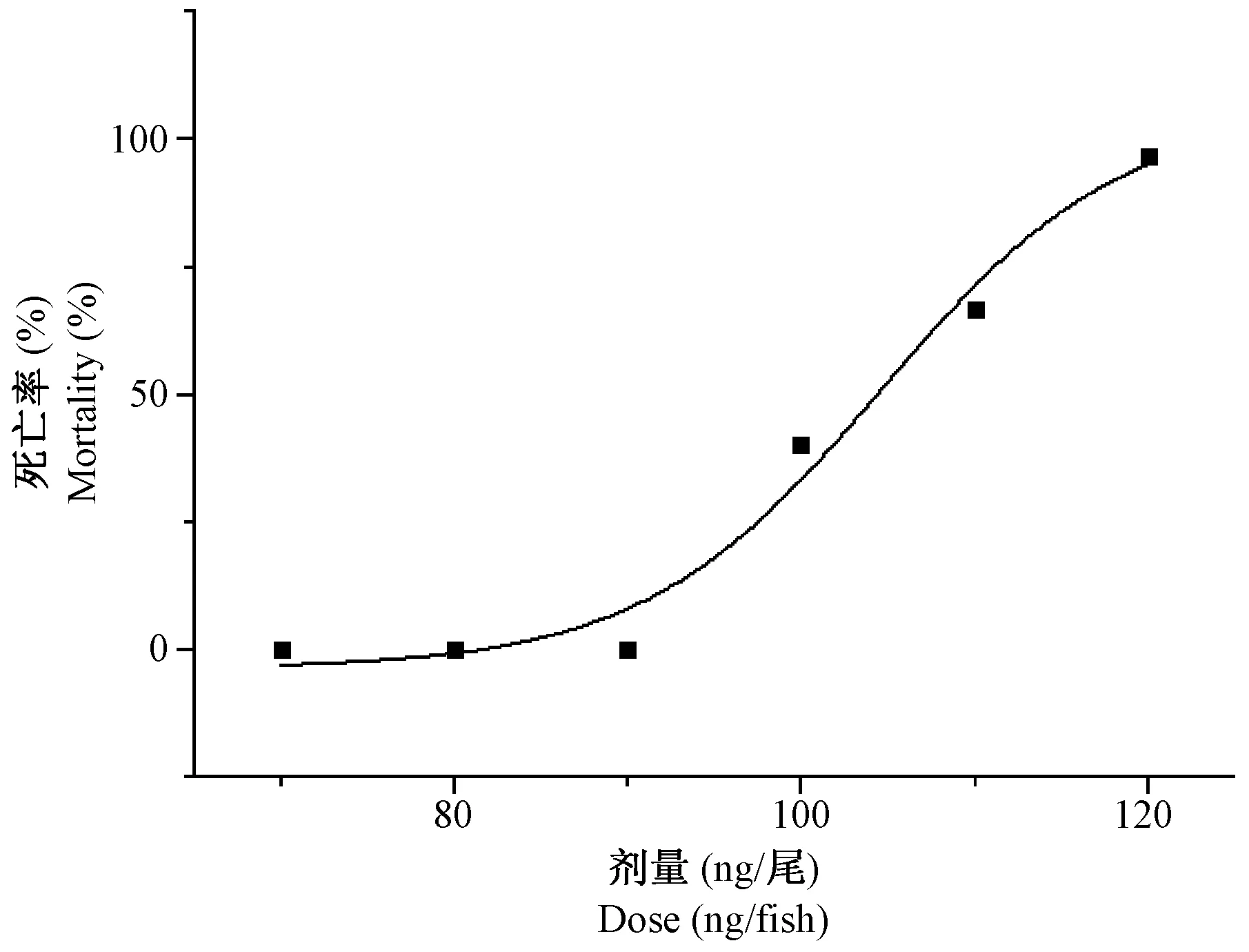
图2 厄贝沙坦浓度致死曲线Fig.2 Irbesartan-induced dose-dependent zebrafish mortality
2.2.2厄贝沙坦对斑马鱼肾性水肿的影响
厄贝沙坦在浓度为8.3 μg/mL(1/10 MNLC)至91 μg/mL(LC10)范围内,斑马鱼均发育正常,未见厄贝沙坦诱导肾毒性发生(表5,图5-6)。

表4 万古霉素对斑马鱼肾毒性的影响
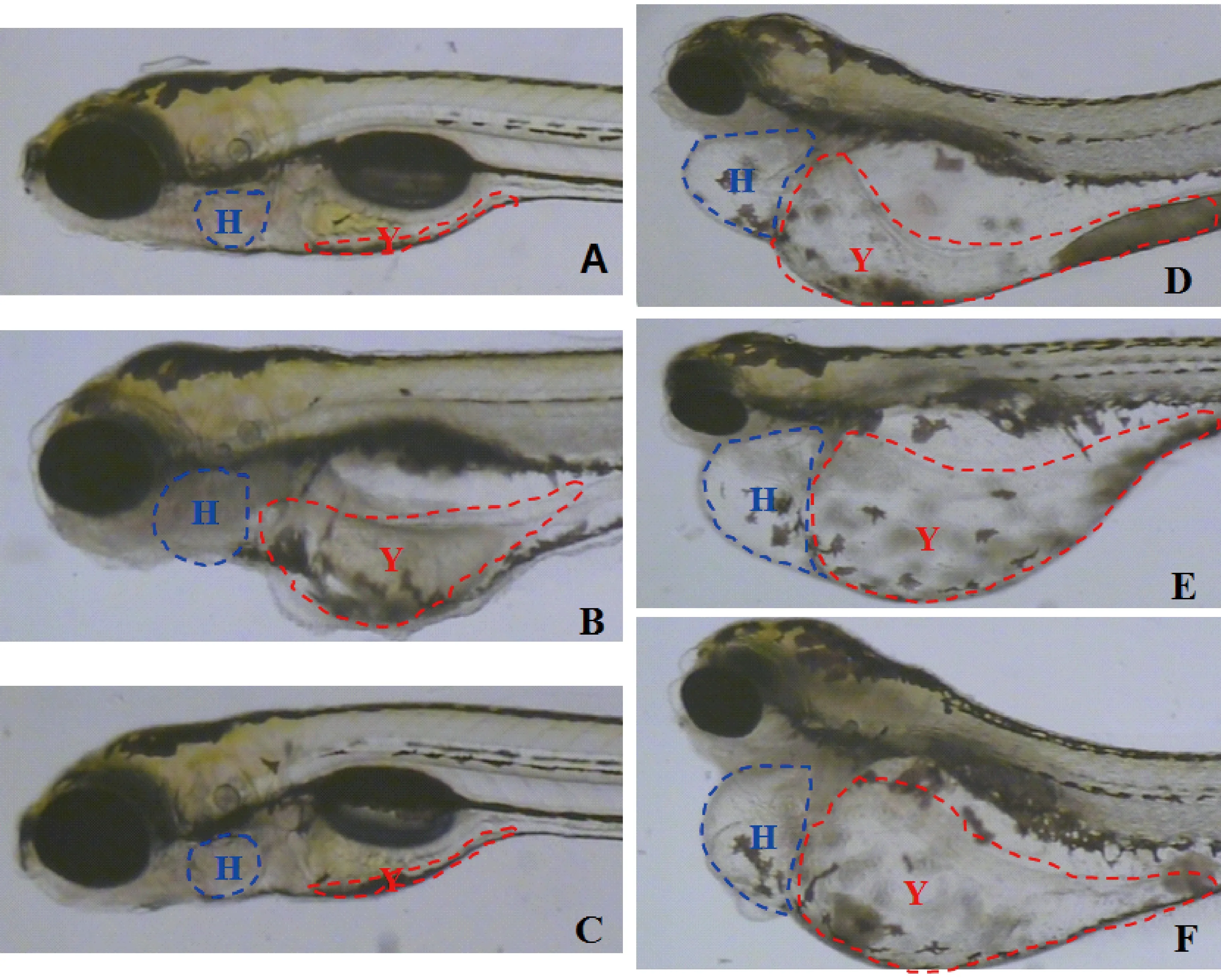
注:(H)心脏;(Y)卵黄囊;(A)空白组;(B)4 μM马兜铃酸;(C)16.4 ng万古霉素;(D)54.7 ng万古霉素;(E)164 ng万古霉素;(F)273 ng万古霉素。图3 万古霉素诱发的毒性表型Note. (H) heart; (Y) yolk sac;(A)Blank;(B)4 μM Aristolochic acids;(C)16.4 ng vancomycin;(D)54.7 ng vancomycin;(E)164 ng vancomycin;(F)273 ng vancomycin.Fig.3 Visual observation of zebrafish after microinjection of vancomycin
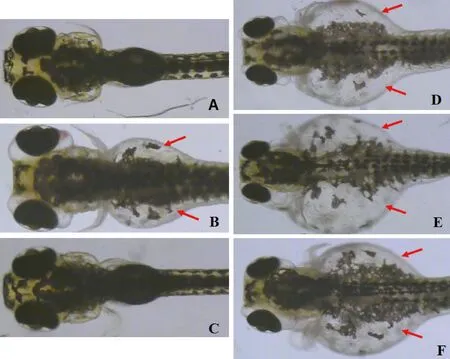
注:(A)空白组;(B)4 μM马兜铃酸;(C)16.4 ng万古霉素;(D)54.7 ng万古霉素;(E)164 ng万古霉素;(F)273 ng万古霉素。图4 万古霉素诱发的肾性水肿(红色箭头指示肾性水肿)Note.(A)Blank;(B)4 μM Aristolochic acids;(C)16.4 ng vancomycin;(D)54.7 ng vancomycin;(E)164 ng vancomycin;(F)273 ng vancomycin.Fig.4 The renal edema induced by vancomycin (red arrows indicate renal edema)
表5 厄贝沙坦对斑马鱼肾毒性影响
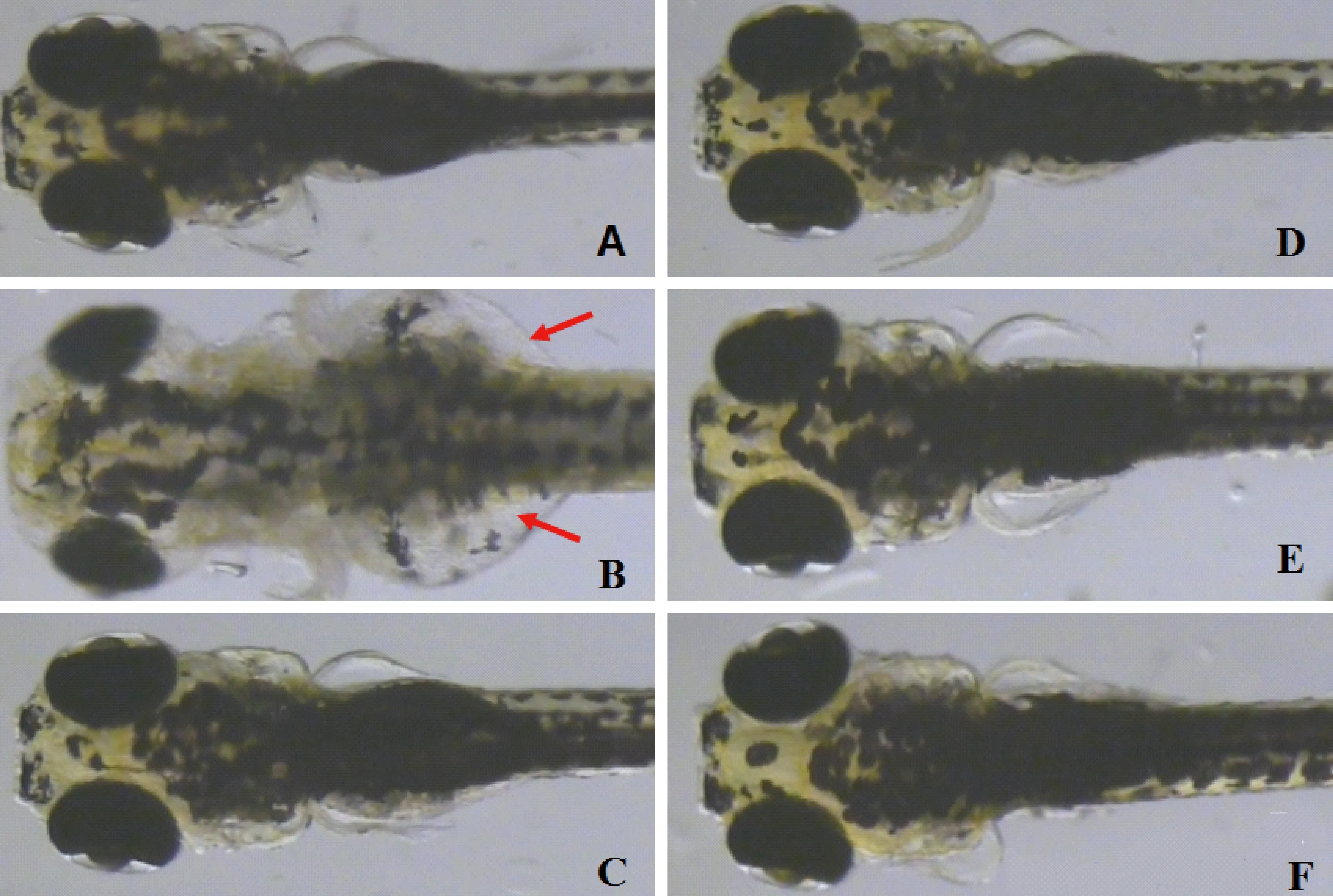
注:(A)空白组;(B)4 μM马兜铃酸;(C)8.3 μg/mL厄贝沙坦;(D)27.7 μg/mL厄贝沙坦;(E)83 μg/mL厄贝沙坦;(F)91 μg/mL厄贝沙坦。图6 厄贝沙坦的斑马鱼背光图(红色箭头指示肾性水肿)Note.(A)Blank;(B)4 μM Aristolochic acids;(C)8.3 μg/mL irbesartan;(D)27.7 μg/mL irbesartan;(E)83μg/mL irbesartan;(F)91μg/mL irbesartan.Fig.6 Visual observation of zebrafish’s backside (red arrows indicate renal edema)
3 讨论
斑马鱼作为较为常用的三大模式动物之一,是药物早期安全性评价的理想模型。通过针对各类疾病发生发展的机制和药物在其体内产生毒性的机制研究,在斑马鱼上已建立了多种药效学和临床前安全性评价的模型和技术,通过这些模型和技术的使用,可以在药物研发的早期发现药物的有效性和安全性,缩短新药研发的周期,降低新药研发的成本。
肾脏是人体最主要的排泄器官,极易受到体内排泄的化合物的影响而引起肾脏损伤,肾脏毒性成为制约新药研发的重要原因之一,针对肾脏毒性的新型模型的研究已成为药物研发的热点。通过对斑马鱼在肾脏毒性中的应用的调研,我们运用斑马鱼构建了基于形态改变的肾脏毒性的评价体系,并将其运用于药物的肾脏毒性评价,这一发现为斑马鱼肾脏毒性模型在新药研发中的应用提供了实验支撑。
万古霉素是治疗耐甲氧西林金葡菌(MRSA)最常用的糖肽类抗生素,已有很长的使用历史,是治疗MRSA检出的首选药物。但是有大量的文献报道提示万古霉素具有显著的肾脏毒性,其发生率较高。万古霉素通过导致肾小管近曲端上皮细胞氧化应激反应引起肾脏毒性[16]。在本实验中,万古霉素在较低剂量下即可引起斑马鱼的肾性水肿,表现出明显的肾脏毒性。
而在另一个药物厄贝沙坦中,厄贝沙坦是新型血管紧张素Ⅱ受体的阻滞剂,可通过调整血流动力学,改善肾小球基底膜通透性,降低系膜细胞增生和小管间质纤维化程度等对肾脏产生保护作用[17]。在本实验中,厄贝沙坦的所有给药浓度下均未发现肾性水肿发生,表明厄贝沙坦无明显肾脏毒性作用,这也与其在临床上对肾脏的保护作用一致。
通过本实验的开展,我们发现了以斑马鱼为载体的早期肾脏毒性评价模型和技术,有利于斑马鱼研究领域的进一步扩展及新药的临床前早期评价。
[1]Choi SY, Baek JI, Zuo X,etal. Cdc42 and sec10 Are Required for Normal Retinal Development in Zebrafish[J]. Invest Ophthalmol Vis Sci., 2015, 56(5):3361-3370.
[2]Hong H, Shen R, Liu W,etal. Developmental toxicity of three hexabromocyclododecane diastereoisomers in embryos of the marine medaka Oryzias melastigma[J]. Mar Pollut Bull, 2015, 101(1):110-118.
[3]Nishimura Y, Inoue A, Sasagawa S,etal. Using zebrafish in systems toxicology for developmental toxicity testing[J]. Congenit Anom (Kyoto), 2016, 56(1):18-27.
[4]Vornanen M, Hassinen M. Zebrafish heart as a model for human cardiac electrophysiology[J]. Channels (Austin), 2016,10(2):101-110.
[5]Seto SW, Kiat H, Simon M,etal. Zebrafish models of cardiovascular diseases and their applications in herbal medicine research[J]. European Journal of Pharmacology, 2015, 768:77-86.
[6]Sarras MP, Leontovich AA, Intine RV. Use of zebrafish as a model to investigate the role of epigenetics in propagating the secondary complications observed in diabetes mellitus[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2015, 178:3-7.
[7]Zhang B, Shimada Y, Hirota T,etal. Novel immunologic tolerance of human cancer cell xenotransplants in zebrafish[J]. Transl Res, 2016,70:89-98.
[8]Boran H, Ulutas G. Genotoxic effects and gene expression changes in larval zebrafish after exposure to ZnCl2 and ZnO nanoparticles[J]. Dis Aquat Organ, 2016, 117(3):205-214.
[9]Veldman MB, Rios-Galdamez Y,Lu XH,etal. The N17 domain mitigates nuclear toxicity in a novel zebrafish Huntington’s disease model[J]. Mol Neurodegener, 2015,10:67.
[10]Oulmi Y, Braunbeck T. Toxicity of 4-chloroaniline in early life-stages of zebrafish (Brachydanio rerio): I. cytopathology of liver and kidney after microinjection[J]. Arch Environ Contam Toxicol, 1996, 30(3):390-402.
[11]Gao Y, Feng J, Zhu L. Prediction of acute toxicity of cadmium and lead to zebrafish larvae by using a refined toxicokinetic-toxicodynamic model[J]. Aquat Toxicol, 2015, 169:37-45.
[12]Yang Y, Qi S, Wang D,etal. Toxic effects of thifluzamide on zebrafish (Danio rerio) [J]. J Hazard Mater, 2016, 307:127-136.
[13]Berman N, Lectura M, Thurman JM,etal. A zebrafish model for uremic toxicity: role of the complement pathway[J]. Blood Purif, 2013, 35(4):265-269.
[14]Hentschel DM, Park KM, Cilenti L,etal. Acute renal failure in zebrafish: a novel system to study a complex disease[J]. Am J Physiol Renal Physiol, 2005, 288(5):923-929.
[15]McKee AR, Wingert AR. Zebrafish Renal Pathology: Emerging Models of Acute Kidney Injury[J]. Curr Pathobiol Rep, 2015, 3:171-181.
[16]Bruniera FR, Ferreira FM, Savioli LR,etal. Endothelial, renal and hepatic variables in Wistar rats treated with Vancomycin[J]. An Acad Bras Cienc, 2014, 86(4):1963-1972.
[17]Yu QX, Zhang H, Xu WH,etal. Effect of Irbesartan on Chemerin in the Renal Tissues of Diabetic Rats[J]. Kidney Blood Press Res, 2015, 40(5):467-477.
Study on the application of zebrafish model in the early stage of renal toxicity in drug development
LIANG Jin-feng1*,ZHU Yong1,ZHANG Hong-yao1,LAO Qiao-cong2,MA Min-kang1,LI Chun-qi2
(1.Zhejiang Center for Drug and Cosmetic Evaluation,Hangzhou 310012,China;2.Hangzhou Hunter Biotechnology,Inc, Hangzhou 310012,China)
Objective To evaluate the renal toxicity of vancomycin hydrochloride and irbesartan tablets using the zebrafish model. Methods After construction of AB zebrafish kidney model, the fish were treated with drug after fertilization 2 days (2 dpf) to 5 dpf. At the end of the experiment, the number of renal edema zebrafish was counted in each experimental group to evaluate the renal toxicity of drugs. ResultsThe zebrafish development was normal and no obvious toxicity at the dose of 16.4 ng/fish (1/10 MNLD)for vancomycin, and zebrafish renal edema occurred rate was 3.3%, 10% and 10% respectively at the dose of 54.7 ng/fish (1/3 MNLD), 164 ng/fish (MNLD) and 273 ng/fish (LD10) with the death rate of 0%, 0% and 16.7%, respectively, which indicated that there was significant renal toxicity of vancomycin at the dose of 54.7 ng/fish (1/3MNLD) to 273 ng/fish (LD10). Irbesartan didn’t induce renal toxicity at the dose of 8.3 μg/mL (1/10 MNLC) to 91 μg/mL (LC10). ConclusionsThe zebrafish model of renal toxicity can be used for the early evaluation of drug renal toxicity and we made evaluation of the renal toxicity of vancomycin and irbesartan with this model.
Zebrafish; Renal toxicity; New drug evaluation; Vancomycin; Irbesartan
浙江省食品药品监管系统科技计划项目(2014002)。
梁锦锋(1976-)男,博士,高级工程师,研究方向:新药技术审评和药品再评价。E-mail: liangwind@sohu.com。
研究报告
R-332
A
1671-7856(2016)09-0030-06
10.3969.j.issn.1671-7856. 2016.09.006
2016-03-09
