hBMSCs幼年食蟹猴脑内移植的安全评价、迁移及分布
2016-10-26李加美朱华姚志刚邓威李秦马春梅秦川
李加美,朱华,姚志刚,邓威,李秦,马春梅,秦川*
(1.山东大学附属省立医院病理科,济南 250021;2.中国医学科学院&北京协和医学院,实验动物研究所病理室,北京 100021;3.中国医学科学院实验动物研究所Motac合作实验室,北京 100021)
hBMSCs幼年食蟹猴脑内移植的安全评价、迁移及分布
李加美1, 2,朱华2,姚志刚1, 2,邓威2,李秦3,马春梅2,秦川2*
(1.山东大学附属省立医院病理科,济南250021;2.中国医学科学院&北京协和医学院,实验动物研究所病理室,北京100021;3.中国医学科学院实验动物研究所Motac合作实验室,北京100021)
目的 评价hBMSCs幼年食蟹猴脑内移植的安全性,并进一步观察hBMSCs在脑内的迁移和分布情况,为治疗儿童中枢神经系统疾病建立新的技术平台及理论依据。方法直接向幼年性食蟹猴脑内注射hBMSCs,通过HE染色和免疫组化的方法观察注射部位炎症反应及免疫排斥情况;通过对hBMSCs体外标记示踪和携带的男性特异基因的检测,观察移植后hBMSCs在脑内的迁移及分布情况。结果研究结果显示直接脑内注射hBMSCs未引起受试动物出现全身症状,移植部位脑组织炎症反应局限,未见明显免疫排斥反应,未见脑组织变性坏死和明显胶质细胞增生聚集。hBMSCs移植4周后,仍大量存活,并可在脑内广泛迁移,其迁移分布具有一定的规律性,可观察到不同移植受体细胞分布重叠现象。另外,hBMSCs迁移分布具有从前脑向后脑迁移及向血管和室管膜下迁移的趋势。结论hBMSCs直接脑内注射移植安全性好;hBMSCs可以在脑内长期存活并迁移。
人骨髓间充质干细胞;食蟹猴;迁移;分布
发生在儿童的神经变性疾病及大脑外伤性损害等均可引起严重的临床神经功能障碍,这些疾病包括脑瘫、运动功能紊乱、缺血缺氧性脑病、脑外伤等,多表现为神经元的变性缺失,神经系统无法产生新的神经元、建立新的突触联系,致使中枢神经系统损伤后结构和功能难以恢复。而目前现有的临床治疗方法有限,不能达到有效恢复神经功能的目的,因此,保护神经免受损伤并促进神经再生对神经系统疾病的治疗至为关键。动物实验及临床实验均证明应用干细胞为基础的细胞治疗可以阻止并修复神经系统损伤[1-3]。
骨髓间充质干细胞(bone marrow derived-mesenchymal stem cells, BMSCs)为骨髓来源的多能干细胞,具有多向分化潜能、获取方便、易于分离培养和鉴定、遗传背景稳定及体内植入免疫反应比较弱等优点。自从首次报道其在脑内可以向神经细胞分化后,BMSCs移植治疗中枢神经系统疾病就成为了研究热点。本实验采用的人BMSCs(hBMSCs)来源于健康志愿者,前期工作已证实其在体外具有多向分化的潜能、并能快速扩增、可诱导免疫耐受、能减轻或抑制移植物抗宿主病等,在神经系统疾病、自身免疫性疾病及血液病的临床前期及临床研究中颇受重视[4, 5]。在神经系统疾病动物模型实验中,静脉及经脑移植的MSCs能够穿过血脑屏障迁移到损伤部位脑组织[6-8]。MSC为基础的治疗对中枢神经系统疾病的治疗安全而有效[9],已成功应用于多种神经系统疾病动物模型的治疗中,如脑出血、阿尔滋海默病和帕金森病[10-13]。很多实验均证实应用MSCs治疗幼年性脑缺血损伤模型非常有效,如脑瘫患者。MSCs移植已经成为可行、有效和安全的治疗方法,对神经功能的恢复效果明显[10]。
目前MSCs的移植途径主要包括直接脑内注射和间接通过静脉、动脉及腹腔注射等。间接途径移植为全身治疗,到达病变部位的时间较长,细胞数量较少,发挥作用较慢。而脑内注射移植为局部治疗,创伤小,起效快,并且脑内的免疫应答能力比较弱,因此直接脑内注射成为局部治疗中枢神经系统疾病的优先选择。但hBMSCs直接脑内移植的安全性如何?其脑内移植后能否进行迁移?这些都是hBMSCs临床应用前期亟需解决的问题。我们通过将hBMSCs直接脑内移植到幼年食蟹猴脑内,观察hBMSCs在脑内注射的安全、迁移和分布情况,为hBMSCs在儿童神经系统疾病的治疗应用奠定基础。
1 材料和方法
1.1实验动物
食蟹猴10只(2~3个月),具体体重、年龄及细胞移植情况见表1,由军事医学科学院实验动物中心提供[SCXK(军)2002-001]。动物用悬挂在脖颈处刻有档案号的标牌作为该动物的编号,动物进入动物室检疫两周。动物实验后由随其母单笼饲养。10只食蟹猴随机分为生理盐水对照组(n=2),hBMSCs移植组(n=8)。每组分为2周和4周(表1)。动物使用申请批准号:MC-07-6008。
1.2hBMSCs标记
hBMSCs 由中国医学科学院北京协和医学院基础研究所组织工程中心提供。CM-DiI(固体)溶解于DMSO,浓度为1 mg/mL。取第4~5代细胞,待细胞融合度达到80%~90%时,加入2 mL 25%胰酶,镜下观察见细胞回缩后,立即倒掉消化液,加入含10%胎牛血清的DMEM培养基2~3 mL,轻轻吹打使细胞之间分散成单个细胞,加培养基至10 mL继续吹打成单细胞悬液,并于镜下观察。离心:1000 rpm/min离心10 min。去上清,用无血清新鲜培养基重悬细胞,将配好的CM-DiI溶液加入到细胞悬液中,使其终浓度为5 μg/μL。37℃孵育5 min,4℃孵育15 min,此过程要避光处理。用生理盐水混悬细胞,调整其密度为10000个/μL。
1.3hBMSCs脑内移植
麻醉后的动物采用俯卧位固定在立体定位仪上,五点法(上颌托、双侧外耳道、双侧眶下缘中点)固定头部,读取坐标并设为坐标原点。根据注射的部位(右侧尾状核头部)得出注射点坐标。Antero-posterior (AP)=+16,Depth (D)=+20,lateral (L)=-4,AP代表前后方向,D代表注射深度,L代表侧方坐标。hBMSCs用微量加样器注射到右侧尾状核;注射细胞数量为1×106个细胞,注射体积为125 μL,注射速率:10 μL/min,注射完后留针3 min;生理盐水对照组注射等体积生理盐水。无菌手术在中国医学科学院实验动物研究所进行[SYXK(京)2005-0042],并按实验动物使用的3R原则给予人道的关怀。
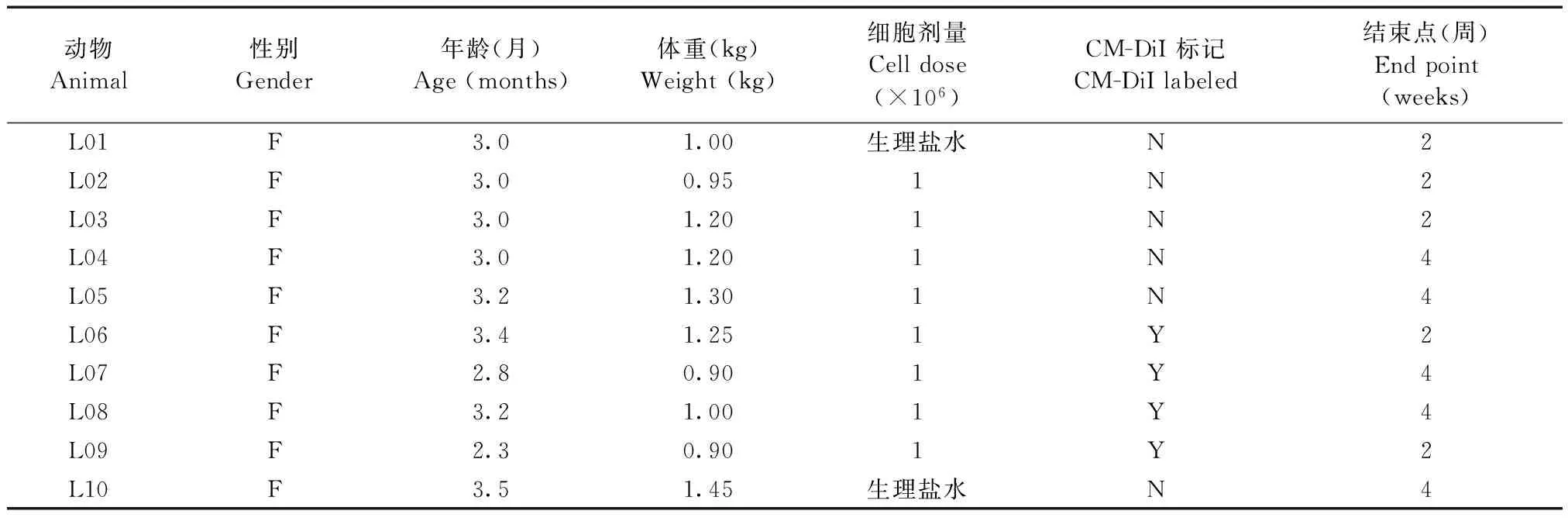
表1 食蟹猴的生理指标及实验分组情况
1.4脑组织取材
解剖前麻醉动物,待动物进入麻醉状态后,股动脉放血处死。开颅取脑,脑组织取材在中国医学科学院实验动物研究所进行[SYXK(京)2005-0042]。具体取材参考Isakova等[10]的方法(图1)。图中白色区域大约4~6 mm用来切冰冻切片直接观察荧光或者石蜡包埋做免疫组织化学染色和原位杂交。浅灰色区域大约3 mm,脑组织脑冠状面被平均分成100~200 mg的小块,用来提取组织DNA,放入冻存管-80℃保存。深灰色区域大约2 mm用来提取组织总RNA。
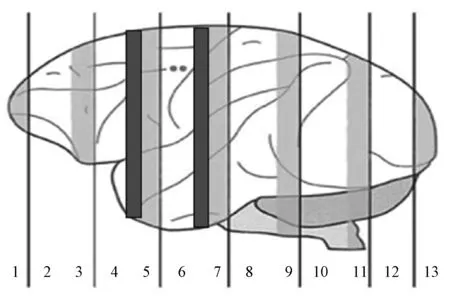
图1 大脑取材示意图Fig.1 The schematic diagram of usagae of brain tissue
1.5hBMSCs脑内移植的局部炎症反应和免疫反应
动物麻醉后,先经生理盐水(1 L/kg)灌注,再经10%中性福尔马林(1 L/kg)灌注后取脑组织。大鼠脑组织平均分为4部位,每部分厚度大约1 cm。标本经10%中性福尔马林固定、石蜡包埋切片、苏木素-伊红(HE)染色,显微镜下观察。
1.6hBMSCs脑内移植迁移的检测
1.6.1CM-DiI荧光检测
白色区域(4~6 mm)组织取材后,立即用OCT包埋,恒温冷冻切片机切片,切片厚度为10 μm,每部分组织共切取20张切片,经4℃多聚甲醛固定10 min后晾干,与-80℃冰箱保存。观察时,将切片从冰箱取出,室温放置30 min,PBS洗10 min后,直接用含有DAPI的封片剂封片,5 min后直接置于倒置荧光显微镜下观察,并做记录。
1.6.2Real-time PCR检测SRY基因
通过检测男性Y染色体特有基因SRY基因,观察hBMSCs的迁移和移植情况。脑组织沿冠状分成12~14个脑冠状面,厚度为3 mm或6 mm,将每个厚为3 mm的脑冠状面分成重量为100~200 mg的小组织块,提取组织总DNA。制备标准品的制备并建立标准曲线。每个脑组织样本重复4次,根据标准曲线得出所检样本中男性DNA的含量。95℃ 3 min,95℃ 30 s,60℃ 30 s 45个循环。人SRY基因引物序列Forward:5′-GGCGAAGATGCTGCCGAAG-3′,Backward: 5′-TTCGCTGCAGAGTACCGAAGC-3′,荧光报告探针:FAM-TGCAGTTTGCTTCCGG CAGATCC-TAMRA
2 结果
2.1移植后一般情况观察
术后动物呼吸平稳,饮食和排泄均正常,四肢运动正常。头部伤口干燥结痂,无红肿及渗出。和hBMSCs移植前相比,移植后1周和2周,血液中的白细胞及分类细胞学均未见明显异常。
2.2局部炎症反应和排斥反应
通过观察HE染色和对炎细胞、参与免疫反应的抗原提呈细胞及效应细胞的检测来观察局部炎症反应及排斥反应。结果发现,注射部位脑组织轻微空泡变性,少量泡沫细胞聚集,未见其他炎细胞浸润,未见明显水肿和神经元变性坏死(图2),其他脏器和器官组织学检查也未见异常。免疫组织化学结果显示,移植局部脑组织,CD4、CD8、CD57和HLA-DR均呈阴性表达,CD68和CD45可见个别阳性细胞,在移植对照组也可见到。
2.3CM-DiI荧光观察结果
CM-DiI荧光示踪结果发现,hBMSCs在脑内能够广泛迁移,每个脑冠状面均能观察到CM-DiI的红色荧光信号。移植后2周,hBMSCs在脑内迁移范围广泛,每个脑冠状面均能观察到CM-DiI的红色荧光信号,以移植部位所在脑冠状面(第1、2和4脑冠状面)荧光信号比较密集,第2个脑冠状面的荧光信号仍然聚集于与注射部位相对应的区域,其他冠状切面也能观察到少量的荧光信号。移植后4周,hBMSCs在脑内的迁移更为广泛,每个冠状面均能观察到CM-DiI荧光信号,移植部位所在脑冠状面信号仍然最为密集,第2、4、5和6脑冠状面均能观察到较多且弥散分布的荧光信号,与移植2周相比,荧光信号的分布更为分散,该结果提示随着时间的变化,hBMSCs在脑内逐步迁移(图3)。
2.4hBMSCs移植后迁SRY基因检测
从SRY基因DNA分布图观察,hBMSCs移植后,每个脑冠状面均能检测到SRY基因的存在,不同受体之间存在重叠现象。移植后2周,男性DNA主要分布与第2、3、4和5脑冠状面,其含量峰值位于第3个脑冠面(注射部位所在脑冠状面),其左右相邻脑冠面的含量也明显高于其他冠面。移植后4周,男性DNA主要分布于3、4、5、6和7脑冠状面,其含量峰值位于第5个面,总体DNA含量较高的脑冠状面为3、4、5、6脑冠状面(图4)。MSCs移植4周后的分布区域要比移植后2周的分布广泛,呈现从前往后迁移的趋势。检测到SRY基因的位置与观察到荧光信号的位置基本基本保持一致。具体分布见图5。
3 讨论
神经系统的疾病复杂多样,大多呈慢性过程,且往往导致严重的后果,由于脑内神经不能再生,因此这些疾病治疗起来比较困难,到目前为止,临床仍没有很好的治疗方法。干细胞的应用,为这类疾病的治疗带来了希望。MSCs能够在脑内迁移和分化,加上其获取简单,体外扩增容易,能够被修饰表达特异重组蛋白,使得它们成为神经系统疾病治疗的首选种子细胞,为MSCs的临床应用奠定了理论基础。
有研究证实小鼠骨髓来源的BMSCs,同种移植后,能够在脑内长期存活并广泛迁移[14, 15],Munoz-Elias将大鼠来源的MSCs向胚胎大鼠的脑室内注射,发现MSCs可以移植、迁移和分化,并能够长时间的存活[16],Isakova等[10]将恒河猴的BMSCs同种移植到大脑尾状核,发现其可在恒河猴脑内长期存活达6个月,并能在脑内广泛迁移,并且发现直接脑内移植是安全的。直接注射到小脑的未经修饰的MSCs可以减轻Niemann-Pick C型疾病中的炎症反应[17]。尽管有很多学者已经做过非人类BMSCs在小鼠、大鼠和恒河猴等实验动物直接脑内注射安全有效,MSCs并能脑内广泛迁移,但hBMSCs直接脑内注射非人灵长类的安全性如何,尚没有文献报道。
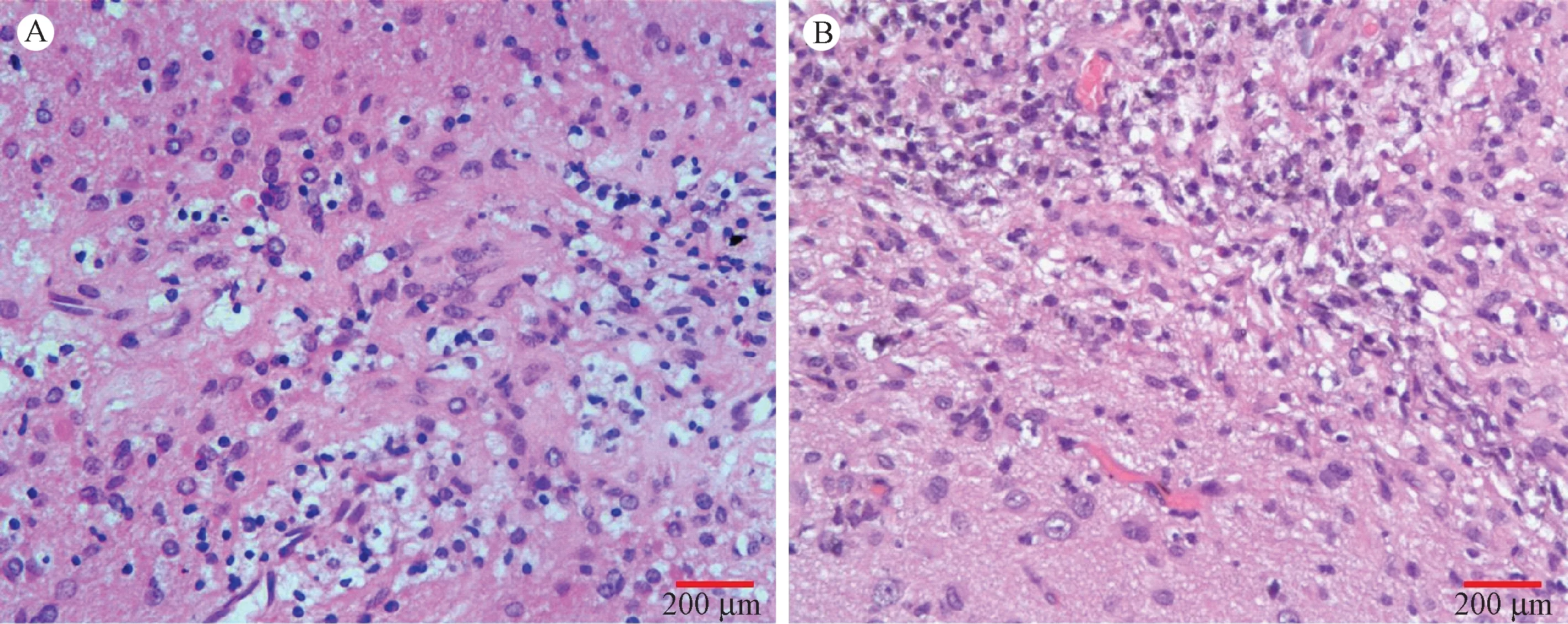
注:(A)hBMSCs移植后2周;(B)hBMSCs移植后4周。图2 hBMSCs移植部位脑组织HE染色 Note.(A)2 weeks post-transplantation;(B)4 weeks post-transplantation.Fig.2 HE staining of injection sites of hBMSCs transplantation
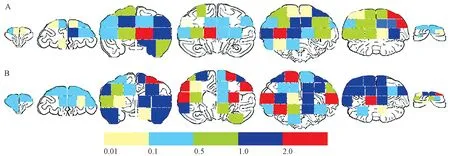
注:A和B分别代表hBMSCs移植后2周和4周;不同的颜色代表不同的DNA含量;颜色条下方的数据单位为ng。图4 SRY基因含量分布示意图Note.A and B showed the distribution of hMSCs after 2 weeks and 4 weeks transplantation respectively;The different color represents different content of SRY gene;The unit under the colour bar is ng. Fig.4 Sketch diagram of SRY gene content distribution
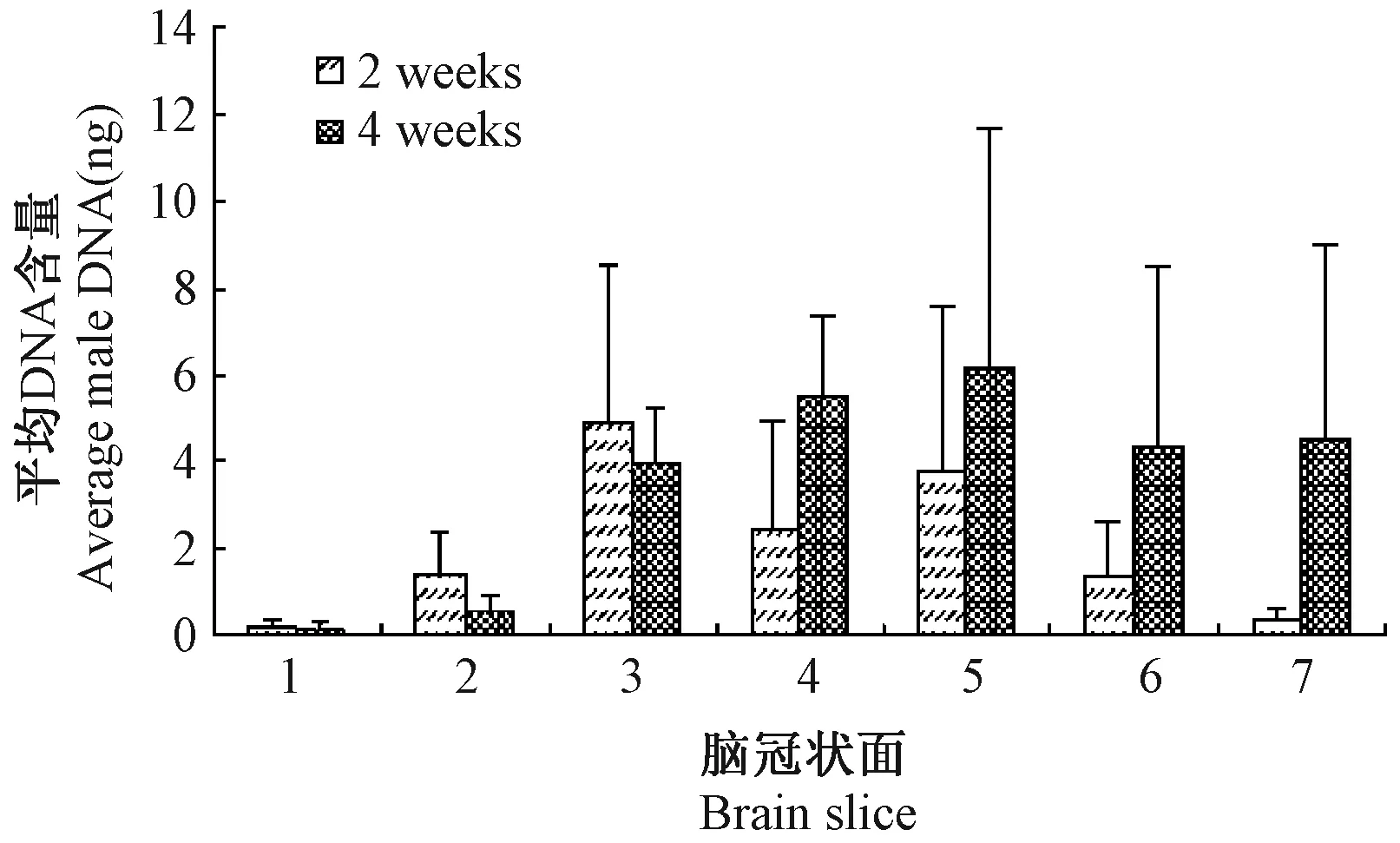
注:移植后2周,男性DNA的含量峰值位于第3个面,而hBMSCs移植后4周,男性DNA的含量峰值位于第5个面。图5 hBMSCs脑内移植水平评价Note.The peak content of male DNA located in the third brain section after 2 weeks transplantation and in the fifth brain section after 4 weeks transplantation. Fig.5 Evaluation of hBMSC engraftment in the CNS
为了评估脑内移植hBMSCs局部治疗的安全性及其在脑内的迁移情况,该研究参考了Isakova等[10]的研究方法,将hBMSCs直接注射到幼年食蟹猴大脑尾状核内,观察对幼年食蟹猴健康、行为及注射局部脑组织的影响,并通过real-time PCR和体外标记hBMSCs的方法,观察hBMSCs在脑内的移植水平和迁移情况。纹状体包括豆状核和尾状核,后者是由部分复杂的连接大脑皮质、基底核以及丘脑的回路组成,具有广泛的认知和运动功能,纹状体-丘脑回路包括拮抗纹状体回路,与行为、运动控制有关,该部位与多种肌张力障碍和运动障碍疾病相关,选择该部位注射,更能评价hBMSCs移植的安全性,为上述疾病的治疗奠定基础。 我们的研究结果显示hBMSCs直接脑内注射后未引起明显副作用,包括移植侧的一过性偏瘫、饮食饮水障碍、脑水肿症状以及情绪变化等。局部注射部位未发现脑组织的水肿、变性坏死,炎细胞浸润以及明显的胶质细胞聚集。hBMSCs移植后的短期内(4周),受试动物未见明显副作用,提示它们对该操作的耐受性比较好,脑内直接注射干细胞移植法治疗神经系统疾病是安全可行的。该研究对hBMSCs直接脑内注射的安全可行性进行验证,对hBMSCs脑内移植后的迁移能力进行了检测,为将来其在神经系统疾病中的临床应用提供理论依据。
为了检测干细胞移植后在脑内前迁移和分布情况,我们应用CM-DiI体外示踪及体内特异性SRY基因检测的方法,比较准确的示踪移植到脑内的hBMSCs。Real-time PCR结果显示hBMSCs可以在脑内广泛迁移,这些数据可以代表整个大脑的1/3的干细胞的移植水平。由real-time PCR的数据绘制成的柱状图发现,每个脑冠状面检测到的基因的含量以注射部位所在脑冠状面及相邻脑冠状面比较高,但在前脑和小脑也可以检测到,并且显示移植的细胞多定位在某些特定的区域。尽管hBMSCs是单侧注射的,但是双侧大脑半球均可以检测到SRY基因存在,而且不同移植受体之间,一些区域hBMSCs移植存在着重叠,从柱状图我们可以推断出,虽然SRY基因的含量在移植后2周和4周没有统计学上的差异,但是随着移植时间的推移,hBMSCs的迁移有沿着头部向尾部迁移的趋势。CM-DiI荧光信号检测结果同时也绘制成不同脑冠状面的分布图,结果显示 hBMSCs的迁移具有从头部向尾部迁移的趋势,与real-time PCR的结果相一致。荧光观察还发现大量的hBMSCs向血管周、脑室旁进行迁移,部分血管内及脑室内也可观察到荧光信号,这提示MSCs还可能通过血液循环和脑脊液循环进行快速的迁移。
我们移植hBMSCs到幼年食蟹猴脑内,结果证实直接脑内注射短期内(4周)局部脑组织没有观察到炎症反应和免疫反应,并且可以在脑内持续存活和迁移,这为hBMSCs的临床应用治疗儿童中枢神经系统疾病打下了理论基础。但hBMSCs长期移植的安全性还需进一步实验证明,而hBMSCs的迁移机制也是复杂多样的,也还需要进一步研究阐明。
[1]Castillo-Melendez M, Yawno T, Jenkin G,etal. Stem cell therapy to protect and repair the developing brain: a review of mechanisms of action of cord blood and amnion epithelial derived cells [J]. Front Neurosci, 2013,7:194.
[2]Dailey T, Tajiri N, Kaneko Y,etal. Regeneration of neuronal cells following cerebral injury [J]. Front Neurol Neurosci, 2013,32:54-61.
[3]Hsu YC, Chen SL, Wang DY,etal. Stem cell-based therapy in neural repair [J]. Biomed J, 2013,36(3):98-105.
[4]van Velthoven CT, Sheldon RA, Kavelaars A,etal. Mesenchymal stem cell transplantation attenuates brain injury after neonatal stroke [J]. Stroke, 2013,44(5):1426-1432.
[5]van Velthoven CT, Kavelaars A, Heijnen CJ. Mesenchymal stem cells as a treatment for neonatal ischemic brain damage [J]. Pediatr Res, 2012,71:474-481.
[6]Okuma Y,Wang F,Toyoshima A,etal.Mannitol enhances therapeutic effects of intra-arterial transplantation of mesenchymal stem cells into the brain after traumatic brain injury [J]. Neurosci Lett, 2013,554:156-161.
[7]Liu L, Eckert MA, Riazifar H,etal. From blood to the brain: can systemically transplanted mesenchymal stem cells cross the blood-brain barrier? [J]. Stem Cells Int, 2013,2013:435093.
[8]Forostyak S, Jendelova P, Sykova E. The role of mesenchymal stromal cells in spinal cord injury, regenerative medicine and possible clinical applications [J]. Biochimie, 2013,95(12):2257-2270.
[9]Li J, Zhu H, Liu Y,etal. Human mesenchymal stem cell transplantation protects against cerebral ischemic injury and upregulates interleukin-10 expression in Macaca fascicularis [J]. Brain Res, 2010,1334:65-72.
[10]Isakova IA, Baker K, Dufour J,etal. Preclinical evaluation of adult stem cell engraftment and toxicity in the CNS of rhesus macaques [J]. Mol Ther, 2006,13(6):1173-1184.
[11]Yun HM, Kim HS, Park KR,etal. Placenta-derived mesenchymal stem cells improve memory dysfunction in an Aβ1-42-infused mouse model of Alzheimer’s disease [J]. Cell Death Dis, 2013,4:e958.
[12]Kim KS, Kim HS, Park JM,etal. Long-term immunomodulatory effect of amniotic stem cells in an Alzheimer’s disease model [J]. Neurobiol Aging, 2013,34(10):2408-2420.
[13]Glavaski-Joksimovic A, Bohn MC. Mesenchymal stem cells and neuroregeneration in Parkinson’s disease [J]. Exp Neurol, 2013,247:25-38.
[14]Kopen GC, Prockop DJ, Phinney, DG. Marrow stromal cells migrate throughout forebrain and cerebellum and they differentiate into astrocytes after injection into neonatal mouse brains [J]. Proc Natl Acad Sci USA, 1999,96(19): 10711-10716.
[15]McBride C, Gaupp D, Phinney DG. Quantifying levels of transplanted murine and human mesenchymal stem cells in vivo by real-time PCR [J]. Cytotherapy, 2003,5(1):7-18.
[17]Bae JS, Furuya S, Ahn SJ,etal. Neuroglial activation in Niemann-Pick type C mice is suppressed by intracerebral transplantation of bone marrow derived mesenchymal stem cells [J]. Neurosci Lett, 2005,381(3):234-236.
Safty evaluation, migration and distribution of human bone marrow derived-mesenchymal stem cells in the cns of young macaca fascicularis
LI Jia-mei1, 2, ZHU Hua2, YAO Zhi-gang1, 2, DENG Wei2, LI Qin3, MA Chun-mei2, QIN Chuan2*
(1. Department of Pathology, Shandong Provincial Hospital Affiliated to Shandong University, Jinan 250021, China;2. Department of Pathology, Institute of Laboratory Animal Science, Chinese Academy of Medical Science and Peking Union Medical College, Beijing 100021, China; 3. China Motac collaborative laboratory, Institute of Laboratory AnimalScience, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)
Objective To evalutate the safty of hBMSCs transpalntation and to observe their migration and distribution in the brain of young macaca fascicularis. To establish a new technology platform and theoretical basis for the treatment of central nervous system diseases in children.MethodsLabelled hBMSCs were transplanted into the striatum of young macaca fascicularis. Brain sections were examined to evalutate the inflammatory reaction and immunological rejection of local injection sites by HE observation and immunohistochemical staining. Migration and distribution of transplanted-hBMSCs was observed by real-time fluorescence quantitative PCR of male DNA and fluorescence microscope.ResultsThe results showed that the direct intracerebral injection of hBMSCs did not cause systemic symptoms in animals. There is no inflammatory reaction and immunological rejection was detected, and degeneration and necrosis of neural cells and proliferation of glial cells were absent in the local injection sites. The transplanted hBMSCs survived, and migrated into the brain after 4 weeks transplantation. Its migration and distribution have certain regularity and were overlapping between transplant recipients. In addtion, hBMSCs tended to extend rostrally into the forebrain and showed preference of migrating toward the blood vessels and below the ependyma.ConculsionsIntracerebral transplantation of hBMSCs is safe. And hBMSCs can survive and migrate into the brain.
Human bone marrow derived-mesenchymal stem cells; Macaca fascicularis; Migration; Distribution
国家自然科学基金项目(81502568,81402479),山东省医药科技发展计划项目(2014WS0355)。
李加美(1981- ),女,主治医师,研究方向:干细胞。E-mail: lijiamei366@126.com。
秦川(1959-),女,教授,研究方向:阿尔滋海默病的比较医学。E-mail: chuanqin @vip.sina.com。
研究报告
R-332
A
1671-7856(2016)09-0007-06
10.3969.j.issn.1671-7856. 2016.09.002
2016-03-08
