耐药白色念珠菌弥散性感染小鼠模型的建立
2016-10-26李航龚宝勇罗银珠吴玉娥陈梅玲陈锐刘晓霖王晖黄韧张钰
李航,龚宝勇,罗银珠,吴玉娥,陈梅玲,陈锐,刘晓霖,王晖,黄韧,张钰*
(1.广东省实验动物监测所,广东省实验动物重点实验室,广州 510663;2.广东药学院中药学院,广州 510006)
耐药白色念珠菌弥散性感染小鼠模型的建立
李航,龚宝勇1,罗银珠1,吴玉娥1,陈梅玲1,陈锐1,刘晓霖1,王晖2,黄韧1,张钰1*
(1.广东省实验动物监测所,广东省实验动物重点实验室,广州510663;2.广东药学院中药学院,广州510006)
目的 为新药筛选建立耐药白色念珠菌弥散性感染小鼠模型。方法对免疫抑制ICR小鼠静脉注射临床耐氟康唑白色念珠菌CaR,通过临床症状、生存情况、组织载菌量、组织病理、细胞因子分析以及药物治疗等方法对模型评价。结果CaR感染小鼠在接种后第1天出现死亡,相比临床药敏菌株CaS感染组,16 d观察期内动物死亡率无显著性差异(CaR, 90.7%; CaS, 86.2%,P=0.158),但观察早期CaR组死亡比CaS组快。感染第4天,不同组织均可检测到念珠菌,并发现与CaS组相比,肾、脑组织载菌量具有显著性差异。真菌引起的典型肉芽肿样是肾、脑、心的主要组织病理学特征。利用流式细胞仪检测肾组织细胞因子,IL-1α、IL-6、TNF-α、IFN-γ等细胞因子变化显著,与CaS组比较,IL-1α和IFN-γ显著升高,TNF-α显著下降。CaR和CaS感染小鼠给予10 mg/kg氟康唑治疗,死亡率分别为83.3%、37.5%,具有显著性差异。结论本研究成功建立了耐药白色念珠菌弥散性感染小鼠模型,有望成为抗感染新药研发的重要工具。
耐药白色念珠菌;感染;模型
白色念珠菌是一种常见的二相性条件致病菌,平时以酵母相寄居在人体中,酵母相白色念珠菌一般不致病。由于艾滋病、癌症放化疗、器官移植等患者免疫功能低下或免疫功能受到抑制,酵母相白色念珠菌会由共生菌发芽增殖为菌丝相致病菌,此时白细胞对其吞噬率及杀灭率大幅降低,这导致临床上白色念珠菌感染的比例大大提高[1]。据统计,全身性白色念珠菌感染有着高达31.8%的死亡率[2],也是医院重症监护病房第四大血液感染因素[3,4]。
氟康唑为第三代三唑类抗真菌药,自上市后凭借良好的临床疗效被广泛应用,但长期大剂量使用导致院内感染耐药菌分离率越来越高,赵德军等[5]检测出院内感染白色念珠菌的耐氟康唑菌株可达10.4%,刘宇[6]在院内感染白色念珠菌感染中耐氟康唑菌株检出率也有10.0%,可见院内感染中白色念珠菌耐药菌感染问题日益严峻,这就亟需开展及加强抗耐药白色念珠菌药物的研究。动物模型作为疾病机理和药物开发研究的重要工具,建立耐药念珠菌感染动物模型对开展耐药菌株的药物筛选具有重要意义。
1 材料和方法
1.1实验动物
SPF级5~6周龄雌性ICR小鼠,体重24~26 g,购自广东省医学实验动物中心[SCXK(粤)2013-0002],饲养在广东省实验动物监测所负压屏障小鼠房[SCXK(粤)2012-0122],实验动物饲料由广东省医学实验动物中心提供[SCXK(粤)2013-0002]。实验研究计划通过广东省实验动物监测所IACUC审查(编号:IACUC2012006)。
1.2供试菌株
临床耐氟康唑菌株CaR、临床药敏菌株CaS[7]由中国科学院北京微生物研究所张立新研究员惠赠,均置于-80℃冰箱保存。使用前利用活菌计数法确定菌液浓度。
1.3环磷酰胺诱导免疫抑制
ICR小鼠适应性饲养3 d后,按体重(100 mg/kg)腹腔注射环磷酰胺(CY),连续注射3 d。
1.4感染动物生存实验
小鼠随机分为两组,分别尾静脉注射浓度为5.0×105CFU/mL的CaR、CaS菌液0.2 mL/只。每天定时观察感染小鼠临床症状及生存情况,及时将死亡小鼠取出。记录小鼠弓背、眼睛或鼻子出现分泌物、呼吸异常、离群等异常情况,当小鼠出现不能行走、濒临死亡时进行安乐死,记做第二天死亡。观察16 d,统计小鼠生存情况。
1.5指标检测
1.5.1组织载菌量检测
在感染第2、4、6天,每组5只小鼠的心、肝、脾、肺、肾、脑组织取出后称重,加入1.0 mL无菌生理盐水研磨至匀浆,确定适当稀释度,吸取0.2 mL匀浆液接种于YEPD培养基,计算各组织载菌量。
1.5.2组织病理诊断
在感染第4天,每组3只小鼠的心、肝、脾、肺、肾、脑组织取出后放入10%福尔马林溶液中,制备病理切片,进行HE染色和PAS染色。
1.5.3细胞因子检测
将感染第4天小鼠肾组织匀浆液4℃低温冷冻离心机3000 r/min离心10 min,取上清液做细胞因子检测。
1.6模型的药效评价应用
CaR组和CaS组小鼠尾静脉注射5.0×105CFU/mL白色念珠菌0.2 mL/只,在感染后5 h给予小鼠按体重(10 mg/kg)灌胃给予临床药物氟康唑治疗,连续给药5 d。观察16 d,统计小鼠生存情况。
1.7统计学方法

2 结果
2.1耐药念珠菌感染小鼠临床症状及生存情况
CaR组和CaS组小鼠感染白色念珠菌临床症状基本一致,感染后体质明显虚弱、立毛严重,眼部出现分泌物,CaR组感染第一天出现死亡,而CaS组在感染第二天出现死亡。在感染早期,CaR感染小鼠死亡率比CaS感染高,中位生存期分别为3.3 d、6.8 d;感染后期小鼠出现身体倾斜、偏头等神经系统症状;尸体剖检,可见感染小鼠肾肿大,表面有白色斑点,其它组织未见明显病变。16 d观察期内,两种菌株感染动物死亡率分别为90.7%、86.2%,无显著差异,结果见图1。
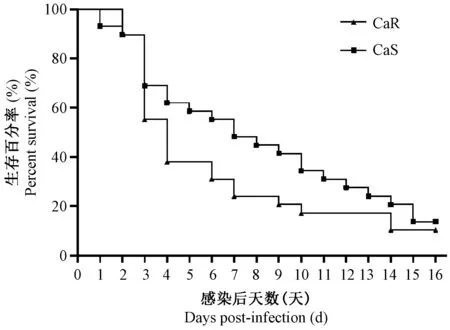
注:3次独立实验。图1 白色念珠菌感染小鼠生存曲线(n=29)Note.3 independent experiments.Fig.1 Survival curves of mice infected with Candida albicans
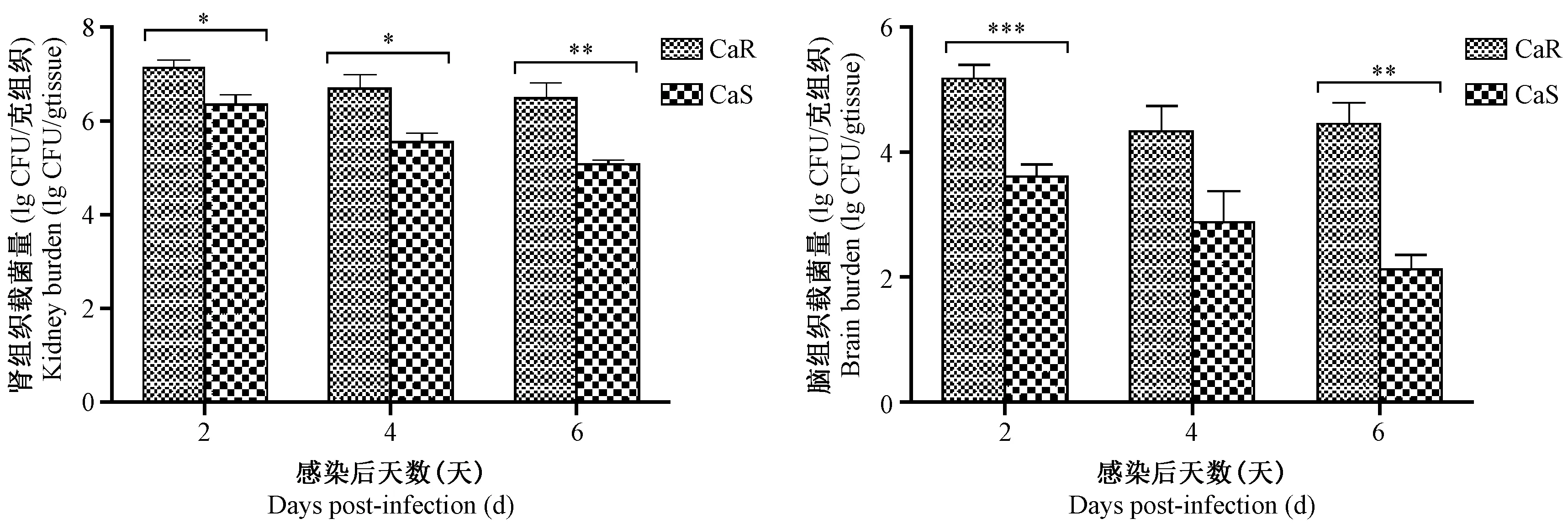
注: *P < 0.05,**P < 0.01,***P < 0.001,与CaS组相比。图2 组织载菌量(n=5)Note. *P < 0.05,**P < 0.01,***P < 0.001,Compared with the CaS group.Fig.2 Fungal burden in tissues
2.2指标检测结果
2.2.1耐药念珠菌感染小鼠组织载菌量变化
感染第2天CaR组小鼠各组织均可检测到念珠菌,随着感染时间的推移,各组织载菌量逐渐下降。其中,感染主要靶器官肾组织载菌量较高,大于107CFU/g组织,脑的载菌量在103~104CFU/g组织,明显高于CaS感染,具有显著性差异,结果见图2。 2.2.2感染小鼠组织病理变化
CaR组小鼠各组织均可检测到念珠菌。组织病理检测显示,肾、心、脑等能观察到典型的病理变化。其中,肾组织的病理变化最为严重,HE染色显示,大部分肾小体结构破坏,病灶周围出现中性粒细胞、巨噬细胞、淋巴细胞等大量炎症细胞浸润,肾小管出血。心组织可观察到病灶中出现大量炎症细胞浸润,伴随着细胞坏死,心肌纤维断裂;大脑皮质内也能观察到组织结构的破坏,病灶中性粒细胞及小胶质细胞浸润。以上组织PAS染色病理切片均显示病灶区出现大量红色深染的酵母型、菌丝型共生的白色念珠菌。
肺、脾、肝组织较少出现典型的组织结构破坏,结果见图3。
以上组织病理变化与CaS感染小鼠组织相比未见明显变化。
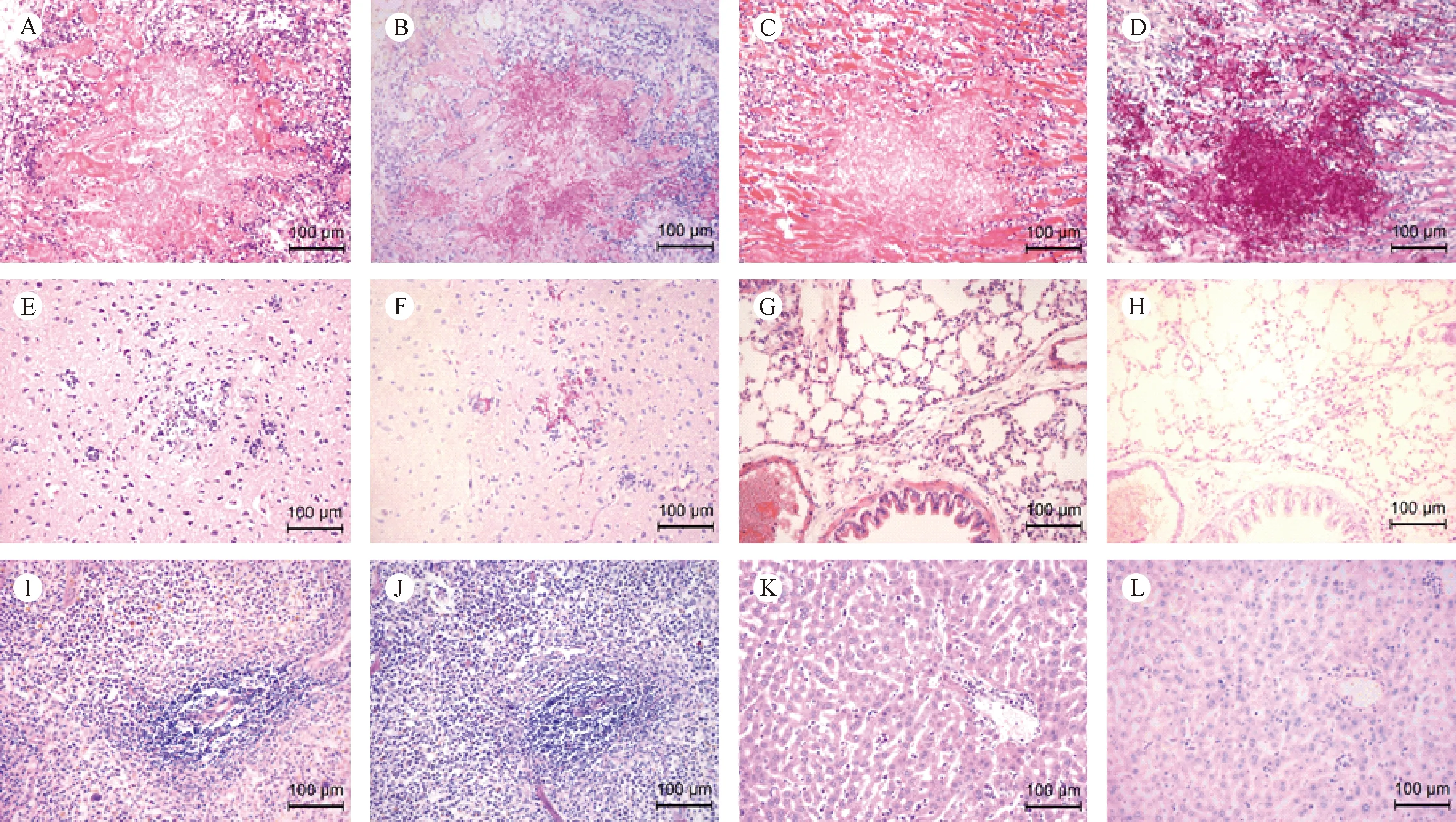
注:(A、C、E、G、I、K)肾、心、脑、肺、脾、肝HE染色切片;(B、D、F、H、J、L)肾、心、脑、肺、脾、肝PAS染色切片。图3 CaR组感染第4天小鼠组织切片(×20,bar=100 μm)Note.(A,C,E,G, I,K)H&E staining of kidney, heart, brain, lung, spleen, liver;(B,D,F,H,J,L)PAS staining of kidney, heart, brain, lung, spleen, liver.Fig.3 Infected mice of CaR group tissue sections at day 4 after infection
2.2.3耐药念珠菌感染小鼠免疫因子的变化
我们利用流式细胞仪对感染第4天小鼠肾组织匀浆液上清液进行细胞因子检测,结果发现IL-6、TNF-α、IL-1α、IFN-γ显示明显升高,表现典型的非特异免疫反应。CaR组与CaS组比较,在感染第4天,IL-1α、IFN-γ显示明显升高,TNF-α明显下降,具有显著性差异,结果见图4。
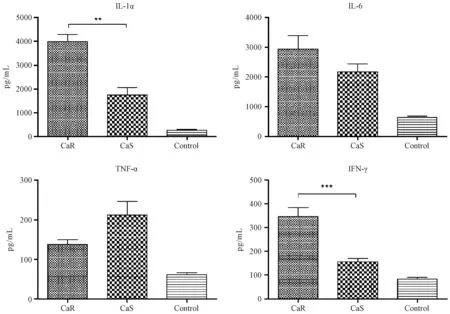
注:**P < 0.01,***P < 0.001,与CaS组相比。图4 感染小鼠第4天肾组织细胞因子含量(n=5)Note. **P < 0.01,***P < 0.001,Compared with the CaS group. Fig.4 Cytokine content of mice kidney at day 4 after infection
2.3耐药念珠菌感染小鼠的药效评价
CaR和CaS小鼠感染1.0×105CFU/只,给予10 mg/kg氟康唑药物进行治疗,在16 d观察期内,CaS组生存率明显升高,CaS组和CaR组动物死亡率分别为37.5%、83.3%,具有显著性差异(图5)。
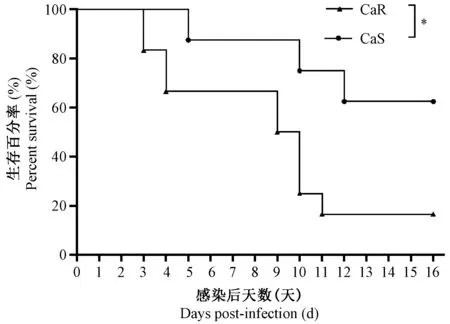
注:*P < 0.05,与CaS组相比。3次独立试验。图5 白色念珠菌感染小鼠给药后生存曲线(n=29)Note. *P < 0.05,Compared with the CaS group.3 independent experiments.Fig.5 Survival curves of mice infected with Candida albicans after administration
3 讨论
根据经典白色念珠菌弥散性感染小鼠模型的建立方法[8],腹腔注射环磷酰胺以降低小鼠体内白细胞数量[9],模拟临床免疫抑制及免疫功能低下患者;然后尾静脉注射耐药念珠菌CaR(1.0×105CFU/只),成功建立了耐药白色念珠菌弥散性感染小鼠模型。该模型以死亡为评价指标,在感染16 d内,动物死亡率约为90%。
CaR组与CaS组感染小鼠显示相似的疾病特征,在感染的早期阶段,虽然两组感染小鼠的生存分析不能显示显著性差异,但CaR组小鼠中位生存时间3.3 d,明显低于CaS组6.8 d;又因感染念珠菌小鼠的肾指数变化与其肾脏载菌量、病理变化呈正相关,肾指数能够较准确的反应机体感染白念菌的程度[10],在感染初期CaR组肾组织载菌量明显高于CaS组,说明CaR菌株毒力与CaS菌株相比较强。
该模型显示出典型的弥散性感染特征。组织病理检测显示,肾、脑、心组织能观察到典型的病灶,大量炎性细胞浸润。小鼠实质组织感染第2天就能检测到念珠菌,其中肾组织载菌量最高,随着感染时间的推移,组织载菌量逐渐下降。说明感染初期动物感染最为严重,随后机体进行非特异性免疫,促炎因子IL-6,IL-1α,TNF-α、IFN-γ显著升高,有效调控了机体的抗感染过程。两组小鼠IL-1α、IFN-γ的显著性差异由念珠菌感染程度不同引起,同时说明IL-1α、IFN-γ在抗感染过程中起重要作用。
利用建立的耐药念珠菌小鼠模型进行氟康唑药效评价,给予10 mg/kg的氟康唑,CaS组小鼠死亡率明显减低,而CaR组小鼠死亡率较高,说明CaR组小鼠不能获得有效保护,耐药模型对氟康唑表现出耐药性。该模型的建立为我们提供了耐药菌株体内药物筛选和致病机理研究的平台,这为后期研究抗感染新药提供体内筛选模型工具。
[1]廖万清,顾菊林.真菌耐药的现状与对策[J]. 药学服务与研究,2006,6(3):161-164.
[2]Morrell M, Fraser VJ, Kollef MH. Delaying the empiric treatment of Candida bloodstream infection until positive blood culture results are obtained: a potential risk factor for hospital mortality[J].Antimicrobial Agents and Chemotherapy, 2005, 49(9): 3640 -3645.
[3]Zaoutis TE, Argon J, Chu J,etal. The epidemiology and attributable outcomes of candidemia in adults and children hospitalized in the United States: a propensity analysis[J].clinical infectious diseases,2005,41(9):1232-1239.
[4]Horn DL. Epidemiology and outcomes of candidemia in 2019 patients:data from the prospective antifungal therapy alliance registry[J]. clinical infectious diseases,2009,48 (12):1695-1703.
[5]赵德军,邱洪,胡昭宇,等.住院病人念珠菌感染的动态变化及耐药性监测[J].中国消毒学杂志,2014,31(2):134-136.
[6]刘宇.呼吸科院内尿路感染患者病原菌及耐药分析[J].临床肺科杂志,2015,20(2):303-305.
[7]Franz R, Kelly SL, Lamb DC,etal. Multiple Molecular Mechanisms Contribute to a Stepwise Development of Fluconazole Resistance in Clinical Candida albicans Strains[J].Antimicrobial agents chemotherapy,1998,42(12): 3065-3072.
[8]Zhang L, Yan K, Zhang Y,etal. High-throughput synergy screening identifies icrobial metabolites as combination agents or the treatment of fungal infections[J]. PANS,2007,104(11):4606-4611.
[9]刘香梅,张钰,闵凡贵,等.环磷酰胺对近平滑念珠菌感染小鼠白细胞的影响[J].实验动物与比较医学,2007,27(2):116-118.
[10]马贤德,感染白色念珠菌小鼠肾指数与病情相关性及其在中药研究中的应用[D],辽宁中医药大学,2010.
The establishment of the drug-resistant Candida albicans disseminated infected mice model
LI Hang1,GONG Bao-yong1,LUO Yin-zhu1, WU Yu-e1, CHEN Mei-ling1,CHEN Rui1, LIU Xiao-lin1, WANG Hui2, HUANG Ren1, ZHANG Yu1*
(1.GuangDong Laboratory Animals Monitoring Institute, Guangdong Key Laboratory of Laboratory Animals,Guangzhou 510663,China;2.College of Traditional Chinese Medicine, Guangdong Pharmaceutical University,Guangzhou 510006,China)
Objective Establishing the drug-resistant Candida albicans disseminative infected mice model for new drug screening. Methods The disseminative infected mouse model was generated by intravenously injecting a clinical Drug-resistant Candida albicans strain (CaR) to immunosuppressive ICR mice. The features of model was evaluated by clinical symptom, survival condition, fungal burden in tissue, histopathology, cytokines assay and medication. ResultsAfter infected with CaR (0 day), the death of mice started at the first day, though, compared to clinical drug sensitive strain (CaS) infected group, the difference of mortality rate in 16-day observation period was not significant in two groups (CaR, 90.7%; CaS, 86.2%,P=0.158), mice in CaR group died faster than those in CaS group at the early stage; On the fourth day of infection, Candida albicans could be detected in the different tissues, and we found fungal burden in kidney and brain was a significant difference. The typical granuloma caused by fungal infection was the main histopathological feature observed in the kidney, brain and heart. Cytokines in renal tissue were detected by flow cytometry, The changes of IL-1α,IL-6,TNF-αand IFN-γin kidney were significant. Compared with CaS group, IL-1 and IFN-γ were significantly higher and TNF-αdecreased significantly in CaR group.The mice of groups CaR and CaS were treated with 10 mg/kg fluconazole, the mortality rates were 83.3% and 37.5%, which have a significant difference. ConclusionsIn this study, we successfully established a drug-resistant Candida albicans disseminative infected mice model which is potential tool for the development of new anti-infectious agent.
Drug-resistant Candida albicans; Infected;Model
广东省科技计划项目(2014A010107018)。
李航(1988-),男,研究实习员,研究方向:实验动物疾病模型。
张钰(1970-),女,研究员,研究方向:实验动物疾病模型。E-mail: zhangyugzh@hotmail.com。
研究报告
R-332
A
1671-7856(2016)09-0025-05
10.3969.j.issn.1671-7856. 2016.09.005
2015-10-26
