陆地生态系统混合凋落物分解研究进展
2016-10-25李宜浓周晓梅张乃莉马克平
李宜浓, 周晓梅,张乃莉, 马克平
1 吉林师范大学生命科学学院,四平 136000 2 中国科学院植物研究所 植被与环境变化国家重点实验室,北京 100093
陆地生态系统混合凋落物分解研究进展
李宜浓1,2, 周晓梅1,*,张乃莉2, 马克平2
1 吉林师范大学生命科学学院,四平136000 2 中国科学院植物研究所植被与环境变化国家重点实验室,北京100093
凋落物分解在陆地生态系统养分循环与能量流动中具有重要作用,是碳、氮及其他重要矿质养分在生态系统生命组分间循环与平衡的核心生态过程。自然生态系统中,植物群落大多具有较高的物种丰富度和多样性,其混合凋落物在分解过程中也更有可能发生养分传递、化学抑制等种间互作,形成多样化的分解生境,多样性较高的分解者类群以及复杂的级联效应分解,这些因素和过程均对研究混合凋落物分解过程、揭示其内在机制形成了极大的挑战。从构成混合凋落物物种丰富度和多样性对分解生境、分解者多样性及其营养级联效应的影响等方面,综合阐述混合凋落物对陆地生态系统凋落物分解的影响,探讨生物多样性在凋落物分解中的作用。通过综述近些年的研究发现,有超过60%的混合凋落物对其分解速率的影响存在正向或负向的效应。养分含量有差异的凋落物混合分解过程中,分解者优先利用高质量凋落物,使低质量的凋落物反而具有了较高的养分有效性,引起低质量凋落物分解加快并最终使混合凋落物整体分解速率加快;而凋落物物种丰富度对土壤动物群落总多度有轻微的影响或几乎没有影响,但是对线虫和大型土壤动物的群落组成和多样性有显著影响,并随着分解阶段呈现一定动态变化;混合凋落物改变土壤微生物生存的理化环境,为微生物提供更多丰富的分解底物和养分,优化微生物种群数量和群落结构及其分泌酶的活性,并进一步促进了混合凋落物的分解。这些基于植物-土壤-分解者系统的动态分解过程的研究,表明混合凋落物分解作用不只是经由凋落物自身质量的改变,更会通过逐级影响分解者多样性水平而进一步改变分解速率和养分释放动态,说明生物多样性确实在一定程度上调控凋落物分解及其养分释放过程。
生物多样性;凋落物分解;微生物多样性;土壤动物;非加和效应
凋落物也称枯落物或有机碎屑,是指在生态系统内由地上植物组分枯死产生并归还到地表,作为分解者的物质和能量来源借以维持生态系统功能的所有有机质的总称[1]。凋落物分解是陆地生态系统中碳素周转和矿质养分循环的重要过程[2]。据统计,全球每年因凋落物分解释放的二氧化碳量达到68GtC,约占全球年碳通量的70%[3];凋落物分解还具有调节土壤有机物组成的作用[4],是释放矿质养分供植物生长的重要生态系统过程,并由此影响陆地生态系统净生产力[5]。在早期的凋落物分解研究中,研究者主要关注单一物种凋落物的分解及其影响因素,然而在自然生态系统中,尤其是物种丰富度较高的生态系统类型,地表凋落物以混合物的形式存在,这种混合的结果不仅会通过改变分解环境影响分解过程、异质凋落物间养分的互补,还会影响以凋落物为食物或栖息生境的土壤动物和微生物群落,最终影响到凋落物的分解速率和养分循环速率。其内在机制复杂,基于单一物种凋落物的研究并不能很好地探究凋落物在生态系统中的真实分解状态及其内在机制。随着研究不断深入,物种多样性与凋落物在分解过程中的相互作用以及凋落物分解过程与地上植物群落的作用机制得到了广泛关注,人们愈发认识到混合凋落物物种组成和多样性与凋落物分解这一重要的生态系统功能间的密切关联,以及理清二者之间关联的重要性[6]。
1 凋落物分解研究历程
对于森林凋落物研究最早可追溯到1867年,Ebermayer[7]发表了经典著作《森林凋落物产量及其化学组成》,阐述了凋落物的化学组成和养分循环。在随后的几十年里,更多的研究者在局域尺度和大尺度上对影响凋落物分解速率的基质性质、环境因素以及凋落物在养分循环中的作用取得了一些认知。Tenney和Waksman[8]在1929年提出土壤有机物的分解速率受到4方面因素的影响:(1)基质的化学成分;(2)分解者能利用的养分;(3)参与分解过程的微生物的性质;(4)环境条件,尤其是温度和水分。1930年,Melin[9]对北美几种森林凋落物分解的研究中首次使用了碳氮比来分析凋落物的分解特征,至今仍然是评价凋落物分解的重要指标之一。20世纪40年代开始出现涉及混合凋落物的研究,如1943年,Gustafson[10]的针-阔混合凋落物分解实验首次提出针叶和阔叶凋落物混合分解能够提高分解速率,并指出阔叶凋落物分解过程中产生大量钙,能够中和针叶在分解过程中产生的抑制细菌活性的酸性物质,从而提高了混合凋落物的分解速率。这个实验也是第1次在自然条件下展开持续8a的凋落物分解实验,此前对凋落物分解的研究大多基于人为条件且分解时间较短。
20世纪50、60年代是凋落物分解研究的高峰期,不仅研究内容全面系统,研究方法和分解模型也有很大改进。1957年,Bocock和Gilbert[11]在不同林地条件下对叶凋落物分解的研究中首次采用质地柔软的尼龙材料代替坚硬的金属容器、木质容器作为分解容器的材料,避免木质材料的分解容器产生的生物学影响,防止中型土壤动物的进入,这就是分解实验中最经典也是应用最广泛的研究方法——分解袋法。1963年,Olson[12]首次提出了单指数分解方程来描述叶凋落物物质残留与分解时间的关系,这一模型被普遍接受,至今仍被大量沿用。
20世纪70年代由于研究方法、实验仪器以及电子计算机的发展,分解研究快速发展,特别是对凋落物养分的研究更加深入。Fogel和Cromack[13]提出氮和木质素是影响分解速率和模式的重要因素,至今氮和木质素在分解中的调控作用仍然是研究的重点;有些研究者开始关注微生物酶在复合有机物基质降解中的作用和土壤中的作用:Almin[14]和Ladd[15]等人提出了多种测定土壤中大多数酶活性的方法。20世纪90年代以来,研究者更多地在全球变化这一背景下研究凋落物分解问题,如氮沉降、全球气候变暖对凋落物分解的影响研究成为生态学的热门方向。有些研究者认为氮沉降增加了凋落物氮含量从而促进了凋落物分解[16]。而有些研究表明氮沉降与凋落物分解过程中的木质素和酚类物质形成稳定化合物[17], 还能与芳香族化合物发生作用产生难分解的腐殖化合物抑制凋落物的分解[18]。尽管上述诸多研究在凋落物分解的研究方法、影响分解速率的关键因子以及气候变化等全球性生态学问题方面做了大量出色的研究工作,但是这些工作大多是基于单种或少数物种混合情况下的研究,直到近十年混合凋落物分解机制的相关研究才开始快速发展。
2 凋落物多样性对分解环境的影响
在陆地生态系统中,地上植物物种多样性高的群落与简单的群落相比,具有较丰富的凋落物种类、碳源、营养物质和复杂的化学成分,土壤的微气候和微生境也更为多样,并主要通过分解过程中的淋溶作用、微生物作用等途径,使分解环境的物理和化学性状发生改变[19],进而间接对凋落物分解产生影响[20]。杉木(Cunninghamialanceolata)、楠木(Phoebezhennan)和木荷(Schimasuperba)的混合凋落物与单种分解相比,不同比例混合处理的土壤pH值有不同程度的升高,说明此三物种凋落物分解对土壤的酸化都有一定的缓解作用[21]。Baish等[22]发现银胶菊(Partheniumhysterophorus)凋落物分解过程中产生的酚酸类物质影响土壤pH值、电导率以及其他土壤养分的有效性。另外,混合凋落物微生境下,微生物的群落结构和数量也会发生变化。胡亚林等人[23]采用杉木、桤木(Alnuscremastogyne)、枫香(Liguidambarformosana)的叶凋落物,分别进行单一物种、两两混合和三种混合的野外分解实验,发现表层有混合凋落物覆盖的土壤与单一物种覆盖的土壤相比微生物量增加,活性也发生改变。杉木和常绿落叶阔叶树混合凋落物处理的土壤与单一施加杉木凋落物处理的土壤相比,土壤微生物量碳与土壤有机碳的比值高,说明杉木和阔叶混合凋落物能够为土壤微生物生长提供更丰富的碳源,利于微生物生长[24]。因此,凋落物物种多样性对分解微生境土壤理化性状、微生物群落等方面的影响与单种凋落物分解微生境相比有显著差异,这些差异是解释特定生态系统中混合凋落物分解产生加和效应的重要方面。
3 混合凋落物对分解速率的影响
3.1物种丰富度对凋落物分解速率的影响
大多数混合凋落物分解实验,通过计算混合凋落物单种组分剩余质量比例的加权平均数,得到混合凋落物分解速率的期望值,将分解速率期望值与实际值进行比较,判断物种多样性是否对凋落物分解产生混合效应,即混合凋落物的实际分解速率与期望分解速率值相等表现出加和效应,混合凋落物的实际分解速率偏离于期望分解速率表现为非加和效应。目前对于多物种混合凋落物在分解和养分释放等方面产生的混合效应无一致结论,大致可分为三类:即物种丰富度对凋落物分解的影响为正效应[25- 27]、负效应[27-28]和加和效应[29- 32]。Wardle等人[27]对人工双子叶草本植物、草原双子叶草本植物、草本、木本4种功能群共32个物种的叶凋落物进行了混合分解实验,在70个不同物种组合混合凋落物处理中,有45个处理表现出正效应,有13个处理表现出负效应,有12个处理表现出加和效应。不同物种混合通常会使凋落物实际分解量比计算值增加20%左右[33]。不同凋落物物种组成和功能群类型对混合凋落物分解有显著影响[34],相同的物种丰富度在不同的分解阶段表现出来的混合效应也会有所差异。如Hansen和Coleman[35]采用3种落叶树凋落物按照等比例混合,在分解的前9个月混合凋落物的分解速率实际值比计算值高7%,表现为正效应;再经过10个月的分解,分解速率的实际值比计算值低9%,表现为负效应;而Rustad和Cronan[36]对红花槭(Acerrubrum)、北美乔松(Pinusstrobus)和红云杉(Picearubens)3个物种凋落物等比例混合分解实验发现在分解第1年,混合凋落物失重率表现为加和效应,而在分解的第2年表现为了正效应。也有研究指出混合凋落物分解不随物种丰富度梯度变化[37- 39],原因可能是,在一些情况下混合凋落物效应影响的大小、物种变化特殊性应答不能在凋落物混合整体水平上体现出来,忽略了各物种之间的相互作用,不同物种的正、负效应相互作用彼此平衡,导致总体失重率差异不显著[40]。因此,需要对组成混合凋落物中的单种组分失重率进行区分[26,41]。目前不同的物种多样性梯度和物种组成对混合凋落物分解速率的影响尚无规律可循,也没有一致的结论,原因可能在于混合凋落物分解受到气候、分解微生境、土壤动物和微生物等许多因素的影响,其质量损失的加和效应或非加和效应或许并不是简单地通过物种丰富度的多寡就能明确解释的,所以混合凋落物分解的效应有待于进一步深入研究。
3.2混合凋落物中特异物种对分解速率的影响
凋落物混合分解过程中,一些物种通过向环境中分泌分解产物对其他物种或微生物产生有害或有益的影响[42],这些物种所具有的特异性会导致不同的物种组合分解速率有很大差异。有研究表明混合凋落物分解表现出负效应与特异物种的抑制作用直接相关。Nilsson等人[28]对阔叶林混合凋落物分解的研究发现,岩高兰(Empetrumhermaphroditum)与赤茎藓(Pleuroziumschreberi)的混合凋落物分解速率与计算值相比产生了负效应,尤其是赤茎藓的分解速率被显著抑制,同时,单独分解的欧洲赤松(Pinussylvestris)的分解速率也受到抑制。Nilsson认为产生这种情况是由于岩高兰产生的二次代谢产物抑制了土壤中微生物的活性,使处于这一微生境中的凋落物分解受到抑制作用。McArthur等人[40]对水生生态系统中河滩植物黑栎(Quercusnigra)和北美枫香(Liquidambarstyraciflua)的混合凋落物研究也得到了相似的结论,由于黑栎的渗透液抑制了相邻的北美枫香的分解,两个物种混合分解表现出负效应。由此可知,混合凋落物的分解过程并非简单的物种丰富度问题,期间更掺杂了不同物种的特异性质,它们在物理和化学组分的差异都可能影响甚至改变混合凋落物分解的最终结果。
4 混合凋落物对分解过程中养分动态的影响
凋落物的养分变化是维持森林生态系统稳定及维持有机物生产的重要过程,生物多样性能够引起混合凋落物分解过程中养分动态发生变化。Gartner和Cardon[33]统计了123个混合凋落物分解实验,其中76%的研究元素释放显示出显著的非加和效应。一般认为,凋落物分解过程中,混合凋落物体系中养分元素含量较高的凋落物会为养分含量低的凋落物有机体提供养分,减缓低质量凋落物养分释放,促进高质量凋落物的分解和养分释放,凋落物养分元素含量差异越大这种相互影响表现得越明显[33]。在自然条件下桉树(Eucalyptus)养分周转速率相对缓慢,很多研究采用桉树凋落物与其他物种混合进行分解实验,来验证添加高质量凋落物对混合凋落物分解的影响以及不同物种之间的养分流动情况。Xiang和Bauhus[43]采用桉树和黑荆(Acaciamearnsii)凋落物按照100%桉树, 75%桉树:25%黑荆,50%桉树:50%黑荆,25%桉树:75%黑荆和100%黑荆五种不同比例进行混合凋落物分解实验,发现混合凋落物中氮元素和磷元素含量随着黑荆在凋落物中所占比例的增加而提高。Briones等人[44]将桉树叶凋落物分别与栎树(Quercussp)、白蜡(Fraxinussp)和桦树(Betulasp)的叶凋落物混合进行分解实验,13周后将混合凋落物中的各个单种分开测定,发现单种凋落物的营养元素含量的增大通常伴随着另一种凋落物营养元素含量的降低。这些研究表明混合凋落物中的养分从含量高的非桉树物种向含量低的桉树发生转移,并且增加了分解者可利用氮的有效性,加快混合凋落物分解早期的分解速率。产生这种效应的机理是在混合凋落物分解过程中,分解者优先利用高质量凋落物,使低质量的凋落物反而具有了较高的养分有效性,引起低质量凋落物分解加快并最终使混合凋落物整体分解速率加快[20]。
有些研究者利用15N同位素标记法不仅再次证实了混合凋落物物种之间氮元素的转移[45-46],还发现氮元素是以氨基酸的形式通过真菌菌丝进行转移的[47],主要通过淋溶作用和菌丝扩散实现,没有发生真菌的转移[45,48]。由于氮元素是以氨基酸的形式进行转移,在转移过程中也伴随着碳元素的转移[47]。Frey等[49]发现分解者将碳元素从混合凋落物转移到土壤的过程中伴随着氮元素的富集,但是研究并没有得出混合凋落物中碳的转移方向。而Berglund等人[50]对欧洲赤松和玉米叶进行混合凋落物分解的研究补充了这方面的不足。他们采用在13C上具有不同自然同位素的欧洲赤松和玉米作为实验材料,通过添加15N标记的方法探究碳、氮在混合凋落物中转移的方向、多少以及他们之间的相互作用,发现碳从欧洲赤松向玉米方向转移较多,而氮则是从玉米向欧洲赤松方向转移,即从高氮植物向低氮植物转移,因此碳释放在一定程度上受到氮释放的限制。在分解过程中不只是碳、氮的释放有一定联系,锰离子作为过氧化物酶的重要组成成分,其浓度与凋落物中木质素的分解呈正相关关系[51]。
另外,在混合凋落物分解的不同时期,物种多样性对元素释放的影响和表现也不同。蒋云峰等[52]对长白山针阔混交林4种主要物种的凋落物进行了2a的野外分解袋实验,在分解第1年4种混合凋落物对碳释放均表现为抑制作用,而在分解第2年则表现出了促进作用;在红松(Pinuskoraiensis)和色木槭(Acermono)混合分解前期对磷元素释放表现出了促进作用,在分解后期无显著影响。由此可知,植物多样性的变化对凋落物分解过程中的养分释放的作用十分复杂,受到物种组成、元素之间的相互作用、分解者和分解阶段等多方面因素的影响。
5 混合凋落物对分解者的影响
5.1对土壤动物的影响5.1.1土壤动物类群对混合凋落物多样性的响应及其对分解的影响
很多研究表明凋落物多样性对土壤动物群落总多度有轻微的影响或几乎没有影响,而物种组成对线虫和大型土壤动物的群落组成和多样性有显著影响[4, 53-54],当把生物类群鉴定到属、种水平时,部分土壤动物类群的多度与混合凋落物植物多样性呈正相关关系[55-56],如甲螨类的物种丰富度与混合凋落物多样性[57]及微生境物种多样性[35]均显著相关;与单种凋落物相比,混合凋落物中螨类和小型节肢动物物种丰富度更高[30]。在火炬松(Pinustaeda)针叶和山茱萸(Cornusofficinalis)混合叶凋落物分解过程中,土壤动物的个体数是各单种凋落物分解时的2.3倍,并导致混合凋落物的分解速率高于各自单独分解的速率[58];另有物种剔除实验表明部分稀有植物类群消失使土壤动物类群和个体数量显著下降[53]。土壤动物类群对不同凋落物多样性产生响应主要原因有两个:一是混合凋落物为土壤微生物提供了更为丰富的碳源和营养物质,避免了单一凋落物分解过程中,早期微生物数量因资源充足种群数量爆发而后期资源匮乏大幅下降,从而解决了因食物源的大幅度波动对土壤动物的生存造成的威胁[59];二是混合凋落物改变了土壤动物的栖息环境,弥补了一些单种凋落物形态单一引起的生境缺陷,还能提供更多产卵和发育的环境。因此,提高凋落物的物种多样性从物理、化学和生物等过程优化微生境,从而驱动土壤动物丰富性的增加。并且由于土壤动物的取食偏好性差异,土壤动物类群对于不同物种构建的相同多样性水平下的混合凋落物的响应也不同,因此不同物种丰富度和均匀的混合凋落物具有不同的土壤动物数量和类群,引起混合凋落物分解速率的差异,凋落物植物多样性和土壤动物之间的相互作对陆地温带森林中的分解速率起决定性作用[20]。
5.1.2混合凋落物不同分解阶段土壤动物丰富度和多样性动态
土壤动物群落结构在混合凋落物分解过程中具有一定的时间动态,随着分解阶段的变化而变化。林英华等[60]在辽东栎(Quercuswutaishanica)和油松(Pinustabuliformis)混交林的研究中发现土壤动物多样性与凋落物分解时间呈显著正相关关系。巨桉与台湾桤木混合凋落物分解初期土壤动物群落以啮虫目为主,中期为后孔寡毛目,后期为鞘翅目,末期为双翅目[61];大型土壤动物和中小型土壤动物的数量和类群均在分解7个月达到最高,9个月时开始下降[62];在6目孔径,即允许大型土壤动物进入的混合凋落物分解袋内,凋落物在6—7月份分解速率最快,与大型土壤动物数量变化有相似模式[63]。土壤动物随着混合凋落物分解的不同阶段产生的动态变化与凋落物分解的速度和所释放出的营养物质浓度有着密切的关联;并且随着冬季的到来土壤温度降低,土壤微生物数量受到影响,以微生物为食的跳虫、甲螨类等中型土壤动物和大型土壤动物的个体数量也随之降低[62-63]。因此,不同物种凋落物混合分解能提高凋落物中大型土壤动物的个体数量,大型土壤动物的类群和个体数对混合凋落物分解的动态过程产生响应,并具有相似的动态变化过程,促进了混合凋落物的分解[20, 64]。
5.2对土壤微生物的影响
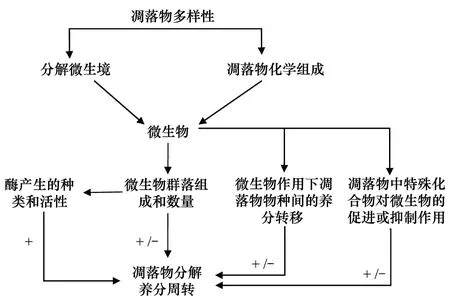
图1 凋落物多样性对土壤微生物的影响Fig.1 Effects of litter diversity on soil microorganism +:促进作用 shows synergistic effects;-:抑制作用 shows antagonistic effects
在混合凋落物分解过程中,凋落物物种组成的变化会改变凋落物化学组成、土壤微环境以及土壤动物群落结构,从而对土壤微生物量、其分泌的胞外酶的活性以及群落组成等产生影响[20],间接或直接地作用于混合凋落物的分解和养分周转(图1)。
混合凋落物与单种凋落物相比通常具有更丰富的碳源和营养成分,能为微生物提供多样的生态位和分解底物,微生物通过互补效应能够更有效地利用混合凋落物[65];凋落物分解过程中会产生氨基酸等物质吸引微生物在其周围聚集,促进微生物的生长发育,对微生物类群、数量和分布产生影响;并且,由于凋落物自身的性质的不同,主导的分解者类群也有所差异,含碳高的凋落物主要依靠真菌类群[66- 69],而主导含氮高的凋落物分解过程的往往是细菌类群[70],进而引起土壤微生物碳代谢特征产生差异,表现为高质量凋落物土壤微生物生物量碳、微生物呼吸速率以及微生物对土壤中有机质的利用效率较高,低质量凋落物则与之相反[71]。Kubartová等人[72]对法国南部温带森林凋落物分解中的真菌多样性研究发现,分解24个月后,混合凋落物中的真菌丰富度显著高于单种凋落物,并且混合凋落物分解速率也显著高于单种凋落物。一般情况下,混合凋落物在分解过程中真菌和细菌的生物量会有所提高[73],且凋落物不同的混合方式对土壤微生物量的促进作用不同[74],进而引起分解过程中微生物主导类群和数量的变化。
微生物是土壤酶的重要来源,在分解过程中土壤酶活性与特定的细菌和真菌类群密切相关[75]:真菌主要影响纤维素酶和几丁质酶的活性,调控凋落物中纤维素和几丁质等较难分解的组分[76];放线菌能够释放降解腐殖质和木质素的过氧化物酶的氧化酶、酯酶、氧化酶等[77-78];担子菌纲真菌释放漆酶、过氧化物酶等,对木质素和纤维素的降解具有重要作用[79-80]。因此,凋落物多样性通过影响微生物群落组成和数量等进一步导致酶种类和活性的差异,并直接作用于混合凋落物的分解[81-82]。宋影等人[83]对中亚热带森林中马尾松、槲栎(Quercusaliena)以及他们的混合凋落物(比例为8∶2)分解实验中证实,与单种分解相比,混合凋落物的微生物数量和多酚氧化酶活性显著提高,混合凋落物分解速率大于两个单种分解的速率,并且与纤维素酶活性、酸性磷酸酶活性呈显著正相关,与酚氧化酶活性呈显著负相关。并证实混合凋落物分解是微生物和多种酶共同作用的结果。
因此,凋落物多样性由于其自身化学组成和对微环境的影响,引起土壤微生物产生的酶种类和活性以及自身的群落结构和数量等方面产生变化,进一步对混合凋落物分解和养分周转产生加和效应和非加和效应。
5.3对土壤生物间交互作用的影响

图2 陆地生态系统凋落物分解过程中物种多样性对土壤动物区系间交互作用的影响Fig.2 Effects of species diversity on interactions among soil fauna durning litter decomposition in terrestrial ecosystem
参与凋落物分解过程中的土壤动物可以按照体长分为三类:以线虫和原生动物为主要类群的小型土壤动物(小于0.1mm),以跳虫和螨虫为主要类群的中型土壤动物(0.1—2mm),体长为2—20mm的大型土壤动物。在陆地生态系统中,土壤生物区系是分解者食物网的重要组成部分[54],也是凋落物分解过程、养分矿化的主要参与者,凋落物多样性对分解过程中不同土壤动物之间的交互作用产生一定的影响(图2)。
凋落物是土壤动物食物的主要来源[84],凋落物的多样性给土壤动物提供了更丰富的食物源,不同形态性状的凋落物叶片互补,提供了更适合的生存空间。如栎树、桦树和槭树叶凋落物混合分解微生境中,栎树叶片较厚并具有疏水性能避免结压,桦树叶凋落物能有效保持水分,而槭树分解较快提供更多的食物和较大表面积以供微生物生长,能够提高凋落物中大型土壤动物的个体数[20, 64]。
中小型土壤动物是取食凋落物的主要类群,对分解作用影响最大,其活性受到大型土壤动物的促进或者抑制,物种类群和数量也因大型土壤动物改变土壤团粒结构,土壤微生境和破碎凋落物而发生改变。中型土壤动物将破碎凋落物,扩大表面积为微生物侵入提供了更多的机会,并且微生物数量与凋落物破碎化程度呈正相关关系[85-86],其粪便为更小型土壤动物提供食物来源,又为微生物生长繁殖提供了能量和养分[87],。以原生动物和线虫为代表的小型土壤动物,通过调节细菌和真菌种群结构,改变凋落物分解和养分周转[30]。原生动物通常优先捕食细菌,甚至是特定的细菌种类和其他小型土壤动物区系动物[88],改变了微生物的群落组成,进一步影响凋落物分解和养分周转;线虫同样以细菌为主要食物来源,在森林凋落物中线虫对细菌的年消耗量为80g m-2a-1,并产生2—13 g m-2a-1氮矿化量,在土壤氮循环中占有很大比例[89],因此,小型土壤动物直接影响微生物群落结构,继而对凋落物分解和养分周转产生影响。不同凋落物物种组成和丰富度通过改变微生境并提供一系列不同食物资源对土壤微生物群落结构、数量和活性产生影响,进而对凋落物分解和养分周转产生促进或抑制作用。由此可见,凋落物分解过程中土壤动物之间的交互作用对于探究分解过程如何受凋落物多样性影响有重要意义。
综上所述,凋落物物种多样性对分解微生境土壤理化性状、微生物群落等方面的影响,与单种凋落物分解微生境相比有显著差异,这些差异是解释特定生态系统中,混合凋落物分解产生非加和效应的重要方面。从目前的研究结果看,有超过60%的研究发现,混合凋落物对其分解速率的影响存在正向或负向的效应。一般认为,分解过程中混合凋落物体系中养分元素含量较高的凋落物,会为养分含量低的有机体提供养分,凋落物养分元素含量差异越大,这种相互影响表现得越明显,分解者优先利用高质量凋落物,使低质量的凋落物反而具有了较高的养分有效性,引起低质量凋落物分解加快并最终使混合凋落物整体分解速率加快;不同物种凋落物混合分解影响大型土壤动物的类群和个体数,并对混合凋落物分解的动态过程产生响应,两者具有相似的动态变化过程;凋落物多样性提供更丰富的碳源和营养物质,并对土壤微生物的生存环境产生不同程度的影响,引起的微生物群落组成和数量等的变化,进一步导致酶种类和活性的差异,并直接作用于混合凋落物的分解。目前不同的物种多样性梯度和物种组成,对混合凋落物分解速率的影响尚无规律可循,也没有一致的结论,原因可能在于混合凋落物分解受到气候、分解微生境、土壤动物和微生物等许多因素的影响,其质量损失的加和效应或非加和效应或许并不是简单地通过物种丰富度的多寡就能明确解释的,所以混合凋落物分解的效应有待于进一步深入研究。因此,基于混合凋落物的分解研究是非常必要的,研究过程中将混合物种的各自分解动态与总的分解动态加以整合和比较,可以更为有效地解释生物多样性对凋落物分解过程的影响。与此同时,还应该将混合凋落物放在全球气候变化的大背景下进行研究。全球气候变化引起陆地生态系统多样性丧失[90],改变凋落物分解微生境和化学组成,进而影响凋落物分解。凋落物作为影响陆地生态系统生物多样性的一个重要因子,同时它的分解又受到物种多样性的调控,这种作用对整个陆地生态系统养分循环和生态系统功能的研究尤为重要。
致谢:感谢中国科学院植物研究所梁宇副研究员对本文写作的帮助。
[1]王凤友. 森林凋落量研究综述. 生态学进展, 1989, 6(2): 82- 89.
[2]Swift M J, Heal O W, Anderson J M. Decomposition in Terrestrial Ecosystems. California: University of California Press, 1979.
[3]Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus B, 1992, 44(2): 81- 99.
[4]Jiang Y F, Yin X Q, Wang F B. The influence of litter mixing on decomposition and soil fauna assemblages in aPinuskoraiensismixed broad-leaved forest of the Changbai Mountains, China. European Journal of Soil Biology, 2013, 55: 28- 39.
[5]Schlesinger W H, Bernhardt E S. Biogeochemistry: An Analysis of Global Change. New York: Academic Press, 2013.
[6]McCann K S. The diversity-stability debate. Nature, 2000, 405(6783): 228- 233.
[7]Ebermayer E. Die Gesammte Lehre Der Waldstreu Mit Rücksicht Auf Die Chemische Statik Des Waldbaues: Unter Zugrundlegung Der in Den Königl. Staatsforsten Bayerns Angestellten Untersuchungen Bearbeitet. Berlin Heidelberg: Springer-Verlag, 1876.
[8]Tenney F G, Waksman S A. Composition of natural organic materials and their decomposition in the soil: IV. The nature and rapidity of decomposition of the various organic complexes in different plant materials, under aerobic conditions. Soil Science, 1929, 28(1): 55- 55.
[9]Melin E. Biological decomposition of some types of litter from North American forests. Ecology, 1930, 11(1): 72- 101.
[10]Gustafson F G. Decomposition of the leaves of some forest trees under field conditions. Plant Physiology, 1943, 18(4): 704- 707.
[11]Bocock K L, Gilbert O J W. The disappearance of leaf litter under different woodland conditions. Plant and Soil, 1957, 9(2): 179- 185.
[12]Olson J S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322- 331.
[13]Fogel R, Cromack Jr K. Effect of habitat and substrate quality on Douglas fir litter decomposition in western Oregon. Canadian Journal of Botany, 1977, 55(12): 1632- 1640.
[14]Almin K E, Eriksson K E. Enzymic degradation of polymers: I. Viscometric method for the determination of enzymic activity. Biochimica et Biophysica Acta (BBA)-Enzymology, 1967, 139(2): 238- 247.
[15]Ladd J N, Butler J H A. Short-term assays of soil proteolytic enzyme activities using proteins and dipeptide derivatives as substrates. Soil Biology and Biochemistry, 1972, 4(1): 19- 30.
[16]Vestgarden L S. Carbon and nitrogen turnover in the early stage of Scots pine (PinussylvestrisL.) needle litter decomposition: effects of internal and external nitrogen. Soil Biology & Biochemistry, 2001, 33(4/5): 465- 474.
[17]Kondo R, Iimori T, Imamura H, Nishida T. Polymerization of DHP and depolymerization of DHP-glucoside by lignin oxidizing enzymes. Journal of Biotechnology, 1990, 13(2/3): 181- 188.
[18]Berg B, McClaugherty C, De Santo A V, Johnson D. Humus buildup in boreal forests: effects of litter fall and its N concentration. Canadian Journal of Forest Research, 2001, 31(6): 988- 998.
[19]Wardle D A, Nilsson M C, Zackrisson O, Gallet C. Determinants of litter mixing effects in a Swedish boreal forest. Soil Biology and Biochemistry, 2003, 35(6): 827- 835.
[20]Hättenschwiler S, Tiunov A V, Scheu S. Biodiversity and litter decomposition in terrestrial ecosystems. Annual Review of Ecology, Evolution, and Systematics, 2005, 36: 191- 218.
[21]林开敏, 章志琴, 邹双全, 曹光球. 杉木与阔叶树叶凋落物混合分解对土壤性质的影响. 土壤通报, 2006, 37(2): 258- 262.
[22]Batish D R, Singh H P, Pandher J K, Arora V, Kohli R K. Phytotoxic effect of Parthenium residues on the selected soil properties and growth of chickpea and radish. Weed Biology and Management, 2002, 2(2): 73- 78.
[23]胡亚林, 汪思龙, 黄宇, 于小军. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响. 生态学报, 2005, 25(10): 2662- 2668.
[24]Anderson T H, Domsch K H. The metabolic quotient for CO2(qCO2) as a specific activity parameter to assess the effects of environmental conditions, such as pH, on the microbial biomass of forest soils. Soil Biology and Biochemistry, 1993, 25(3): 393- 395.
[25]Conn C, Dighton J. Litter quality influences on decomposition, ectomycorrhizal community structure and mycorrhizal root surface acid phosphatase activity. Soil Biology and Biochemistry, 2000, 32(4): 489- 496.
[26]Salamanca E F, Kaneko N, Katagiri S. Effects of leaf litter mixtures on the decomposition ofQuercusserrataandPinusdensiflorausing field and laboratory microcosm methods. Ecological Engineering, 1998, 10(1): 53- 73.
[27]Wardle D A, Bonner K I, Nicholson K S. Biodiversity and plant litter: experimental evidence which does not support the view that enhanced species richness improves ecosystem function. Oikos, 1997, 79(2): 247- 258.
[28]Nilsson M C, Wardle D A, Dahlberg A. Effects of plant litter species composition and diversity on the boreal forest plant-soil system. Oikos, 1999, 86(1): 16- 26.
[29]Ashton E C, Hogarth P J, Ormond R. Breakdown of mangrove leaf litter in a managed mangrove forest in Peninsular Malaysia. Hydrobiologia, 1999, 413: 77- 88.
[30]Blair J M, Parmelee R W, Beare M H. Decay rates, nitrogen fluxes, and decomposer communiies of single-and mixed-species foliar litter. Ecology, 1990, 71(5): 1976- 1985.
[31]Delaney M T, Fernandez I J, Simmons J A, Briggs R D. Red Maple and White Pine Litter Quality: Initial Changes with Decomposition. Maine Agricultural and Forest Experiment Station Technical Bulletin 162, 1996.
[32]Hansen R A. Red oak litter promotes a microarthropod functional group that accelerates its decomposition. Plant and Soil, 1999, 209(1): 37- 45.
[33]Gartner T B, Cardon Z G. Decomposition dynamics in mixed-species leaf litter. Oikos, 2004, 104(2): 230- 246.
[34]Hector A, Loreau M, Schmid B, Beierkuhnlein C, Caldeira M, Diemer M,. Biodiversity manipulation experiments: studies replicated at multiple sites // Loreau M, Naeem S, Inchausti P, eds. Biodiversity and Ecosystem Functioning: Synthesis and Perspectives. Oxford, UK: Oxford University Press, 2002: 36- 46.
[35]Hansen R A, Coleman D C. Litter complexity and composition are determinants of the diversity and species composition of oribatid mites (Acari: Oribatida) in litterbags. Applied Soil Ecology, 1998, 9(1/3): 17- 23.
[36]Rustad L E, Cronan C S. Element loss and retention during litter decay in a red spruce stand in Maine. Canadian Journal of Forest Research, 1988, 18(7): 947- 953.
[37]Knops J M, Wedin D, Tilman D. Biodiversity and decomposition in experimental grassland ecosystems. Oecologia, 2001, 126(3): 429- 433.
[38]Lecerf A, Risnoveanu G, Popescu C, Gessner M O, Chauvet E. Decomposition of diverse litter mixtures in streams. Ecology, 2007, 88(1): 219- 227.
[39]Rustad L E. Element dynamics along a decay continuum in a red spruce ecosystem in Maine, USA. Ecology, 1994, 75(4): 867- 879.
[40]Mudrick D A, Hoosein M, Hicks Jr R R, Townsend E C. Decomposition of leaf litter in an Appalachian forest: effects of leaf species, aspect, slope position and time. Forest Ecology and Management, 1994, 68(2/3): 231- 250.
[41]Prescott C E, Zabek L M, Staley C L, Kabzems R. Decomposition of broadleaf and needle litter in forests of British Columbia: influences of litter type, forest type, and litter mixtures. Canadian Journal of Forest Research, 2000, 30(11): 1742- 1750.
[42]Einhellig F A, Rasmussen J A, Hejl A M, Souza I F. Effects of root exudate sorgoleone on photosynthesis. Journal of Chemical Ecology, 1993, 19(2): 369- 375.
[43]Xiang W, Bauhus J. Does the addition of litter from N-fixingAcaciamearnsiiaccelerate leaf decomposition ofEucalyptusglobulus?. Australian Journal of Botany, 2007, 55(5): 576- 583.
[44]Briones M J I, Ineson P. Decomposition of eucalyptus leaves in litter mixtures. Soil Biology and Biochemistry, 1996, 28(10/11): 1381- 1388.
[45]Lummer D, Scheu S, Butenschoen O. Connecting litter quality, microbial community and nitrogen transfer mechanisms in decomposing litter mixtures. Oikos, 2012, 121(10): 1649- 1655.
[46]Schimel J P, Hättenschwiler S. Nitrogen transfer between decomposing leaves of different N status. Soil Biology and Biochemistry, 2007, 39(7): 1428- 1436.
[47]Tlalka M, Bebber D P, Darrah P R, Watkinson S C, Fricker M D. Emergence of self-organised oscillatory domains in fungal mycelia. Fungal Genetics and Biology, 2007, 44(11): 1085- 1095.
[48]Tiunov A V. Particle size alters litter diversity effects on decomposition. Soil Biology and Biochemistry, 2009, 41(1): 176- 178.
[49]Frey S D, Six J, Elliott E T. Reciprocal transfer of carbon and nitrogen by decomposer fungi at the soil-litter interface. Soil Biology and Biochemistry, 2003, 35(7): 1001- 1004.
[50]Berglund S L, Ågren G I, Ekblad A. Carbon and nitrogen transfer in leaf litter mixtures. Soil Biology and Biochemistry, 2013, 57: 341- 348.
[51]Hofrichter M. Review: lignin conversion by manganese peroxidase (MnP). Enzyme and Microbial Technology, 2002, 30(4): 454- 466.
[52]蒋云峰. 长白山针阔混交林主要凋落物分解及土壤动物的作用[D]. 长春: 东北师范大学, 2013.
[53]Sayer E J. Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems. Biological Reviews, 2006, 81(1): 1- 31.
[54]Wardle D A, Zackrisson O. Effects of species and functional group loss on island ecosystem properties. Nature, 2005, 435(7043): 806- 810.
[55]Wardle D A, Yeates G W, Barker G M, Bonner K I. The influence of plant litter diversity on decomposer abundance and diversity. Soil Biology and Biochemistry, 2006, 38(5): 1052- 1062.
[56]Yan S K, Singh A N, Fu S L, Liao C H, Wang S L, Li Y L, Cui Y, Hu L L. A soil fauna index for assessing soil quality. Soil Biology and Biochemistry, 2012, 47: 158- 165.
[57]Kaneko N, Salamanca E. Mixed leaf litter effects on decomposition rates and soil microarthropod communities in an oak-pine stand in Japan. Ecological Research, 1999, 14(2): 131- 138.
[58]Crossley Jr D A, Hoglund M P. A litter-bag method for the study of microarthropods inhabiting leaf litter. Ecology, 1962, 43(3): 571- 573.
[59]Lussenhop J. Mechanisms of microarthropod-microbial interactions in soil. Advances in Ecological Research, 1992, 23: 1- 33.
[60]林英华, 杨德付, 张夫道, 王建修, 白秀兰, 王兵. 栎林凋落层土壤动物群落结构及其在凋落物分解中的变化. 林业科学研究, 2006, 19(3): 331- 336.
[61]李艳红, 罗承德, 杨万勤, 胡杰, 吴福忠. 桉-桤混合凋落物分解及其土壤动物群落动态. 应用生态学报, 2011, 22(4): 851- 856.
[62]林英华, 张夫道, 刘海东, 苏化龙. 百望山土壤动物群落结构在枸树落叶分解中的变化. 动物学杂志, 2005, 40(3): 60- 66.
[63]李艳红, 杨万勤, 罗承德, 吴福忠, 胡杰. 桉-桤不同混合比例凋落物分解过程中土壤动物群落动态. 生态学报, 2013, 33(1): 159- 167.
[64]Irmler U. Changes in the fauna and its contribution to mass loss and N release during leaf litter decomposition in two deciduous forests. Pedobiologia, 2000, 44(2): 105- 118.
[65]严海元, 辜夕容, 申鸿. 森林凋落物的微生物分解. 生态学杂志, 2010, 29(9): 1827- 1835.
[66]Frey S D, Elliott E T, Paustian K. Bacterial and fungal abundance and biomass in conventional and no-tillage agroecosystems along two climatic gradients. Soil Biology and Biochemistry, 1999, 31(4): 573- 585.
[67]Guggenberger G, Frey S D, Six J, Paustian K, Elliott E T. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems. Soil Science Society of America Journal, 1999, 63(5): 1188- 1198.
[68]Holland E A, Coleman D C. Litter placement effects on microbial and organic matter dynamics in an agroecosystem. Ecology, 1987, 68(2): 425- 433.
[69]McMahon S K, Williams M A, Bottomley P J, Myrold D D. Dynamics of microbial communities during decomposition of carbon- 13 labeled ryegrass fractions in soil. Soil Science Society of America Journal, 2005, 69(4): 1238- 1247.
[70]Six J, Feller C, Denef K, Ogle S M, de Moraes Sa J C, Albrecht A. Soil organic matter, biota and aggregation in temperate and tropical soils-Effects of no-tillage. Agronomie, 2002, 22(7/8): 755- 775.
[71]立天宇, 康峰峰, 韩海荣, 高晶, 宋小帅, 于舒, 赵金龙, 于晓文. 冀北辽河源自然保护区土壤微生物碳代谢对阔叶林叶凋落物组成的响应. 应用生态学报, 2015, 26(3): 715- 722.
[72]Kubartová A, Ranger J, Berthelin J, Beguiristain T. Diversity and decomposing ability of saprophytic fungi from temperate forest litter. Microbial Ecology, 2009, 58(1): 98- 107.
[73]Malosso E, English L, Hopkins D W, O′Donnell A G. Use of13C-labelled plant materials and ergosterol, PLFA and NLFA analyses to investigate organic matter decomposition in Antarctic soil. Soil Biology & Biochemistry, 2004, 36(1): 165- 175.
[74]刘增文, 段而军, 高文俊, 张丽萍, 杜红霞, 付刚, 崔芳芳. 秦岭山区人工林地枯落叶客置对土壤生物、化学性质的影响. 应用生态学报, 2008, 19(4): 704- 710.
[75]Aon M A, Cabello M N, Sarena D E, Colaneri A C, Franco M G, Burgos J L, Cortassa S. I. Spatio-temporal patterns of soil microbial and enzymatic activities in an agricultural soil. Applied Soil Ecology, 2001, 18(3): 239- 254.
[76]Andersson M, Kjøller A, Struwe S. Microbial enzyme activities in leaf litter, humus and mineral soil layers of European forests. Soil Biology and Biochemistry, 2004, 36(10): 1527- 1537.
[77]Dari K, Béchet M, Blondeau R. Isolation of soilStreptomycesstrains capable of degrading humic acids and analysis of their peroxidase activity. FEMS Microbiology Ecology, 1995, 16(2): 115- 122.
[78]Magnuson T S, Crawford D. Comparison of extracellular peroxidase-and esterase-deficient mutants of Streptomyces viridosporus T7A. Applied and Environmental Microbiology, 1992, 58(3): 1070- 1072.
[79]Sariaslani F S, Dalton H. Microbial enzymes for oxidation of organic molecules. Critical Reviews in Biotechnology, 1989, 9(3): 171- 257.
[80]杨万勤, 王开运. 森林土壤酶的研究进展. 林业科学, 2004, 40(2): 152- 159.
[81]Bandick A K, Dick R P. Field management effects on soil enzyme activities. Soil Biology and Biochemistry, 1999, 31(11): 1471- 1479.
[82]Dilly O, Munch J C. Microbial biomass content, basal respiration and enzyme activities during the course of decomposition of leaf litter in a black alder (Alnusglutinosa(L.) Gaertn.) forest. Soil Biology & Biochemistry, 1996, 28(8): 1073- 1081.
[83]宋影, 辜夕容, 严海元, 毛文韬, 吴雪莲, 万宇轩. 中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态. 环境科学, 2014, 35(3): 1151- 1158.
[84]陈法霖, 郑华, 欧阳志云, 张凯, 屠乃美. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 2011, 48(3): 603- 611.
[85]Tarafdar J C, Meena S C, Kathju S. Influence of straw size on activity and biomass of soil microorganisms during decomposition. European Journal of Soil Biology, 2001, 37(3): 157- 160.
[86]Witkamp M, Olson J S. Breakdown of confined and nonconfined oak litter. Oikos, 1963, 14(2): 138- 147.
[87]Hendrix P F, Parmelee R W, Crossley D, Coleman D C, Odum E P, Groffman P M. Detritus food webs in conventional and no-tillage agroecosystems. BioScience, 1986, 36(6): 374- 380.
[88]Lavelle P, Bignell D, Lepage M, Wolters W, Roger P, Ineson P, Heal O W, Dhillion S. Soil function in a changing world: the role of invertebrate ecosystem engineers. European Journal of Soil Biology, 1997, 33(4): 159- 193.
[89]Anderson R, Coleman D, Cole C. Effects of saprotrophic grazing on net mineralization // Clark F E, Rosswall T. Terrestrial Nitrogen Cycles. Stockholm: Ecological Bulletins (Sweden), 1981.
[90]Newbold T, Hudson L N, Hill S L, Contu S, Lysenko I, Senior R A, Börger L, Bennett D J, Choimes A, Collen B, Day J, De Palma A, Díaz S, Echeverria-Londoo S, Edgar M J, Feldman A, Garon M, Harrison M L, Alhusseini T, Ingram D J, Itescu Y, Kattge J, Kemp V, Kirkpatrick L, Kleyer M, Correia D L, Martin C D, Meiri S, Novosolov M, Pan Y, Phillips H R, Purves D W, Robinson A, Simpson J, Tuck S L, Weiher E, White H J, Ewers R M, Mace G M, Scharlemann J P, Purvis A. Global effects of land use on local terrestrial biodiversity. Nature, 2015, 520(7545): 45- 50.
The research of mixed litter effects on litter decomposition in terrestrial ecosystems
LI Yinong1,2, ZHOU Xiaomei1,*, ZHANG Naili2, MA Keping2
1CollegeofLifeScience,JilinNormalUniversity,Siping136000,China2StateKeyLaboratoryofVegetationandEnvironmentalChange,InstituteofBotany,ChineseAcademyofSciences,Beijing100093,China
Decomposition is one of the most important ecosystem processes, which plays a critical role in regulating nutrient cycling and energy flow in terrestrial ecosystems. In terrestrial ecosystems, multiple plant species coexist in a community with high plant species richness, which may lead to diverse plant litter input and complicated litter chemicals, high microhabitat heterogeneity, and highly diverse decomposers and their interactions. Mixed soil litters with diverse plant species usually have more complex mechanism underlying decomposition because of the complementary use of nutrients and transfer among different species, greatly challenging the assumptions about litter decomposition and biodiversity. We reviewed the studies on decomposition of mixed-species litter in terms of the impact of plant diversity on litter quality, decomposing microhabitats, and decomposers and their interactions. We found that the majority of recent studies revealed a non-additive effect of mixed litters on mass loss and nutrient dynamics during the duration of decomposition. The occurrence of some specific plant species might strengthen the non-additive effect because they contained some special compounds. Different litter types differ in chemical composition and physical properties, and decomposing of high-quality litter by decomposer organisms eventually leads to a high nutrient availability and allows nutrient transfer to low-quality litter. Transferred nutrients, in turn, lead to a more rapid decomposition of the low-quality litter and, consequently, of the entire litter mixture. Litter species identity was an important determinant of abundance and diversity of soil fauna, while litter mixing had weak or no significant effect on the soil fauna communities; however, it had significant effect on components of the macrofauna and nematodes and their diversity. Moreover, the effects of mixed litters on decomposers usually depend on the decomposing time. Some studies showed that litter diversity may induce significant changes in the composition, diversity, and enzyme activities of decomposers such as soil fauna and microbes, and also modify the interactions among the decomposers, which may induce further changes in litter decomposition. These results suggest significant effects of mixed litter on decomposition rate and an important role of decomposers in regulating decomposition of mixed litters, which are helpful to understand the effects of mixed litter on litter decomposition and nutrient dynamics in the plant-soil-decomposer system.
Biodiversity; litter decomposition; microbial diversity; soil fauna; non-additive effects
国家自然科学基金项目(31270559);植被与环境变化国家重点实验室自由探索项目
2015- 01- 20; 网络出版日期:2015- 12- 03
Corresponding author.E-mail: 18609872395@163.com
10.5846/stxb201501200165
李宜浓, 周晓梅,张乃莉, 马克平.陆地生态系统混合凋落物分解研究进展.生态学报,2016,36(16):4977- 4987.
Li Y N, Zhou X M, Zhang N L, Ma K P.The research of mixed litter effects on litter decomposition in terrestrial ecosystems.Acta Ecologica Sinica,2016,36(16):4977- 4987.
