根际效应对大豆田土壤线虫群落组成及多样性的影响
2016-10-25王雪峰毛之夏徐济责吴东辉
王雪峰,毛之夏,徐济责,常 亮,吴东辉,*
1 中国科学院东北地理与农业生态研究所湿地生态与环境重点实验室,长春 130102 2 吉林农业科技学院,吉林 132101
根际效应对大豆田土壤线虫群落组成及多样性的影响
王雪峰1,毛之夏1,徐济责2,常 亮1,吴东辉1,*
1 中国科学院东北地理与农业生态研究所湿地生态与环境重点实验室,长春130102 2 吉林农业科技学院,吉林132101
根际作为重要的环境界面是植物与环境之间物质能量交换的场所,关于根际效应的研究已成为土壤生态学的新兴热点领域,然而有关大豆根际效应对土壤动物多样性影响的研究报道并不多见。在三江平原选择连续耕作15a的大豆田,对大豆根际区与非根际区土壤线虫群落结构组成进行了对比分析。结果表明:大豆根际区土壤线虫总数、辛普森多样性指数(Dom)显著高于非根际区,根际区的物种数(S)、物种丰富度指数(SR)显著低于非根际区。说明大豆根际效应增加土壤线虫的丰度,但降低了线虫群落结构的复杂性。大豆根际区植物寄生线虫(PP)、食真菌线虫(FF)和食细菌线虫(BF)数量显著高于非根际区,而PP类群的比例在根际区却显著低于非根际区。这一研究结果表明食微线虫(FF和BF)类群在大豆根际区的比例增加更显著。食真菌与食细菌线虫数量比值(F/B)指示大豆根际区细菌生物量相对高于真菌生物量。研究结果丰富了农田土壤线虫多样性的研究内容,并为我国东北大豆田线虫病害的防治及定制相应的农业管理措施提供参考。
根际效应; 土壤线虫; 群落组成; 大豆田
根际是一个重要的环境界面,是植物与环境之间物质能量交换的场所,长期以来,根际环境一直是植物营养学、生态学、土壤学、微生物学学者研究和关注的热点[1- 2]。根际一般指距细根表面2 mm以内的土壤环境,是受根系活动影响最直接,植物、土壤和微生物关系最复杂的区域[3]。在植物、土壤、水、大气、微生物的综合作用下,根际区形成独特的物理、化学根际环境和生物区系[4- 6]。大豆是典型的固氮作物,其根际区植物有益根际细菌(plant growth-promoting rhizobacteria, PGPR)菌种资源丰富,促生菌的群落结构复杂多样[7],同时大豆也是农业致病线虫侵染研究和关注的典型作物[8],因此,大豆根际区可能形成特殊的土壤微生物及线虫群落结构。
土壤线虫是土壤动物区系的重要组成部分,土壤线虫因其占据土壤碎屑食物网的关键位置及多个营养级,在土壤有机质的分解及植物营养物质的矿化过程中起重要作用[9-12]。农田土壤线虫根据其取食习性及生活史策略被划分为不同的营养类群和功能团类群[13-14]。植物寄生线虫以取食植物根系为主,食微线虫(食细菌线虫和食真菌线虫)则通过取食微生物调控土壤微生物量进而影响植物营养物质的矿化及土壤的养分循环过程[15]。因此土壤线虫群落组成、营养类群和功能类群多样性,以及生态指数能够有效指示土壤微食物网、生态过程的变化情况[16-18]。长期以来关于大豆田土壤线虫的研究主要集中于植物寄生线虫大豆胞囊线虫的防治策略,以及不同农作管理措施下对土壤线虫群落组成结构的影响[8,19-21],而关于大豆根际效应对土壤线虫群落组成多样性影响的研究报道还不多见,特别是关于大豆根际区与非根际区土壤线虫的分布特征研究还未见报道。
三江平原是我国的最大淡水沼泽分布区,也是我国重要的商品粮基地,区内农田主要源自于1950s起大面积的湿地垦殖,大豆作为重要的经济作物在该区域种植普遍。本研究在三江平原腹地中国生态系统网络监测站(三江平原沼泽生态系统网络监测站)内选择由湿地开垦连续耕作15a的大豆田,通过比较大豆根际区与非根际区土壤线虫群落结构组成及多样性的变化情况,揭示土壤线虫群落对大豆根际效应的响应,进而为我国东北大豆田线虫病害的可持续防治及制定东北大豆田农业管理措施提供科学参考。本研究结果对农田生态系统土壤线虫生态学,以及农业土壤线虫病虫害的防治具有理论实践意义。
1 研究区概况与研究方法
1.1样地选择与采样方法
本研究于2013年8月初在中国科学院东北地理与农业生态研究所三江实验站内选择连作15a大豆田内采样。土质为沼泽草甸土。研究区为亚热带季风气候,海拔343 m,年均气温20℃,年降雨量1200—1500 mm。大豆田土壤基本理化性质为:土壤有机碳(SOC)17.6 g/kg,全氮(TN)3.32 g/kg,pH值为5.3,施肥量为4×104kg/km2复合肥(N∶P2O5∶K2O),供试作物为大豆宝丰7号(GlycinemaxMerr)。
根据以往的研究结果大豆花期固氮作用最强,根系作用活跃[22-23],因此本试验根据既定研究目标,将采样期定为2013年8月份大豆开花期进行采样,人为设置面积100 m2取样样方5个,每个样方相距50 m,非根际土采用2.5 cm直径的土钻在距离大豆根10 cm的垄台采集0—10 cm土壤样品,五点混合法采集土样放在自封袋中;大豆根际土样采集采用“抖根法”[24],即将大豆连根拔起,轻轻抖动后仍然粘在根上的土壤作为根际土,装袋、封口并作好标签,立即带回实验室分析处理。采集的根际土和非根际土土壤样品迅速运回实验室尽快完成线虫分离工作。
1.2土壤线虫的分离鉴定、计算
蔗糖离心法分离土壤线虫:每个土样称取100 g,用淘洗一过筛一蔗糖梯度密度离心法分离线虫,60℃温和热杀死,再加入等量的2倍三乙醇胺和福尔马林(TAF)固定液固定,然后混匀,倒入标本瓶中,待测。线虫总数通过解剖镜直接计数,依据土壤湿度将线虫个体数量折算成每100 g干土含有线虫的条数[14];线虫鉴定参照相关文献[13,25],根据线虫的头部形态学特征和取食习性将土壤线虫分成植物寄生线虫(PP)、食细菌线虫(BF)、食真菌线虫 (FF)和捕食/杂食线虫(OP)4个营养类群的分类方法,在光学显微镜下尽可能将线虫分类鉴定到科属水平,鉴定检索参见《中国土壤动物检索图鉴》[26]。
1.3线虫多样性指数计算方法
多样性指数度量采用土壤线虫生态学者普遍应用的多样性指数来度量土壤线虫群落多样性[13- 14,18]。
辛普森多样性指数(Dom):Dom=∑Pi2;
丰富度指数(SR):SR=(S-1)/lnN;
营养多样性指数(TD):TD=1/∑Pi2;式中Pi为各营养类群在线虫群落中所占的比例;
瓦斯乐斯卡指数[27](WI):WI=(FF+BF)/PP;
食真菌与食细菌线虫数量比值(F/B):F/B=FF/BF;
线虫通路指数[28](NCR):NCR=NBa/(NBa+NFu);
式中,N为所鉴定的线虫个体数目;S为鉴定分类单元的数目,某一给定的分类单元可以看作是第i个分类单元;Pi为第i个分类单元中个体所占的比例。FF、BF和PP分别为食真菌、食细菌和植物寄生性线虫的数量。NBa和NFu分别为食细菌线虫和食真菌线虫占线虫总数的相对多度。
1.4统计分析
采用SPSS(17.0)统计软件对数据进行T检验、方差分析、相关分析等。
2 结果与分析
2.1土壤线虫群落组成
本研究共鉴定出土壤线虫16属,根据其取食习性及生活史策略可划分为4个营养类群,9个功能类群(表1)。根际区鉴定出土壤线虫10个属,非根际区15个属,根际区线虫物种数显著低于非根际区。根际区优势属线虫Acrobeloides(Ba2),Aphelenchoides(Fu2)的相对多度显著高于非根际区(P<0.01),植物寄生类群线虫(PP)Coslenchus(H2)和Heterodera(H3)的相对多度在根际区显著低于非根际区(P<0.01和P<0.05)。与非根际区相比,根际区土壤出现一个常见属Rhabditis,同时分布于各营养类群的5个常见属消失,说明大豆根际区从细菌群落组成,植物根系种类都区别于非根际区,从而导致根际区与非根际区土壤线虫群落组成结构的明显变化。
2.2土壤线虫总数
大豆田根际区与非根际区土壤线虫总数和优势属线虫数量分析结果表明:根际区土壤线虫总数最高为568条/100 g干土,非根际区土壤线虫总数为236条/100 g干土,根际区土壤线虫总数显著高于非根际区(P<0.01)。同时4个主要线虫优势属Acrobeloides(Ba2),Aphelenchoides(Fu2),Coslenchus(H2)和Heterodera(H3)的数量在根际区高于非根际区,其中根际区与非根际区Acrobeloides(Ba2),Aphelenchoides(Fu2)和Heterodera(H3)属线虫的数量差异达显著水平(P<0.01)。优势属土壤线虫数量与线虫总数变化趋势一致,优势属土壤线虫数量决定线虫总数,分别占线虫总数的87.0%和67.8%。根际区优势属线虫数量对线虫总数的贡献大于非根际区(图1)。
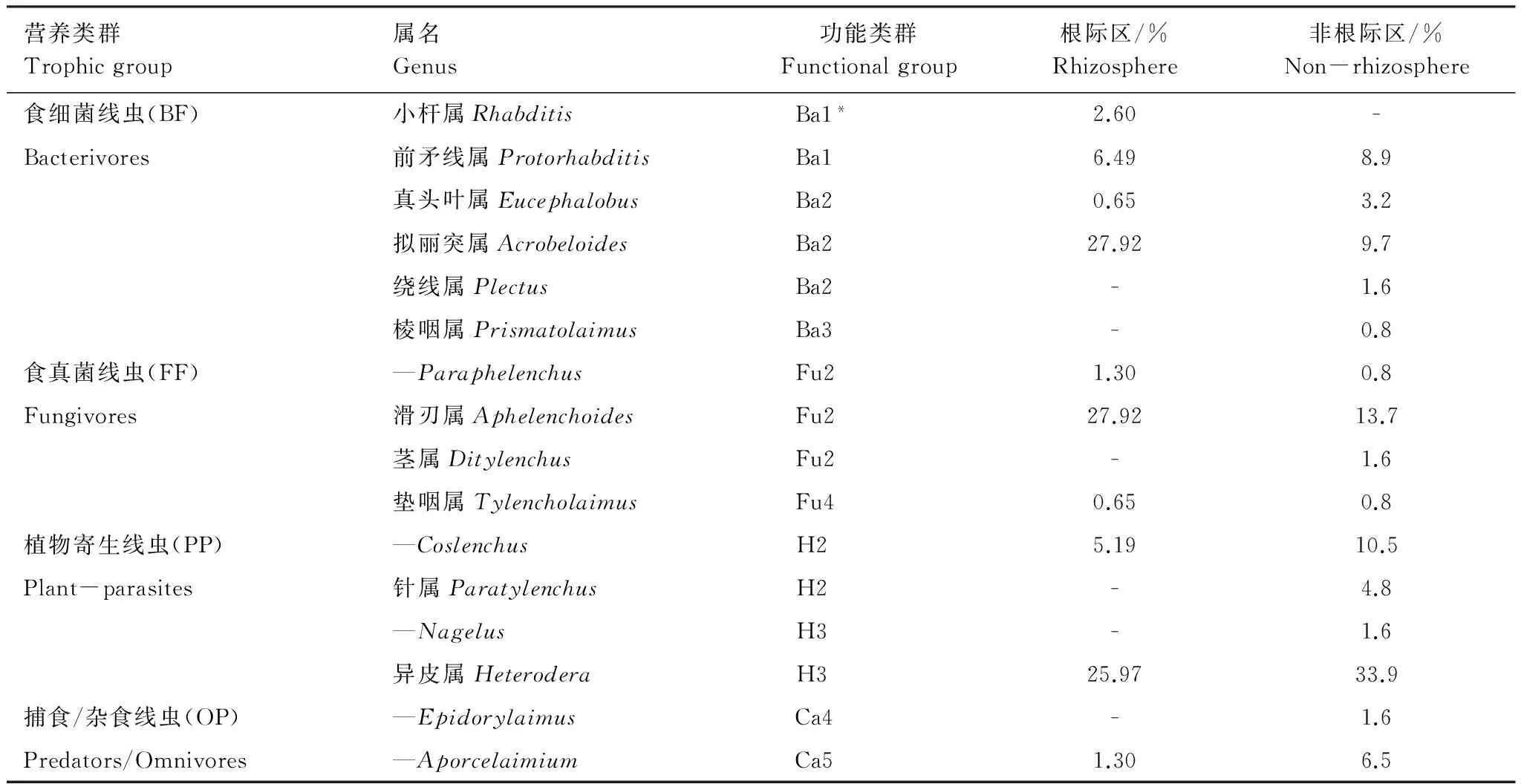
表1 大豆根际区与非根际区鉴定土壤线虫属的相对多度
Ba:食细菌线虫 Bacterivores;Fu:食真菌线虫 Fungivores;H:植食性线虫 Herbivores;Ca:捕食性线虫Carnivores;*线虫被赋予的c-p值;—还没有确定中文名称
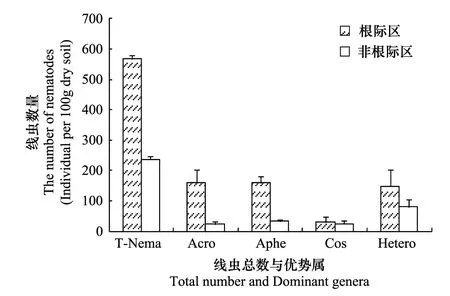
图1 大豆根际区与非根际区土壤线虫总数、优势属线虫数量 Fig.1 Numbers of total totality of nematodes and in Rhizosphere and Non-rhizosphere
2.3土壤线虫营养类群组成
大豆田土壤线虫根据Yeates[13]的营养类群划分方法划分为4个营养类群,除捕食/杂食线虫(OP)类群外,根际区植物寄生线虫(PP)、食细菌线虫(BF)和食真菌线虫(FF)3个营养类群的个体数量均显著高于非根际区(P<0.01),与总数变化趋势相一致。根际区食细菌线虫(FF)数量最高为214条/100 g干土,最低为捕食/杂食(OP)类群线虫7条/100 g干土(图2)。各营养类群在线虫总数中的比例如图2所示,食真菌线虫(FF)与食细菌线虫(BF)比例在根际区的比例显著高于非根际区(P<0.01),而植物寄生线虫(PP)和捕食/杂食线虫(OP)的比例在根际区的比例显著低于非根际区(P<0.01)。

图2 大豆根际区与非根际区土壤线虫营养类群数量、比例分布Fig.2 Abundance and relative abundance of four trophic groups of soil nematodes in Rhizosphere and Non-rhizosphere
2.4土壤线虫生态指数
根际区与非根际区各生态指数分析结果如表2所示,根际区线虫的物种数(S)和线虫物种丰富度指数(SR)均显著低于非根际区(P<0.01);辛普森多样性指数(Dom)对常见种敏感,稀有种对该指数的影响较小。根际区线虫Dom指数0.23显著高于非根际区0.17(P<0.05);线虫营养类群多样性指数(TD),根际区(3.05)>非根际区(2.81);线虫瓦斯勒斯卡指数(WI)表现为根际区(2.17)>非根际区(0.81);而根际区食真菌与食细菌线虫数量比值(F/B)和线虫通路指数(NCR)低于非根际区,其中根际区、非根际区F/B值差异达极显著水平(P<0.01)。
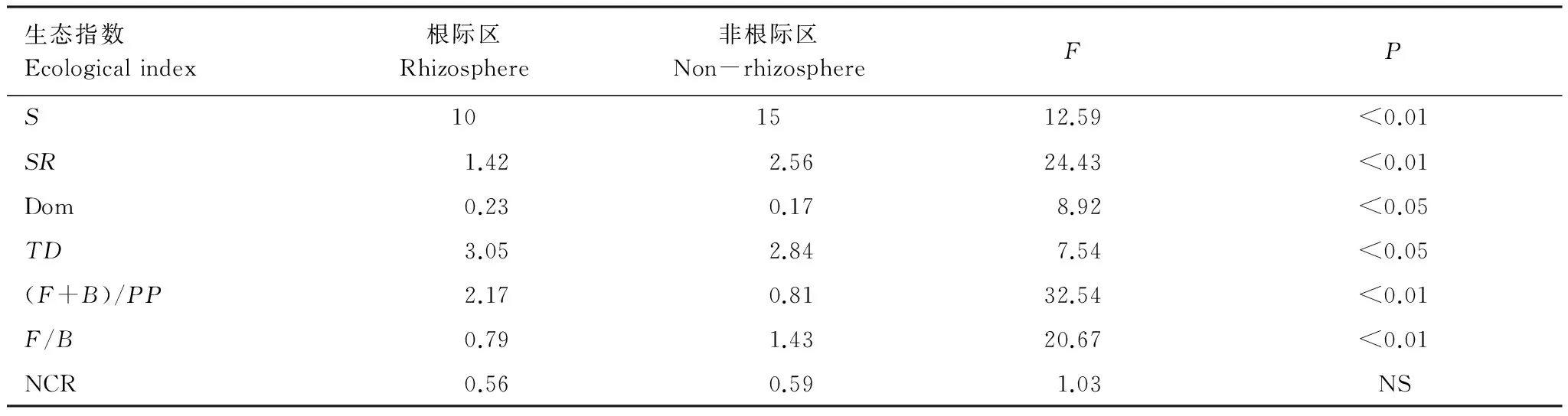
表2 大豆根际区与非根际区土壤线虫生态指数
S:线虫物种数 Spices;SR:丰富度指数 Richness;Dom:辛普森指数 Dominance;TD:营养多样性指数 Trophic Diversity;(F+B)/PP:瓦斯乐斯卡指数 Wasilewska Index;F/B:食真菌与食细菌线虫数量比值 Ratio of Fungivores to Bacterivores;NCR:线虫通路指数 Nematode Channel Ratio
3 讨论
本研究在三江平原大豆田根际区与非根际区共鉴定出土壤线虫16属,隶属于12科,大豆根际区、非根际区线虫总数分别为568条/100 g干土和214条/100 g干土。鉴定到的线虫可划分为4个营养类群,9个功能类群。这一结果可能与其它有大豆田土壤线虫研究中鉴定到的线虫数目相比较少。如Liang等[14]对地中海农业生态系统不同农作管理措施大豆田土壤线虫的研究中鉴定出9科23属;陈立杰等[21]在连作和轮作对大豆胞囊线虫的影响研究中鉴定到22科36属线虫;韩新华等[8]对我国黑土区轮作系统大豆田土壤线虫的研究中发现19科43个属线虫。土壤线虫的丰度分布与食物源和水分、温度等环境条件关系密切[10-11,13]。根据各自研究目的不同,以往的研究多是对大豆的整个生长期进行,而花期大豆根系生长迅速,根系生理代谢能力强,根际区微生物数量丰富,根系具有较强的呼吸代谢活动[22-23]。本研究侧重于根际效应对植物寄生线虫及自由生活线虫的研究,故选择大豆根际效应的旺盛时期(花期),有助于分析根际效应对线虫群落的影响。因此,生长期选择的不同可能是鉴定到线虫种类相对较少的直接原因。
辛普森指数(Dom)是Simpson在1949年利用概率论的原理提出来的,该指数对常见种敏感,稀有种对该指数的影响较小,而S、SR指数能够有效指示群落的物种数及群落结构的复杂性[29-30]。本研究发现虽然大豆根际区线虫总数显著高于非根际区土壤线虫总数,但是根际区的Dom多样性指数显著高于非根际区,而根际区的S、SR指数显著低于非根际区。由于Dom多样性指数倾向于优势属的数量,较高的Dom指数结合较低的S、SR指数说明根际区线虫群落组成优势种群单一,大豆根际效应增加土壤线虫的丰度,但降低了线虫群落结构的复杂性。与非根际区相比,在根际区一些常见属土壤线虫类群消失,而根际区优势属如Acrobeloides、Aphelenchoides和Heterodera属线虫丰富度显著高于非根际区。土壤线虫的分布主要受其取食的基质种类和数量影响,这一现象可能与食物资源分布的差异有关[31]。食物资源的供给状况是影响线虫群落的主要因素之一。例如Griffiths等[32]研究发现,由于大麦根系的分解而引起的微生物活性的增加,能使食细菌线虫中雌虫的比例迅速增大,最终导致整个线虫种群数量的增加。Heterodera属是典型的大豆根系寄生线虫,其在根际区的丰度显著高于非根际区的研究结果与根际区较多的大豆根系分布有关。而Acrobeloides和Aphelenchoides分别是典型的食细菌线虫(Bacterivores)和食真菌线虫(Fungivores),它们主要取食有益的、腐生的细菌和真菌以及有害的植物病原微生物[33-34],食微线虫的丰富度与土壤中微生物的数量或活性有关。本研究中大豆根际区丰富的食微线虫指示根际区可能分布某一较高的微生物生物量。大豆根际区微生物数量高于非根际区土壤,根际区丰富的根系生物量和微生物量为某些特殊的线虫类群提供了专一的食物源,显著刺激了其数量的增加。
从土壤线虫营养类群和功能类群角度认知土壤生物多样性不仅有效规避了人们对许多常见类群分类知识的相对匮乏,而且为从营养通道角度有效地分析食物网奠定了基础[35]。本研究发现构成大豆田线虫群落的3个主要类群(PP、FF和BF)在根际区的丰富度显著高于非根际区,然而植物寄生线虫(PP)的比例在根际区却显著低于非根际区,这说明大豆根际效应对土壤线虫群落中食微线虫类群(FF和BF)比例增加更显著。而根际区瓦斯乐斯卡指数(WI)高于非根际区,说明在根际区虽然植物寄生线虫数量显著增加,但是土壤食物网却比非根际区健康。食真菌与食细菌线虫数量比(F/B)指示根际区具有相对较高的细菌生物量,而在非根际区真菌生物量相对较高,但是以往关于大豆根际微生物的研究报道多集中于细菌群落组成及多样性的研究,而关于大豆根际区真菌群落多样性的研究报道还不多见,因此本研究通过F/B指数显示大豆根际微生物中,根际效应对真菌群落多样性的研究亦不能忽视。
4 结论
本研究结果表明,大豆根际区土壤线虫丰富度高于非根际区,但物种丰富度低于非根际区,大豆根际效应增加了土壤线虫群落的辛普森指数(Dom)多样性,但降低了线虫群落结构的复杂性。根际效应显著提高了Acrobeloides、Aphelenchoides和Heterodera属线虫的丰富度。大豆根际区、非根际区土壤线虫均由PP、FF和BF 3个主要类群构成。与非根际区相比,虽然根际区植物寄生类群线虫数量显著增加,但是低于根际效应对食微线虫丰度增加幅度;根际区食微线虫与植食性线虫的丰富度比值高于非根际区。土壤线虫能够有效指示大豆根际、非根际区域微生物群落特征,根际区丰度的线虫优势属数量、营养类群构成以及生态指数说明大豆根际区分布较高的微生物量,且根际效应可能增加了细菌生物量与真菌生物量的比。
[1]刘芷宇. 根际动态及其效应的研究. 世界农业, 1987, (8): 39- 41.
[2]王延平, 王华田, 谭秀梅, 姜岳忠, 孔令刚. 杨树人工林品种更替连作与非更替连作根际效应的比较. 生态学报, 2010, 30(5): 1379- 1389.
[3]赵琼, 曾德惠, 于占源, 邓斌, 范志平. 沙地樟子松人工林土壤磷素转化的根际效应. 应用生态学报, 2006, 17(8): 1377- 1381.
[4]张磊, 宋凤斌, 崔良, 于燕玲. 根际效应下镉在土壤中的吸附与解吸. 农业环境科学学报, 2007, 26(4): 1427- 1431.
[5]Ström L. Root exudation of organic acids: importance to nutrient availability and the calcifuge and calcicole behaviour of plants. Oikos, 1997, 80(3): 459- 466.
[6]Morel C, Hinsinger P. Root-induced modifications of the exchange of phosphate ion between soil solution and soil solid phase. Plant and Soil, 1999, 211(1): 103- 110.
[7]王志刚, 徐伟慧, 莫继先, 肖静, 孙剑秋, 王建丽. 东北黑土区大豆根际促生菌群落组成研究. 中国生态农业学报, 2012, 20(5): 592- 596.
[8]韩新华, 许艳丽, 潘凤娟, 李春杰. 黑土区轮作系统大豆田土壤线虫种群结构研究. 大豆科学, 2008, 27(1): 118- 123.
[9]Bernard E C. Soil nematode biodiversity. Biology and Fertility of Soils, 1992, 14(2): 99- 103.
[10]Yeates G W, Bongers T. Nematode diversity in agroecosystems. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 113- 135.
[11]Ferris H, Matute M M. Structural and functional succession in the nematode fauna of a soil food web. Applied Soil Ecology, 2003, 23(2): 93- 110.
[12]Schon N L, Mackay A D, Hedley M J, Minor M A. The soil invertebrate contribution to nitrogen mineralisation differs between soils under organic and conventional dairy management. Biology and Fertility of Soils, 2012, 48(1): 31- 42.
[13]Yeates G W, Bongers T, de Goede R G M, Freckman D W, Georgieva S S. Feeding habits in soil nematode families and Genera-an outline for soil ecologists. Journal of Nematology, 1993, 25(3): 315- 331.
[14]Liang W J, Lavian I, Steinberger Y. Effect of agricultural management on nematode communities in a Mediterranean agro-ecosystem. Journal of Nematology, 2001, 33(4): 208- 213.
[15]Yeates G W. Nematodes as soil indicators: functional and biodiversity aspects. Biology and Fertility of Soils, 2003, 37(4): 199- 210.
[16]Wardle D A, Yeates G W, Watson R N, Nicholson K S. The detritus food-web and the diversity of soil fauna as indicators of disturbance regimes in agro-ecosystems. Plant and Soil, 1995, 170(1): 35- 43.
[17]DuPont S T, Ferris H, Van Horn M. Effects of cover crop quality and quantity on nematode-based soil food webs and nutrient cycling. Applied Soil Ecology, 2009, 41(2): 157- 167.
[18]Bongers T, Ferris H. Nematode community structure as a bioindicator in environmental monitoring. Trends in Ecology & Evolution, 1999, 14(6): 224- 228.
[19]陈立杰, 梁文举, 段玉玺, 栾军波, 李琪. 施用生防颗粒剂对大豆田土壤线虫群落结构和生物多样性的影响. 大豆科学, 2003, 22(4): 251- 256.
[20]陈立杰, 段玉玺, 梁文举, 李永峰. 涕灭威对大豆田土壤线虫生物多样性的影响. 大豆科学, 2006, 22(2): 164- 169.
[21]陈立杰, 朱艳, 刘彬, 段玉玺. 连作和轮作对大豆胞囊线虫群体数量及土壤线虫群落结构的影响. 植物保护学报, 2007, 34(4): 347- 352.
[22]邹莉, 袁晓颖, 李玲, 王欣宇. 连作对大豆根部土壤微生物的影响研究. 微生物学杂志, 2005, 25(2): 27- 30.
[23]Zhang Y L. Analysis of phosphorus nutrition efficiency of soybean genotypes with different phosphorus efficiency at blooming stage under low phosphorus stress. Agricultural Science & Technology, 2012, 13(12): 2544- 2548.
[24]陈小云, 李辉信, 胡 锋, 刘满强. 食细菌线虫对土壤微生物量和微生物群落结构的影响. 生态学报, 2004, 24(12): 2825- 2831.
[25]Ferris H, Venette R C, Scow K M. Soil management to enhance bacterivore and fungivore nematode populations and their nitrogen mineralisation function. Applied Soil Ecology, 2004, 25(1): 19- 35.
[26]尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998: 51- 89, 437- 475.
[27]Wasilewska L. The effect of age of meadows on succession and diversity in soil nematode communities. Pedobiologia, 1994, 38(1): 1- 11.
[28]Bongers T, Bongers M. Functional diversity of nematodes. Applied Soil Ecology, 1998, 10(3): 239- 251.
[29]Yeates G W. Variation in soil nematode diversity under pasture with soil and year. Soil Biology and Biochemistry, 1984, 16(2): 95- 102.
[30]Ingham R E, Anderson R V, Gould W D, Coleman D C. Vertical distribution of nematodes in a short grass prairie. Pedobiologia, 1985, 28: 155- 160.
[31]Norton D C, Niblack T L. Biology and ecology of nematodes // Nickle W R, ed. Manual of Agricultural Nematology, 1991: 47- 71. New York: Marcel Dekker Inc.
[32]Wasilewska L. The structure and function of soil nematode communities in natural ecosystems and agrocoenoses. Polish Ecological Studies, 1979, 5: 97- 145
[33]Bååth E, Lohm U, Lundgren B, Rosswall T, Söderström B, Sohlenius B. Impacts of microbial-feeding animals on total soil activity and nitrogen dynamics: a soil microcosm experiment. Oikos, 1981, 37(3): 257- 264.
[34]Chantanao A, Jensen H J. Saprozoic nematodes as carriers and disseminators of plant pathogenic bacteria. Journal of Nematology, 1969, 1(3): 216- 218.
[35]李琪, 梁文举, 欧伟. 潮棕壤线虫群落对土地利用方式的响应. 生物多样性, 2007, 15(2): 172- 179.
Responses of soil nematode community composition and diversity to rhizosphere effects in a soybean field
WANG Xuefeng1, MAO Zhixia1, XU Jize2, CHANG Liang1, WU Donghui1,*
1NortheastInstituteofGeographyandAgroecology,KeyLaboratoryofWetlandEcologyandEnvironment,ChineseAcademyofScience,Changchun130102,China2JilinAgricultureScienceandTechnologyCollege,Jilin132101,China
The rhizosphere is an important interface for the exchange of materials and energy between the plant and the environment. As a result, research on investigating the rhizosphere effect has become an area of considerable interest in the field of soil ecology. However, research reports on responses of soil fauna to the rhizosphere effect of soybean are lacking. Soil nematode communities can provide important information about soil food web structure and function because they are the most abundant metazoan and ubiquitous in soil. In the present study, the soil nematode trophic composition, colonizer-persister (c-p) scale (1—5) group structure, functional structure index, as well as the diversity between the rhizosphere and non-rhizosphere areas of a soybean field were investigated. The aim of the present study was to understand the effect of rhizosphere effects on soil nematode community composition and diversity. Five plots of 10 m × 10 m were selected in soybean field, which had been converted from marshland in the Sanjiang Plain of China, and continuously cultivated with soybean for 15 years. The soybean rhizosphere was collected by the Root-Shaking method, using a 2.5 cm diameter core, and sampling the soil range 0—10 cm in depth. The non-rhizosphere soil samples were collected at a depth of 10 cm. A total of 4021 nematodes were identified and classified into 12 families and 16 genera, and further divided into 4 trophic groups and 9 functional guilds. The abundance ofAcrobeloides(Ba2),Aphelenchoides(Fu2), andHeterodera(H3) in the soybean rhizosphere were significantly higher than those in the non-rhizosphere soil (P< 0.01). The results showed that the total number of nematodes and Simpson′s diversity (Dom) in rhizosphere soil were significantly higher than those in the non-rhizosphere soil (P< 0.01). In addition, the number of nematode species (S), and species richness index (SR) in the rhizosphere were significantly lower. These results indicate that the rhizosphere effect of soybean increased the abundance of soil nematodes, but reduced the complexity of the nematode community structure. The abundance of fungivores (FF), bacterivores (BF), and plant-parasitic nematodes (PP) were significantly higher in the rhizosphere than in the non-rhizosphere soil (P< 0.01). The proportion of plant-parasitic nematode (PP) taxa in rhizosphere was significantly lower than that in non-rhizosphere soil (P< 0.01). Furthermore, the ratios of microbivorous nematodes (FF and BF) in soybean rhizosphere soil increased significantly (P< 0.01). The ratio of fungi-feeding to bacteria-feeding nematodes (F/B) indicated that the soybean rhizosphere bacterial biomass was relatively higher than the fungal biomass.
rhizosphere effects;soil nematodes;community composition; soybean field
国家自然科学基金(41201245);中国博士后科学基金(2013M531003, 2014T70302)
2015- 01- 25; 网络出版日期:2015- 11- 30
Corresponding author.E-mail: wudonghui@iga.ac.cn
10.5846/stxb201501250195
王雪峰,毛之夏,徐济责,常亮,吴东辉.根际效应对大豆田土壤线虫群落组成及多样性的影响.生态学报,2016,36(16):5256- 5262.
Wang X F, Mao Z X, Xu J Z, Chang L, Wu D H.Responses of soil nematode community composition and diversity to rhizosphere effects in a soybean field.Acta Ecologica Sinica,2016,36(16):5256- 5262.
