粉煤灰源C-S-H吸附U(Ⅵ)性能及机理
2016-10-25祁光霞雷雪飞孙方研孙应龙李磊袁超王邦达王毅
祁光霞,雷雪飞,孙方研,孙应龙,李磊,袁超,王邦达,王毅
粉煤灰源C-S-H吸附U(Ⅵ)性能及机理
祁光霞1,2,雷雪飞2,3,孙方研4,孙应龙2,李磊2,袁超2,王邦达2,王毅2
(1北京工商大学环境科学与工程系,北京 100048;2固体废物处理与环境安全教育部重点实验室(清华大学),北京 100084;3中国五洲工程设计集团有限公司,北京 100053;4北京交通大学理学院,北京 100044)
以粉煤灰铝回收过程的脱硅液为原料,通过控制钙硅摩尔比的常规沉淀法制备得到大比表面积介孔C-S-H(401 m2·g-1),系统研究了初始浓度、投加量、pH和离子强度对C-S-H吸附U(Ⅵ)过程的影响,以及吸附的热动力学特征,并评价了C-S-H去除实际含铀废水中毒性金属的性能。结果表明,通过控制合成条件实现了低品质硅钙渣向高附加值吸附材料的转变。0.75 g·L-1 C-S-H在pH 2仍具有较高的平衡吸附容量(e=67.9 mg·g-1),在富含CO32-的碱性溶液中UO2(H2O)52+转变为UO2(CO3)34-不利于带负电的C-S-H表面吸附U(Ⅵ)。当C-S-H投加量升高至2~5 g·L-1,材料对U(Ⅵ)的吸附去除效率即能维持在相对较高水平([U(Ⅵ)]initial= 500 mg·L-1,去除率88.3%~93.5%),吸附可在数小时内达到平衡,符合拟二级动力学模型和两阶段Weber-Morris方程模型,吸附等温线符合Langmuir模型,吸附机理主要为离子交换(84.6%)和表面络合。材料对含铀废水中的U、Zn、Hg、Mn和Cd均表现出良好的吸附去除性能,因而C-S-H可成为在废水毒性金属去除方面极具应用前景的材料。
粉煤灰;可持续性;吸附剂;多孔材料;吸附;废水
引 言
我国粉煤灰进行资源化提铝具有重要的环境和战略意义[1-2]。其中,粉煤灰预脱硅联合烧结工艺由于能够有效减少石灰石、生石灰和Na2CO3等碱性助溶剂的使用量及尾渣产生量,同时促进后续Al的回收并保证Al2O3产品品质,因而在工业上逐渐得到推广运用[3-4],但工艺中的NaOH回收环节产生了大量高含水率、低品质的硅酸钙副产品,目前仅少量作为填料用于造纸、橡胶等领域[5-8],其处理消纳成为该工艺路线的新瓶颈。
工艺中NaOH的回收是通过脱硅液与熟石灰浆液反应来实现,反应涉及以Si、Ca和O为主要元素的无机硅酸盐的反应。事实上,以Si、Ca和O为主要元素的无机硅酸盐可通过调节钙硅摩尔比(以下简称Ca/Si比)和合成温度合成不同的硅酸盐矿物[9-10],主要包括白钙沸石系列、脱钡莫来石系列、六水硅钙石和硬硅钙石。相比于其他硅酸盐矿物高温高压的水热合成条件,脱钡莫来石系列的水化硅酸钙(C-S-H)合成温度≤ 80℃,条件较为温和。此外,C-S-H是胶凝材料实现放射性核素和重金属(如U、Sr、Eu、Cu)固化稳定化的主要活性组分[11-12],其固定机理包括吸附、共沉淀、与Ca离子交换键合进入微观结构等[13-18]。受此启发,有研究者利用工业固体废物合成C-S-H用于废水中污染物的吸附去除。如Kuwahara等[19]通过两步式“溶解-沉淀”反应由高炉炉渣于70~100℃制备得到Ca/Si比为1.0的C-S-H,对Cu2+、磷酸根离子和经水稀释的模式蛋白(卵清蛋白)均具有良好的吸附性能,对Cu2+吸附容量达到99.9~118.2 mg·g-1;Zhu等[20]使用含氟硅渣与熟石灰合成的C-S-H对废水中的P吸附容量高达125.7 mg·g-1。本课题组前期研究也已证实由粉煤灰合成的C-S-H可对废水中的Co(Ⅱ)和典型重金属实现高效去除[21-22]。然而,对于粉煤灰源C-S-H吸附去除废水中U(Ⅵ)的性能及机理鲜有报道。
针对目前矿山含铀废水的处理难题[23-24],本文以内蒙古高铝粉煤灰“预脱硅-碱石灰烧结法”回收氧化铝过程中大量生成的脱硅液为原料,通过控制Ca/Si比制备C-S-H,并评估其用于水溶液中U(Ⅵ)吸附去除的性能,系统研究温度、pH、投加量对C-S-H吸附U(Ⅵ)过程的影响,揭示可能的吸附机理,以期为粉煤灰源C-S-H吸附剂的实际环境应用提供科学依据,最终同时解决粉煤灰低品质硅酸钙的处理消纳难题和含铀废水中放射性核素及重金属的低成本环境安全处置难题。
1 实验材料和方法
1.1 材料
U3O8由西北核技术研究所提供,吸附实验所用UO2(NO3)2溶液由U3O8于900℃焙烧2 h后,再经浓HNO3加热溶解至蒸干,最后用去离子水溶解定容至1000 mg·L-1(以U计)备用。无水NaCl为分析纯,购于北京现代东方精细化学品有限公司;无水Na2CO3为分析纯,购于国药集团化学试剂有限公司;HNO3、HCl,购于北京化工厂;含U标准液购于钢研纳克检测技术有限公司;实验用超纯水由 DW 100型实验室超纯水机(上海和泰仪器有限公司)制备,电阻率为18.2 MΩ·cm。
实验所用脱硅液由取自内蒙古呼和浩特市某燃煤电厂的高铝粉煤灰按照固液质量比1:10添加质量分数20%的NaOH溶液于120℃进行搅拌水热反应2 h再经过滤得到。本研究中所用粉煤灰和脱硅液主要化学组成列于表1。
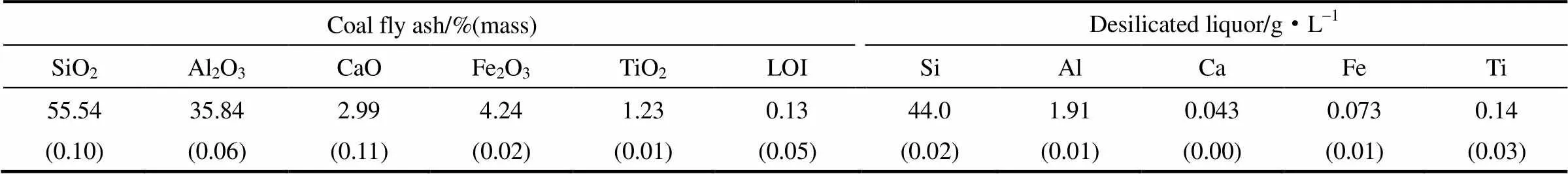
表1 粉煤灰及脱硅液的化学组成
1.2 分析测试仪器
扫描电子显微镜(SEM),S-5500型,日本Hitachi;X射线衍射仪(XRD), D8 Advance型, 德国Bruker;激光粒度仪,LS13320型,美国Beckman Coulter;比表面与孔隙度分析仪,ASAP 2020HD型,美国Micromeritics;电感耦合等离子体发射光谱仪,Thermo IRIS型,美国Thermo Fisher;电感耦合等离子体质谱仪,X Series 2型,美国Thermo Fisher;pH计,FE 20型,上海梅特勒-托利多仪器有限公司;恒温气浴摇床,TS 200B型,上海天呈仪器设备制造有限公司;高速冷冻离心机,HC-3108R型,安徽中科中佳科学仪器有限公司。
1.3 C-S-H制备
C-S-H的制备通过1.1节制备得到的高铝粉煤灰脱硅液添加Ca(OH)2以控制Ca/Si比和材料矿相组成的常规沉淀法制备得到。在磁力搅拌情况下,脱硅液按照Ca/Si比1.1~1.2与饱和Ca(OH)2溶液混合,并于60℃水热反应2 h。悬浊液经过滤得到C-S-H沉淀,沉淀经去离子水洗至无Na+检出(< 1 mg·L-1),最后置于恒温干燥箱于105℃干燥24 h备用。
1.4 C-S-H吸附U(Ⅵ)实验
采用静态序批式吸附的方法研究条件参数对C-S-H吸附U(Ⅵ)的影响,包括吸附剂投加量(/,0.75、2.0和5.0 g·L-1)、温度(,25、35、45和55℃)、初始pH(pHinitial, 2和11)和离子强度(NaCl),水平振荡时间为180~240 min。吸附实验所用到的其他浓度溶液由1000 mg·L-1的含U(Ⅵ)贮存液稀释得到,溶液pH通过1 mol·L-1HCl或0.1 mol·L-1NaOH调节。pH 11的含U(Ⅵ)溶液为避免U(Ⅵ)生成沉淀,向溶液中加入0.7 g·L-1Na2CO3生成[UO2(CO3)3]4-络合离子。在研究C-S-H释放的Ca(Ⅱ)与吸附的U(Ⅵ)之间的相关性时,设置空白为未添加U(Ⅵ)的特定pH去离子水单独养护C-S-H。
在吸附动力学研究中,0.500 g固体加入100 ml初始浓度[U(Ⅵ)]initial=50~500 mg·L-1、初始pH 2 或11的含U(Ⅵ)溶液中,于25~55℃水平振荡240 min。在特定的时间间隔取样、离心,上清液过0.45 μm滤膜,滤液中的U(Ⅵ)浓度通过ICP-AES或ICP-MS(Thermo IRIS,美国)测定。吸附U(Ⅵ)的量通过初始溶液和取样溶液中U(Ⅵ)浓度的差值进行计算,每次实验设置两组平行。选用吸附容量(q)和金属离子去除率()两个指标来评价材料对U(Ⅵ)的吸附性能,计算公式如下
式中,0和C分别为溶液中金属初始浓度和时刻对应浓度;为溶液体积,L;为吸附剂投加量,g。
在热力学研究部分,吸附剂投加量为0.75 g·L-1,初始U(Ⅵ)浓度为10~500 mg·L-1,温度为25~55℃,吸附时长为240 min,最大吸附容量由e-e吸附等温线进行确定。
1.5 C-S-H处理含铀废水
含铀废水取自云南省临沧县某锗矿厂,该厂在提取精制锗的同时产生含有一定量U及其他金属的废水。准确称量1、2.5和5 g C-S-H分别加入盛有500 ml含铀废水的1 L玻璃烧杯中,磁力搅拌1 h后,静置,取上清液通过ICP-AES或ICP-MS分析各金属含量。
2 实验结果与讨论
2.1 C-S-H形貌及矿相特征
通过材料XRD谱图可知,本研究通过常规的化学沉淀法在60℃成功合成了C-S-H,而且其矿相主要为低结晶度的C-S-H(Ⅰ)(脱钡莫来石的亚稳态),因为材料经300℃焙烧20 h后其d(003)显示的层间域出现了崩塌(图1)。除此以外,鉴于空气中CO2的溶解并与Ca(OH)2反应,C-S-H中还夹杂一定量的CaCO3。合成的C-S-H是白色的粉末状颗粒,其微观形貌呈现相互交错连接的片层状结构(图2),平均粒径和孔径分别为14.9 nm和6.3 nm,BET比表面积达到401 m2·g-1,孔隙发达,其主要的粒径和孔径分布均处在典型介孔材料粒径和孔径范围内(图3)。
2.2 初始浓度和投加量对C-S-H吸附U(Ⅵ)影响
初始U(Ⅵ)浓度对C-S-H吸附U(Ⅵ)具有促进效应,这主要源于吸附质浓度增加可增大浓度梯度强化传质。值得注意的是,这种促进效应在C-S-H投加量为0.75 g·L-1时显得比较有限,材料对U(Ⅵ)的吸附容量在U(Ⅵ)初始浓度增加至300 mg·L-1后即稳定在75 mg·g-1,对U(Ⅵ)去除率随着初始U(Ⅵ)浓度升高而快速下降。伴随C-S-H投加量升高至2~5 g·L-1,材料对U(Ⅵ)的吸附容量随着初始U(Ⅵ)浓度增加几乎线性增加(图4),对U(Ⅵ)去除率由90.9%~99.1%下降至88.3%~93.5%,对U(Ⅵ)的吸附去除效果维持在较稳定水平。上述投加量对吸附剂吸附不同浓度U(Ⅵ)的影响结果表明,C-S-H中可利用的活性位点数量是影响U(Ⅵ)去除效果的重要因素。
在低C-S-H投加量情况下(0.75 g·L-1),材料部分溶解带来的结构破坏将极大降低C-S-H吸附去除U(Ⅵ)的能力,而随着投加量增加,结构破坏部分所占比例将逐渐减少,因而其负面影响也将随之减少。然而,在5 g·L-1的高投加量情况下,可吸附U(Ⅵ)的活性位点未被充分占据,因而计算得到的吸附容量较 2 g·L-1投加量显著降低。因此,该材料吸附去除废水中U(Ⅵ)存在最优投加剂量。
2.3 pH对C-S-H吸附U(Ⅵ)影响
C-S-H在强酸性pH和强碱性pH条件下对U(Ⅵ)的吸附等温线如图5所示。由图中数据可知,pH 11的强碱性条件不利于C-S-H对U(Ⅵ)的吸附,其平衡吸附容量由pH 2时的67.9 mg·g-1下降至49.3 mg·g-1,降幅达到27.4%。究其原因在于,UO2(H2O)52+在富含Na2CO3的碱性溶液中(pH> 8.4)主要以UO2(CO3)34-形式存在[25],该络合物离子极大削弱了带负电的C-S-H表面吸附U(Ⅵ)的能力,这种材料表面与U(Ⅵ)静电相互作用的转变预示碱性实际废水中可能存在的大量CO32-通过与UO2(H2O)52+络合将极大降低材料对U(Ⅵ)的吸附容量。此外,C-S-H发生水解反应释放的Ca2+还将与部分UO2(CO3)34-反应生成电中性的Ca2UO2(CO3)30稳定胶体,该情形也不利于C-S-H对U(Ⅵ)的吸附去除。在上述情况下,一个可行的做法就是增加C-S-H投加量以满足相关标准,而总的处理成本仍然十分低。
2.4 离子强度对C-S-H吸附U(Ⅵ)影响
对于离子强度影响,随着NaCl浓度由4.2×10-3mol·L-1升高至4.2×10-2mol·L-1,C-S-H对U(Ⅵ)的平衡吸附容量降低4.8%~12.9%(图6)。由此说明,盐分对吸附过程有明显影响,其可能原因是小部分UO22+与溶液中的Cl-发生配位作用形成UO2Cl+、UO2Cl20等不利于吸附过程的进行[26-27],又或者Na+与UO22+竞争活性位点。
对于实际废水的处理,水体中存在的大量阴离子(如Cl-、NO-3、SO42-)将会与U(Ⅵ)发生不同程度的配位作用,而大量阳离子(Na+、K+等)将构成竞争吸附,由此C-S-H对U(Ⅵ)的吸附能力将大幅下降。针对上述情况,增加材料投加量可实现废水处理至达标排放,甚至可将C-S-H进行造粒并填充柱体实现废水的连续处理,直至C-S-H被穿透失效。由于C-S-H来源于粉煤灰,合成温度低,因而处理成本将相对低廉。
2.5 C-S-H吸附U(Ⅵ)的动力学和热力学
2.5.1 吸附动力学 C-S-H材料吸附U(Ⅵ)速率较快,当U(Ⅵ)初始浓度为200 mg·L-1时,吸附在4 h内即可达到平衡(图7)。其中,前5 min为瞬时快速吸附阶段,吸附U(Ⅵ)量占平衡吸附量30.2%;而10~180 min则表现为稳定的慢速吸附阶段。根据2.1节对合成C-S-H结构性质的表征结果,前5 min的瞬时快速吸附可能很大程度上归功于C-S-H材料表面存在的活性吸附位点,而后续的稳定慢速吸附预示吸附机理可能有所改变。
吸附动力学实验数据用拟一级动力学模型、拟二级动力学模型和颗粒内部扩散模型(Weber-Morris model)进行拟合,各模型计算公式依次分别为式(3)、式(4)和式(5)。
式中,e为材料对U(Ⅵ)平衡吸附容量,mg·g-1;q为时刻材料对U(Ⅵ)吸附容量,mg·g-1。
与拟一级动力学模型相比,拟二级动力学模型和两阶段Weber-Morris方程模型能够较好地拟合实验结果(2>0.98,表2),而且拟二级吸附动力学模型拟合得到的C-S-H材料对U(Ⅵ)平衡容量为65.8 mg·g-1,与实测值61.9 mg·g-1极为相近。由此,说明材料吸附U(Ⅵ)的速率同时受表面扩散和颗粒内部扩散过程控制[28-31]。其中,表面过程对应材料颗粒表面自发的瞬时占位(如表面络合),带负电的表面促成吸附的快速进行;而颗粒内部扩散过程对应U(Ⅵ)在孔隙内部的慢速吸附阶段。

表2 不同吸附动力学模型拟合结果
2.5.2 等温吸附模型 等温吸附实验数据进行Langmuir[式(6)]和Freundlich[式(7)]等温吸附模型拟合,各吸附模型表达式依次如下
式中,e为材料对U(Ⅵ)平衡吸附容量,mg·g-1;e为吸附平衡溶液中U(Ⅵ)浓度,mg·L-1;max为C-S-H表面对U(Ⅵ)的最大吸附容量,mg·g-1;和f分别为Langmuir和Freundlich等温吸附模型的吸附平衡常数。
与Freundlich等温吸附模型相比,Langmuir等温吸附模型能够更好地拟合实验结果(2> 0.997)(图8)。当C-S-H投加量为0.75 g·L-1时,材料对U(Ⅵ)的最大吸附容量由25℃的68.0 mg·g-1升高至55℃时的100.0 mg·g-1。因此,该吸附为吸热的单分子层化学吸附过程[32]。
2.6 C-S-H吸附U(Ⅵ)机理
将吸附U(Ⅵ)后的C-S-H烘干进行矿相分析,根据XRD谱图可以排除UO2(OH)2(s)共沉淀的存在(数据未展示)。而相对于未添加U(Ⅵ)进行养护的C-S-H空白,C-S-H吸附U(Ⅵ)的过程伴随释放相当数量的Ca(Ⅱ)。图9显示了溶液相对养护空白额外释放的Ca(Ⅱ)物质的量与吸附的U(Ⅵ)物质的量之间的相关性,发现对于初始U(Ⅵ)浓度为500 mg·L-1、初始pH 2的强酸性溶液,即使C-S-H投加量增加至20 g·L-1,溶液平衡pH升高至pH 9.86,体系额外释放的Ca(Ⅱ)与吸附的U(Ⅵ)也呈现很好的线性相关性(2> 0.99),说明C-S-H主要通过Ca(Ⅱ)与U(Ⅵ)进行离子交换实现吸附。
值得注意的是,释放的Ca(Ⅱ) 数量只占吸附的U(Ⅵ)数量的84.6%(U(Ⅵ)主要以UO22+形式存在),说明除了离子交换,C-S-H还通过其他作用吸附U(Ⅵ),如与C-S-H表面的硅醇羟基发生络合作用等[18]。
2.7 C-S-H处理含铀废水效果
合成的C-S-H对实际含铀废水中金属的处理结果见表3。C-S-H除对废水中的U具有良好的吸附去除效果外,还对废水中存在的其他超过地表水环境质量标准的金属Zn、Hg、Mn和Cd也实现了同步去除。当C-S-H投加量为10 g·L-1时,其对U、Mn、Zn和Ni的去除率> 99.9%,微量Co、Cu和Cd亦被吸附去除至含量低于ICP-MS的仪器检测限,仅对Hg的去除率稍低(98.7%)。废水经处理后,Mn、Zn、Cu和Cd含量满足地表水环境质量标准I类水标准(GB 3838—2002),而Hg含量仍然超过我国污水综合排放标准(GB 8978—1996)的0.05 mg·L-1限值。为使废水的Hg含量达标,可进一步增加C-S-H投加量,本研究发现C-S-H投加量增加至20 g·L-1,Hg含量即可达到污水综合排放标准(数据未显示)。

表3 含铀废水金属含量随不同C-S-H投加量的变化
由此表明,本研究通过控制合成条件实现了低品质硅钙渣向高附加值功能吸附材料的转变,材料对废水中的U(Ⅵ)及其他金属元素均具有吸附去除效果,而且鉴于C-S-H(I)与水泥、混凝土具有较好的化学相容性,因而C-S-H吸附剂可部分替代水泥添加剂进行固化稳定化处理,由此可进一步避免后续废吸附剂的处理难题。综上所述,由粉煤灰衍生而来的C-S-H在废水U和其他毒性金属的高效去除和稳定化处理方面具有很大的应用前景。
3 结 论
(1)以工业粉煤灰铝回收过程的脱硅液为原料,通过控制Ca/Si比制得C-S-H介孔材料,其中有效组分C-S-H(I)呈现出相互交错连接的片层状结构以及较大比表面积(401 m2·g-1)。
(2)投加量决定C-S-H中可用活性位点数量;pH 11的强碱性条件因UO2(H2O)52+在富含CO32-溶液中形成UO2(CO3)34-而不利于C-S-H对U(Ⅵ)的吸附;水体中大量Cl-、NO-3、SO42-会与U(Ⅵ)发生一定配位作用而降低C-S-H对U(Ⅵ)的吸附。
(3)C-S-H吸附U(Ⅵ)的速率为初期快速吸附和后续稳定慢速吸附两段,符合拟二级动力学及两段Weber-Morris模型;吸附U(Ⅵ)符合Langmuir等温吸附模型,为吸热单分子层化学吸附。
(4)溶液体系额外释放的Ca(Ⅱ)与吸附的U(Ⅵ)线性相关(2> 0.99),C-S-H主要通过Ca(Ⅱ)与U(Ⅵ)离子交换实现吸附(84.6%)。
(5)C-S-H对废水中U和其他超标金属具有良好的吸附去除效果:C-S-H投加量为10 g·L-1时,其对U、Mn、Zn和Ni的去除率> 99.9%,微量Co、Cu和Cd亦被吸附去除至含量低于ICP-MS检测限,对Hg的去除率稍低(98.7%)。
References
[1] 刘康, 薛济来, 刘亮, 等. 粉煤灰浓硫酸焙烧过程及其非等温动力学[J]. 化工学报, 2015, 66(4): 1337-1343. LIU K, XUE J L, LIU L,Roasting process and non-isothermal kinetics for sulfating roasting of coal fly ash[J]. CIESC Journal, 2015, 66(4): 1337-1343.
[2] 李来时, 翟玉春, 秦晋国, 等. 以粉煤灰为原料制备高纯氧化铝[J]. 化工学报, 2006, 57(9): 2189-2193. LI L S, ZHAI Y C, QIN J G,Extracting high purity alumina from fly ash[J]. Journal of Chemical Industry and Engineering (China), 2006, 57(9): 2189-2193.
[3] YAO T, XIA M S, SARKER P K,A review of the alumina recovery from coal fly ash, with a focus in China[J]. Fuel, 2014, 120: 74-85.
[4] BAI G, TENG W, WANG X,Alkali desilicated coal fly ash as substitute of bauxite in lime-soda sintering process for aluminum production[J]. Transactions of Nonferrous Metals Society of China, 2010, 20: s169-s175.
[5] 孙俊民, 王成海, 张战军, 等. 多孔硅酸钙作为造纸功能性填料的助留作用研究[J]. 中国造纸, 2014, 33(9): 1-5. SUN J M, WANG C H, ZHANG Z J,Application of porous calcium silicate as retention aid and mechanism analysis[J]. China Pulp & Paper, 2014, 33(9): 1-5.
[6] 魏晓芬, 孙俊民, 王成海, 等. 新型硅酸钙填料的理化特性及对加填纸张性能的影响[J]. 造纸化学品, 2012, 24(6): 24-30. WEI X F, SUN J M, WANG C H,Study on physicochemical properties of new calcium silicate filler and its effect on paper properties[J]. Paper Chemicals, 2012, 24(6): 24-30.
[7] 吴盼, 张美云, 王建, 等. 粉煤灰基新型硅酸钙与碳酸钙和滑石粉在纸张加填中的应用效果对比[J]. 造纸科学与技术, 2013, 32(3): 90-94. WU P, ZHANG M Y, WANG J,Comparison of the filling effect of a novel fly ash based calcium silicate with calcium carbonate and talc powder[J]. Paper Science & Technology, 2013, 32(3): 90-94.
[8] 刘钦甫, 张士龙, 孙俊民, 等. 活性硅酸钙填充丁苯橡胶复合材料性能研究[J]. 湖南科技大学学报(自然科学版), 2013, 28(2): 95-101. LIU Q F, ZHANG S L, SUN J M,Study on properties of styrene-butadiene rubber filled by active calcium silicate[J]. Journal of Hunan University of Science & Technology (Natural Science Edition), 2013, 28(2): 95-101.
[9] 张吉清. 含碱硅酸钠溶液合成硅酸钙基矿物材料的研究 [D]. 长沙: 中南大学, 2012. ZHANG J Q. Study on the synthesis of calcium silicate-based mineral materials from alkaline sodium silicate solution[D]. Changsha: Central South University, 2012.
[10] 张文生, 王宏霞, 叶家元. 水化硅酸钙的结构及其变化[J]. 硅酸盐学报, 2005, 33(1): 63-68. ZHANG W S, WANG H X, YE J Y. Structure and its variation of calcium silicate hydrates[J]. Journal of the Chinese Ceramic Society, 2005, 33(1): 63-68.
[11] BATCHELOR B. Overview of waste stabilization with cement[J]. Waste Management, 2006, 26: 689-698.
[12] MANDALIEV P, DAHN R, TITS J,EXAFS study of Nd(Ⅲ) uptake by amorphous calcium silicate hydrates (C—S—H)[J]. Journal of Colloid and Interface Science, 2010, 342: 1-7.
[13] CAIRNS M J, BORRMANN T, HOLL W H,A study of the uptake of copper ions by nanostructured calcium silicate[J]. Microporous and Mesoporous Materials, 2006, 95: 126-134.
[14] HARFOUCHE M, WIELAND E, DAHN R,EXAFS study of U(Ⅵ) uptake by calcium silicate hydrates[J]. Journal of Colloid and Interface Science, 2006, 303: 195-204.
[15] TITS J, WIELAND E, MULLER C J,Strontium binding by calcium silicate hydrates[J]. Journal of Colloid & Interface Science, 2006, 300: 78-87.
[16] TITS J, STUMPF T, RABUNG T,Uptake of Cm(Ⅲ) and Eu(Ⅲ) by calcium silicate hydrates: a solution chemistry and time-resolved laser fluorescence spectroscopy study[J]. Environmental Science & Technology, 2003, 37: 3568-3573.
[17] SCHLEGEL M L, POINTEAU I, COREAU N,Mechanism of europium retention by calcium silicate hydrates: an EXAFS study[J]. Environmental Science & Technology, 2004, 38: 4423-4431.
[18] TITS J, GERHARD G, MACE N,Determination of uranium(VI) sorbed species in calcium silicate hydrate phases: a laser-induced luminescence spectroscopy and batch sorption study[J]. Journal of Colloid and Interface Science, 2011, 359: 248-256.
[19] KUWAHARA Y, TAMAGAWA S, FUJITANI T,A novel conversion process for waste slag: synthesis of calcium silicate hydrate from blast furnace slag and its application as a versatile adsorbent for water purification[J]. Journal of Materials Chemistry A, 2013, 1(24): 7199-7210.
[20] ZHU X H, ZHANG Z, SHEN J. Preparation of calcium silicate using hazardous solid wastes and its application in treatment of phosphate-containing wastewater[J]. Advanced Materials Research, 2014, 937: 652-658.
[21] QI G X, LEI X F, LI L,Preparation and evaluation of a mesoporous calcium-silicate material (MCSM) from coal fly ash for removal of Co(II) from wastewater[J]. Chemical Engineering Journal, 2015, 279: 777-787.
[22] QI G X, LEI X F, LI L,Coal fly ash-derived mesoporous calcium-silicate material (MCSM) for the efficient removal of Cd(Ⅱ), Cr(Ⅲ), Ni(Ⅱ), and Pb(Ⅱ) from acidic solutions[J]. Procedia Environmental Sciences, 2016, 31: 567-576.
[23] 彭燕, 陈迪云, 张志强. 零价铁-四钛酸钾晶须处理铀矿山废水[J]. 环境工程, 2014, (3): 1-6. PENG Y, CHEN D Y, ZHANG Z Q. Combined treatment of uranium mine wastewater by zero-valent iron and potassium tetratitanate whisper[J]. Environmental Engineering, 2014, (3): 1-6.
[24] NOUBACTEP C, SCHONER A, MEINRATH G. Mechanism of uranium removal from the aqueous solution by elemental iron[J]. Journal of Hazardous Materials, 2006, 132(2 /3): 202-212.
[25] WANG D, BALL W P, LIU C,Influence of calcite and dissolved calcium on uranium(VI) sorption to a Hanford subsurface sediment[J]. Environmental Science & Technology, 2005, 39: 7949-7955.
[26] ZHANG H, XIE Y, TAO Z. Sorption of uranyl ions on gibbsite:effects of contact time, pH, ionic strength, concentration and anion of electrolyte[J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2005, 252: 1-5.
[27] CRISCENTI L J, SVERJENSKY D A. The role of electrolyte anions ClO-4, NO-3, and Cl-in divalent metal (M2+) adsorption on oxide and hydroxide surfaces in salt solutions[J]. American Journal of Science, 1999, 299: 828.
[28] WANG L, LIN C. Adsorption of chromium(Ⅲ) ion from aqueous solution using rice hull ash[J]. Journal of the Chinese Institute of Chemical Engineers, 2008, 39: 367-373.
[29] GUPTA S S, BHATTACHARYYA K G. Kinetics of adsorption of metal ions on inorganic materials: a review[J]. Advances in Colloid and Interface Science, 2011, 162: 39-58.
[30] ALSHAMERI A, IBRAHIM A, ASSABRI A M,The investigation into the ammonium removal performance of Yemeni natural zeolite: modification, ion exchange mechanism, and thermodynamics[J]. Powder Technology, 2014, 258: 20-31.
[31] JI Z, YUAN J, LI X. Removal of ammonium from wastewater using calcium form clinoptilolite[J]. Journal of Hazardous Materials, 2007, 141: 483-488.
[32] TENG H, HSIEH C. Influence of surface characteristics on liquid-phase adsorption of phenol by activated carbons prepared from bituminous coal[J]. Industrial and Engineering Chemistry Research, 1998, 37: 3618-3624.
Performance and mechanisms of coal fly ash-derived C-S-H on adsorption of U(Ⅵ)
QI Guangxia1,2, LEI Xuefei2,3, SUN Fangyan4, SUN Yinglong2, LI Lei2, YUAN Chao2,WANG Bangda2, WANG Yi2
(1Department of Environmental Science and Engineering, Beijing Technology and Business University, Beijing 100048, China;2Key Laboratory for Solid Waste Management and Environment Safety (Tsinghua University), Ministry of Education of China, Beijing 100084, China;3China Wuzhou Engineering Group, Beijing 100053, China;4School of Science, Beijing Jiaotong University, Beijing 100044, China)
Taking the desilication liquor produced during the alumina recovery of coal fly ash as raw material, mesoporous C-S-H with large specific surface area (401 m2·g-1) was prepared by using the normal precipitation method, of which the molar ratio of calcium to silicon had been controlled. The effects of initial concentration, sorbent dosage, solution pH and ionic strength on the sorption of U(Ⅵ) by C-S-H were systematically investigated, and the sorption kinetics and thermodynamics were also studied. Moreover, the performance of C-S-H on the removal of toxic metals in actual uranium-containing wastewater was evaluated. The results indicated that the transformation of calcium silicate solid in low quality to high-value-added sorbent material had been realized by controlling the synthesis condition. C-S-H of0.75 g·L-1still had a high sorption capacity in equilibrium at pH 2 (e=67.9 mg·g-1), while UO2(H2O)52+transformed to UO2(CO3)34-in alkaline solution with high amount of CO32-, and it was not good for the sorption of U(Ⅵ) on the negative surface of C-S-H. When C-S-H dosage increased to 2—5 g·L-1, the removal efficiency of U(Ⅵ) by C-S-H could be maintained at a comparatively higher level ([U(Ⅵ)]initial= 500 mg·L-1, 88.3%—93.5%). The equilibrium of the adsorption could be reached within several hours, and the process followed the pseudo-second-order kinetic model and two-stage Weber-Morris equation model. The adsorption followed Langmuir isotherm model. Ion exchange (84.6%) and surface complexation were the main mechanisms accounting for the sorption. The material exhibited a great capacity to remove U, Zn, Hg, Mn and Cd in uranium-containing wastewater. Therefore, C-S-H had great potential to become a promising material to remove the toxic metals from wastewater.
coal fly ash; sustainability; adsorbents; porous materials; adsorption; wastewater
2016-03-25.
Prof. WANG Yi, yi_wang@tsinghua.edu.cn
10.11949/j.issn.0438-1157.20160343
X 705
A
0438—1157(2016)10—4255—09
国家自然科学基金项目(21407089);中联环SWMES 教育部重点实验室开放基金项目(SWMES 201605)。
2016-03-25收到初稿,2016-06-21收到修改稿。
联系人:王毅。第一作者:祁光霞(1985—),女,博士,讲师。
supported by the National Natural Science Foundation of China (21407089), the Key Laboratory for Solid Waste Management and Environment Safety (Tsinghua University), Ministry of Education of China (SWMES201605).
