金属-金属键化合物的分类及其前景展望
2016-10-25杜利利王中英董青松
杜利利,王中英,陈 照,董青松
(河南大学 化学化工学院,河南 开封 475004)
金属-金属键化合物的分类及其前景展望
杜利利,王中英,陈照,董青松*
(河南大学 化学化工学院,河南 开封 475004)
金属-金属键不仅涉及到新型化学键的本质、成键方式等基本理论,而且在催化及材料等方面表现出潜在的应用前景. 本文主要从键级方面对金属-金属键化合物进行分类,并对不同键级的金属-金属键化合物通过举例进行详细说明. 最后,对金属-金属键化合物的应用前景进行了展望.
金属-金属键;键级;晶体结构;应用前景
1893年,瑞士化学家WERNER提出了配位化合物的概念,创立了化学史上具有重要里程碑意义的配位学说. 配位学说中提出配位化合物的本质特点是:金属离子或原子只与其周围的一系列配体发生相互作用,而金属与金属之间无直接键合. 后来也有不同于Werner型配合物的新型金属配合物存在,比如:我们现在所熟知的含Pt-Pt键的 [Pt2(SO4)4]2-离子,但当时人们对于这些配合物的成键性质和结构并不清楚,只将这类化合物的组成描述为多核化合物[1]. 随着X-射线晶体学的发展并将其应用到化合物结构的测定中,人们开始从一定程度上认识到非Werner型配合物的存在. 直到COTTON小组[2]与ROBINSON小组[3]分别在研究 Cs3Re3Cl12化合物时,同时发现阴离子 [Re3Cl12]3-结构中存在三角形的Re3单元,其 Re-Re键长为2.47 nm,明显小于两个金属铼原子的半径 (2.75 nm). COTTON通过光电子能谱和分子轨道理论计算证实了Re-Re之间具有双键,并准确地描述了其分子结构. 这项工作使人们首次清楚地认识到金属-金属键的存在,在金属-金属键化合物的发展中起着举足轻重的作用.
金属-金属键的概念首先是由COTTON在1964年提出[4],它是指金属原子之间所存在的一种直接的相互作用,如靠Re-Re金属键将铼原子连在一起形成的双核铼金属-金属键配合物 (图1a). 不含金属-金属键的双核及多核金属化合物属于经典的Werner型配合物,如利用桥联配体Cl将两个原子连在一起形成的无Re-Re 键的双核铼配合物 (图1b). 近年来,有关金属-金属键化合物的研究取得了重要进展,如首例Ga-Ga三重键 (1997)[5],Cr-Cr五重键 (2005)[6],Mg-Mg键 (2007)[7]等的发现,种类和结构极为丰富. 金属-金属键化合物有多种分类方法,常见的有:按照是否有成桥配体进行划分,可以分为不借助于成桥配体金属直接成键的分子 (离子) 和含有成桥配体及直接成键金属原子的分子 (离子),如卤素桥联的M2Cl93-离子;按照构成金属-金属键的元素可分为主族金属-金属键化合物和副族金属-金属键化合物;按照形成金属-金属键的元素是否相同,可分为同核金属-金属键化合物和异核金属-金属键化合物.
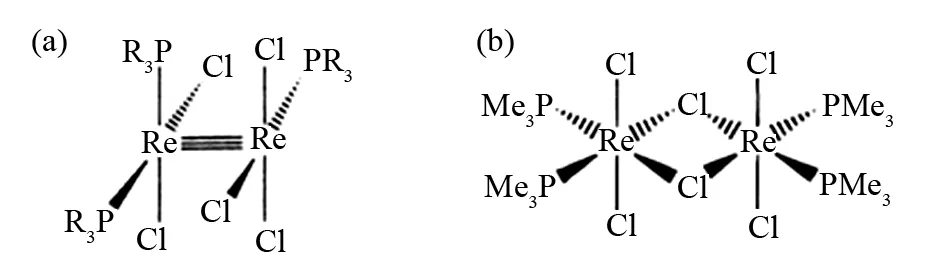
图1 金属-金属键配合物(a)和Werner型配合物(b)Fig.1 Metal-metal bonding complex (a) andWerner complex (b)
键级又称键序,不仅能直接反应金属与金属间是否成键,还能表明金属与金属间所成化学键的重数. 这里主要按照键级对金属-金属键化合物进行分类,可分为金属-金属单键化合物和金属-金属多重键化合物,金属-金属多重键最高可达到五重键,并对金属-金属键化合物的应用前景进行了展望.
1 金属-金属单键化合物
虽然金属-金属单键是最简单的金属-金属键,但含有该种类型键的金属-金属键化合物却有着极为丰富的构型,比如:垂直构型 (即金属-金属键所在的轴与其配体的对称轴垂直或接近垂直),平行构型 (即金属-金属键所在的轴与其配体的对称轴平行或接近平行) 及三角构型等,这极大地丰富了金属-金属键化合物的构型. 2013年,我们课题组通过控制还原剂的量合成出两种构型的Ni-Ni键化合物:[Na(DME)3][{Ni(μ-L·-)}2] (垂直构型,图2a) 和 [Na(Et2O)]2Na[L2-Ni-NiL2-] (平行构型,图2b) (L = [(2,6-iPr2C6H3)NC(Me)]2,L0代表中性的取代基为异丙基的α-二亚胺配体,L·-代表-1价的阴离子自由基形式,L2-代表-2价的阴离子形式)[8]. 在垂直构型化合物中,每个Ni 原子与来自两个不同的亚胺配体的N原子和另一个Ni原子形成一个三配位的T字构型,这种配位方式导致了Ni-Ni键所在的直线与亚胺配体的对称轴相互垂直 (或接近垂直);在平行构型化合物中,每个亚胺配体以端基螯合形式与Ni原子配位,每个Ni原子与同一配体中的两个N原子和另一个Ni原子配位形成一个三角平面构型,使Ni-Ni键所在的直线与亚胺配体的对称轴相互平行(或接近平行). 单晶衍射研究发现垂直构型中的Ni-Ni键长为2.295 7(6) nm,远远短于平行构型中Ni-Ni键长 (2.464 9(8) nm). DFT 计算显示在垂直构型化合物中Ni-Ni键由29.7%s,1.2%p和69.1%d轨道组成,Ni-Ni键级为0.54;在平行构型化合物中Ni-Ni键NBOs由α自旋轨道和β自旋轨道组成,Ni-Ni键级为0.88,两种构型化合物中的Ni-Ni键均为单键.

图2 [Na(DME)3][{Ni(μ-L·-)}2]结构图(a)和[Na(Et2O)]2Na[L2-Ni-NiL2-]结构图(b) [8]Fig.2 Structures of [Na(DME)3][{Ni(μ-L·-)}2] (a) and[Na(Et2O)]2Na[L2-Ni-NiL2-] (b) [8]
20世纪90年代中期,ROBINSON小组报道了一例Ga-Ga-Ga三元环化合物Na2[(2,4,6-Me3C6H2)2C6H3-Ga]3[9],它由金属钠还原化合物 (2,6-Mes2-C6H3)GaCl2得到的. 其晶体结构 (图3)表明,Ga-Ga-Ga之间的夹角为60°,Ga-Ga键长为2.441 nm,2个Na原子分别在三元环平面Ga3中心的上下方. 在该化合物中,每个Ga原子为sp2杂化,留下一个空的p轨道,每个碱金属原子提供一个电子给三个Ga原子的p轨道,这样就提供了满足Hückel的4N+2规则所必需的2个π电子,也就是说这个Ga-Ga-Ga三元环化合物具有金属芳香性 (图4a). 通过对模型化合物Na2[HGa]3[10]的理论计算研究也证明了该化合物的金属芳香性 (图4b).

图3 Na2[(2,4,6-Me3C6H2)2C6H3-Ga]3结构图[9]Fig.3 Structure of Na2[(2,4,6-Me3C6H2)2C6H3-Ga]3[9]

图4 Na2[(2,4,6-Me3C6H2)2C6H3Ga]3的电子结构(a)和Na2[HGa]3的π-电子云(b)[10]Fig.4 Electronic structure of Na2[(2,4,6-Me3C6H2)2C6H3Ga]3(a) and π-electronic cloud of Na2[HGa]3 (b)[10]
2 金属-金属多重键化合物
主族元素中的Ga、Ge、As和副族元素中Cr、Mo、W等容易形成金属-金属多重键化合物,到目前为止,人们已经发现的金属-金属多重键包括双键、三键、四重键及五重键.
2.1金属-金属双键化合物
人们对金属-金属双键开始广泛而深入的研究始于含有Re=Re化合物的报道[2,3],近年来人们合成了一系列含有机配体的金属-金属双键化合物. 例如含W=W双键的 [W(NAr)(CH2-t-Bu)OCH(C6F3)]2(Ar = 2,6-iPr2C6H3),在该化合物中金属-金属间无桥连原[11],其晶体结构见图5. 该化合物所含的W=W双键近似于烯烃中的不饱和键,但也有其自身特殊之处,该结构呈反式弯曲构型且在平面上发生扭转,使与金属相连的原子不在同一平面上. 金属-金属双键的另一常见构型为垂直构型,例如JONES等报道的化合物 [As2{μ-(ArN)2CR}2] (Ar = 2,6-iPr2C6H3; R = N(C6H11)2) (合成路线图6),As-As键所在的直线与胍基配体的对称轴相互垂直(或接近垂直). 在该化合物中As-As键长 (2.256 0(5) nm)与未配位的As=As键长 (2.21-2.36 nm)相当[12]. 对此类型的化合物,不能仅从金属-金属键的键长来判断其是几重键,因为这种配位方式往往会将两个金属原子间的距离拉的更近. 借助于DFT量化手段计算所得该化合物中As-As键键级 (WBI) 为1.62,这表明该化合物中As-As键为双键.

图5 [W(NAr)(CH2-t-Bu)OCH(C6F3)]2结构图[11]Fig.5 Structure of [W(NAr)(CH2-t-Bu)OCH(C6F3)]2 [11]
2.2金属-金属三重键
自从双核铼化合物Re2Cl5(CH3SCH2CH2SCH3)2被报道后,近年来人们对第六副族金属的M≡M (M=Cr,Mo,W) 三键化合物进行了系统的研究. 这类化合物中M≡M三键的电子构型为σ2π4δ2δ*2,通常可用2种方法合成. 一是通过相应的环戊二烯与M(CO)6在高沸点溶剂中回流;二是热解或光解相应的M-M单键化合物. 例如,通式为[η5-MenC5H5-nM(CO)2]2(n=3,4;M=Cr, Mo, W)的三键化合物系由第一种方法制得,而通式为[η5-RC5H4M(CO)2]2(R=MeCO, MeO2C, EtO2C;M=Cr, Mo, W) 的三键化合物可由第二种方法制得.

图6 [As2{μ-(ArN)2CR}2] (Ar = 2,6-iPr2C6H3; R = N(C6H11)2)的合成方法[12]Fig.6 Synthesis of [As2{μ-(ArN)2CR}2] (Ar = 2,6-iPr2C6H3; R = N(C6H11)2)[12]
关于主族金属-金属三键化合物也有报道. ROBINSION等人通过用Na还原RGaCl2合成了含有低价态以及低配位数Ga化合物Na2[RGa≡GaR] (R = C6H3-2,6-(C6H2-2,4,6-iPr3)2) (图7)[5],这是首例含有Ga≡Ga三重键的化合物,其晶体结构显示Ga-Ga键长为2.319(3) nm,小于Ga的共价键半径 (1.21 nm) 之和,是所有报道的Ga-Ga键化合物中最短的. 结构中Ga-Ga-C是非线性的,呈反式弯曲结构,角度分别为128.5(4)°与133.5(4)°,该物质的结构与乙炔类似,称为类似乙炔的金属有机化合物. 该实验室对模型化合物Na2[RGaGaR] (R = H) 进行DFT理论研究[13],计算所得的Ga-Ga键级为3.02,进一步证明了Ga-Ga三重键的存在.
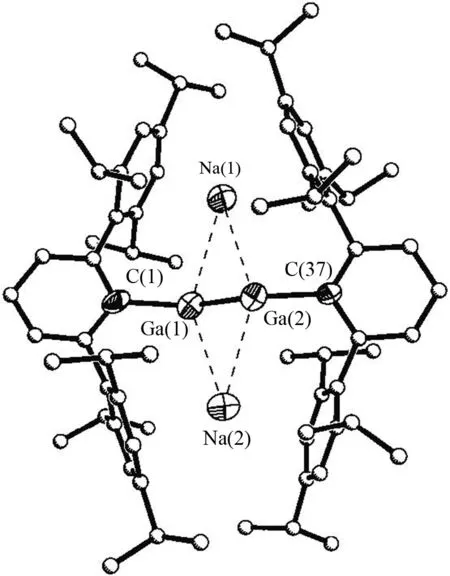
图7 Na2[RGa≡GaR] (R = C6H3-2,6-(C6H2-2,4,6-iPr3)2)晶体结构图[5]Fig.7 Structure of Na2[RGa≡GaR] (R = C6H3-2,6-(C6H2-2,4,6-iPr3)2)[5]
2.3金属-金属四重键
目前认为金属-金属四重键是由d轨道或d轨道和f,g等轨道参与形成的,现用近似的方法只考虑d轨道的重叠,定性地对金属-金属四重键的键合作用进行描述,图8所示. 2个金属原子的dz2轨道形成一个σ成键轨道和一个σ*反键轨道;2个dyz或dxz轨道的重叠形成一组正交和二重简并的π成键和π*反键轨道;2个dxy或dx2-y2轨道的重叠形成一组二重简并的δ成键和δ*反键轨道.
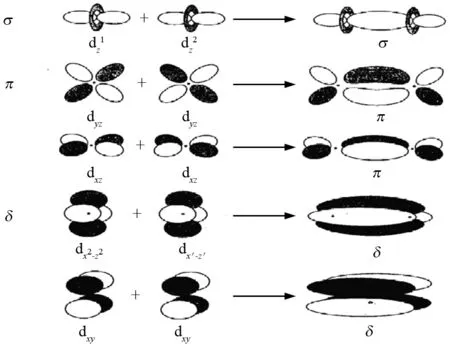
图8 金属-金属四重键中2个金属原子间的5种d轨道重叠Fig.8 Five types of d orbital overlap between two metalatoms in metal-metal four bonds
2006 年,TSAI 等人合成了第一例对称桥联的M2X4类型的含Mo-Mo四重键化合物Mo2[μ-η2-Me2Si(NDipp)2]2[14]. 电子吸收光谱和拉曼光谱都显示该化合物中存在Mo-Mo四重键,单晶结构 (图9) 显示Mo-Mo四重键键长为2.1784(12) nm. 该化合物的电子构型与经典的轮浆式结构的M-M 四重键化合物不同:该化合物中两个Mo 原子的dx2-y2轨道重叠形成Mo-Mo四重键中的δ键,并且每个dx2-y2轨道的一半又用来形成2个Mo-到-N的σ-键,两个dxy轨道重叠形成4个Mo-到-N的π-键,而在经典的轮浆式结构的M-M四重键化合物中,两个dxy轨道重叠形成金属-到-配体的σ-键. 随后,该小组又报道了两例Mo-Mo 四重键化合物:Mo2(μ-Cl)[Cl2Li(OEt2)][μ-η2-(Ph)C(N-2,6-iPr2C6H3)2]2[15]和[Mo2{μ-HC(N-2,6-Et2C6H3)}2(μ-Cl) {(μ-Cl)2Mo(μ-Cl)2Li(thf)(OEt2)}][16]分别作为合成Mo-Mo 五重键化合物的前驱体.
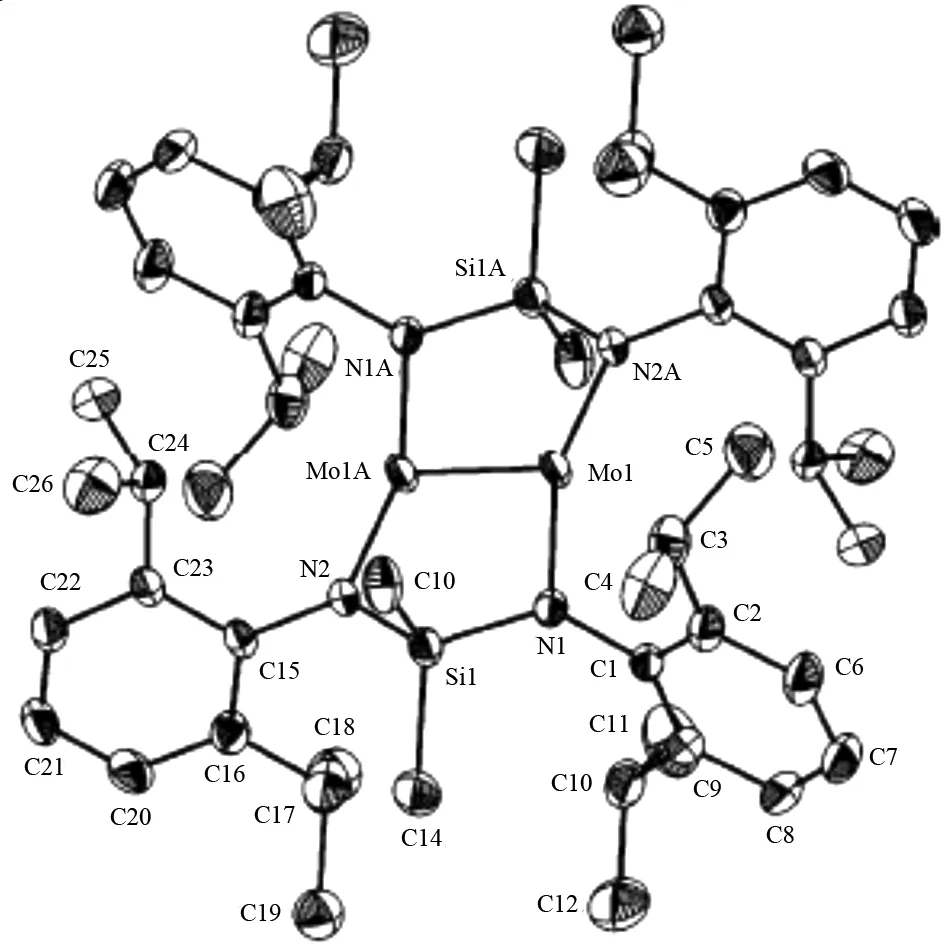
图9 Mo2[μ-η2-Me2Si(NDipp)2]2晶体结构图[14]Fig.9 Structure of Mo2[μ-η2-Me2Si(NDipp)2]2[14]
2.4金属-金属五重键
20世纪70年代中期,理论研究表明在双核Cr2和Mo2中可以存在金属-金属六重键 (2σ, 2π, 2δ)[17-19],但这类分子在室温下不能稳定存在. POWER 等人认为如果要分离出可能的含最高金属-金属键级的化合物,就要求配体的数目必须最少,以使得中心金属上的可填充在成键轨道上的价电子数最多. 此外,配体的空间位阻必须足够大,以抑制发生分子内反应而生成具有较低的金属-金属键级的簇合物或聚合物. 2005年,POWER小组利用配体Ar (C6H3-2,6(C6H3-2,6-iPr2)2)合成了首例含Cr-Cr五重键的化合物ArCrCrAr[6]. 该化合物的晶体结构(图10)显示,Cr-Cr键长为1.835 1 nm,结构中每个Cr原子不仅与相连配体上的碳原子有相互作用,还与相邻配体中苯环上的碳以π-键形式相互作用. 随后,该研究小组又通过实验[20]及量化[21]比较了相同配体、不同金属的化合物ArCoCoAr及ArFeFeAr的配位方式、成键模式等,发现导致Cr-Cr五重键的主要原因不是配体,而是Cr中心原子的d5-d5电子排布所引起的. 该化合物 (ArCrCrAr) 一经报道立刻引起了人们的广泛关注.
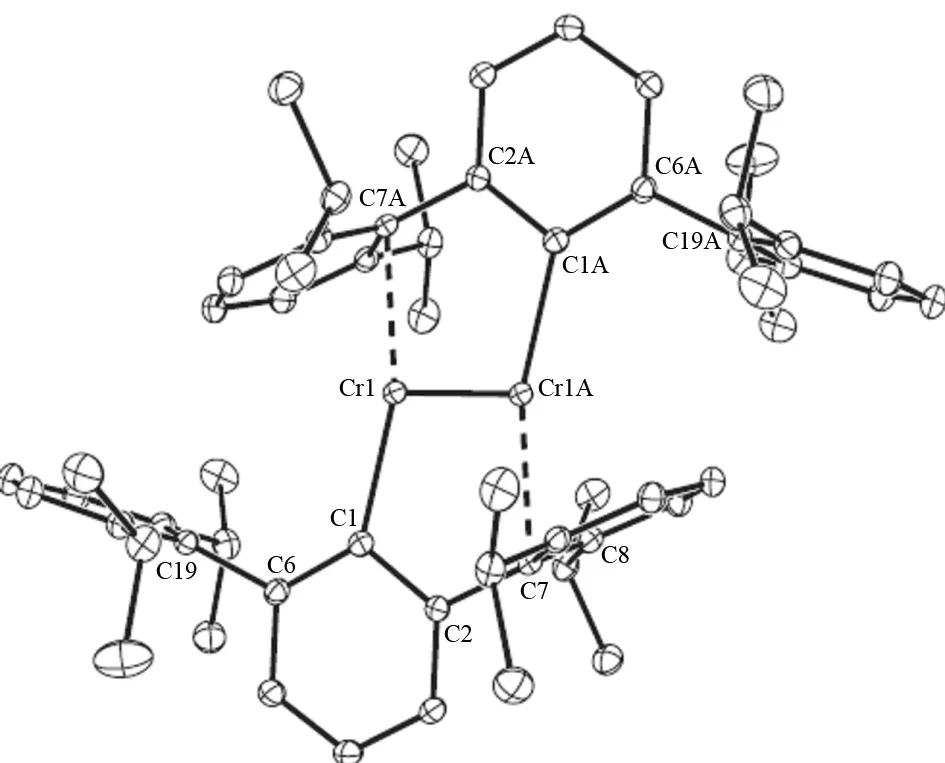
图10 ArCrCrAr (Ar = C6H3-2,6(C6H3-2,6-iPr2)2)晶体结构图[6]Fig.10 Structure of ArCrCrAr (Ar = C6H3-2,6(C6H3-2,6-iPr2)2) [6]
2009年,TSAI小组又报道了用KC8还原含有Mo-Mo四重键的化合物 Mo2(μ-Cl)[Cl2Li(OEt2)][μ-η2-RC(N-2,6-iPr2C6H3)2]2(R = H; R = Ph) 得到首例含有Mo-Mo五重键的化合物 Mo2[μ-η2-RC(N-2,6-iPr2C6H3)2]2(R = H; R = Ph)[15]. 晶体结构显示在这两个化合物中 Mo-Mo五重键的键长非常短,分别为2.018 7(9)和2.015 7(4) nm,这也说明Mo-Mo五重键键长与辅助配体的位阻关系不大. 2012年,该小组又通过一种不同于上述的新方法合成出一例Mo-Mo 五重键的化合物[Mo2(-Li){-HC(N-2,6-Et2C6H3)2}3],该化合物的晶体结构显示它为一个桨轮式构型,两个金属Mo原子由三个脒配体和一个金属Li原子桥连. 其Mo-Mo五重键键长为2.061 2(4) nm,与上述首例Mo-Mo五重键键长基本一样长. 对该化合物的阴离子部分量化计算发现其Mo-Mo五重键的键长与中性化合物的实验值基本一致,这表明金属 Li+离子的存在并不影响Mo-Mo五重键的键长.
3 总结与展望
金属-金属键是一种新型的化学键,涉及到化学键的本质、成键模式等基本理论问题,是现代化学的一个重要研究领域和前沿课题. 金属-金属键历经了从Re-Re双键化合物,Re-Re三重键化合物,直到Cr-Cr五重键化合物的发展历程,到目前已有数千例含金属-金属键的化合物被报道,并且金属-金属键化合物的化学反应性已经成为新的研究热点. 近几年的研究表明,含金属-金属键的化合物可作为催化剂、还原剂、化学感应器、 π 电子供体,在生物体系中也有潜在的应用价值. 为了更好的应用各种金属-金属键化合物,需要对其进行更深入的研究. 期望本文能够有助于我们进一步理解金属-金属键的本质、成键模式及反应性质等问题.
[1] LINDNER K. Die räumliche konfiguration der Hhalogenderivate des zweiwertigen molybdäns, wolframs und tantals [J]. Z Anorg Allg Chem, 1927, 162(113): 203-221.
[2] BERTRAND J A, COTTON F A, DOLLASE W A. The metal-metal bonded, polynuclear complex anion in CsReC14[J]. J Am Chem Soc, 1963, 85(9): 1349-1350.
[3] ROBINSON W T, FERGUSSON J E, PENFOLD B R. The configuration of the anion in CsReCl4[J]. Proc Chem Soc, 1963, 116.
[4] COTTON F A, LIPPARD S J. The preparation and characterization of compounds containing both hexabromorhenate (IV) and the trirhenium nonabromide group [J]. Inorg Chem, 1965, 4(9): 1843-1843.
[5] SU J, LI X W, CRITTENDON R C, et al. How short is a Ga≡Ga triple bond? Synthesis and molecular structure of Na2[Mes*2C6H3-Ga≡Ga-C6H3Mes*2] (Mes* = 2,4,6-iPr3C6H2): the first gallyne [J]. J Am Chem Soc, 1997, 119(23): 5471-5472.
[6] KREISEL K A, YAP G P A, DMITRENKO O, et al. The shortest metal-metal bond yet: molecular and electronic structure of a dinuclear chromium diazadiene complex [J]. J Am Chem Soc, 2007, 129(50): 14162-14163.
[7] LIU Y, LI S, YANG X J, et al. Magnesium-magnesium bond stabilized by a doubly reducedα-diimine: synthesis and structure of [K(THF)3]2[LMg-MgL] (L = [(2,6-iPr2C6H3)NC(Me)]22-) [J]. J Am Chem Soc, 2009, 131(12): 4210-4211.
[8] DONG Q S, YANG X J, GONG S D, et al. Distinct stepwise reduction of a nickel-nickel-bonded compound containing ana-diimine ligand: from perpendicular to coaxial structures [J]. Chem Eur J, 2013, 19(45): 15240-15247.
[9] LI X W, PENNINGTON W T, ROBINSON G H. A metallic system with aromatic character. Synthesis and molecular sructure of Na2(Mes2C6H3)Ga]2(Mes = 2,4,6-Me3C6H2): the first cyclogallane [J]. J Am Chem Soc, 1995, 117(28): 7578-7579.
[10] XIE Y, SCHREINER P R, SCHAEFER H F, et al. Are cyclogallenes [M2(GaH)3] (M = Li, Na, K) aromatic? [J]. J Am Chem Soc, 1996, 118(43): 10635-10639.
[11] LOPEZ L P H, SCHROCK R R, MVLLER P. Dimers that contain unbridged W(IV)/W(IV) double bonds [J]. Organometallics, 2006, 25(8): 1978-1986.
[12] GREEN S P, JONES C, JIN G, et al. Base-stabilized amidodiarsenes: synthesis, structure, and theoretical studies [J]. Inorg Chem, 2007, 46(1): 8-10.
[13] XIE Y, SCHAEFER H F, ROBINSON G H. The gallium-gallium triple bond in a realistic model. A density functional theory study of Na2[(C6H5)2C6H3GaGaC6H3(C6H5)2] [J]. Chem Phys Lett, 2000, 317(1): 174-180.
[14] TSAI Y C, LIN Y M, YU J S K, et al. A three-coordinate and quadruply bonded Mo-Mo complex [J]. J Am Chem Soc, 2006, 128(43): 13980-13981.
[15] TSAI Y C, CHEN H Z, CHANG C C, et al. Journey from Mo-Mo quadruple bonds to quintuple bonds [J]. J Am Chem Soc, 2009, 131(35): 12534-12535.
[16] LIU S C, KE W L, YU J S K, et al. An electron-rich molybdenum-molybdenum quintuple bond spanned by one lithium atom [J]. Angew Chem Int Ed, 2012, 51(26): 6394-6397.
[17] KVNDIG E P, MOSKOVITS M, OZIN G A. Matrix synthesis and characterisation of dichromium [J]. Nature, 1975, 254(10): 503-504.
[18] BOUDREAUX E A, BAXTER E. More QR-SCMEH-MO calculations on group VIB transition metal molecules, M2(M = Cr, Mo, W): valence and valence-core effects [J]. Int J Quantum Chem, 2004, 100(6): 1170-1178.
[19] JULES J L, LOMBARDI J R. Transition metal dimer internuclear distances from measured force constants [J]. J Phys Chem A, 2003, 107(9): 1268-1273.
[20] NGUYEN T, MERRILL W A, NI C, et al. Synthesis and characterization of the metal(I) dimers [Ar′MMAr′]: comparisons with quintuple-bonded [Ar′CrCrAr′] [J]. Angew Chem Int Ed, 2008, 47(47): 9115-9117.
[21] MACCHIA G L, GAGLIARDI L, POWER P P, et al. Large differences in secondary metal-arene interactions in the transition-metal dimers ArMMAr (Ar = Terphenyl; M = Cr, Fe, or Co): implications for Cr-Cr quintuple bonding [J]. J Am Chem Soc, 2008, 130(15): 5104-5114.
[责任编辑:吴文鹏]
Classification and prospect of the metal-metal bonding compounds
DU Lili, WANG Zhongying, CHEN Zhao, DONG Qingsong*
(CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
Synthesis and study of compounds containing metal-metal bonds are one of the most important research fields in chemistry because such compounds not only are related to the fundamental theory about the nature of new chemical bonds, but also found potential applications in catalysis and material science, etc.. In this paper, we made classification of the metal-metal bonding compounds according to bond orders, and detail described example about every bond order. Besides, the prospect application of the metal-metal bonding compounds is discussed.
metal-metal bond; bond order; crystal structure; prospect applications
2015-05-15.
河南大学博士科研启动基金(B2015106).
杜利利(1995-), 女, 研究方向为金属有机化学.*
, E-mail:dongqingsong01@163.com.
O614
A
1008-1011(2016)05-0644-06
