螺羟吲哚类杂环衍生物的一锅法合成
2016-10-25黄小梅
黄小梅,邓 祥,朱 华
(1.四川文理学院 化学化工学院, 四川 达州 635000; 2.四川省高校重点实验室 特色植物开发研究重点实验室,四川 达州 635000)
螺羟吲哚类杂环衍生物的一锅法合成
黄小梅1,2*,邓祥1,2,朱华1,2
(1.四川文理学院 化学化工学院, 四川 达州 635000;2.四川省高校重点实验室 特色植物开发研究重点实验室,四川 达州 635000)
在室温和水作溶剂条件下,阴离子交换树脂IRA-900有效催化含不同取代基的靛红、丙二腈和1,3-环己二酮,一锅法合成了12个相应的螺羟吲哚类杂环衍生物,其产率高达92%~99%. 同时讨论了催化剂的种类、溶剂用量和催化剂的重复使用次数对反应的影响,并对IRA-900催化剂的反应机理进行了初步探讨. 该方法具有条件温和,实验操作简单,以及催化剂能重复使用等优点,为螺羟吲哚类杂环衍生物提供了一条绿色合成方法.
螺羟吲哚类杂环衍生物;一锅法;IRA-900;绿色合成方法
螺羟吲哚类杂环衍生物是一类重要的杂环化合物,是很多药物和天然产物的核心结构[1-4],该类化合物具有广泛的生物活性和药理作用,如抗感染、抗肿瘤、抗艾滋病、杀菌和保护神经元等[5-8]. 该类化合物上连接的氰基和氨基等取代基又是合成某些具有特殊结构的天然产物的中间体. 由于其重要的生物活性和药理作用,螺羟吲哚类杂环衍生物的合成得到了广泛的关注. 有文献报道了TEBA[9]、InCl3-SiO2[10]、InCl3[11]、Sodium stearate[12]、EDDA[13]、cyclodextrin[14]、L-proline[15]和TBAF[16]等催化剂催化合成方法. 但这些方法存在反应条件苛刻,时间长,产率低,一般在有机溶剂中进行,而且需用酸、碱和盐等催化剂,对环境造成一定程度的污染.
目前,绿色化学合成越来越引起大家的重视,其中寻找环境友好的反应条件是绿色有机合成化学研究的一个重要课题,尤其是水作溶剂的化学反应. 水作为一种绿色的溶剂,具有廉价、易得和无毒等优点. 本文报道了在水相中以阴离子交换树脂IRA-900(Cl-)为绿色反应催化介质,有效催化含不同取代基的靛红、丙二腈和1, 3-环己二酮的反应,实现了三组分一锅法合成螺羟吲哚类杂环衍生物. 其合成路线如图1所示.

图1 螺羟吲哚类杂环衍生物合成路线Fig.1 Synthesis route of the spirooxindoles derivatives
1 实验部分
1.1仪器与试剂
AV 300型核磁共振波谱仪(德国Brucker公司);WRS-1B型数字熔点仪(上海精贤光电科技有限公司);DF-101S集热式恒温加热磁力搅拌器油浴锅(河南巩义仪器设备有限公司);FA2004A电子天平(上海垒固仪器有限公司).
IRA-900 阴离子交换树脂、A-26阴离子交换树脂、50wx8-200阳离子交换树脂均购于Sigma公司;靛红、1,3-环己二酮、5-硝基靛红、4-羟基香豆素、丙二腈、氰乙酸乙酯、氰乙酸甲酯、5,5-二甲基1,3-环己二酮均购于国药集团化学试剂有限公司,所有试剂均为分析纯,实验用水均为二次蒸馏水.
1.2螺羟吲哚类杂环衍生物的合成
在反应试管(25 mL)中, 分别加入IRA-900阴离子交换树脂200 mg,靛红、1,3-环己二酮、丙二腈各1.0 mmo1,蒸馏水10 mL,室温25 ℃下搅拌反应(TLC监控). 反应完成后,有大量絮状沉淀析出, 冷却反应、过滤,将过滤得到的沉淀物用15 mL无水乙醇溶解,加热至沸腾,趁热将催化剂滤出,滤液倒入冰水中,抽滤后得到粗产物,粗产物经乙醇重结晶分离得到淡黄色固体2-amino-2′,5-dioxo-5,6,7,8-tetrahydrospiro[chromene-4,3′-indoline]-3-carbonitrile(4a)产物;1H NMR (DMSO-d6, 300 MHz,δ): 10.42 (s, 1H), 7.24 (s, 2H), 7.18-6.79 (m, 4H), 2.68 (s, 2H), 2.25 (s, 2H), 1.95 (s, 2H).13C NMR (DMSO-d6, 75 MHz,δ): 195.36, 178.49, 166.39, 159.02, 142.40, 134.93, 128.50, 123.57, 122.00, 117.72, 112.29, 109.52, 57.99, 47.28, 36.71, 27.13, 20.18.
2 结果与讨论
2.1催化剂的筛选
在室温(25 ℃)条件下,用10 mL蒸馏水做溶剂,选用离子交换树脂作为绿色反应催化介质,分别考察了阴离子交换树脂IRA-900(Cl-)和A-26(OH-),阳离子交换树脂50wx8-200(H+)作催化剂对试验的影响,催化剂用量均为200 mg,催化各反应物用量均为1 mmol的靛红、丙二腈和1,3-环己二酮的反应,其实验结果见表1所示.
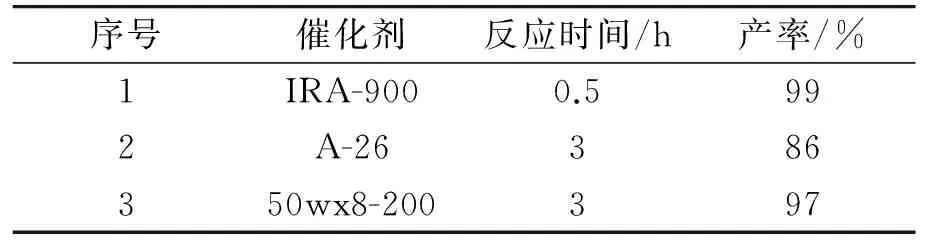
表1 催化剂的筛选Table 1 Screening of catalysts
从表1可知,阴离子交换树脂A-26的催化效果较差,反应时间长且产物产率最低,阳离子交换树脂50wx8-200催化反应虽然产率较高,但时间相对较长,阴离子交换树脂IRA-900催化效果最好,反应时间短,而且产率达到99%,因此选取IRA-900作为合成螺羟吲哚类杂环衍生物反应的催化剂.
2.2溶剂用量对反应的影响
在室温(25 ℃)条件下,用阴离子交换树脂IRA-900(Cl-)作催化剂,催化剂用量为200 mg,靛红、丙二腈和1,3-环己二酮各反应物用量均为1 mmol,反应时间为0.5 h,考察溶剂蒸馏水用量对反应的影响,实验结果如图2所示.

图2 溶剂用量的影响Fig.2 Effect of solvent dosage
由上图可知,随着溶剂量的增加,产率增大,当溶剂蒸馏水用量达到10 mL后,产率几乎没有变化,并达到99%,由此可见,当溶剂用量达到一定值时,溶剂用量对反应的影响较小,因此选取10 mL蒸馏水作为此反应的最佳溶剂用量.
2.3催化剂的重复使用性能测试
由于离子交换树脂催化剂在反应过程中进行的非均相催化,使得催化剂易于从原反应体系中重新分离出来,因而使催化剂的重复使用变为现实,从而达到绿色催化的目的. 表2列出了催化剂IRA-900催化靛红、丙二腈和1,3-环己二酮反应的重复使用性能.

表2 催化剂重复使用对反应的影响Table 2 Effect of catalyst recycling on the reaction
从表中可以看出,催化剂IRA-900在重复使用5次后,仍具有良好的催化活性,但是随着重复使用次数的增加,催化活性有所减低,产率呈现下降趋势. 这可能是由于催化剂回收损失造成的. 但催化剂仍然可以很好的催化反应,符合绿色催化的要求.
2.4催化不同底物的反应
在室温(25 ℃)条件下,用10 mL水做溶剂,选取了几种带有不同取代基的靛红、丙二腈和1,3-环己二酮(各1 mmol),考察催化剂IRA-900(200 mg)对不同底物催化反应的影响. 实验结果表3所示.
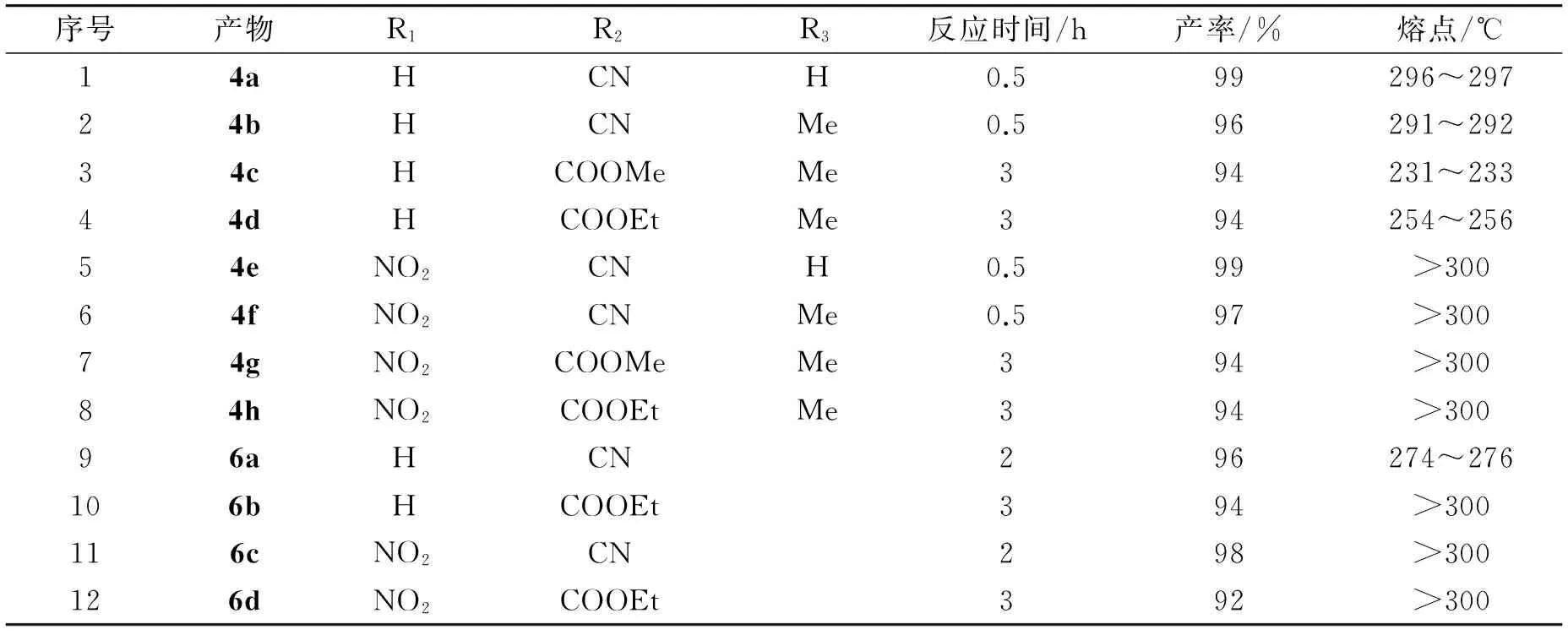
表3 IRA-900催化不同底物的反应Table 3 Reaction of various substrates catalyzed by IRA-900
从表中可以看出,IRA-900能有效催化含有不同取代基的靛红、丙二腈和1,3-环己二酮的反应,通过实验合成得到了12个相应的螺羟吲哚类杂环衍生物4a~4h和6a~6d,其产率达到了92%~99%.
2.5反应机理的初步探讨
在室温(25 ℃)和没有催化剂加入的条件下,用水作溶剂时,不同取代基的靛红、丙二腈和1,3-环己二酮几乎不能发生反应,当加入催化剂阴离子交换树脂IRA-900后,反应顺利进行,并得到92%~99%的产率. 我们认为该催化剂催化反应的可能机理如图3所示. 首先丙二腈与靛红发生Knoevenagel反应, 然后中间产物再与1,3-环己二酮进行Michael加成反应,最后通过分子内缩合反应得到目标化合物.

图3 IRA-900催化反应机理Fig.3 Proposed mechanism of the IRA-900 catalyze reaction
3 结论
通过阴离子交换树脂IRA-900有效催化了含不同取代基的靛红、丙二腈和1,3-环己二酮,一锅法合成了相应的螺羟吲哚类杂环衍生物,其产率达到92%~99%. 该反应在水相中于室温(25 ℃)条件下进行,具有反应条件温和、反应时间短、实验操作简单、产率高, 以及催化剂能重复使用等优点. 为螺羟吲哚类杂环衍生物的合成提供了一条绿色途径.
[1] DANDIA A, SINGH R, KHATURIA S, et al. Efficient microwave enhanced regioselective synthesis of a series of benzimidazolyl/triazolyl spiro [indole-thiazolidinones] as potent antifungal agents and crystal structure of spiro[3H-indole-3,2′-thiazolidine]-3′(1,2,4-triazol-3-yl)-2,4′(1H)-dione [J]. Bioorg Med Chem, 2006, 14(7): 2409-2417.
[2] RUIZ-SANCHIS P, SAVINA S A, ALBERICIO F, et al. Structure, bioactivity and synthesis of natural products with hexahydropyrrolo[2,3-b]indole [J]. Chem-Eur J, 2011, 17(5): 1388-1408.
[3] KHAFAGY M M, ABD EL-WAHAB A H, EID F A, et al. Synthesis of halogen derivatives of benzo[h]chromene and benzo[a]anthracene with promising antimicrobial activities [J]. Farmaco, 2002, 57(9): 715-722.
[4] MA J, HECHT S M. Javaniside, a novel DNA cleavage agent from Alangium javanicum having an unusual oxindole skeleton [J]. Chem Commun, 2004, 21(10): 1190-1191.
[5] HENEGOUWEN W G B V, FIESELER R M, RUTJES F P J T, et al. First total synthesis of ent-gelsedine via a novel iodide-promoted allen N-acyliminium ion cyclization [J]. J Org Chem, 2000, 65(24): 8317-8325.
[6] HAYASHI S, UENO N, MURASE A, et al. Novel acid-type cyclooxygenase-2 inhibitors: Design, synthesis, and structure-activity relationship for anti-inflammatory drug [J]. Eur J Med Chem, 2012, 50(6): 179-195.
[7] SUENAGA K, ARAKI K, SENGOKU T, et al. Enantioselective synthesis of attenols A and B [J]. Org Lett, 2001, 3(4): 527-529.
[8] EI-NAKKADY S S, HANNA M M, ROAIAH H M, et al. Synthesis, molecular docking study and antitumor activity of novel 2-phenylindole derivatives [J]. Eur J Med Chem, 2012, 47(1): 387-398.
[9] DABIRI M, BAHRAMNEJAD M, BAGHBANZADEH M. Ammonium salt catalyzed multicomponent transformation: simple route to functionalized spirochromenes and spiroacridines [J]. Tetrahedron, 2009, 65(45): 9443-9447.
[10] ZHU S L, JI S J, ZHANG Y. A simple and clean procedure for three-component synthesis of spirooxindoles in aqueous medium [J]. Tetrahedron, 2007, 63(38): 9365-9372.
[11] SHANTHI G, SUBBULAKSHMI G, PERUMAL P T. A new InCl3-catalyzed, facile and efficient method for the synthesis of spirooxindoles under conventional and solvent-free microwave conditions [J]. Tetrahe-dron, 2007, 63(9): 2057-2063.
[12] WANG L M, JIAO N, QIU J, et al. Sodium stearate-catalyzed multicomponent reactions for efficient synthesis of spirooxindoles in aqueous micellar media [J]. Te-trahedron, 2010, 66(1): 339-343.
[13] HARI G, YONG L. Efficient one-pot synthesis of spirooxindole derivatives by ethylenediamine diacetate catalyzed reactions in water [J]. Synthesis, 2010, 46(3): 453-464.
[14] SRIDHAR R, SRINIVAS B, MADHAV B, et al. Multi-component supramolecular synthesis of spirooxindoles catalyzed byβ-cyclodextrin in water [J]. Can J Chem, 2009, 87(12): 1704-1707.
[15] LI Y, CHEN H, SHI D, et al. Efficient one-pot synthesis of spirooxindole derivatives catalyzed byL-proline in aqueous medium [J]. J Comb Chem, 2010, 12(2): 231-237.
[16] GAO S, TSAI C H, TSENG C, et al. Fluoride ion catalyzed multicomponent reactions for efficient synthesis of 4H-chromene and N-arylquinoline derivatives in aqueous media [J]. Tetrahedron, 2008, 64(38): 9143-9149.
[责任编辑:刘红玲]
One-pot synthesis of spirooxindoles derivatives
HUANG Xiaomei1, 2*, DENG Xiang1, 2, ZHU Hua1,2
(1.DepartmentofChemistryandChemicalEngineering,SichuanUniversityofArtsandScience,Dazhou635000,Sichuan,China;2.KeyLaboratoryofExploitationandStudyofDistinctivePlantsinEducationDepartmentofSichuanProvince,Dazhou635000,Sichuan,China)
At room temperature with water as a solvent, anion exchange resin IRA-900 can effectively catalyze the reaction of isatin, malononitrile and 1,3-cyclohexanedione with different substituents, producing twelve corresponding spirooxindoles derivatives via a one-pot method with 92%~99% yields. At the same time, the effects of the different catalyst, the amount of solvent, the repeated use times of catalyst on the reaction were discussed, and the reaction mechanism of IRA-900 were discussed. This method with the advantages of mild conditions, simple operation, and repeated use of the catalyst provides a green synthesis for spirooxindoles derivatives.
spirooxindoles derivatives; one-pot method; IRA-900; green synthesis method
2016-01-17.
四川省科技厅基金(2015JY0033),四川省教育厅基金(16ZA0356),四川文理学院基金(2014YY002,2014Z007Z).
黄小梅(1977-),女,高级实验师,研究方向为光电分析化学及有机合成.*
,E-mail: dxw8066031@163.com.
O626.4
A
1008-1011(2016)05-0573-05
