上调miR-181a对胃癌细胞AGS增殖和凋亡的影响
2016-10-25余钧辉孙学军郑见宝王孝珑魏光兵
余钧辉,孙学军,郑见宝,王孝珑,魏光兵,高 琪,王 恺
(西安交通大学第一附属医院普通外科,陕西西安 710061)
◇基础研究◇
上调miR-181a对胃癌细胞AGS增殖和凋亡的影响
余钧辉,孙学军,郑见宝,王孝珑,魏光兵,高琪,王恺
(西安交通大学第一附属医院普通外科,陕西西安710061)
目的探讨miR-181a对胃癌细胞增殖、周期及凋亡的影响及其作用机制。方法荧光实时定量PCR检测5种胃癌细胞及人胃黏膜细胞系GES-1中miR-181a的表达情况,以及胃癌细胞AGS瞬时转染miR-181amimic后miR-181a的表达情况;MTT法和流式细胞仪检测上调miR-181a表达对胃癌细胞AGS增殖、周期和凋亡等生物学行为的影响;Westernblot检测上调miR-181a后细胞周期调控蛋白(CDC25A、cyclinA2、cyclinD1、p21)和凋亡相关蛋白(Bcl-2和Bax)的表达变化。结果与人胃黏膜细胞系GES-1比较,miR-181a在人胃癌细胞株SGC-7901和MKN28表达升高(P均<0.01),在MGC-803、BGC-823、AGS表达差异无统计学意义(P均>0.05);瞬时转染miR-181amimic后,胃癌细胞AGS中miR-181a的表达明显上调(P<0.05);转染miR-181amimics后AGS细胞增殖明显,G0/G1期细胞减少,S期细胞明显增多,细胞凋亡明显减弱(P均<0.05)。Westernblot结果显示,上调miR-181a后胃癌细胞AGS中CDC25A、cyclinA2和Bcl-2表达升高(P均<0.05),cyclinD1和p21表达差异没有统计学意义(P>0.05),Bax表达降低(P<0.05)。结论上调miR-181a可以促进胃癌细胞AGS增殖,其作用机制可能与CDC25A、CyclinA2表达升高有关;上调miR-181a可抑制胃癌细胞凋亡,其作用机制可能与Bcl-2表达升高及Bax表达降低有关。
miR-181a;胃癌;增殖;凋亡;细胞周期
胃癌是最为常见的消化道肿瘤之一,全球的胃癌发病率达到第四位,并且在肿瘤相关的死亡中位列第二[1]。microRNA(miRNA,miR)是一类19~25个核苷酸大小的内源非编码小分子RNA,是真核生物中广泛存在的一类重要的调控分子,通过与靶基因信使RNA(mRNA)的3′非编码区(3′-UTR)特异性的碱基配对引起mRNA的降解或翻译抑制,从而发挥对靶基因的转录后沉默作用[2]。生物学分析认为,miRNA调控着人类大约30%的基因,参与调控包括分化、增殖以及凋亡等多个细胞生物学过程[3]。因此,miRNA的表达失调与肿瘤等疾病密切相关。目前的研究显示,所有的实体肿瘤中都存在miRNA表达谱的显著差异,而这些差异表达的miRNA有望成为癌症治疗的新靶点[4]。miR-181a是miR-181家族成员之一,在多种肿瘤的发生发展中起着重要作用。本课题组前期的工作已经证实miR-181a在胃癌组织中高表达,为了进一步探讨其在胃癌发生发展中的作用,本研究采用miR-181amimics上调人胃癌细胞AGS中miR-181a的表达,检测其对胃癌细胞增殖、凋亡等生物学行为的影响,探讨可能的作用机制。
1 材料与方法
1.1主要试剂和仪器Trizol试剂(美国Invitrogen公司);反转录试剂盒RevertAidFirstStrandcDNASynthesisKit(ThermoScientific公司);Real-timePCR(日本TaKaRa公司);Real-timePCR检测仪(美国Bio-Rad公司,CFX96TMReal-timePCRDetectionSystem);miR-181a、U6引物由广州锐博生物科技有限公司设计并合成;RPMI-1640培养基(美国Corning公司);胎牛血清(法国Biowest公司);LipofectamineTM2000 转染试剂(美国Invitrogen公司);OPTI-MEN(美国Gibco公司);AnnexinV-FITC试剂盒(美国BD公司);MTT(美国Sigma公司);miR-181amimics及NegativeControl(NC)(上海吉玛公司);CDC25A、cyclinA2、cyclinD1和GAPDH抗体(美国SantaCruz公司),Bcl-2和Bax(美国Abcam公司);凝胶成像仪(美国Bio-Rad公司)。
1.2细胞培养GES-1、SGC-7901、MGC-803、AGS、BGC-823和MKN28为本实验室长期保存,采用RPMI1640培养基(含100mL/L胎牛血清),于37 ℃、50mL/LCO2培养箱中培养,每天观察并更换细胞培养液1次,待细胞长满约80%时,用2.5g/L胰蛋白酶消化传代,取生长状态良好的对数生长期细胞用于实验。
1.3总RNA提取及Real-timePCR用Trizol试剂按照操作说明书,分别提取人胃黏膜细胞系GES-1和5株胃癌细胞的总RNA,各取2μgRNA进行反转录成cDNA,行Real-timePCR。反应条件:95 ℃预变性30s;然后按95 ℃ 5s,60 ℃ 30s进行40个循环。以每个样本的U6作为内参,基因相对表达量采用2-△△Ct方法进行计算分析。实验重复3次。
1.4细胞转染将对数生长期SGC-7901细胞按2×104个接种于6孔板,按照实验设计分组,实验组(转染miR-181amimics)、阴性对照组(转染negativecontrol)和空白对照组(untreatedcell,只加转染试剂)。用250μLOPTI-MEN稀释LipofectamineTM2000转染试剂5μL,室温下静置5min,再用250μLOPTI-MEN稀释miR-181amimics或negativecontrol5μL,两者混合室温下静置20min,每孔加入500μL中的转染复合液,在50mL/LCO2、37 ℃培养箱中孵育4~6h,用新鲜的完全培养基(含血清)替换含有转染复合物的培养基,供后续实验使用。实验重复3次。
1.5MTT法检测细胞增殖将胃癌细胞按照5×103个/孔接种于96孔板中,按1.4项随机分为实验组、阴性对照组和空白对照组,每组设4个复孔;未接种细胞的孔中加入RPMI1640培养基作为调零孔。接种后24、48、72、96h各检测1次,每孔加入MTT20μL继续在培养箱中孵育4h,用酶标仪检测其490nm处吸光度(A)值。实验重复3次。
1.6流式细胞仪检测细胞周期按2×105个/孔接种胃癌细胞于6孔板中,按1.4项分组为实验组、阴性对照组和空白对照组,转染48h换为无血清培养基,24h后再换成含100mL/L胎牛血清的RPMI1640培养基培养24h,用胰酶消化收集各组细胞,并用预冷PBS洗涤3次,1 000r/min,5min/次,弃上清。加入―20 ℃ 预冷的750mL/L冰乙醇1mL固定细胞,置于4 ℃冰箱过夜。检测前离心(1 000r/min,5min),PBS洗涤2次;加入100μLPBS并将细胞吹悬;用含0.1g/LRNase和5g/L碘化丙锭(PI)4 ℃处理细胞20min。过300目尼龙网。送流式细胞仪检测。实验重复3次。
1.7AnnexinV-FITC染色检测凋亡胃癌细胞按2×105个/孔接种于6孔板并按1.4项分组,转染后24h按照AnnexinV-FITC试剂盒说明进行染色,并在1h内进行流式细胞仪检测。实验重复3次。
1.8Westernblot检测CDC25A、cyclinA2、cyclinD1、p21、Bcl-2及Bax的表达胃癌细胞按2×105个/孔接种于6孔板并按1.4项分组,转染72h后收集各组细胞,提取细胞总蛋白并用BCA法检测总蛋白浓度,每组样本取10μL进行100g/LSDS-PAGE垂直电泳,湿转法将胶中蛋白水平转移至PVDF膜上,50g/L脱脂牛奶在37 ℃摇床上封闭1h,先后分别加入TBST稀释后的一抗(4 ℃过夜)、二抗,经ECL显影,凝胶成像系统扫描,采用相关图像分析软件(Bio-radQuantityOne,CA)进行条带灰度分析。GAPDH作为参照蛋白。
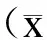
2 结 果
2.1人胃黏膜细胞系和胃癌细胞的miR-181a表达变化与人胃黏膜细胞系GES-1组比较,人胃癌细胞MKN28和SGC-7901中miR-181a相对高表达,差异有统计学意义(P均<0.01),而MGC-803、BGC-823、AGS等胃癌细胞中miR-181a的表达与GES-1细胞相比,差异无统计学意义(P均>0.05,图1)。后续功能学研究选用miR-181a表达较低的胃癌细胞AGS为实验细胞,采用miR-181amimics上调其miR-181a表达。

图1人胃黏膜细胞系GES-1及5种人胃癌细胞中miR-181a的表达
Fig.1ExpressionofmiR-181ainfivegastriccancercelllinesandnormalgastriccancercelllineGES-1
2.2转染24h后miR-181a的表达变化胃癌细胞AGS转染miR-181amimics后,miR-181a的表达较阴性对照组显著上调,差异有统计学意义(P<0.05);阴性对照组和空白对照组差异无统计学意义(P>0.05,图2)。
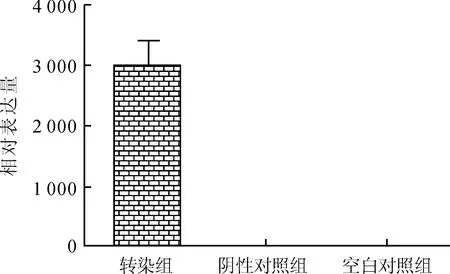
图2胃癌细胞株AGS转染miR-181amimics24h后miR-181a的表达
Fig.2ExpressionofmiR-181aingastriccancercellAGSaftertransfectionwithmiR-181amimics
2.3miR-181a对胃癌细胞增殖的影响MTT检测结果显示,胃癌细胞AGS转染miR-181amimics后24、48、72h的生长速度相对阴性对照组,差异没有统计学意义(P均>0.05),96h生长速度明显增快,差异有统计学意义(P<0.05);阴性对照组和空白对照组间差异没有统计学意义(P>0.05,图3)。

图3胃癌细胞AGS转染miR-181amimics后的细胞生长曲线
Fig.3CellgrowthcurvesofgastriccancercellAGSaftertransfectionwithmiR-181amimics
2.4miR-181a对胃癌细胞周期的影响流式细胞仪检测结果显示,人胃癌细胞AGS转染miR-181amimics组的G0/G1期细胞比例较阴性对照组明显减少(P<0.05),S期细胞比例增多(P<0.05),G2/M期细胞比例差异没有统计学意义 (P>0.05)。阴性对照组和空白对照组间差异没有统计学意义(P>0.05,图4、表1)。

图4流式细胞术检测胃癌细胞AGS转染miR-181amimics时的细胞周期变化
Fig.4CellcycledistributionofgastriccancercellAGSaftertransfectionwithmiR-181amimicsdetectedbyflowcytometry
A:miR-181amimics(转染组);B:Negativecontrol(阴性对照组);C:Untreatedcell(空白对照组)。
表1胃癌细胞AGS转染miR-181amimics时细胞周期时相的分布

Tab.1 Cell cycle distribution of gastric cancer cell AGS after transfection with miR-181a mimics(%, ±s)
与阴性对照组比较,*P<0.05;与空白对照组比较,#P<0.05。2.5miR-181a对胃癌细胞凋亡的影响转染miR-181amimics的人胃癌细胞AGS的凋亡比例较阴性对照组减少,差异有统计学意义(P<0.05)。阴性对照组和空白对照组间差异没有统计学意义(P>0.05,图5)。

图5流式细胞仪检测各组AGS细胞凋亡的结果(A、B、C)及凋亡率的比较(D)
Fig.5ApoptosisineachgroupofAGScellsdetectedbyflowcytometryandcomparisonofapoptosisratesamonggroups
A、B、C:分别为转染组、阴性对照组、空白对照组;D:1~3分别为转染组、阴性对照组、空白对照组。
2.6miR-181a对胃癌细胞周期蛋白表达的影响AGS细胞miR-181amimics转染组的CDC25A、cyclinA2 表达较阴性对照组明显升高(P<0.05),cyclinD1 及p21表达差异没有统计学意义(P>0.05)。阴性对照组和空白对照组间差异没有统计学意义(P>0.05,图6)。
2.7miR-181a对胃癌细胞Bcl-2及Bax表达的影响AGS细胞转染miR-181amimics组的抗凋亡蛋白Bcl-2表达较阴性对照组明显升高,凋亡蛋白Bax表达降低,差异均有统计学意义(P<0.05)。阴性对照组和空白对照组间差异没有统计学意义(P>0.05,图7)。
3 讨 论
胃癌的发生发展涉及到多种癌基因、抑癌基因、凋亡调节基因等的异常表达,是一个复杂的病变过程[5]。miRNA作为新的研究切入点,为癌症的诊断与治疗开辟了一条新途径。研究表明,胃癌组织中存在着差异表达的miRNA,可能与细胞增殖、凋亡的调控及癌细胞对化疗药物的敏感性相关,理解这些miRNA有助于为胃癌的诊断和监测提供新的潜在分子靶标[6-7]。
miR-181a是近年来受到众多关注的miRNA之一,家族成员包括已知的miR-181a、miR-181b、miR-181c及miR-181d等4个成熟序列。其中,miR-181a是miR-181家族的重要成员,与肿瘤的发生发展关系密切。miR-181a在乳腺癌[8]、肝癌[9]和头颈部肿瘤[10]表达上调,发挥着癌基因的作用,而在胶质瘤[11]、结肠癌[12]中miR-181a表达下调,发挥抑癌基因的作用。此外,miR-181a参与肿瘤细胞增殖[13]、凋亡[14]及耐药性[15]等生物学行为过程。然而,miR-181a在胃癌中的研究较少且存在争议。本课题组前期工作采用Real-timePCR检测了miR-181a在42例胃癌组织及配对的正常组织的表达情况,证实miR-181a在胃癌组织中高表达,但是对胃癌的细胞生物学行为的影响以及具体的作用机制,目前仍未见阐明。
图6AGS各组细胞CDC25A、cyclinA2、p21及cyclinD1的表达变化
Fig.6ProteinexpressionsofCDC25A,cyclinA2,p21andcyclinD1ineachgroupofAGScells
A:Westernblot条带;1:转染组;2:阴性对照组;3:空白对照组;B:各组细胞周期蛋白表达量的比较。

图7AGS各组细胞Bcl-2和Bax表达的变化
Fig.7ProteinexpressionsofBcl-2andBaxineachgroupofAGScells
A:Westernblot条带;1:转染组;2:阴性对照组;3:空白对照组。B:蛋白表达结果的统计学分析。
本研究上调miR-181a表达并观察其对胃癌细胞增殖、凋亡的影响并探讨可能的作用机制。MTT结果显示,上调miR-181a具有促进胃癌细胞AGS增殖的作用;细胞周期结果表明,上调miR-181a时,G0/G1期细胞比例明显减少,S期细胞比例增多。这提示miR-181a促进胃癌细胞AGS增殖及G1/S期转化。ZHANG等[16]采用MTT和软琼脂克隆形成实验结果也显示上调miR-181a可促进胃癌细胞增殖。
本研究进一步采用Westernblot检测了4个细胞周期调节因子。CDC25A是细胞分裂周期基因CDC25 (celldivisioncycle25)家族中最为重要的成员,CDC25A对于G1/S、G2/M期转换至关重要。CDC25A通过对细胞周期蛋白依赖性激酶2-细胞周期素E复合物(CDK2-cyclinE)和CDK2-cyclinA的去磷酸化作用而促进细胞进入S期。因此,CDC25A高表达可加速G1/S期的转化,下调其表达则会导致S期的阻滞[17]。本研究结果表明,转染了miR-181amimics的AGS细胞的CDC25A、cyclinA2表达明显升高。提示miR-181a可能通过CDC25A、cyclinA2通路促进胃癌细胞G1/S期转化。抑癌基因p21是一个广谱的细胞周期依赖性激酶抑制剂和细胞周期的负调控因子,具有阻止细胞通过G1/S期的作用;癌基因cyclinD1参与G1/S期转换的调控,是细胞周期重要的正性调控因子。ZHU等[18]研究发现miR-181a可通过p21的表达促进骨肉瘤细胞MG63增殖。本研究上调miR-181a时,p21和cyclinD1的表达差异没有统计学意义。提示miR-181a可能通过不同的信号途径参与不同肿瘤细胞增殖的调控。
miR-181a是调节多种肿瘤细胞凋亡的重要因子。JIAO等[19]研究发现,乳腺癌耐药株MCF-7/MX的miR-181a表达较亲本MCF-7细胞株下调,而上调miR-181a表达可增加MCF-7/MX对抗肿瘤药物米托蒽醌(mitoxantrone)的敏感性;还证实miR-181a通过调节乳腺癌耐药蛋白(BRCP)表达而影响肿瘤药物的耐药性。Bcl-2和Bax是Bcl-2家族的两个关键成员,Bax和Bcl-2通过形成同源或异源二聚体调节细胞凋亡:当Bax形成同源二聚体时诱导细胞凋亡;Bax与Bcl-2形成异源二聚体时则抑制细胞凋亡。本研究结果显示,上调胃癌细胞miR-181a时,凋亡比例降低,Westernblot结果可见Bcl-2表达升高,Bax降低。这提示miR-181a可能抑制Bax同源二聚体形成和促进Bax/Bcl-2异源二聚体形成而抑制细胞凋亡,这与ZHU[17]在骨肉瘤中的miR-181a研究结论一致,但具体机制有待于进一步研究。
研究表明血清中特异性表达的miRNA有望成为胃癌诊断及预后的监测指标。WANG等[20]发现,血清中miR-17-5p/20a的表达水平与胃癌的分化程度及TNM分期密切相关,生存曲线分析发现高表达的miR-17-5p/20a往往预示着不良的预后,提示miR-17-5p/20a有望成为判断胃癌进展程度及预后的良好的标志物。GUO等[21]发现,血清中miR-181a诊断乳腺癌的灵敏度及特异度达到70.7%和59.9%,远高于传统的乳腺癌诊断标志物CA153和CEA,预示着miR-181a具有成为乳腺癌诊断标志物的潜力。血清miRNA检测具有无创性、稳定性好、灵敏度高等优点,具备成为理想肿瘤标记物的条件。本课题组前期的研究表明miR-181a在胃癌组织中高表达,提示miR-181a有可能成为胃癌的诊断的新一代标志物。目前仍未有血清中miR-181a与胃癌研究的报道,这也是本课题今后研究的一个方向。
综上所述,上调miR-181a能够促进胃癌细胞的增殖活性,抑制胃癌凋亡,提示miR-181a在胃癌中可能扮演致癌基因的角色,这与其在胃癌组织中表达上调时的生物作用一致。在后续实验中,我们将通过生物学实验寻找miR-181a的靶蛋白,为胃癌的发生机制及临床生物治疗提供新的靶点。
[1]JEMALA,BRAYF,CENTERMM,etal.Globalcancerstatistics[J].CACancerJClin, 2011, 61(2):69-90.
[2]BARTELDP.MicroRNAs:genomics,biogenesis,mechanism,andfunction[J].Cell, 2004, 116(2):281-297.
[3]YUZ,JIANZ,SHENSH,etal.GlobalanalysisofmicroRNAtargetgeneexpressionrevealsthatmiRNAtargetsarelowerexpressedinmaturemouseandDrosophilatissuesthanintheembryos[J].NucleicAcidsRes, 2007, 35(1):152-164.
[4]LANH,LUH,WANGX,etal.MicroRNAsaspotentialbiomarkersincancer:opportunitiesandchallenges[J].BioMedResInt, 2015, 2015:125094.
[5]TAMURAG.Alterationsoftumorsuppressorandtumor-relatedgenesinthedevelopmentandprogressionofgastriccancer[J].WorldJGastroenterol, 2006, 12(2):192-198.
[6]KIMCH,KIMHK,RETTIGRL,etal.miRNAsignatureassociatedwithoutcomeofgastriccancerpatientsfollowingchemotherapy[J].BMCMedGenomics, 2011, 4:79.
[7]UEDAT,VOLINIAS,OKUMURAH,etal.RelationbetweenmicroRNAexpressionandprogressionandprognosisofgastriccancer:amicroRNAexpressionanalysis[J].LancetOncol, 2010, 11(2):136-146.
[8]TAYLORMA,SOSSEY-ALAOUIK,THOMPSONCL,etal.TGF-betaupregulatesmiR-181aexpressiontopromotebreastcancermetastasis[J].JClinInvest, 2013, 123(1):150-163.
[9]MENGF,GLASERSS,FRANCISH,etal.FunctionalanalysisofmicroRNAsinhumanhepatocellularcancerstemcells[J].JCellMolMed, 2012, 16(1):160-173.
[10]NURUL-SYAKIMAAM,YOKE-KQUEENC,SABARIAHAR,etal.DifferentialmicroRNAexpressionandidentificationofputativemiRNAtargetsandpathwaysinheadandneckcancers[J].IntJMolMed, 2011, 28(3):327-336.
[11]SHIL,CHENGZ,ZHANGJ,etal.hsa-mir-181aandhsa-mir-181bfunctionastumorsuppressorsinhumangliomacells[J].BrainRes, 2008, 1236:185-193.
[12]LIY,KUSCUC,BANACHA,etal.miR-181a-5pinhibitscancercellmigrationandangiogenesisviadownregulationofmatrixmetalloproteinase-14[J].CancerRes, 2015, 75(13):2674-2685.
[13]FEIJ,LIY,ZHUX,etal.miR-181apost-transcriptionallydownregulatesoncogenicRalAandcontributestogrowthinhibitionandapoptosisinchronicmyelogenousleukemia(CML)[J].PLoSOne, 2012, 7(3):e32834.
[14]KEG,LIANGL,YANGJM,etal.MiR-181aconfersresistanceofcervicalcancertoradiationtherapythroughtargetingthepro-apoptoticPRKCDgene[J].Oncogene, 2013, 32(25):3019-3027.
[15]LIH,HUIL,XUW.miR-181asensitizesamultidrug-resistantleukemiacelllineK562/A02todaunorubicinbytargetingBCL-2[J].ActaBiochimBiophysSin(Shanghai), 2012, 44(3):269-277.
[16]ZHANGX,NIEY,LIX,etal.MicroRNA-181afunctionsasanoncomiringastriccancerbytargetingthetumoursuppressorgeneATM[J].PatholOncolRes, 2014, 20(2):381-389.
[17]VERDUZCOD,DOVEYJS,SHUKLAAA,etal.MultipleisoformsofCDC25opposeATMactivitytomaintaincellproliferationduringvertebratedevelopment[J].MolCancerRes, 2012, 10(11):1451-1461.
[18]JIANWEIZ,FANL,XIANCHENGL,etal.MicroRNA181aimprovesproliferationandinvasion,suppressesapoptosisofosteosarcomacell[J].TumourBiol, 2013, 34(6):3331-3337.
[19]JIAOX,ZHAOL,MAM,etal.MiR-181aenhancesdrugsensitivityinmitoxantone-resistantbreastcancercellsbytargetingbreastcancerresistanceprotein(BCRP/ABCG2)[J].BreastCancerResTreat, 2013, 139(3):717-730.
[20]WANGM,GUH,WANGS,etal.CirculatingmiR-17-5pandmiR-20a:molecularmarkersforgastriccancer[J].MolMedRep, 2012, 5(6):1514-1520.
[21]GUOLJ,ZHANGQY.DecreasedserummiR-181aisapotentialnewtoolforbreastcancerscreening[J].IntJMolMed, 2012, 30(3):680-686.
(编辑国荣)
Influenceofup-regulationofmiR-181aexpressiononproliferationandapoptosisofgastriccancercellAGS
YUJun-hui,SUNXue-jun,ZHENGJian-bao,WANGXiao-long,WEIGuang-bing,GAOQi,WANGKai
(DepartmentofGeneralSurgery,theFirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China)
ObjectiveToinvestigatetheeffectofmiR-181aontheproliferationandapoptosisofgastriccancercellsanditspossiblemechanism.MethodsmiR-181aexpressionin5typesofgastriccancercellsandnormalgastricmucosalcelllineGES-1wasdetectedbyReal-timePCR.miR-181amimicswastransfectedtransientlyintogastriccancercelllineAGStoup-regulatetheexpressionofmiR-181a.Theinfluencesofup-regulationofmiR-181aoncellgrowth,cellcycleandapoptosiswereevaluatedbyMTTandflowcytometry.ProteinlevelsofCDC25A,cyclinA2,cyclinD1,p21,Bcl-2andBaxweredetectedbyWesternblot.ResultComparedwithGES-1,theexpressionlevelsofmiR-181aingastriccancercelllinesSGC-7901andMKN28weresignificantlyhigher(bothP<0.01),whilemiR-181ahadnosignificantdifferencesinMGC-803,BGC-823andAGS(allP>0.05).ThetransfectionofmiR-181amimicsup-regulatedmiR-181aexpressioninAGS(P<0.05).InAGScellaftertransfectionwithmiR-181aminics,theproliferativeabilitywasincreased,G0/G1phasecellratiowasdecreased,Sphasecellratiowasincreased,andapoptosisratewasreduced(allP<0.05).InmiR-181aup-regulatedAGScell,theproteinexpressionsofCDC25A,cyclinA2andBcl-2wasincreased,andtheexpressionofBaxwasdecreased(allP<0.05).ButtheexpressionsofcyclinD1andp21hadnostatisticaldifferences(bothP>0.05).ConclusionOverexpressionofmiR-181apromotescellgrowthandcellcycleinAGS;up-regulationofCDC25AandCyclinA2maybeoneofthemechanisms.OverexpressionofmiR-181ainhibitscellapoptosisinAGS,andup-regulationofBcl-2anddown-regulationofBaxmaybeinvolvedintheprocess.
miR-181a;gastriccancer;proliferation;apoptosis;cellcycle
2015-12-29
2016-03-30
国家自然科学基金资助项目(No.81101874;81172362);陕西省科技统筹创新工程计划资助项目(No.2013KTCQ03-08)
孙学军.E-mail:sunxy@mail.xjtu.edu.cn
R735.2
A
10.7652/jdyxb201605008
SupportedbytheNationalNaturalScienceFoundationofChina(No.81101874, 81172362)andtheCoordinatedandInnovativePlanProjectsofScienceandTechnologyofShaanxiProvince(No.2013KTCQ03-08)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160803.1148.014.html(2016-08-03)
