男性原发性高血压患者血清OX-LDL、PON-1、DHEA-S水平与颈动脉硬化的关系
2016-10-24李宏伟葛庆锋李海涛王晓春
李宏伟,葛庆锋,李海涛,王晓春
(华北理工大学附属医院,河北唐山063000)
男性原发性高血压患者血清OX-LDL、PON-1、DHEA-S水平与颈动脉硬化的关系
李宏伟,葛庆锋,李海涛,王晓春
(华北理工大学附属医院,河北唐山063000)
目的探讨男性原发性高血压(EH)患者血清氧化型低密度脂蛋白(OX-LDL)、对氧磷酯酶1(PON-1)、硫酸脱氢表雄酮(DHEA-S)水平与颈动脉硬化(CAS)的相关性。方法 男性EH患者202例,根据颈部超声检查结果分为伴CAS组(CAS组)和不伴CAS组(NCAS组)。记录其年龄、体质量指数(BMI)、病程、收缩压(SBP)、舒张压(DBP)及降压药物使用情况。收集其临床检验结果,包括空腹血糖(FPG)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、尿酸(UA)、同型半胱氨酸(Hcy)、高敏C反应蛋白(hs-CRP),采用ELISA双抗夹心法检测血清OX-LDL水平,速率法测定血清PON-1,放射免疫法检测血清DHEA-S水平。比较以上两组一般资料及血清OX-LDL、PON-1、DHEA-S是否存在差异;分析OX-LDL、PON-1、DHEA-S与一般资料及CAS的相关性。结果 CAS组较NCAS组患者血清Hcy、hs-CRP、OX-LDL水平升高,HDL、PON-1、DHEA-S水平下降(P均<0.05)。血清OX-LDL与TG呈正相关,与PON-1、DHEA-S呈负相关;PON-1与HDL呈正相关(P均<0.05);DHEA-S与HDL呈正相关,与年龄呈负相关(P均<0.05)。血清Hcy、OX-LDL与CAS呈正相关,PON-1、DHEA-S与CAS呈负相关(P均<0.05)。结论 男性EH患者血清OX-LDL水平升高,PON-1、DHEA-S水平下降与CAS相关。
原发性高血压;氧化型低密度脂蛋白;对氧磷脂酶1;硫酸脱氢表雄酮;颈动脉硬化;男性
原发性高血压(EH)是一种常见的心血管疾病,其进展可以导致心、脑、肾等器官损害。动脉粥样硬化(AS)作为EH最常见的并发症之一,是心脑血管疾病发生的重要危险因素。其中,颈动脉硬化(CAS)作为全身AS的表现之一,其位置表浅且易于通过超声检测,因此成为早期评价全身AS的一个指标[1]。目前EH合并CAS的机制尚不清楚,与多种因素相关。氧化型低密度脂蛋白(OX-LDL)、对氧磷脂酶1(PON-1)、硫酸脱氢表雄酮(DHEA-S)是近年来发现的分别具有氧化及抗氧化活性的血管内皮物质,其与EH伴CAS的研究鲜见报道。本文进行了相关探讨。现报告如下。
1 资料与方法
1.1临床资料选取2014年6月~2015年8月华北理工大学附属医院心内科就诊的男性EH患者202例,均符合2012年《中国高血压防治指南》中高血压病诊断标准,年龄(52.68±12.05)岁、BMI(24.35±3.64)kg/m2、SBP(151.33±20.07)mmHg、DBP(85.40±12.54)mmHg、FPG(4.69±0.62)mmol/L,其中应用血管紧张素Ⅱ受体阻滞剂85例、钙通道阻滞剂126例、β受体阻滞剂41例、利尿剂22例,他汀类药物27例、抗血小板类药物28例。排除入选者有继发性高血压或者白大衣性高血压;心功能Ⅲ~Ⅳ级(NYHA分级)、心梗、心绞痛、心脏瓣膜病、先天性心脏病及心脏急慢性炎症;卒中等脑血管疾病;类风湿/痛风等自身免疫性疾病;糖尿病、性激素水平异常等内分泌性疾病;感染、创伤及手术者;服用炎症抑制剂者;恶性肿瘤;肝炎、肝硬化及肝功能不全,各种肾病及肾功能不全;目前在使用激素治疗者;吸烟量平均每天超过5支、饮酒量每天超过50 g。 根据颈部超声检查结果将患者分为CAS组(n=81)和NCAS组(n=121)。两组年龄、病程、BMI、SBP、DBP、FPG及降压药物使用情况有可比性。
1.2血糖、血脂的检测于临床检验中心采用氧化酶法检测空腹血糖(FPG),采用酶法检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
1.3血浆尿酸(UA)、同型半胱氨酸(Hcy)、高敏C反应蛋白(hs-CRP)的检测于临床检验中心采用氧化还原法检测血浆UA水平,免疫法检测血浆Hcy水平,免疫比浊增强法检测血浆hs-CRP。
1.4血清OX-LDL、PON-1、DHEA-S水平的检测 患者于晨起6~7时抽取空腹静脉血6 mL,室温放置30 min后3 000 r/min离心15 min,收集上清液放入-80 ℃冰箱中待用。采用ELISA双抗夹心法检测血清OX-LDL,试剂盒由美国R&D公司提供;采用速率法测定血清PON-1,试剂盒由美国Sigmag公司提供;采用放射免疫法检测血清DHEA-S,试剂盒由美国DPC公司提供。

2 结果
2.1两组血脂、UA、Hcy、hs-CRP比较见表1。

表1 CAS组和NCAS组血脂、UA、Hcy、hs-CRP比较
注:与NCAS组比较,*P<0.01。
2.2两组血清OX-LDL、PON-1、DHEA-S水平比较 见表2。

表2 两组血清OX-LDL、PON-1、DHEA-S水平比较
注:与NCAS组比较,*P<0.05,**P<0.01。
2.3血清OX-LDL、PON-1、DHEA-S水平与一般资料的相关性以血清OX-LDL、PON-1、DHEA-S水平为因变量,年龄、病程、BMI、收缩压、舒张压、FPG、TC、TG、HDL、LDL、UA、Hcy、hs-CRP、OX-LDL、PON-1、DHEA-S为自变量进行多元逐步回归分析。结果见表3。
2.4CAS危险因素的多因素分析以是否合并CAS为因变量,年龄、病程、BMI、SBP、DBP、FPG、TC、TG、HDL、LDL、UA、Hcy、hs-CRP、OX-LDL、PON-1、DHEA-S为自变量进行Logistic多元回归分析。结果见表4。
3 讨论
AS是多种心血管疾病发生的重要病理基础之一,以侵犯大、中动脉为主。高血压可促进AS斑块的形成,致使动脉管腔发生狭窄、闭塞以及血栓的形成。颈动脉作为脑供血的主要血管,其AS可以增加脑卒中发生的风险[2]。
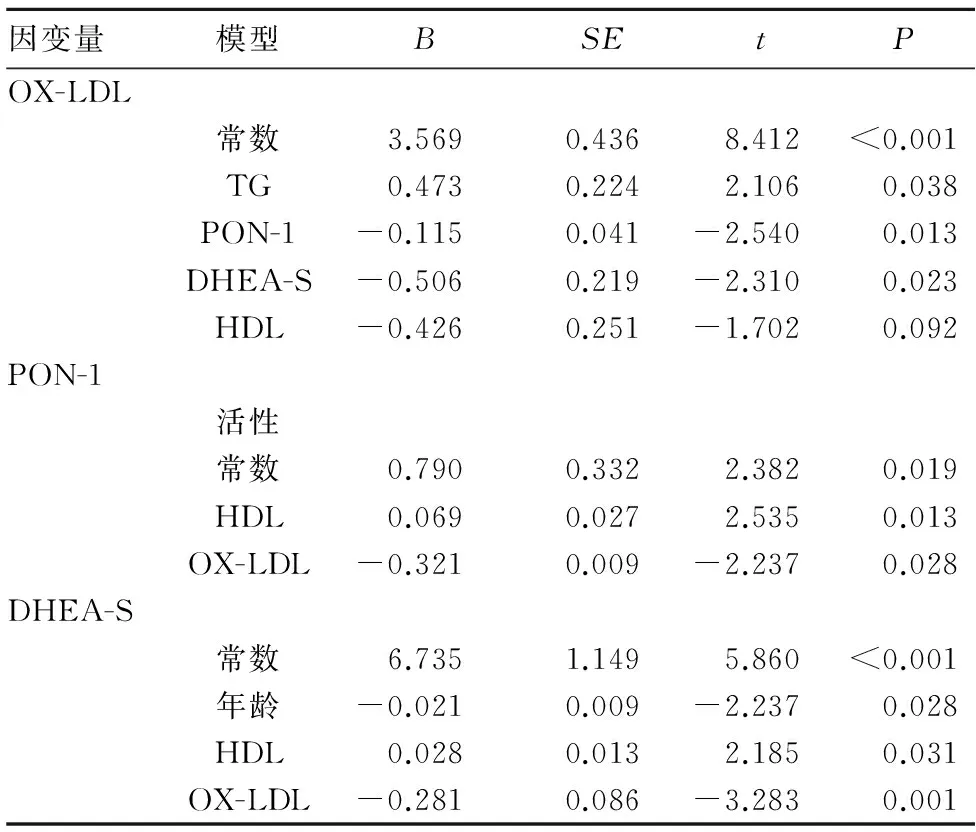
表3 男性EH患者血清OX-LDL、PON-1、DHEA-S水平与一般资料的相关性
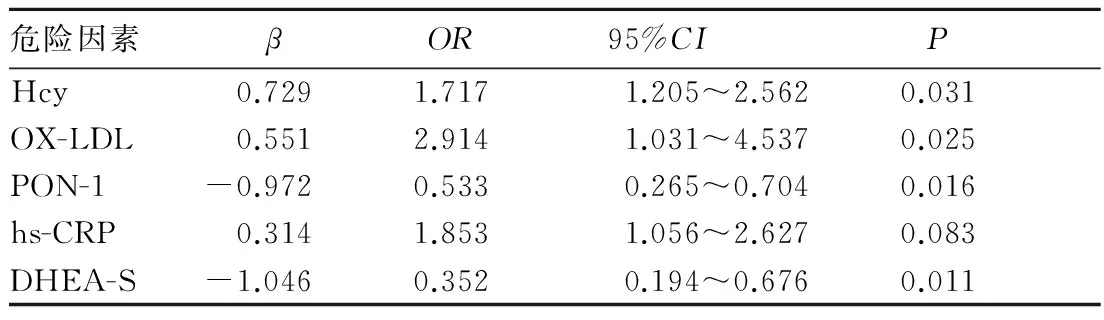
表4 男性EH患者CAS危险因素的Logistic多元回归分析
OX-LDL是LDL在体内通过氧化应激反应被氧化修饰而形成的[3]。LDL氧化修饰后,可以导致血管内皮细胞NO合成和释放减少,血管舒张功能降低;促进血管内皮黏附因子和趋化因子表达,抑制内皮细胞抗凝物质产生。OX-LDL被巨噬细胞吞噬后,其可以转化为泡沫细胞,泡沫细胞不断地在血管内皮下积累最终形成脂质条纹改变;此外,OX-LDL还能诱导血管平滑肌细胞发生迁移、增殖和转化来促进AS发生[4]。本研究发现,EH伴CAS者血清OX-LDL水平较非CAS者升高,并且OX-LDL与CAS的发生呈正相关,这与AS发病机制和病理过程一致,与杨丽萍等[5]文献报道相似。
PON-1是由肝脏合成的一种钙离子依赖的芳香酯酶,在外周与HDL紧密结合,参与构成HDL抗氧化活性的主要部分[6]。目前已经证实,PON-1可以通过水解脂质过氧化物或使其再酰基化来抑制LDL的氧化,并且可以抑制醛类物质的形成[7]。此外,PON-1还能通过抑制巨噬细胞吞噬OX-LDL来减少泡沫细胞的形成[8]。动物研究发现,PON-1基因敲除的小鼠OX-LDL水平升高,AS发生率增加[9]。人体研究也表明,PON-1水平与AS明显相关。本研究发现,EH患者PON-1水平下降,HDL作为PON-1的载体也是下降的,并且血清PON-1水平与HDL呈正相关,因此这可能是造成PON-1水平下降的一个主要原因。而且,血清PON-1水平与OX-LDL呈负相关,这与上述PON-1能够抑制LDL氧化的理论相符。此外,本研究还发现血清PON-1水平与CAS呈负相关,提示血清PON-1降低可能是EH患者发生CAS的危险因素之一,这与目前的研究[10]结果一致。
DHEA-S是由肾上腺合成的一种类固醇激素,随着年龄的增加其血清水平逐渐下降,被认为是一种抵抗衰老的保护性因子。目前研究发现,DHEA-S与冠状动脉疾病密切相关[11],并且具有抑制AS形成和斑块进展的作用。Fukui等[12]也发现在男性2型糖尿病患者中,血清DHEA-S水平与其CAS相关。根据目前的研究结果,推测其抗AS的主要机制有抑制AS中平滑肌细胞和成纤维细胞的增殖;改善内皮功能,降低纤溶酶原激活物抑制剂水平;降低致AS炎症因子的水平;抑制LDL的氧化修饰,降低OX-LDL引起的内皮细胞损伤。本研究发现,EH患者血清DHEA-S在伴CAS患者中低于不伴CAS者,并且与血清OX-LDL、CAS呈负相关,这说明EH患者发生CAS可能与其血清DHEA-S水平下降,不足以抑制OX-LDL的过氧化损伤作用有关。
综上所述,男性EH患者CAS的发生可能与OX-LDL水平升高、PON-1和DHEA-S水平下降有关,这为CAS的病因、预测及治疗提供了重要线索。由于本研究属于回顾性研究,局限于男性患者,且样本量较小,因此只能用来推测血清OX-LDL、PON-1和DHEA-S水平变化与CAS的相关性,无法得出因果关系的结论,还需要前瞻性试验进一步来证实。
[1] 许先进,董旭.颈动脉内膜中膜厚度的临床研究进展[J].中国动脉硬化杂志,2008,16(8):665-668.
[2] Handa N, Matsumoto M, Maeda H, et al. Ischemic stroke events and carotid atherosclerosis results of the Osaka follow-up study for ultrasonographic assessment of carotid atherosclerosis (the OSACA Study)[J]. Stroke, 1995,26(10):1781-1786.
[3] Hermsdorff HH, Puchau B, Volp AC, et al. Dietary total antioxidant capacity is inversely related to central adiposity as well as to metabolic and oxidative stress markers in healthy young adults[J]. Nutr Metab(Lond), 2011,8:59.
[4] Chen M, Masaki T, Sawamura T. LOX-1, the receptor for oxidized low-density lipoprotein identified from endothelial cells: implications in endothelial dysfunction and atherosclerosis[J]. Pharmacol Ther, 2002,95(1):89-100.
[5] 杨丽萍,张国华,王珊,等.脑梗死患者颈动脉粥样硬化斑块与血清YKL40、ox-LDL水平的相关性[J].中国医师杂志,2013,15(4):449-452.
[6] Getz GS, Reardon CA. Paraoxonase, a cardioprotective enzyme: continuing issues[J]. Curr Opin Lipidol, 2004,15(3):261-267.
[7] Mackness MI, Mackness B, Durrington PN, et al. Paraoxonase and coronary heart disease[J]. Curr Opin Lipidol, 1998,9(4):319-324.
[8] Watson AD, Berliner JA, Hama SY, et al. Protective effect of high density lipoprotein associated paraoxonase. Inhibition of the biological activity of minimally oxidized low density lipoprotein[J]. J Clin Invest, 1995,96(6):2882.
[9] Rozenberg O, Rosenblat M, Coleman R, et al. Paraoxonase (PON1) deficiency is associated with increased macrophage oxidative stress: studies in PON1-knockout mice[J]. Free Radic Biol Med, 2003,34(6):774-784.
[10] Coombes RH, Crow JA, Dail MB, et al. Relationship of human paraoxonase-1 serum activity and genotype with atherosclerosis in individuals from the Deep South[J]. Pharmacogenet Genomics, 2011,21(12):867-875.
[11] Hak AE, Witteman JCM, de Jong FH, et al. Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men: the Rotterdam study[J]. J Clin Endocrinol Metab, 2002,87(8):3632-3639.
[12] Fukui M, Kitagawa Y, Nakamura N, et al. Serum dehydroepiandrosterone sulfate concentration and carotid atherosclerosis in men with type 2 diabetes[J]. Atherosclerosis, 2005,181(2):339-344.
王晓春(E-mail:elton_kmh@126.com)
10.3969/j.issn.1002-266X.2016.29.022
R544.1
B
1002-266X(2016)29-0063-03
2015-12-24)
