HSP70及Ezrin蛋白表达变化对人成骨肉瘤MG63细胞凋亡和增殖的影响
2016-10-24马国涛孙晓茹
马国涛,孙晓茹
(1平顶山市第一人民医院,河南平顶山467000;2平顶山市中医院)
HSP70及Ezrin蛋白表达变化对人成骨肉瘤MG63细胞凋亡和增殖的影响
马国涛1,孙晓茹2
(1平顶山市第一人民医院,河南平顶山467000;2平顶山市中医院)
目的分析人成骨肉瘤MG63细胞中热休克蛋白70(HSP70)、细胞骨架蛋白(Ezrin)的表达对该细胞凋亡和增殖的影响。方法 首先在有双启动子的质粒载体pGFP-V-RS中构建能够表达HSP70和Ezrin蛋白shRNA的载体并重组质粒,将质粒转染入MG63细胞,分为联合表达组、单纯shRNA组、空白载体组,筛选稳定表达细胞培养增殖,采用RT-PCR及Western blotting法检测这两种蛋白基因表达情况与蛋白水平;Western blotting法检测凋亡相关蛋白,使用流式细胞术及噻唑蓝比色法分别检测第1、3、5、7天细胞凋亡及增殖率。结果 联合表达组Ezrin mRNA及Ezrin蛋白合成量低于空白载体组和单纯shRNA组,HSP70 mRNA及HSP70蛋白合成量高于空白载体组和单纯shRNA组(P均<0.01),HSP70和Ezrin联合表达的MG63细胞构建成功。低表达Ezrin和高表达HSP70的载体质粒构建成功。联合表达组MG63细胞凋亡率(23.94%±0.48%)较空白载体组(10.96%±0.25%)高(P<0.01),增殖速度(308.67%±2.91%)较单纯shRNA组(394.80%±2.63%)慢(P<0.01);与空白载体组比较,单纯shRNA组、联合表达组第3、5、7天细胞增殖率降低,抑制率升高(P均<0.01)。与单纯shRNA组比较,联合表达组第3、5、7天细胞增殖率低,抑制率低(P均<0.01)。结论 高表达的HSP70和低表达的Ezrin在促进骨肉瘤细胞凋亡的同时减缓其增长速度。
骨肉瘤细胞;热休克蛋白质70;Ezrin蛋白;shRNA
骨肉瘤是一种多发于年轻人群的具有较高转移率和复发率的恶性肿瘤,近80%的患者在诊断明确时已发生癌细胞转移,在较新的放化疗治疗手段下,其5年存活率仍在一半以下,而治疗后约有三分之一的患者3年后再次被检出癌细胞[1],所以,研究骨肉瘤细胞的凋亡和增殖机制,发现其干扰新方法对于临床治疗非常有意义。Ezrin蛋白存在于细胞表面,作为连接和受体蛋白存在,通过多种信号途径调节癌细胞凋亡、增殖、浸润、转移[2]。系统性分析表明,骨肉瘤细胞中Ezrin蛋白过表达会导致患者5年生存率显著降低[3]。但Ezrin参与肿瘤细胞凋亡、增殖、局部浸润、转移的相关机制尚未清楚,而目前单一靶蛋白很难完全杀死体内所有癌细胞,所以复合的多靶点基因表达治疗是较有意义的研究方向[4]。热休克蛋白(HSP)是一种应激性蛋白,在病理条件下,HSP能够诱导产生特异性细胞毒性T淋巴细胞(CTL),增加HSP70在癌组织细胞中的含量能够干预肿瘤细胞生长,并对癌细胞的清除有一定影响[5]。本文探讨了HSP70和Ezrin蛋白shRNA联合对于人成骨肉瘤MG63细胞凋亡和增殖的影响。现报告如下。
1 材料与方法
1.1细胞系及细胞培养MG63系人骨肉瘤细胞,于含10%胎牛血清的RPMI1640培养基中培养,置于空气中CO2体积为5%、温度37 ℃的环境中,培养基及胎牛血清均购自Hyclone公司。
1.2表达载体的构建①Ezrin蛋白shRNA表达载体的构建:在Genbank数据库中查询Ezrin蛋白的mRNA碱基序列,得到BC013903.2碱基顺序,合成一端带有HindⅢ内切酶酶切位点,另一端带有BamHⅡ内切酶酶切位点,中部含有5′-TGCTATGTTGGAATACCTTTCAAGAGAAGGTATCCAACATAGCAT-3′发卡序列的DNA片段。将其引入载体pGFP-V-RS,合成pGFP-V-RS-shRNA转化感受态细胞JM 10,经过增殖筛选并经北京诺禾致源生物科技公司测序后,确认为目标载体。②HSP70与Ezrin蛋白shRNA共表达载体的构建:在Genbank数据库中查询HSP70的mRNA碱基序列,得到L12723.1碱基顺序并合成HSP70基因片段,通过PCR将载体pGFP-V-RS的GFP段替换为HSP70片段,经过增殖筛选并经测序后,确认为目标载体pGFP-V-RS-HSP70。按上述操作建立目标载体pGFP-V-RS-shRNA-HSP70。
1.3MG63细胞株的转染及分组将质粒转染入MG63细胞,分为联合表达组(pGFP-V-RS-shRNA-HSP70)、单纯shRNA组(pGFP-V-RS-shRNA)、空白载体组(pGFP-V-RS),每组70份。使用DNAfectin 2100高效转染试剂转染,200 μg/mL遗传霉素418筛选培养1个月,扩增后得到稳定表达的细胞。PCR法鉴定转染细胞。
1.4MG-63细胞中Ezrin、HSP70 mRNA的检测采用RT-PCR法。收集稳定转染细胞株,加入1 mL TRIzol溶液进行总RNA提取,行反转录反应。在M-MLV反转录酶(Promega)作用下反转录为cDNA。PCR引物为Ezrin-F:5′-ACTCACCAGAAACCGAAAATG-3′、Ezrin-R:5′-TGGAGGCCAAAGTACCACAC-3′,扩增产物159 bp;HSP70-F: 5′-AAGAGCAACAGCAG-CAGACA-3′、HSP70-R:5′-CGATFGGCAGGTCCA-CAGTA-3′,扩增产物150 bp;内参为18 s RNA-F:5′-CCTGGATACCGCAGCTAGGA-3′、18 s RNA-R:5′-GCGGCGCAATACGAATGCCCC-3′,扩增产物112 bp。参考荧光定量PCR试剂盒操作指导进行相对定量PCR实验,实验条件为:单个样本重复3次,50 ℃、2 min预变性;95 ℃、2 min;95 ℃、15 s,60 ℃、32 s,读板(40次循环)。
1.5MG-63细胞中Ezrin、HSP70蛋白的检测采用Western blotting法。将稳定表达细胞中的所有蛋白质提取,经SDS-PAGE凝胶电泳后转移到PVDF膜上可得清晰蛋白条带,后封闭1 h,加入一抗GADPH、Ezrin或HSP70,稀释度1∶1 000,二抗为羊抗兔血清IgG,稀释度1∶20 000,按顺序孵育后,经化学发光反应及X线片处理得到图像,分光密度仪检测条带净光密度值,计算相对净光密度值。
1.6MG-63细胞凋亡率、增殖率的检测①细胞凋亡率的检测:采用流式细胞术。参考Annexin V-FITC细胞凋亡检测试剂盒相关指导步骤,将稳定表达的细胞加入缓冲液0.5 mL制作成细胞悬液,每份含有5×105个细胞,加入1.25 μL Annexin V-PE后在25 ℃下避光孵育,15 min后离心洗脱,加入预冷1×结合缓冲液后第1、3、5、7天检测,检测3次得到均值。Annexin-V阴性、PI阴性代表正常细胞,Annexin-V阳性、PI阴性代表凋亡早期的细胞,Annexin-V阳性、PI阳性代表凋亡晚期的细胞。② 细胞增殖能力的检测:采用噻唑蓝比色(MTT)法。转染后稳定表达的细胞稀释并接种于96孔板,保证每孔细胞数为1~2×103,加入20 μL PMS/MTS混合液,培养4 h后测定吸光度,持续7 d,检测3次得到均值。
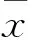
2 结果
2.1转染情况经转染的细胞培养1个月后,转染成功率约70%,选择状态较佳的细胞,在荧光显微镜下观测,联合表达组和单纯shRNA组细胞中都表现出HSP70-GFP显示为绿色荧光。
2.2各组Ezrin、HSP70 mRNA及蛋白表达比较见表1。

表1 各组Ezrin、HSP70 mRNA及蛋白表达比较
注:与空白载体组相比,*P<0.01;与单纯shRNA组相比,#P<0.01。
2.3各组细胞凋亡率比较 见表2。
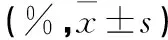
表2 各组细胞凋亡率比较
注:与空白载体组相比,*P<0.01;与单纯shRNA组相比,#P<0.01。
2.4各组不同时间细胞增殖率及抑制率比较见表3。
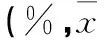
表3 各组不同时间细胞增殖率及抑制率比较±s)
注:与空白载体组同时间相比,*P<0.01;与单纯shRNA组同时间相比,#P<0.01。
3 讨论
Ezrin基因和HSP70基因存在于每一个人体细胞中,但正常状态下,绝大多数细胞的两种基因处于休眠状态,而在部分骨髓瘤细胞中发现了Ezrin蛋白或HSP70蛋白同时或单独存在,两种蛋白的表达强度并不一致。本研究为避免干扰,保持实验的可重复性,构建了双基因稳定表达载体。pGFP-V-RS是一个携带CMV和pU6双启动位点的载体,在插入Ezrin shRNA片段的同时将HSP70标记GFP绿色荧光蛋白基因后代替质粒上的GFP序列,构建出双靶点调控pGFP-V-RS质粒载体,插入shRNA并替换GFP序列为HSP70序列后可以在两个启动子分别启动表达。本研究将稳定转染细胞经过培养1个月后,荧光显微镜及荧光定量PCR显示HSP70-GFP稳定表达,与空白载体组比较,联合表达组Ezrin mRNA及蛋白质表达均下降,HSP70 mRNA及蛋白表达均升高;单纯shRNA组Ezrin mRNA及蛋白下降。单纯shRNA与联合表达组上述各指标比较,P均<0.01。提示联合表达的MG63细胞构建成功。
使细胞中Ezrin基因低表达的方法有siRNA干扰、shRNA抑制等,也可以使Ezrin基因结构发生变化失去生物作用。考虑到siRNA及改变蛋白结构的方法持续时间短,不能长期观察。笔者选择了应用shRNA抑制的方法。而在质粒的选择上,Zhang等[6]研究发现引入pGenesil-1质粒的Ezrin基因的shRNA虽然稳定转染MG63,但沉默效率较低;而Gouri-Fard等[7]发现pGFP-V-RS载体质粒能够稳定利用shRNA抑制RHOXFl基因,沉默效率超过80%,但是转染的细胞为乳腺癌细胞;另外,周永春等[8]也发现,以pGFP-V-RS为载体的shRNA抑制Sox4基因,沉默效率较高。提示利用pGFP-V-RS载体质粒对于基因的shRNA抑制效果较好,沉默率较高。而本研究将Ezrin基因转录的shRNA引入载体转染细胞后,发现Ezrin蛋白的合成受到抑制,沉默效率超过95%;而Ezrin基因的shRNA在转染后36 h表达最低,同时延迟12 h出现蛋白表达最低,这可能与调控基因表达的时序性有关。
本研究中利用流式细胞术统计到稳定转染的MG63肿瘤细胞的早期自发凋亡率为4.2%,晚期自发凋亡率6.6%。Bcl-2常和Bax结合形成特异性同源二聚体,一起介导细胞凋亡,当促进凋亡的Bax生物效果超过抗凋亡蛋白Bcl-2时,表现为促进凋亡,反之抑制凋亡。另外,本研究发现,当shRNA抑制Ezrin蛋白的基因表达时,细胞的各期凋亡率均显著提高。Lévy等[9]研究发现,Ezrin蛋白通过NF-vB通道使Bcl-2高表达而Bax低表达介导凋亡。Wick等[10]发现,Ezrin通过连接抗原-CD44及HSP70,在其他炎症因子的介导下,提高Bcl-2水平、抑制胶质细胞瘤凋亡;另外Wick等发现此过程中提高了基质金属蛋白酶(MMPs)合成,也促进癌细胞的分裂。
通常认为,肿瘤细胞凋亡的同时伴随着细胞增殖率的降低。有研究认为,抑制Ezrin基因表达或将其蛋白结构改变,可以通过ROCK信号通路传导,抑制MMPs基因。本研究中与空白载体组比较,单纯shRNA组、联合表达组第3、5、7天增殖率降低、抑制率均升高,联合表达组第3、5、7天增殖率及抑制率均低于shRNA组。提示高表达的HSP70基因和低表达的Ezrin基因在促进骨肉瘤细胞凋亡的同时减缓其增长速度,但本研究还需要继续在肿瘤动物模型进行体内研究,才能更准确地评估其对瘤细胞的凋亡和增殖的影响。
[1] Hofbauer LC, Ten RM, Khosla S. The anti-androgen hydroxyflutamide and androgens inhibit interleukin-6 production by an androgen-responsive human osteoblastic cell line[J]. J Bone Miner Res, 1999,14(8):1330-1337.
[2] Riggs BL, Khosla S, Melton LJ. A unitary model for involutional osteoporosis: estrogen deficiency causes both type I and type II osteoporosis in postmenopausal women and contributes to bone loss in aging men[J]. J Bone Miner Res, 1998,13(5):763-773.
[3] 林秾,叶招明,李玢,等.成人骨肉瘤的临床特点及预后影响因素[J].中华骨科杂志,2009,29(8):717-722.
[4] Lacey DL, Timms E, Tan HL, et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation[J]. Cell, 1998,93(2):165-176.
[5] Prestwood KM, Kenny AM, Unson C, et al. The effect of low dose micronized 17B-estradiol on bone turnover, sex hormone levels, and side effects in older women: a randomized, double blind, placebo-controlled study[J]. J Clin Endocrinol Metab, 2000,85(12):4462-4469.
[6] Zhang J, Zuo J, Lei M, et al. Ezrin promotes invasion and migration of the MG63 osteosarcoma cell[J]. Chin Med J, 2014,127(10):1954-1959.
[7] Gouri-Fard S, Abdollahi DZ, Omrani M, et al. shRNA mediated RHOXFl silencing influences expression of BCL2 but not CASP8 in MCF-7 and MDA-MB-231 cell lines [J]. Asian Pac J Cancer Prey, 2012,13(11):5865-5869.
[8] 周永春,王熙才,陈艳,等.靶向敲降Sox4基因抑制宣威地区女性肺癌细胞系XWLC-05裸鼠移植瘤的生长[J].中华肿瘤杂志,2014,36(1):11-16.
[9] Lévy P, Robin H, Bertrand F, et al. Butyrate-treated colonic Caco-2 cells exhibit defective integrin-mediated signaling together with increased apoptosis and differentiation[J]. J Cell Physiol, 2003,197(3):336-347.
[10] Wick W, Grimmel C, Wild-Bode C, et al. Ezrin-dependent promotion of glioma cell clonogenicity, motility, and invasion mediated by BCL-2 and transforming growth factor-beta2[J]. J Neurosci, 2001,21(10):3360-3368.
10.3969/j.issn.1002-266X.2016.29.013
R738.3
A
1002-266X(2016)29-0039-03
2015-09-14)
